Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero v.22 n.2 Buenos Aires dic. 2007
Ecología y conservación del Aguilucho Langostero (Buteo swainsoni) en Argentina
José Hernán Sarasola 1,2, Maximiliano Adrián Galmes 1 y Miguel Ángel Santillán 1
1 Centro para el Estudio y Conservación de las Aves Rapaces en Argentina (CECARA), Facultad de Ciencias Exactas y Naturales, Universidad Nacional de La Pampa. Avda. Uruguay 151, 6300 Santa Rosa, La Pampa, Argentina.
2 sarasola@exactas.unlpam.edu.ar
Resumen
A mediados de la década de 1990 el Aguilucho Langostero (Buteo swainsoni) se convirtió en uno de los casos paradigmáticos de los efectos negativos que tienen las prácticas agrícolas sobre la fauna silvestre en la Región Pampeana de Argentina. Sus hábitos de agregación espacial, de selección de hábitat y de alimentación, sumados a condiciones ambientales que favorecieron explosiones demográficas de insectos perjudiciales para los cultivos de la región, fueron factores que se conjugaron dramáticamente y que concluyeron en una serie de eventos de mortalidad por envenenamiento que afectaron aproximadamente 20000 individuos de esta especie, un 5% de la población total estimada por ese entonces. A pesar de que el insecticida causante de aquellas mortalidades ha sido retirado del mercado y que no se han reportado nuevos incidentes de mortandad durante los últimos años, son diversos los aspectos de la biología de la especie que necesitan de mayores estudios para asegurar su conservación. En este trabajo se recopila la información disponible sobre la ecología de la especie en la Región Pampeana, analizando al mismo tiempo los aspectos que motivaron la ocurrencia de envenenamientos masivos, las medidas y acciones tomadas para evitar nuevos incidentes y los logros alcanzados a partir del desarrollo de actividades de extensión, educación e investigación. El Aguilucho Langostero se transformó de esta forma en una “especie paraguas” para la conservación de la biodiversidad en los agroecosistemas pampeanos, dado que el esfuerzo puesto en la conservación de sus poblaciones seguramente ha redundado en la conservación de otras especies de aves en este ecosistema.
Palabras clave: Agroecosistemas; Aguilucho Langostero; Área de distribución austral; Buteo swainsoni; Conservación; Migración; Mortalidades masivas.
Abstract
Ecology and conservation of Swainson’s Hawk (Buteo swainsoni) in Argentina
In the mid-1990’s, the Swainson’s Hawk (Buteo swainsoni) turned into one of the most paradigmatic cases in relation to the potential effects of agricultural practices on wildlife in the Argentine pampas. Its habits of spatial segregation, prey and habitat selection, added to environmental conditions that determined demographic outbreaks of insect populations, most of them very prejudicial for crops and pastures implanted in this region, were factors that combined to result in a series of poisoning incidents that affected approximately to 20000 hawks, a 5% of the world population estimated in that moment. Despite the fact that the pesticide that caused these mortality incidents has been banned from Argentina and new mortality incidents have not been reported in the area, several important aspects of the wintering ecology of the Swainson’s Hawk related with conservation planning are still unknown. In this paper we review the information available on the austral ecology of the Swainson’s Hawk, analyzing those conservation measures taken to avoid the occurrence of new mortality incidents and the achievement of extension, educational and research goals. The Swainson’s Hawk has become a “umbrella species” for the conservation of biodiversity in the agroecosystems of Argentina and all the efforts made to preserve wintering populations of this raptor surely have resulted in the conservation of other birds inhabiting these habitats.
Key words: Agroecosystems; Buteo swainsoni; Conservation; Massive mortalities; Migration; Swainson’s Hawk; Wintering grounds.
Recibido 22 febrero 2007, aceptado 23 diciembre 2007
“One of the most spectacular and easily observed movements of birds in the New World, and possibly anywhere…” Smith (1980), en referencia al paso de aguiluchos langosteros sobre el Istmo de Panamá.
La migración de las aves es un fenómeno que ha suscitado durante siglos la atención de científicos y naturalistas. En épocas recientes, y con el desarrollo de disciplinas que exploran las relaciones de las especies silvestres con su ambiente (ecología) y el mantenimiento del balance y diversidad biológica en los ambientes naturales (biología de la conservación), el estudio y la conservación de las especies de aves migratorias han significado un verdadero desafío para biólogos y ornitólogos del mundo entero. A diferencia de lo que ocurre con las especies sedentarias, cuyas poblaciones se ven afectadas por eventos y procesos ambientales que suceden en un lugar geográfico único y determinado, la demografía de las especies migratorias está regulada por las condiciones ambientales que los individuos experimentan tanto en la estación reproductiva, que afectan su fecundidad, como en la época no reproductiva, durante la cual deben asegurar su supervivencia (Newton 2004).
El Aguilucho Langostero (Buteo swainsoni) es una ave rapaz migratoria que cría a lo largo del oeste de Estados Unidos y Canadá, habitando praderas y áreas agrícolas, y que se desplaza a la Región Pampeana durante el invierno boreal, ocupando principalmente áreas agrícolas del centro de Argentina (England et al. 1997). A pesar de ser una especie ampliamente estudiada en diversos aspectos de su biología en su área de distribución en América del Norte, tanto la ecología como las rutas migratorias de la especie en las áreas no reproductivas eran desconocidas hasta hace relativamente poco tiempo. En 1995 dos hembras fueron equipadas con transmisores satelitales antes de abandonar sus áreas de cría en California (EEUU) con el objetivo de establecer sus rutas migratoria e identificar las áreas que ocupaban en América del Sur durante el verano austral (Woodbridge et al. 1995). Aunque solo una de ellas alcanzó su destino final, el seguimiento de este individuo no solo confirmó a los agroecosistemas de la Región Pampeana de Argentina como principal área de distribución austral de la especie, sino que, al mismo tiempo, reveló la ocurrencia de mortandades masivas de aguiluchos como resultado de la intoxicación con insecticidas organofosforados. En este incidente, localizado geográficamente en el norte de la provincia de La Pampa, 714 aguiluchos envenenados fueron recolectados en un dormidero comunal ubicado a pocos centenares de metros de una parcela que había sido tratada con insecticidas y donde los aguiluchos se habían alimentado durante los días previos al hallazgo (Woodbridge et al. 1995). Esto puso en alerta a los países comprendidos dentro del rango de distribución de la especie, tanto en sus áreas de cría (EEUU, Canadá) como no reproductivas (Argentina). Las primeras acciones destinadas a evitar nuevas mortandades, llevadas a cabo durante el verano austral de 1995-1996 por investigadores, organismos oficiales y no gubernamentales locales y extranjeros, no pudieron impedir que se repitieran eventos de mortandad con consecuencias aún mayores sobre las poblaciones de Aguilucho Langostero (Goldstein et al. 1996). Sin embargo, las actividades de investigación, educación y extensión permitieron lograr un mayor conocimiento de la ecología de la especie, evitando la ocurrencia de nuevas mortandades durante el verano siguiente, para finalmente conseguir en 1999 la prohibición total del producto responsable de estos incidentes.
En este trabajo se recopila la información disponible sobre la biología y la ecología del Aguilucho Langostero en Argentina, así como las acciones llevadas a cabo para evitar la ocurrencia de envenenamiento por pesticidas. Finalmente, se proponen una serie de medidas y estudios que deberían realizarse para la implementación de una estrategia que asegure la conservación de la especie en su rango de distribución austral.
Una especie, dos mundos
El Aguilucho Langostero está incluido en el género Buteo, el cual comprende a un grupo de aves rapaces medianas (700-1000 g), de alas y cola anchas, adaptadas al vuelo en planeo utilizando corrientes térmicas ascendentes al estilo de los buitres. Aunque el origen de este género se ubica en la Región Neotropical (Riesing et al. 2003), comprende actualmente un amplio grupo de aves rapaces diurnas (28 especies; del Hoyo et al. 1994) con una distribución casi mundial, incluyendo islas remotas en los océanos Atlántico y Pacífico, excepto Australia y la Antártida. El Aguilucho Langostero ha sido relacionado filogenéticamente con otras especies con distribución en América del Sur y con especies insulares del Océano Pacífico, como el Aguilucho de las Galápagos (Buteo galapagoensis) y el Aguilucho de Hawai (Buteo solitarius) (Riesing et al. 2003). En estas filogenias desarrolladas recientemente utilizando técnicas moleculares, el Aguilucho Langostero aparece como una especie basal en el clado que incluye este grupo de especies insulares, lo que hace suponer un origen común para todas ellas a partir de una especie migratoria con una alta capacidad de dispersión y cuyos individuos podrían haber alcanzado islas distantes al desviarse de su ruta migratoria (Riesing et al. 2003, Bollmer et al. 2006).
En el Aguilucho Langostero los individuos de ambos sexos son similares en apariencia, aunque existe un dimorfismo sexual inverso por el cual las hembras son de mayor tamaño que los machos, como sucede en la mayoría de las rapaces (England et al. 1997). Por ello, es posible discriminar el sexo de los individuos a partir de medidas morfométricas cuando los aguiluchos son capturados y manipulados (Sarasola y Negro 2004). Como la mayor parte de las especies del género, el Aguilucho Langostero presenta un marcado polimorfismo en cuanto a su plumaje, con individuos de morfos claros, rufos y oscuros (Wheeler y Clark 1995).
Distribución geográfica y migración
El Aguilucho Langostero cría en el oeste de América del Norte desde Canadá (Columbia Británica, Alberta, Saskatchewan, Manitoba) y Estados Unidos (Washington, Idaho, Montana, Dakota del Norte y del Sur, Oregon, Minnesota, Wyoming, California, Nevada, Utah, Colorado, sureste de Arizona, Nuevo México y centro de Texas) hasta México (Baja California) (England et al. 1997; Fig. 1). En el área de cría ocupa tanto estepas y pastizales como ambientes agrícolas, y construye sus nidos tanto en árboles como en postes de tendidos eléctricos. Debido al amplio rango de distribución, la fenología reproductiva es muy variable; el tamaño de la única puesta que realizan es de 1-4 huevos y el número promedio de individuos que abandonan el nido es de 2 pichones/puesta (England et al. 1997).
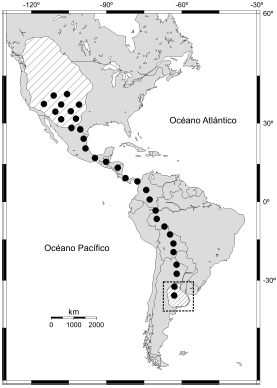
Figura 1. Distribución del Aguilucho Langostero (Buteo swainsoni) en el continente americano y su ruta migratoria (de acuerdo a Fuller et al. 1998). Las zonas rayadas indican las áreas de cría y de invernada en el hemisferio norte y sur, respectivamente, y los puntos muestran la trayectoria de la migración.
En el invierno boreal el Aguilucho Langostero migra al sur de América del Sur, cubriendo una ruta migratoria de aproximadamente 10000 km (Fuller et al. 1998, Bechard et al. 2006). Durante el verano austral se establece en la Región Pampeana de Argentina, principalmente en las áreas agrícolas de las provincias del centro del país (La Pampa, Buenos Aires, Santa Fe, Córdoba, Entre Ríos; Fig. 1). A pesar de ser esta su principal área de distribución austral, es común observar también grupos de aguiluchos en otras provincias del oeste y noreste de Argentina y en áreas del sur de Brasil, Paraguay, Uruguay y Bolivia (England et al. 1997).
El viaje migratorio comienza a fines de septiembre y principios de octubre, empleando en promedio 51 días para llegar a su área de distribución austral y aproximadamente 60 días en su viaje de vuelta hacia las áreas de cría (Fuller et al. 1998, Bechard et al. 2006). La estrategia de alimentación del Aguilucho Langostero durante la migración es tal vez uno de los aspectos más controvertidos de la biología de la especie. Mientras algunos autores sostienen la “hipótesis del ayuno” y proponen que los aguiluchos no se alimentan durante el viaje migratorio, utilizando solo las reservas energéticas acumuladas durante los períodos pre-migratorios (Smith et al. 1986), una hipótesis alternativa sugiere que los aguiluchos se alimentan durante la migración (Kirkley 1991, Bechard et al. 2006). La hipótesis del ayuno está respaldada por la ausencia de egagrópilas y deposiciones debajo de los árboles utilizados como dormideros comunales en sitios de América Central donde los aguiluchos se establecen brevemente durante el viaje migratorio. Además, se ha reportado que los aguiluchos arriban a las áreas de invernada en una condición física muy disminuida, lo cual permite incluso que sean capturados a mano (Smith 1980). En concordancia con estas observaciones, se ha comprobado que los aguiluchos incrementan significativamente su masa corporal durante la invernada hasta emprender nuevamente el viaje migratorio hacia las zonas de cría (Goldstein et al. 1999a), logrando valores normales de condición física y nutrición hacia mediados de la estación no reproductiva (Sarasola et al. 2004). Recientemente, Bechard et al. (2006) han contrastado el modelo energético propuesto por Smith et al. (1986) utilizando valores de masa corporal de individuos de Aguilucho Langostero de distintas edades y sexos en diferentes momentos de su ciclo anual. Aunque algunas de las predicciones del modelo de Smith et al. (1986) sobre la masa corporal de los aguiluchos se ajustan a las observadas (e.g., al momento de iniciar la migración hacia las áreas de cría), los valores de masa corporal para machos y hembras al arribar a las áreas de cría o de distribución austral luego de la migración son mayores que los predichos por el modelo energético. Este análisis sugiere que los aguiluchos se alimentan durante el viaje migratorio, aunque existe poca información sobre la localización de los sitios de descanso a través de la ruta migratoria donde se alimentarían para recuperar su condición física.
Comportamiento y hábitos de alimentación
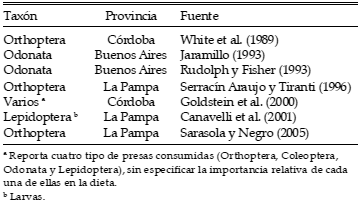
Tal vez uno de los aspectos más curiosos del Aguilucho Langostero y de su biología sean los marcados cambios ecológicos y comportamentales que tienen lugar entre el área de cría en el Hemisferio Norte y el área no reproductiva en el Hemisferio Sur. Durante la reproducción se comporta como una especie territorial, defendiendo el territorio reproductivo de la presencia o ataques de individuos de la misma o de otras especies de rapaces con las que compite por el uso del espacio (England et al. 1997). Durante este período, la dieta del Aguilucho Langostero es similar a la de otras especies del género y se compone principalmente de pequeños vertebrados (aves, mamíferos —especialmente ardillas terrestres del género Spermophilus— y reptiles; ver revisión en England et al. 1997). Sin embargo, tanto durante las agregaciones pre-migratorias como en el transcurso de la época no reproductiva en el Hemisferio Sur, la especie cambia completamente sus hábitos de comportamiento y alimentación, convirtiéndose en una especie gregaria, utilizando dormideros comunales durante la noche (Johnson et al. 1987, White et al. 1989, Woodbridge et al. 1995, Sarasola y Negro 2005; Fig. 2) y alimentándose exclusivamente de insectos (Tabla 1).

Figura 2. Individuos de Aguilucho Langostero (Buteo swainsoni) volando sobre una arboleda de Eucalyptus sp. en el norte de la provincia de La Pampa. Los aguiluchos seleccionan este tipo de plantaciones de especies exóticas como estructuras para establecer sus dormideros comunales (Sarasola y Negro 2006).
Tabla 1. Principales taxa de insectos registrados en la dieta del Aguilucho Langostero (Buteo swainsoni) en Argentina a partir del análisis de egagrópilas, contenidos estomacales u observaciones del comportamiento de alimentación.
Como resultado de su dieta insectívora, las estrategias de caza y de búsqueda de alimento en su área de distribución austral son particulares y sustancialmente distintas a las empleadas en la de cría. Sobre un total de 236 intentos de captura de insectos, el 61% corresponde a intentos que los aguiluchos realizaron en el aire mientras volaban aprovechando las corrientes térmicas durante las horas centrales del día, mientras que intenta la captura de insectos desde el suelo (39% del total registrado) durante las primeras horas de la mañana y por la tarde, cuando la temperatura ambiente es menor (Sarasola y Negro 2005). En el área de cría, sin embargo, los aguiluchos capturan vertebrados volando desde posaderos o desde el aire mientras planean buscando sus presas (England et al. 1997).
En comparación con las presas capturadas por otras rapaces insectívoras en áreas agrícolas de la provincia de La Pampa, el Aguilucho Langostero selecciona ortópteros de mayor biomasa que los capturados por la Lechucita Vizcachera (Athene cunicularia) y el Chimango (Milvago chimango). Esta selección de presas de mayor tamaño podría estar relacionada con el mayor tamaño corporal de la especie en comparación con las otras dos, aunque también puede suceder que estas presas sean más fáciles de capturar, proporcionando al mismo tiempo una mayor recompensa energética (Galmes 2006).
Otras causas de mortalidad
Además de la intoxicación con pesticidas, en Argentina el Aguilucho Langostero es susceptible de verse afectado por otro tipo de eventos no relacionados con la acción del hombre que resultan en incidentes de mortalidad masiva. En noviembre de 2003, 113 aguiluchos murieron en un dormidero comunal ubicado cerca de Villa Mirasol (provincia de La Pampa) como consecuencia de una tormenta de granizo (Sarasola et al. 2005). Otros 14 individuos fueron recuperados vivos, con evidentes signos de golpes y contusiones, aunque solo una decena de ellos sobrevivieron a la semana siguiente de ser recuperados en el terreno. Las marcas halladas en la corteza de los árboles que comprendían la arboleda utilizada como dormidero comunal permitieron estimar en más de 7 cm el diámetro de las piedras de hielo precipitadas durante la tormenta. Aunque Goldstein (1997) también menciona la caída de aguiluchos de sus posaderos en los dormideros luego de una tormenta como consecuencia de las fuertes ráfagas de viento, este tipo de fenómenos meteorológicos no parece tener la gravedad del primero, ya que no se ha registrado la muerte de individuos. Además del registro de este incidente de mortalidad, otro evento de similares características habría ocurrido en una fecha no precisa en un dormidero comunal ubicado próximo a la localidad de Olavarría (provincia de Buenos Aires), involucrando en este caso a varios centenares de aguiluchos (Santillán y Galmes, datos no publicados).
Aunque los hábitos relacionados con el comportamiento social (e.g., la utilización de dormideros comunales) podrían implicar un beneficio para las especies gregarias en términos de una reducción en las demandas de termorregulación, un menor riesgo de predación (efecto de dilución) y un incremento en su eficiencia de alimentación (Beauchamp 1999), podrían tener consecuencias catastróficas ante factores de mortalidad localizados en forma heterogénea, como son los eventos meteorológicos o los incidentes de intoxicación con pesticidas. La distribución discontinua del hábitat apropiado para la especie (i.e., las arboledas de especies exóticas o las pasturas dispersas en una matriz de cultivos) resulta en grandes agregaciones de aves en pequeñas áreas, lo que puede incrementar la probabilidad de mortalidad ante sucesos de este tipo.
El paradigma de la conservación sin fronteras: de dichos y hechos
Hasta hace relativamente pocos años era escasa la información sobre el área que ocupaba el Aguilucho Langostero en América del Sur durante el verano austral y el conocimiento sobre el destino austral de la especie se encontraba limitado a recuperaciones aisladas de anillos y a observaciones de campo anecdóticas (White et al. 1989). Durante el verano austral de 1995-1996, un año después de registrado el primer incidente de mortalidad de aguiluchos en el norte de la provincia de La Pampa (Woodbridge et al. 1995), investigadores argentinos y estadounidenses registraron más de 5000 aguiluchos envenenados como consecuencia de la intoxicación directa o la ingestión de langostas tratadas con insecticidas (Goldstein et al. 1996, 1999b, Hooper et al. 2002). En la mayoría de los 18 incidentes de mortalidad registrados, localizados geográficamente en el norte de la provincia de La Pampa, noroeste de Buenos Aires y sur de Córdoba, se identificó como causante del envenenamiento a un insecticida organofosforado de nombre comercial Monocrotophos (Goldstein et al. 1999b, Hooper et al. 2002). La estimación total de individuos afectados para la Región Pampeana se cifró en más de 20000 aguiluchos, aproximadamente el 5% de la población mundial estimada para la especie en aquel momento (Goldstein et al. 1996).
Los incidentes de mortandad registrados determinaron el inicio de un proyecto internacional y multidisciplinario que incluyó un seguimiento ecotoxicológico de las poblaciones invernantes (Goldstein 1997, Goldstein et al. 1999c), de sus movimientos y del uso de hábitat (Canavelli 2000, Canavelli et al. 2003). En forma paralela se desarrolló una campaña de difusión y educación destinada a productores, asesores agropecuarios y agentes vinculados a la comercialización de agroquímicos (Zaccagnini 2001), que incluyó la elaboración de un manual de procedimientos para documentar de mortandades de fauna silvestre en agroecosistemas (Uhart y Zaccagnini 1999). Las tareas de campo se desarrollaron con mayor énfasis durante el verano austral de 1996-1997 en el área que abarcaba la localización de los incidentes registrados durante el verano anterior y donde el producto causante de las mortandades fue excluido (Goldstein et al. 1999c). Los resultados de este trabajo fueron más que alentadores. En el verano austral de 1996-1997 no se registraron incidentes de mortandad en la zona de estudio y de exclusión del Monocrotophos en el norte de la provincia de La Pampa (Goldstein et al. 1999c) y solo se reportó un caso de mortalidad por envenenamiento en la provincia de Córdoba, que afectó a una veintena de aguiluchos (Goldstein et al. 2000, Hooper et al. 2002).
Este esfuerzo de cooperación y colaboración entre los países involucrados en la conservación de la especie fueron determinantes en el logro de los objetivos propuestos. La utilización del insecticida organofosforado causante del envenenamiento de los aguiluchos fue revisada y finalmente el producto fue retirado del mercado, quedando prohibida su comercialización y aplicación en el país desde 1999 (resolución Nº 189/99 de SAGPYA-SENASA). A pesar de este importante logro y aunque el riesgo de ocurrencia de nuevas mortandades puede haber disminuido a partir de la exclusión del Monocrotophos, otros productos organofosforados altamente tóxicos para la fauna silvestre siguen siendo empleados como insecticidas en la Región Pampeana (Hooper et al. 1999, 2002).
El Aguilucho Langostero y los agroecosistemas pampeanos
La Región Pampeana comprende una de las llanuras más extensas del planeta y conformó una de las primeras fronteras físicas con la que se encontraron los viajeros y colonos europeos que arribaron a esta región del sur de América del Sur. Su fisonomía, casi carente de relieve y de accidentes orográficos, sumada a la peculiaridad de esta vasta extensión de pastizales con casi nula vegetación arbórea, fueron las características que más remarcaron los primeros naturalistas en las crónicas de sus viajes a través de las pampas de Argentina. Este paisaje permaneció casi inalterado hasta entrado el siglo XIX, cuando sufre un rápido y profundo cambio, no solo por el establecimiento de nuevos asentamientos de colonos europeos luego del desplazamiento de los indígenas, sino también por el desarrollo de actividades productivas ligadas a esta colonización (Morello et al. 2003). Los datos referidos al incremento de la superficie cultivada dan claro ejemplo de este vertiginoso proceso. El área promedio destinada a cultivos en esta región aumentó de unos 6 millones de hectáreas durante los primeros cinco años del siglo XX a aproximadamente 20 millones hacia 1935-1940, alcanzando 26 millones en 1984 (Soriano 1992). Actualmente, las praderas pampeanas conforman una amplia planicie de más de 50 millones de hectáreas aptas para el cultivo y la crianza de ganado.
Este cambio se produjo tanto por la conversión de los pastizales naturales en campos de labranza como también por una gradual intensificación de la agricultura en zonas que ya estaban bajo regímenes de cultivo (Viglizzo 1994). Actualmente, la mayor superficie de la tierra en esta región se dedica a los cultivos anuales como trigo, maíz, girasol y soja (INDEC 2008). En algunas áreas, sin embargo, la producción agrícola y ganadera se combina en diferentes proporciones en respuesta a las condicionantes ambientales (Viglizzo et al. 1997), determinando el mantenimiento de pastizales naturales y el uso de amplias zonas para la implantación de pasturas anuales o perennes (avena y alfalfa) para el pastoreo directo o el acopio de pasto.
Tanto en su área de cría como en la de invernada, el Aguilucho Langostero se muestra como una especie adaptada a ambientes humanos, como son los ambientes agrícolas pampeanos. Los análisis de uso de hábitat a escala de paisaje realizados por Canavelli et al. (2003) mostraron una clara asociación entre el Aguilucho Langostero y pastizales implantados (e.g., alfalfa) o remanentes de pastizales naturales. En el norte de la provincia de La Pampa, los aguiluchos utilizan pasturas en una proporción significativamente mayor a la disponibilidad de áreas dedicadas a este tipo de uso de la tierra (Canavelli et al. 2003). Lo mismo ocurre con la utilización de arboledas y plantaciones de árboles exóticos, que los aguiluchos utilizan como dormideros comunales. Este tipo de arboledas, implantadas con el propósito de brindar protección contra el viento y el sol, han agregado una mayor complejidad estructural a un paisaje que, antes de la colonización europea, carecía casi completamente de vegetación arbórea. De un total de 34 dormideros comunales localizados a través de la Región Pampeana, todos ellos fueron arboledas de especies exóticas compuestas por Eucalyptus viminalis, Ulmus pumila, Cupressus spp. y Pinus spp. (Sarasola y Negro 2006). La selección como dormideros comunales de este tipo de arboledas que llevan implantadas en la región poco más de un centenar de años plantea, al menos, dos hipótesis sobre los efectos de estas estructuras sobre la ecología austral del Aguilucho Langostero. Por un lado, los aguiluchos podrían haber colonizado la Región Pampeana recientemente, cuando estas estructuras comenzaron a estar disponibles, ocupando hasta ese momento otros ambientes (e.g., la región del Espinal y su ecotono con los pastizales pampeanos). Por otro lado, la disponibilidad de estas arboledas podría haber afectado el comportamiento social de la especie, permitiendo que las agregaciones de aguiluchos en dormideros comunales involucren actualmente un mayor número de individuos que en el pasado (Sarasola y Negro 2006). Es de esperar que los cambios en el uso de la tierra en la Región Pampeana hayan modificado también la estructura y composición de la comunidad de insectos original y, por consiguiente, afectado en alguna medida los hábitos y la ecología espacial del Aguilucho Langostero en relación con los desplazamientos y disponibilidad de estas presas. Sin embargo, la escasez de registros históricos sobre la presencia de los aguiluchos en la Región Pampeana y de sus hábitos y comportamiento durante el verano austral no permiten contrastar adecuadamente estos posibles escenarios y, por lo tanto, evaluar en qué forma esta transformación del paisaje en las pampas argentinas puede haber afectado a la especie.
Desplazamiento y patrones de distribución
Durante el verano austral de 1997 unos pocos aguiluchos fueron observados en la misma área donde se localizó el mayor número de incidentes de mortandad y donde miles de aguiluchos invernaron durante los veranos australes previos (Canavelli 2000). Las causas de este cambio abrupto en la abundancia de aguiluchos se relacionaron inicialmente con la ocurrencia del fenómeno del Niño durante 1997-1998, que generó un incremento de 2.5-4 veces en la precipitación anual de la región, afectando la presencia de ortópteros (Canavelli 2000). En la actualidad, la precipitación anual de la región se ha establecido en sus valores promedio históricos, pero la abundancia de aguiluchos en esta zona no se ha reestablecido con respecto a las observadas durante 1996 y años precedentes (JH Sarasola, obs. pers.).
En enero de 1997 cuatro aguiluchos equipados con radio-emisores fueron localizados cerca de San Francisco (Córdoba), poco más de un mes después de haber sido capturados y marcados en el norte de la provincia de la Pampa a más de 500 km de su última localización (Goldstein et al. 2000). Esta alta capacidad de desplazamiento y el hecho de tratarse de una especie que explota recursos alimenticios superabundantes pero espacialmente impredecibles son factores que dificultan poder precisar su patrón de ocupación del espacio en una escala regional y sus posibles variaciones interanuales. Canavelli et al. (datos no publicados) realizaron mapas de distribución para la especie en una pequeña fracción (180000 ha) del área de distribución potencial del Aguilucho Langostero en la Región Pampeana. Aunque la finalidad de esos estudios era el monitoreo poblacional de la especie en relación con el riesgo de exposición a agroquímicos, la escala de estudio reducida (considerando su alta capacidad de desplazamiento) hace difícil tanto identificar las áreas ocupadas por las poblaciones de aguiluchos como así también asociar cualquier cambio local en la abundancia a incidentes de mortalidad. Sin embargo, la utilización de modelos predictivos de presencia-ausencia y de abundancia relativa a través de la Región Pampeana ha demostrado ser una herramienta adecuada para abordar la problemática que implica identificar el área de distribución actual de la especie. Variables topográficas, de uso de la tierra y de precipitación-evapotranspiración, estas últimas derivadas de imágenes satelitales y del cálculo del índice verde (NDVI; Normalized Difference Vegetation Index), predicen adecuadamente el patrón de distribución y abundancia de los aguiluchos en la Región Pampeana (Sarasola et al. 2008a). Para el período comprendido entre 2001-2003, los modelos predictivos y los mapas derivados de los mismos muestran una clara selección por parte de los aguiluchos de áreas en el centro-oeste y centro-sur de la provincia de Buenos Aires, que se mantuvo consistentemente durante los tres años. El enfoque regional de este estudio ha permitido identificar zonas de la Región Pampeana que, hasta el momento, no han sido consideradas de importancia como destino austral de la especie y donde no se han planteado estudios de monitoreo ecotoxicológico ni de evaluación de riesgo de intoxicación por pesticidas (Sarasola et al. 2008a).
Segregación espacial, conservación y el efecto del “área de distribución austral”
En las aves migratorias existe lo que se ha dado en llamar migración diferencial (Ketterson y Nolan 1983): una varianza intrapoblacional en el patrón de migración. Individuos de distintas edades o de distinto sexo viajan más lejos o más rápido, dependiendo en gran medida del papel que cumplen cada uno de estos grupos en los diferentes períodos del ciclo biológico de la especie (e.g., durante la reproducción). En el caso de una especie gregaria como el Aguilucho Langostero, la existencia de este tipo de estrategia de migración se vería reflejada en la segregación espacial de los individuos en su área de invernada, observándose bandadas o grupos compuestos por individuos de la misma edad y sexo. No existe una evaluación sobre este tipo de patrones de segregación para el Aguilucho Langostero, aunque Jaramillo (1993) observó que en el litoral bonaerense las bandadas de aguiluchos estaban compuestas enteramente por juveniles, mientras que England et al. (1997) mencionan áreas de la Región Pampeana en que las agregaciones de aguiluchos se componen casi exclusivamente por adultos.
A pesar de que es importante conocer estos aspectos de la ecología espacial del Aguilucho Langostero, desde el punto de vista de la conservación de la especie tiene mayor relevancia dilucidar la existencia de un patrón de segregación en función de su origen en el área de cría. Esto implica reconocer vínculos o conexiones geográficas entre las poblaciones reproductivas en el Hemisferio Norte y poblaciones en su área de distribución austral. De las 300 especies de aves migratorias neotropicales, se ha reportado una declinación significativa en las poblaciones reproductivas de al menos un tercio de ellas (109 especies; Rappole y McDonald 1994). Sin embargo, en la mayoría de los casos se desconocen cuáles son los factores que afectan en forma negativa a estas especies y que podrían, por lo tanto, relacionarse con las tendencias poblacionales observadas. Esta incertidumbre ha dado lugar a extensos debates sobre el origen geográfico (i.e., áreas de cría o áreas no reproductivas) de los factores limitantes para las poblaciones de aves migratorias neotropicales (Robbins et al. 1989, Rappole y MacDonald 1994, 1998, Latta y Baltz 1997). En el caso del Aguilucho Langostero, las poblaciones reproductivas han mostrado importantes retrocesos en su abundancia y distribución en California (una reducción de más del 90% de sus poblaciones en el último siglo; Bloom 1980, Risebrough et al. 1989), Oregon (Littlefield et al. 1984), Nevada (Herron et al. 1985) y en Alberta y Saskatchewan, en su rango de distribución canadiense (Houston y Schmutz 1995). Sin embargo, no existe un patrón general en el estatus poblacional de la especie para toda el área de cría. Mientras que las poblaciones mencionadas han decrecido a valores en algunos casos críticos, el resto de las poblaciones reproductivas se encuentran estables o incluso muestran incrementos leves en su abundancia (England et al. 1997). Este estatus de conservación diferencial ha llevado a hipotetizar sobre la existencia de un patrón de segregación de los aguiluchos: ciertas poblaciones reproductivas se segregarían en zonas del área de distribución austral, donde a su vez experimentarían altas mortalidades (Bloom 1980). Los envenenamientos y mortandades masivas ocurridas en la década de 1990 sustentan en parte esta hipótesis. A pesar de estas evidencias, estudios recientes que emplean el análisis de isótopos estables de hidrógeno en plumas de individuos capturados a través de la región han demostrado que las agregaciones de aguiluchos en la Región Pampeana están compuestas por individuos que provienen de distintas zonas de su área de cría (Sarasola et al. 2008b). De esta forma, la hipótesis de un “efecto del área de distribución austral” como causante de la declinación en la abundancia de ciertas poblaciones reproductivas del Hemisferio Norte pierde sustento. Por el contrario, y de acuerdo a estos resultados, los efectos demográficos que pueden tener las mortandades masivas de aguiluchos en su área de distribución austral se “diluirían” entre todas las poblaciones reproductivas en el Hemisferio Norte, sin afectar a ninguna en particular. Estos resultados están a su vez en concordancia con estudios que reportaron la ausencia de una clara estructura genética en las poblaciones reproductivas, pero también una reducción en el tamaño efectivo poblacional y un cuello de botella genético ocurrido en la última centuria que ha afectado a toda la población reproductiva en el Hemisferio Norte (Hull et al. 2008).
Conclusiones
A pesar de los avances logrados en el conocimiento de la ecología del Aguilucho Langostero durante su invernada en Argentina, son varios los aspectos directamente relacionados con una adecuada planificación de las actividades de monitoreo poblacional, educación ambiental y conservación de la especie que requieren de mayores estudios y esfuerzos de investigación.
Comparando las áreas donde previamente se han realizado tareas de investigación y seguimiento de la especie con las actualmente ocupadas por los aguiluchos, existe una amplia zona de la Región Pampeana en donde hoy se concentra la mayor población invernante de la especie y en la cual la problemática de la especie es desconocida, tanto por los productores rurales como por los profesionales vinculados directamente con el uso de agroquímicos (Sarasola et al. 2008a). De la misma forma, en estas zonas del centro y sur de la provincia de Buenos Aires no se han realizado estudios sobre el efecto que tienen las prácticas agrícolas sobre las poblaciones de Aguilucho Langostero, ni tampoco una evaluación ecotoxicológica de los individuos o un monitoreo poblacional. La principal dificultad para llevar adelante estas tareas radica en la amplia superficie que comprende la Región Pampeana, que imposibilita un trabajo que comprenda toda el área de distribución de la especie. El desarrollo de cartografía sobre el uso de agroquímicos, incluyendo también información sobre toxicidad relativa para la vida silvestre, podría ser un complemento a los mapas de distribución y abundancia en el área de invernada que permitiría identificar zonas críticas en donde concentrar esfuerzos de monitoreo y conservación. Aunque se han realizado mapas de riesgo de toxicidad y de uso de agroquímicos en parte de la Región Pampeana (Zaccagnini 2004), los resultados son incompletos y de poca utilidad a la luz del patrón de distribución y abundancia actual de la especie, que concentra la mayor parte de su población en la provincia de Buenos Aires, la cual no ha sido considerada en aquellos estudios.
Los sistemas agrícolas son altamente dinámicos; los cambios en el uso de la tierra o la intensificación de algunas actividades productivas en detrimento de otras pueden tener lugar en períodos cortos de tiempo (e.g., de solo unos pocos años). En el norte de la provincia de La Pampa, por ejemplo, los sistemas mixtos agro-ganaderos se están reemplazando gradualmente por sistemas netamente agrícolas, con predominio casi exclusivo de cultivos de soja (JH Sarasola, obs. pers.). Considerando los estudios previos sobre el uso de hábitat del Aguilucho Langostero en Argentina, tanto a escala local (Canavelli et al. 2003) como regional (Sarasola et al. 2008a), así como las principales presas consumidas por esta rapaz y los tipos de uso de la tierra con los que éstas se encuentran asociadas (e.g., Torrusio et al. 2002), el reemplazo de áreas de pastizal natural o implantado por cultivos de oleaginosas podría suponer una pérdida del hábitat propicio para la especie y el subsiguiente cambio en su patrón de distribución en la Región Pampeana. Las acciones futuras de investigación sobre esta especie deberían, por lo tanto, enfocarse en una evaluación de los efectos de estos cambios en el uso de la tierra sobre su ecología espacial y sus patrones de distribución.
El Aguilucho Langostero fue la especie que puso en evidencia un proceso que probablemente tenía lugar tiempo antes de que las mortandades por envenenamiento con agroquímicos fueran registradas y denunciadas, y que seguramente ha afectado a otras especies mucho menos conspicuas o con hábitos que dificultan registrar su muerte por envenenamiento (e.g., especies territoriales). De esta forma, el Aguilucho Langostero se ha convertido en una “especie paraguas” (Simberloff 1998) dentro de los agroecosistemas pampeanos, y las medidas y acciones de conservación llevadas adelante con el objetivo de preservar sus poblaciones, como la prohibición del producto responsable de las mortandades masivas de los años 1995 y 1996, han redundado también en la conservación de poblaciones de muchas especies de aves que habitan este ecosistema.
Agradecimientos. Este trabajo se ha nutrido en gran medida del trabajo de tesis doctoral de JHS, el cual fue realizado con el apoyo de la Wildlife Conservation Society (EEUU), la James L. Baillie Memorial Fund for Bird Research and Conservation (Canadá), Idea Wild (EEUU), la Universidad Nacional de La Pampa y el Consejo Nacional de Investigaciones Científicas y Técnicas de Argentina (CONICET). Agradecemos a Marc Bechard por su asesoramiento sobre la especie y por la discusión y aporte sobre las técnicas de campo, a Agustín Lanusse y familia por el apoyo logístico en el campo y a Juan José Negro, Ramón A. Sosa, Beltrán Gómez, Noah Whiteman, Verónica Salvador, Adelmar Funk, Marki Reyes, Vanesa Peretti y Juan José Urrutia por su colaboración en las tareas de campo.
Bibliografía Citada
Beauchamp G (1999) The evolution of communal roosting in birds: origin and secondary losses. Behavioral Ecology 10:675-687 [ Links ]
Bechard MJ, Sarasola JH y Woodbridge B (2006) A re-evaluation of evidence raises questions about the fasting migration hypothesis for Swainson’s Hawk (Buteo swainsoni). Hornero 21:65-72 [ Links ]
Bloom PH (1980) The status of the Swainson’s hawk in California, 1979. Bureau of Land Management and Federal Aid in Wildlife Restoration, California Department of Fish and Game, Sacramento [ Links ]
Bollmer J, Kimball RT, Whiteman NK, Sarasola JH y Parker PG (2006) Phylogeography of the Galápagos hawk: a recent arrival to the Galápagos Islands. Molecular Phylogenetics and Evolution 39:237-247 [ Links ]
Canavelli SB (2000) Abundance, movement and habitat use of Swainson’s hawks in their wintering grounds, Argentina. Tesis de Maestría, University of Florida, Gainsville [ Links ]
Canavelli SB, Bechard MJ, Woodbridge B, Kochert MN, Maceda JJ y Zaccagnini ME (2003) Habitat use by Swainson’s hawks on their austral wintering grounds in Argentina. Journal of Raptor Research 37:125-134 [ Links ]
Canavelli SB, Maceda JJ y Bosisio AC (2001) Dieta del Aguilucho Langostero (Buteo swainsoni) en su área de invernada (La Pampa, Argentina). Hornero 16:89-92 [ Links ]
England AS, Bechard MJ y Houston CS (1997) Swainson’s Hawk (Buteo swainsoni). Pp. 1-28 en: Poole A y Gill F (eds) The birds of North America. Academy of Natural Sciences y American Ornithologists’ Union, Filadelfia y Washington DC [ Links ]
Fuller MR, Seegar WS y Schueck LS (1998) Routes and travel rates of migrating Peregrine Falcons Falco peregrinus and Swainson’s Hawks Buteo swainsoni in the western hemisphere. Journal of Avian Biology 29:433-440 [ Links ]
Galmes MA (2006) Relaciones tróficas en un ensamble de rapaces con diferentes estatus de residencia en agroecosistemas de la Región Pampeana. Tesis de Grado, Universidad Nacional de La Pampa, Santa Rosa [ Links ]
Goldstein MI (1997) Toxicological assessment of a Neotropical migrant on its non-breeding grounds: case study of the Swainson’s hawk in Argentina. Tesis de Maestría, Clemson University, Clemson [ Links ]
Goldstein MI, Bechard MJ, Parker ML, Kochert MN y Lanusse AE (2000) Abundance, behavior, and mortality of Buteo swainsoni near San Francisco, Córdoba, Argentina in 1997. Hornero 15:117-121 [ Links ]
Goldstein MI, Bloom PH, Sarasola JH y Lacher TE (1999a) Post-migration weight gain of Swainson’s Hawks in Argentina. Wilson Bulletin 111:428-432 [ Links ]
Goldstein MI, Lacher TE Jr, Woodbridge B, Bechard MJ, Canavelli SB, Zaccagnini ME, Cobb GP, Scollon EJ, Tribolet R y Hooper MJ (1999b) Monocrotophos-induced mass mortality of Swainson’s hawks in Argentina, 1995-96. Ecotoxicology 8:201-214 [ Links ]
Goldstein MI, Lacher TE Jr, Zaccagnini ME, Parker ML y Hooper MJ (1999c) Monitoring and assessment of Swainson’s Hawks in Argentina following restrictions on monocrotophos use, 1996-97. Ecotoxicology 8:215-224 [ Links ]
Goldstein MI, Woodbridge B, Zaccagnini ME, Canavelli SG y Lanusse A (1996) An assessment of mortality of Swainson’s hawks in wintering grounds in Argentina. Journal of Raptor Research 30:106-107 [ Links ]
Herron GB, Mortimer CA y Rawlings MS (1985) Nevada raptors: their biology and management. Nevada Department of Wildlife, Reno [ Links ]
Hooper MJ, Mineau P, Zaccagnini ME, Winegrad GW y Woodbridge B (1999) Monocrotophos and the Swainson’s hawk. Pesticide Outlook 10:97-102 [ Links ]
Hooper MJ, Mineau P, Zaccagnini ME y Woodbridge B (2002) Pesticides and international migratory bird conservation. Pp. 737-753 en: Hoffman DJ, Rattner BA, Burton GA Jr y Cairns J Jr (eds) Handbook of ecotoxicology. Segunda edición. Lewis Publishers, Boca Raton [ Links ]
Houston CS y Schmutz JK (1995) Declining reproduction among Swainson’s hawks in prairie Canada. Journal of Raptor Research 29:198-201 [ Links ]
del Hoyo J, Elliott A y Sargatal J (1994) Handbook of the birds of the world. Volume 2. New World vultures to guineafowls. Lynx Edicions, Barcelona [ Links ]
Hull JM, Anderson R, Bradbury M, Estep JA y Ernest HB (2008) Population structure and genetic diversity in Swainson’s Hawks (Buteo swainsoni): implications for conservation. Conservation Genetics 9:305-316 [ Links ]
INDEC (2008) INDEC web. Instituto Nacional de Estadísticas y Censos, Buenos Aires (URL: http://www.indec.gov.ar/) [ Links ]
Jaramillo AP (1993) Wintering Swainson’s hawks in Argentina: food and age segregation. Condor 95:475-479 [ Links ]
Johnson CG, Nickerson LA y Bechard MJ (1987) Grasshopper consumption and summer flocks of nonbreeding Swainson’s hawks. Condor 89:676-678 [ Links ]
Ketterson ED y Nolan V Jr (1983) The evolution of differential bird migration. Current Ornithology 1:357-402 [ Links ]
Kirkley JS (1991) Do migrant Swainson’s Hawks fast en route to Argentina? Journal of Raptor Research 25:82-86 [ Links ]
Latta SC y Baltz ME (1997) Population limitation in Neotropical migratory birds: comments on Rappole and McDonald (1994). Auk 114:754-762 [ Links ]
Littlefield CD, Thompson SP y Bradley DE (1984) History and present status of Swainson’s hawks in southeast Oregon. Journal of Raptor Research 18:1-5 [ Links ]
Morello J, Mateucci SD y Rodríguez A (2003) Sustainable development and urban growth in the Argentine Pampas region. Annals of the American Academy of Political and Social Science 590:115-130 [ Links ]
Newton I (2004) Population limitation in migrants. Ibis 146:197-226 [ Links ]
Rappole JH y McDonald MV (1994) Cause and effect in population declines of migratory birds. Auk 111:652-660 [ Links ]
Rappole JH y McDonald MV (1998) Response to Latta and Baltz (1997). Auk 115:246-251 [ Links ]
Riesing MJ, Kruckenhauser L, Gamauf A y Haring E (2003) Molecular phylogeny of the genus Buteo (Aves: Accipitridae) based in mitochondrial marker sequences. Molecular Phylogenetics and Evolution 27:328-342 [ Links ]
Risebrough RW, Schlorff RW, Bloom PH y Littrell EE (1989) Investigations of the decline of Swainson’s hawk populations in California. Journal of Raptor Research 23:63-71 [ Links ]
Robbins CS, Sauer JR, Greenberg RS y Droege S (1989) Population declines in North American birds that migrate to the Neotropics. Proceedings of the National Academy of Sciences 86:7658-7662 [ Links ]
Rudolph DC y Fisher CD (1993) Swainson’s hawk predation on dragonflies in Argentina. Wilson Bulletin 105:365-366 [ Links ]
Sarasola JH, Bustamante J, Negro JJ y Travaini A (2008a) Where do Swainson’s Hawks winter? Satellite images used to identify potential habitat. Diversity and Distributions 14:742-753 [ Links ]
Sarasola JH y Negro JJ (2004) Gender identification in the Swainson’s Hawk Buteo swainsoni using molecular procedures and discriminant function analysis. Journal of Raptor Research 38:357-361 [ Links ]
Sarasola JH y Negro JJ (2005) Hunting success of wintering Swainson’s hawks: environmental effects on timing and choice of foraging method. Canadian Journal of Zoology 83:1353-1359 [ Links ]
Sarasola JH y Negro JJ (2006) Role of exotic tree stands on the current distribution and social behaviour of Swainson’s hawk, Buteo swainsoni, in the Argentine Pampas. Journal of Biogeography 33:1096-1101 [ Links ]
Sarasola JH, Negro JJ, Hobson K, Bortolotti GR y Bildstein KL (2008b) Can a “wintering area effect” explain the population status of Swainson’s hawks? A stable isotope approach. Diversity and Distributions 14:686-691 [ Links ]
Sarasola JH, Negro JJ, Salvador V y Maceda JJ (2005) Hailstorms as a cause of mass mortality of Swainson’s hawks in their wintering grounds. Journal of Wildlife Diseases 41:643-646 [ Links ]
Sarasola JH, Negro JJ y Travaini A (2004) Nutritional condition and serum biochemistry for free-living Swainson’s Hawks wintering in Central Argentina. Comparative Biochemistry and Physiology B 137:697-701 [ Links ]
Serracín Araujo R y Tiranti SI (1996) Stomach contents of a Swainson’s hawk from Argentina. Journal of Raptor Research 30:105-106 [ Links ]
Simberloff D (1998) Flagships, umbrellas, and keystones: is single-species management passé in the landscape era? Biological Conservation 83:247-257 [ Links ]
Smith NG (1980) Hawk and vulture migration on the Neotropics. Pp. 51-65 en: Keast A y Morton ES (eds) Migrant birds on the Neotropics: ecology, behavior, distribution and conservation. Smithsonian Institution Press, Washington DC [ Links ]
Smith NG, Goldstein DL y Bartholomew GA (1986) Is long-distance migration possible using only stored fat? Auk 103:607-611 [ Links ]
Soriano A (1992) Río de la Plata grasslands. Pp. 367-407 en: Coupland RT (ed) Ecosystems of the world. 8A. Natural grasslands: introduction and Western Hemisphere. Elsevier, Amsterdam [ Links ]
Torrusio S, Cigliano MM y de Wysiecki ML (2002) Grasshopper (Orthoptera: Acridoidea) and plant community relationships in the Argentine pampas. Journal of Biogeography 29:221-229 [ Links ]
Uhart M y Zaccagnini ME (1999) Manual de procedimientos operativos estandarizados de campo para documentar incidentes de mortandad de fauna silvestre en agroecosistemas. INTA, Buenos Aires [ Links ]
Viglizzo EF (1994) The response of low-imput agricultural systems to environmental variability: a theoretical approach. Agriculture Systems 44:1-17 [ Links ]
Viglizzo EF, Roberto ZE, Lértora F, López-Gay E y Bernardos J (1997) Climate and land-use change in field-crop ecosystems of Argentina. Agriculture Ecosystems and Environment 66:61-70 [ Links ]
Wheeler BK y Clark WS (1995) A photographic guide to North American raptors. Academic Press, San Diego [ Links ]
White CM, Boyce DA y Straneck R (1989) Observations on Buteo swainsoni in Argentina, 1984, with comments on food, habitat alteration, and agricultural chemicals. Pp. 79-87 en: Meyburg B-U y Chancellor RD (eds) Raptors in the modern world. Proceedings of the III World Conference on Birds of Prey and Owls. Eilat, Israel, 22-27 March 1987. World Working Group on Birds of Prey, Berlín, Londres y París [ Links ]
Woodbridge B, Finley KK y Seager ST (1995) An investigation of the Swainson’s Hawk in Argentina. Journal of Raptor Research 29:202-204 [ Links ]
Zaccagnini ME (2001) Agricultura y conservación: el Aguilucho Langostero de Argentina. Pp. 212-213 en: Primack R, Rozzi R, Feinsinger P, Dirzo R y Massardo F (eds) Fundamentos de conservación biológica. Perspectivas latinoamericanas. Fondo de Cultura Económica, México DF [ Links ]
Zaccagnini ME (2004) ¿Porqué monitoreo ecotoxicológico de diversidad de aves en sistemas productivos? Pp. 69-89 en: Larrea E (ed) INTA expone 2004. Volumen III. INTA, Buenos Aires [ Links ]














