Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
El hornero
Print version ISSN 0073-3407
Hornero vol.24 no.2 Ciudad Autónoma de Buenos Aires Aug./Dec. 2009
ARTÍCULOS
Dieta de la Lechucita Vizcachera (Athene cunicularia) en dos áreas con diferente uso de la tierra en el centro–sur de la provincia de La Pampa, Argentina
Daniela C. de Tommaso 1,4, Roberta G. Callicó Fortunato 2, Pablo Teta 1 y Javier A. Pereira 3
1 Museo Argentino de Ciencias Naturales "Bernardino Rivadavia". Av. Ángel Gallardo 470, C1405DJR Buenos Aires, Argentina.
2 Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Pab. 2, Ciudad Universitaria, C1428EHA Buenos Aires, Argentina.
3 Asociación para la Conservación y el Estudio de la Naturaleza (ACEN). Barrio Cardales Village, UF 90, Ruta 4 km 5.5, Los Cardales, 2814 Campana, Buenos Aires, Argentina.
4 danieladetommaso@yahoo.com.ar
Resumen
Se estudió la dieta de la Lechucita Vizcachera (Athene cunicularia) en dos áreas con diferente uso de la tierra en el sector central de la ecorregión del Monte de Llanuras y Mesetas, en la provincia de La Pampa, Argentina: en un área protegida (el Parque Nacional Lihué Calel) y en un establecimiento ganadero sujeto a pastoreo intensivo (estancia La Manuela). Se identificaron 1251 ítems presa, en su mayoría correspondientes a Coleoptera, Scorpiones y Rodentia. La Lechucita Vizcachera presentó hábitos tróficos generalistas. La importancia numérica de los distintos ítems presa en la dieta varió significativamente entre ambas áreas, tanto durante la estación reproductiva como durante la no reproductiva. Sin embargo, el peso promedio de los pequeños mamíferos consumidos y la amplitud de nicho trófico estandarizada fueron muy similares entre ambas áreas y coinciden con la información existente para esta especie en otros sectores de la ecorregión del Monte de Llanuras y Mesetas. Sobre la base de la biomasa consumida, la Lechucita Vizcachera se comportó como un predador carnívoro durante la estación reproductiva y como carnívoro–insectívoro durante la estación no reproductiva.
Palabras clave: H ábitos tróficos; Monte de Llanuras y Mesetas; Pequeños mamíferos; Strigidae; Strigiformes.
Abstract
Diet of the Burrowing Owl (Athene cunicularia) in two areas with different land use in south–central La Pampa Province, Argentina
We studied the diet of the Burrowing Owl (Athene cunicularia) in two areas with different land use in the central sector of the Monte de Llanuras y Mesetas Ecoregion, La Pampa Province, Argentina: a protected area (Lihué Calel National Park) and an intensively grazed cattle ranch (La Manuela). We identified 1251 prey items, mainly corresponding to Coleoptera, Scorpiones and Rodentia. In both areas the Burrowing Owl was a generalist feeder. The frequency of the different prey items in the diet varied significantly between areas, both during the reproductive and the non-reproductive seasons. However, the mean weight of ingested small mammals and the standardized trophic niche breadth were similar between areas and to those reported for this species in other sectors of the Monte de Llanuras y Mesetas Ecoregion. According to the ingested biomass, the Burrowing Owl behaved as a carnivorous predator during the reproductive season and as carnivorous–insectivorous during the non-reproductive one.
Key words: Food habits; Monte de Llanuras y Mesetas; Small mammals; Strigidae; Strigiformes.
Recibido 22 junio 2009, aceptado 30 diciembre 2009
La Lechucita Vizcachera (Athene cunicularia) es una estrigiforme de tamaño pequeño (154–247 g), de costumbres diurno-crepusculares y de hábitos de nidificación hipogeos, que habita en pastizales, montes abiertos, praderas y estepas arbustivas desde Canadá hasta el extremo austral de América del Sur (Marks et al. 1999). En Argentina es la especie de lechuza más frecuente en agroecosistemas y áreas abiertas de pastizal (Bellocq 1993). La ecología trófica de esta especie ha sido bien estudiada en los matorrales esclerófilos del centro de Chile (e.g., Schattler et al. 1980a, 1980b, Torres-Contreras et al. 1994, Silva et al. 1995) y en los agroecosistemas, pastizales y áreas urbanas del centro–este de Argentina (e.g., Coccia 1984, Bellocq 1987, 1988, 1997, Bó et al. 2007, Sánchez et al. 2008). En la ecorregión del Monte de Llanuras y Mesetas, un bioma endémico de Argentina (Burkart et al. 1999), la dieta de esta lechuza ha sido reportada para el sector más austral y en áreas de ecotono con la Patagonia (e.g., Massoia et al. 1988, De Santis et al. 1997, Osorio 2004, Nabte et al. 2008), pero no para los sectores centrales. En general, estos estudios se han enfocado en la relación predador–presa, tanto en forma cualitativa como cuantitativa, sin evaluar la influencia de las actividades humanas sobre la ecología trófica de esta especie. De hecho, muchos de ellos fueron realizados en áreas con escasa presencia humana, como el área natural protegida de Península de Valdés en Argentina (Nabte et al. 2008) o el Parque Nacional Fray Jorge en Chile (Silva et al. 1995).
En América del Norte, las poblaciones de la Lechucita Vizcachera han declinado significativamente en las últimas décadas, fundamentalmente como resultado de la pérdida y fragmentación del hábitat, el uso de pesticidas y la persecución directa (Holroyd et al. 2001, Conway et al. 2006), aunque algunas evidencias son contradictorias (e.g., Moulton et al. 2006). El pastoreo por ganado, entre otras actividades de origen humano, afecta la presencia y abundancia de micromamíferos (e.g., Tabeni y Ojeda 2003), que según varios autores constituyen el principal ítem en términos de biomasa en la dieta de esta lechuza (e.g., Bellocq 1988, Silva et al. 1995). Sin embargo, al menos en el Hemisferio Norte, las lechucitas son más abundantes y tienen mayor éxito reproductivo en áreas pastoreadas por bóvidos silvestres. Esto podría deberse a que el pastoreo genera áreas abiertas que las lechuzas prefieren porque les permiten detectar posibles predadores, así como por la mayor heterogeneidad que, a escala de paisaje, presentan los parches pastoreados (Murray 2005). En la provincia de La Pampa, Villareal et al. (2005) estudiaron el tamaño de los parches ocupados por la Lechucita Vizcachera en sectores con distinta intensidad de pastoreo por vizcachas (Lagostomus maximus) y la disponibilidad de artrópodos (sus principales presas en términos de frecuencia) en los mismos. Las lechucitas prefirieron los parches pastoreados pequeños (aproximadamente unas 0.18 ha) ya que éstos se asocian generalmente con espacios arbustivos más abiertos. Sin embargo, tal como reconocen los mismos autores, una limitación del estudio fue no haber cuantificado la dieta de las lechucitas bajo diferentes condiciones de pastoreo.
En este trabajo se presentan los primeros datos de dieta para la Lechucita Vizcachera en la provincia de La Pampa, Argentina. Al mismo tiempo, se compara la composición de la dieta en dos áreas adyacentes que difieren en el uso de la tierra, incluyendo una reserva con exclusión de ganado y un establecimiento dedicado a la ganadería de cría extensiva.
Métodos
Se colectaron 106 egagrópilas enteras, un número indeterminado de egagrópilas fragmentadas y restos de presas de la Lechucita Vizcachera en dos áreas que difieren en el uso de la tierra: el Parque Nacional Lihué Calel (37°57'S, 65°39'O) y la estancia La Manuela (37°57'S, 65°42'O). El Parque Nacional Lihué Calel es un área protegida de 32000 ha libre de la presencia de ganado desde hace al menos 25 años. La estancia La Manuela, por el contrario, es un establecimiento dedicado a la ganadería bovina extensiva de cría, con cargas de 0.1 vacas/ha. Ambas áreas se ubican en el centro–sur de la provincia de la Pampa, Argentina, en la ecorregión del Monte de Llanuras y Mesetas (Burkart et al. 1999). La vegetación corresponde a un arbustal mixto–pastizal con Larrea divaricata, Condalia microphylla, Chuquiraga erinacea, Stipa tenuis y Piptochaetium napostaense (Cano et al. 1980). La cobertura del estrato arbustivo varía entre 60–70% en Lihué Calel y 10–20% en La Manuela, mientras que la del estrato graminoso alcanza un 20–25% y un 10–40%, respectivamente. El clima es fuertemente estacional, con veranos húmedos y cálidos e inviernos fríos y secos. La temperatura promedio es de 24.7 °C en enero y de 8.9 °C en julio. Las precipitaciones se concentran mayormente entre la primavera y el otoño, con un promedio de 498 mm por año (período 1986–2002, datos obtenidos en la estación meteorológica del Parque Nacional Lihué Calel).
Las egagrópilas fueron colectadas en sitios de perchado y en la entrada de cuevas entre febrero de 2007 y febrero de 2008, provenientes al menos de siete parejas de Lechucita Vizcachera (tres en el Parque Nacional Lihué Calel y cuatro en la estancia La Manuela). En cada área se consideraron por separado las egagrópilas y restos de presas correspondientes a la estación reproductiva (primavera–verano; desde septiembre hasta febrero) y no reproductiva (otoño–invierno; desde marzo hasta agosto) (Silva et al. 1995, Bellocq 1993).
La determinación taxonómica de los ítems presa fue realizada a partir de fragmentos cráneo-mandibulares o cuerpos enteros en el caso de los vertebrados y de restos de exoesqueleto para los artrópodos, utilizando como referencia material comparativo depositado en las colecciones del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia". El número mínimo de individuos en las muestras fue establecido a partir del conteo de restos cráneo-mandibulares (mamíferos, aves y reptiles), cuerpos enteros (anfibios), cabezas y élitros (coleópteros), patas (ortópteros) y pinzas (escorpiones).
Para cada uno de los tipos de presa se calculó la frecuencia relativa como FR = Ni/Nt (donde Ni es el número mínimo de individuos de la presa i y Nt es el número total de presas) y la biomasa, en porcentaje, como BM = (100 wi Ni) / S wi Ni, donde wi es el peso de la presa i. Los pesos de las presas fueron tomados de Sarasola et al. (2003), excepto en el caso de Rhinella arenarum para el que corresponde al reportado por Sánchez et al. (2008). El peso promedio de las presas consumidas se calculó como PP = S wi Ni/Nt (Jaksic y Marti 1981). La amplitud de nicho trófico se estimó con el Índice de Levins, B = 1 / S pi2, donde pi es la frecuencia relativa de cada categoría de presa, y con su versión estandarizada, Best = (B – Bmin) / (Bmax – Bmin), donde Bmin = 1 y Bmax es el número máximo de categorías (véase Marti 1987).
Las diferencias en la dieta entre estaciones y áreas fueron evaluadas con la Prueba de Chi-cuadrado. Para este análisis se agruparon los ítems presa en cuatro categorías que incluyen los tres principales grupos de presas utilizados por la Lechucita Vizcachera (coleópteros, escorpiones, mamíferos y otros). Para los mamíferos se consideraron cinco categorías, incluyendo las cuatro especies mejor representadas en la dieta (Calomys musculinus, Ctenomys azarae, Eligmodontia typus, Graomys griseoflavus y otros).
Resultados
Se identificaron 1251 ítems presa, correspondientes a ocho órdenes (Tabla 1). Los ítems que fueron más consumidos pertenecen a los órdenes Coleoptera y Scorpiones, mientras que para el orden Rodentia se registró un menor consumo. Con frecuencias numéricas más bajas (<5%), también se registraron otros pequeños vertebrados (e.g., Amphibia, Passeriformes, Squamata) y artrópodos (e.g., Orthoptera). Se hallaron diferencias significativas en la dieta de las lechucitas a nivel de categorías de ítems presa entre ambas áreas, tanto durante la estación reproductiva (X2 = 32.6, gl = 3, P < 0.001) como durante la no reproductiva (X2 = 63.0, gl = 3, P < 0.001). La dieta varió estacionalmente en forma significativa tanto en el Parque Nacional Lihué Calel (X2 = 46.6, gl = 3, P < 0.001) como en la estancia La Manuela (X2 = 80.0, gl = 3, P < 0.001). En Lihué Calel, la proporción de coleópteros fue similar en ambas estaciones, mientras que los escorpiones fueron más abundantes durante la estación no reproductiva (Tabla 1). En La Manuela, tanto los coleópteros como los escorpiones fueron más frecuentes en la estación no reproductiva. En ambas áreas la participación de los mamíferos (principalmente roedores) en la dieta aumentó durante la estación reproductiva.
Tabla 1. Dieta de la Lechucita Vizcachera (Athene cunicularia) en un área protegida (Parque Nacional Lihué Calel) y en un establecimiento ganadero (estancia La Manuela) en el centro–sur de la provincia de La Pampa, Argentina. Para cada ítem presa se muestra su peso, la frecuencia relativa en la dieta (FR) y la biomasa, en porcentaje, en la dieta (BM). Para cada periodo, entre paréntesis, se muestra el número de presas.
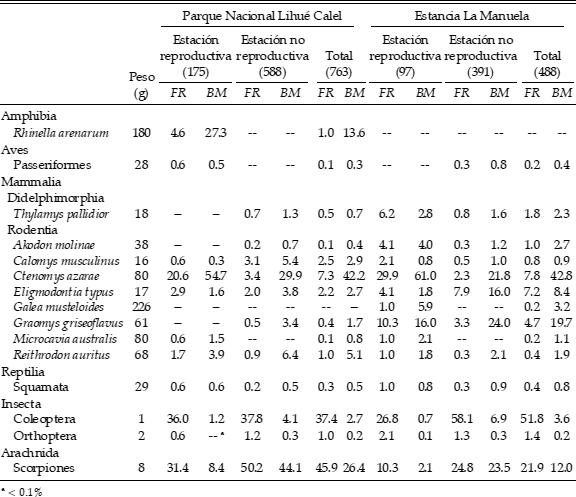
Entre los micromamíferos, la especie mejor representada en la dieta en ambas áreas fue Ctenomys azarae, seguido por Calomys musculinus en Lihué Calel y por Eligmodontia typus y Graomys griseoflavus en La Manuela (Tabla 1). En forma global, los ensambles de pequeños mamíferos (peso < 500 g) predados por la Lechucita Vizcachera variaron entre las áreas (X2 = 36.9, gl = 5, P < 0.001).
El peso de las presas consumidas varió entre 1 g (Coleoptera) y 226 g (Microcavia australis) (Tabla 1). Aunque los coleópteros fueron muy frecuentes en todas las muestras, su aporte en términos de biomasa fue minoritario (<7% en todos los casos) (Tabla 1). El mayor aporte correspondió a Rodentia, seguido por Scorpiones durante la estación no reproductiva y por Amphibia (en Lihué Calel) y Didelphimorphia (en La Manuela) durante la estación reproductiva (Tabla 1). Los vertebrados representaron más del 90% de la biomasa consumida durante la estación reproductiva y poco menos del 70% en la estación no reproductiva. El peso promedio de las presas consumidas durante la estación no reproductiva fue similar en ambas áreas, con un importante aumento durante la estación reproductiva (Tabla 2). Con el peso promedio de los mamíferos consumidos se registró una tendencia similar. En un análisis global de las muestras, este peso promedio varió entre 50 y 55 g (La Manuela y Lihué Calel, respectivamente).
Tabla 2. Peso promedio de las presas consumidas (PPp), peso promedio de los pequeños mamíferos consumidos (PPpm), amplitud de nicho trófico (B) y amplitud de nicho trófico estandarizada (Best) de la dieta de la Lechucita Vizcachera (Athene cunicularia) en un área protegida (Parque Nacional Lihué Calel) y en un establecimiento ganadero (estancia La Manuela) en el centro-sur de la provincia de La Pampa, Argentina.
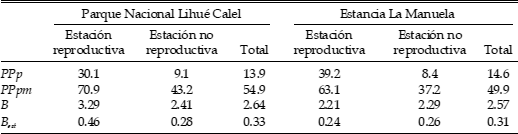
La amplitud de nicho trófico estandarizada, considerando todas las clases como categorías, varió entre 0.24 (en La Manuela) y 0.46 (en Lihué Calel), en ambos casos durante la estación reproductiva (Tabla 2). Globalmente, varió entre 0.31 y 0.33 (La Manuela y Lihué Calel, respectivamente). Las mayores diferencias para este parámetro entre las áreas se observaron durante la estación reproductiva, ya que la participación relativa de mamíferos, coleópteros y escorpiones fue más equitativa en Lihué Calel que en La Manuela (en donde más de la mitad de las presas fueron mamíferos).
Discusión
La dieta de la Lechucita Vizcachera en la zona central de la ecorregión del Monte de Llanuras y Mesetas se compone principalmente de coleópteros, escorpiones y roedores. Con cierta variación entre regiones y estaciones, estos mismos grupos han sido previamente registrados por otros autores como las principales presas de Athene cunicularia, tanto en el Hemisferio Norte como en el Sur (Jaksic y Marti 1981, Marks et al. 1999). En este estudio, las proporciones de los principales ítems variaron entre los períodos considerados, siendo más frecuentes los vertebrados (principalmente mamíferos) en la estación reproductiva. Estas variaciones se vieron reflejadas tanto en el peso promedio de las presas como en el peso promedio de los micromamíferos.
Todos los micromamíferos registrados en la dieta corresponden a especies ampliamente distribuidas en el Monte de Llanuras y Mesetas (Pardiñas et al. 2005). Sin embargo, algunas de las especies mejor representadas variaron entre las áreas, probablemente como consecuencia de su abundancia en el campo. En efecto, Calomys musculinus (una especie que prefiere los ambientes arbustivos, jarillales y pastizales) fue la especie más frecuente en muestreos de capturas con trampas dentro del Parque Nacional Lihué Calel (Teta et al. 2009). Por el contrario, Eligmodontia typus y Graomys griseoflavus, dos roedores sigmodontinos que, por sus características morfológicas y funcionales (e.g., bulas timpánicas globosas y grandes, locomoción a saltos y en zigzag; Tabeni y Ojeda 2003, Taraborelli et al. 2003) están mejor adaptados para explotar espacios abiertos y con baja cobertura vegetal, fueron más abundantes en La Manuela (Pereira datos no publicados). Eligmodontia typus, por ejemplo, es una especie oportunista que usualmente aumenta su frecuencia en áreas sometidas a perturbaciones, tanto de origen humano como naturales (e.g., sobrepastoreo, incendios; véase Tabeni y Ojeda 2003).
El peso promedio de las presas consumidas fue mayor o igual que el registrado para otras zonas de América del Sur (e.g., 1.2–1.5 g en matorrales esclerófilos del centro de Chile, Jaksic et al. 1981; 21 g en un pastizal costero periurbano del centro–este de Argentina, Sánchez et al. 2008; 13.2–18.1 g en pastizales y sabanas del sudeste de Brasil, Motta-Junior y Bueno 2004; 1.3 g en ambientes de Cerrado en el centro–sur de Brasil, Motta-Junior 2006), mientras que el peso promedio de los mamíferos consumidos fue similar a otros registrados en la literatura (e.g., 45–67 g en el centro de Chile, Jaksic et al. 1981; 41 g en el centro–este de Argentina, Sánchez et al. 2008; 32.2–43.6 g en el Monte de Llanuras y Mesetas en la provincia de Chubut, Argentina, De Santis et al. 1997, Nabte et al. 2008).
Tomando como base el aporte en biomasa de vertebrados e invertebrados, se podría clasificar a la Lechucita Vizcachera como un predador carnívoro durante la estación reproductiva y como carnívoro–insectívoro (en ese orden) durante la estación no reproductiva (Silva et al. 1995). Situaciones similares, con un consumo elevado de vertebrados (especialmente de roedores) durante la estación reproductiva, han sido documentadas para ambientes áridos y semiáridos de Chile y Perú (Schattler et al. 1980a, 1980b, Torres-Contreras et al. 1994, Silva et al. 1995, Arana et al. 2006). La selección de presas más grandes durante la etapa de crianza de los pichones podría responder, como ha sido referido para otras aves rapaces (e.g., Lamore 1963, Balgooyen 1976, Sarasola et al. 2003), a los mayores requerimientos energéticos que poseen los pichones en comparación con los individuos adultos.
La amplitud de nicho trófico estandarizada, considerando a todas las clases como categorías, fue mayor que la registrada en otras regiones de América del Sur (e.g., 0.10 en el centro de Chile, Jaksic et al. 1981; 0.08–0.23 en el centro–este de Argentina, Sánchez et al. 2008; 0.05–0.22 en el sudeste de Brasil, Motta-Junior y Bueno 2004; 0.06 en el centro–sur de Brasil, Motta-Junior 2006; 0.11–0.61 en matorrales xerófitos del noroeste de Paraguay, Andrade et al. 2004), pero estuvo dentro del rango de los valores documentados para otras localidades en el Monte de Llanuras y Mesetas (0.26–0.88; Ramírez-Llorens 2003).
La falta de réplicas para las áreas consideradas en este estudio y los reducidos tamaños de muestra limitan la generalidad de las conclusiones alcanzadas. Aunque las evidencias sugieren que los principales parámetros de la dieta (e.g., peso promedio de las presas consumidas, peso promedio de los pequeños mamíferos consumidos, amplitud de nicho trófico estandarizada) no varían mucho entre ambas áreas (a pesar de las marcadas diferencias en el uso de la tierra), esta hipótesis merece nuevos exámenes, tanto a través del análisis de un mayor número de muestras como de estudios de más largo aliento.
Agradecimientos. Silvina Bisceglia, Natalia Fracassi y Fernando Gallego participaron de la recolección de las muestras y en la discusión de los resultados. Pablo Collavino y el personal del Parque Nacional Lihué Calel brindaron su hospitalidad y facilidades logísticas. La Administración de Parques Nacionales, a través de Claudio Chehébar, concedió los permisos para realizar los trabajos en el área. Javier Lopez de Casenave, Ulyses Pardiñas y tres revisores anónimos realizaron valiosas sugerencias que contribuyeron a mejorar substancialmente la claridad de este manuscrito.
Bibliografía Citada
1. Andrade A, Teta P y Contreras JR (2004) Dieta de la Lechucita Vizcachera (Speotyto cunicularia) en el Parque Nacional Médanos del Chaco (Paraguay). Ornitología Neotropical 15:87–92 [ Links ]
2. Arana M, Ruíz-Luna ML, Santa María S y Ramírez O (2006) Population fluctuations of the house mouse in the Peruvian loma and the functional response of Burrowing Owls. Austral Ecology 31:956–960 [ Links ]
3. Balgooyen TG (1976) Behavior and ecology of the American Kestrel (Falco sparverius L.) in the Sierra Nevada of California. University of California Publications in Zoology 103:1–87 [ Links ]
4. Bellocq MI (1987) Selección de hábitat de caza y depredación diferencial de Athene cunicularia sobre roedores en ecosistemas agrarios. Revista Chilena de Historia Natural 60:81–86 [ Links ]
5. Bellocq MI (1988) Dieta de Athene cunicularia (Aves; Strigidae) y sus variaciones estacionales en ecosistemas agrarios de la pampa argentina. Physis 46:17–22 [ Links ]
6. Bellocq MI (1993) Reproducción, crecimiento y mortalidad de la Lechucita Vizcachera (Speotyto cunicularia) en agroecosistemas pampeanos. Hornero 13:272–312 [ Links ]
7. Bellocq MI (1997) Ecology of the Burrowing Owl in agroecosystems of Central Argentina. Journal of Raptor Research Reports 9:35–41 [ Links ]
8. Bó MS, Baladrón AV y Biondi LM (2007) Ecología trófica de Falconiformes y Strigiformes: tiempo de síntesis. Hornero 22:97–115 [ Links ]
9. Burkart R, Bárbaro NO, Sánchez RO y Gómez DA (1999) Eco-regiones de la Argentina. Instituto Nacional de Tecnología Agropecuaria, Buenos Aires [ Links ]
10. Cano E, Casagrande G, Conti H, Salazar J, Plaza LEA, Peña Zubiate C, Maldonado Pinedo D, Martínez H, Hevia R, Scoppa C, Fernández B, Montes M, Musto J y Pittaluga A (1980) Inventario integrado de los recursos naturales de la provincia de La Pampa. Instituto Nacional de Tecnología Agropecuaria y Universidad Nacional de La Pampa, Buenos Aires [ Links ]
11. Coccia M (1984) Observaciones ecológicas sobre Athene cunicularia partridgei, Olrog 1976, en pastizales inundables de la albufera Mar Chiquita (provincia de Buenos Aires). Tesis de licenciatura, Universidad Nacional de Mar del Plata, Mar del Plata [ Links ]
12. Conway CJ, García V, Smith MD, Ellis LA y Whitney JL (2006) Comparative demography of Burrowing Owls in agricultural and urban landscapes in southeastern Washington. Journal of Field Ornithology 77:280–290 [ Links ]
13. De Santis LJM, García Esponda CM y Moreira GJ (1997) Mamíferos integrantes de la dieta de Athene cunicularia (Aves: Strigidae) en la región costera de la provincia del Chubut (Argentina). Neotrópica 43:125–126 [ Links ]
14. Holroyd GL, Rodríguez-Estrella R y Sheffield SR (2001) Conservation of the Burrowing Owl in western North America: issues, challenges, and recommendations. Journal of Raptor Research 35:399–407 [ Links ]
15. Jaksic FM, Greene HW y Yáñez JL (1981) The guild structure of a community of predatory vertebrates in Central Chile. Oecologia 49:21–28 [ Links ]
16. Jaksic FM y Marti CD (1981) Trophic ecology of Athene owls in Mediterranean-type ecosystems: a comparative analysis. Canadian Journal of Zoology 59:2331–2340 [ Links ]
17. Lamore DH (1963) Prey of a sparrow hawk family when raising young. Wilson Bulletin 75:461 [ Links ]
18. Marks JS, Cannings RJ y Mikkola H (1999) Family Strigidae (typical owls). Pp. 76–242 en: del Hoyo J, Elliott A y Sargatal J (eds) Handbook of the birds of the world. Volume 5. Barn owls to hummingbirds. Lynx Edicions, Barcelona [ Links ]
19. Marti CD (1987) Raptor food habits studies. Pp. 67–80 en: Pendleton BAG, Millsap BA, Cline KW y Bird DM (eds) Raptor management techniques manual. National Wildlife Federation, Washington DC [ Links ]
20. Massoia E, Vetrano AS y La Rossa FR (1988) Análisis de regurgitados de Athene cunicularia de Península Valdés, Departamento Biedma, provincia de Chubut. Boletín Científico APRONA 4:4–13 [ Links ]
21. Motta-Junior JC (2006) Relações tróficas entre cinco Strigiformes simpátricas na região central do Estado de São Paulo, Brasil. Revista Brasileira de Ornitologia 14:359–377 [ Links ]
22. Motta-Junior JC y Bueno AA (2004) Trophic ecology of the Burrowing Owl in Southeast Brazil. Pp. 763–775 en: Chancellor RD y Meyburg BU (eds) Raptors worldwide. World Working Group on Birds of Prey/MME-BirdLife Hungary, Berlin and Budapest [ Links ]
23. Moulton CE, Bryan RS y Belthoff JR (2006) Association between wildlife and agriculture: underlying mechanisms and implications in Burrowing Owls. Journal of Wildlife Management 70:708–716 [ Links ]
24. Murray JO (2005) The influence of grazing treatments on density of nesting Burrowing Owls on the Cheyenne River Sioux Reservation. Tesis de Maestría, South Dakota State University, Brookings [ Links ]
25. Nabte MJ, Pardiñas UFJ y Saba SL (2008) The diet of the Burrowing Owl, Athene cunicularia, in the arid lands of northeastern Patagonia, Argentina. Journal of Arid Environments 72:1526–1530 [ Links ]
26. Osorio MV (2004) Respuesta de micromamíferos al fuego en Península Valdés, analizada a través de la dieta de Speotyto cunicularia (Aves: Strigidae). Mastozoología Neotropical 11:253–254 [ Links ]
27. Pardiñas UFJ, Abba AM y Merino ML (2005) Micromamíferos (Didelphimorphia y Rodentia) del sudoeste de la provincia de Buenos Aires (Argentina): taxonomía y distribución. Mastozoología Neotropical 11:211–232 [ Links ]
28. Ramírez-Llorens P (2003) Ecología trófica de Strigiformes en Argentina: Pulsatrix perspicillata (Lechuzón Mocho Grande). Tesis de licenciatura, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Buenos Aires [ Links ]
29. Sánchez KB, Malizia AI y Bó MS (2008) Trophic ecology of the burrowing owl (Athene cunicularia) in urban environments of Mar Chiquita Biosphere Reserve (Buenos Aires Province, Argentina). Ornitología Neotropical 19:71–80 [ Links ]
30. Sarasola JH, Santillán MA y Galmes MA (2003) Food habits and foraging ecology of American Kestrels in the semiarid forests of Central Argentina. Journal of Raptor Research 37:236–243 [ Links ]
31. Schlatter RP, Yáñez J, Núñez H y Jaksic FM (1980a) Estudio estacional de la dieta del pequén, Athene cunicularia (Molina) (Aves, Strigidae) en la precordillera de Santiago. Ambientes Terrestres 6:9–18 [ Links ]
32. Schlatter R, Yáñez J, Núñez H y Jaksic FM (1980b) The diet of the Burrowing Owl in central Chile and its relation to prey size. Auk 97:616–619 [ Links ]
33. Silva SI, Lazo I, Silva-Aranguiz E, Jaksic FM, Meserve P y Gutiérrez JR (1995) Numerical and functional responses of Burrowing Owl to long-term mammal fluctuations in Chile. Journal of Raptor Research 29:250–255 [ Links ]
34. Tabeni S y Ojeda RA (2003) Assessing mammal responses to perturbations in temperate aridlands of Argentina. Journal of Arid Environments 55:715–726 [ Links ]
35. Taraborelli P, Corbalán V y Giannoni SM (2003) Locomotion and escape modes in rodents of the Monte Desert (Argentina). Ethology 109:475–485 [ Links ]
36. Teta P, Pereira JA, Fracassi NG, Bisceglia SBC y Heinonen Fortabat S (2009) Micromamíferos (Didelphimorphia y Rodentia) del Parque Nacional Lihue Calel, La Pampa, Argentina. Mastozoología Neotropical 16:183–198 [ Links ]
37. Torres-Contreras H, Silva Aranguiz E y Jaksic FM (1994) Dieta y selectividad de presas de Speotyto cunicularia en una localidad semiárida del norte de Chile a lo largo de siete años (1987–1993). Revista Chilena de Historia Natural 67:329–340 [ Links ]
38. Villareal D, Machicote M, Branco LC, Martínez JJ y Gopar A (2005) Habitat patch size and local distribution of Burrowing Owls (Athene cunicularia) in Argentina. Ornitología Neotropical 16:529–537 [ Links ]














