Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407
Hornero vol.25 no.1 Ciudad Autónoma de Buenos Aires ene./ago. 2010
ARTÍCULOS
Ensambles de aves del Parque Nacional Pre-Delta (Entre Ríos, Argentina): análisis de la importancia ornitológica de distintas unidades ambientales
Ana L. Ronchi-Virgolini 1,2, Rodrigo E. Lorenzón 2,3, Adolfo H. Beltzer 2 y Julián M. Alonso 4
1 CICyTTP-CONICET. Matteri y España, 3105 Diamante, Entre Ríos, Argentina. lronchi@gmail.com
2 Instituto Nacional de Limnología. Ciudad Universitaria El Pozo, 3000 Santa Fe, Santa Fe, Argentina.
3 Universidad Nacional del Litoral. Ciudad Universitaria El Pozo, 3000 Santa Fe, Santa Fe, Argentina.
4 Parque Nacional Pre-Delta, Administración de Parques Nacionales. 3105 Diamante, Entre Ríos, Argentina.
Resumen
Se analizó la riqueza de especies, composición, abundancia y diversidad de aves en diferentes unidades ambientales en el Parque Nacional Pre-Delta (Entre Ríos, Argentina). Fueron muestreadas tres unidades ambientales (bosque ribereño no inundable, bosque ribereño inundable y humedal) desde marzo de 2006 hasta marzo de 2007, mediante puntos de conteo. Se registraron 147 especies y una abundancia promedio de 1845 individuos. Existieron diferencias significativas en la riqueza, la abundancia promedio y la diversidad entre las unidades ambientales. Los humedales presentaron la mayor riqueza y abundancia. Los bosques presentaron relativamente pocas especies, aunque el bosque ribereño inundable presentó la más alta diversidad promedio. Ambos tipos de bosque compartieron la mayoría de las especies. Los bosques en conjunto solo contribuyeron con 29 especies (20%) que no aparecieron en los humedales y con 22 especies indicadoras. Los humedales, por la alta proporción de especies y las abundancias que presentaron, serían la unidad ambiental más representativa del área de estudio. Algunas especies indicadoras de bosques también fueron registradas en los humedales debido a la contigüidad entre las unidades ambientales. El alto número de especies adicionales encontrado sugiere que hay una elevada proporción de especies generalistas y que es necesario un abordaje integral que considere a todas las unidades ambientales cuando se estudia la dinámica de la avifauna del área de estudio.
Palabras clave: Bosques ribereños; Delta del Paraná; Humedales; Parque Nacional Pre-Delta; Unidades ambientales.
Abstract
Bird assemblages of the Pre-Delta National Park (Entre Ríos, Argentina): analysis of the ornithological importance of different environmental units.
Species richness, composition, abundance and diversity of birds were analyzed in different environmental units in the Pre-Delta National Park (Entre Rios, Argentina). Three environmental units (non-flooded riverine forest, flooded riverine forest and wetlands) were sampled by point counts from March 2006 until March 2007. A total of 147 bird species and an average abundance of 1845 individuals were recorded. A significant difference among habitats was observed in species richness, average abundance and diversity. Wetlands showed the highest richness and abundance values. Both types of riverine forests exhibited a relatively low number or species, although the flooded riverine forest showed the highest average diversity values. Both forests shared most species, and contributed with only 29 species (20%) which did not appear in wetlands, and with 22 indicator species. Wetlands, with higher proportions of species number and abundance, constitute the most representative environmental unit. Some forest indicator species were also recorded in wetlands because of the closeness between environmental units. The high number of additional species suggests a large amount of generalist species. An integral approach embracing all environmental units is needed in order to understand the dynamics of this avifauna.
Key words: Delta of the Paraná River; Environmental units; Pre-Delta National Park; Riverine forests; Wetlands.
Recibido 8 diciembre 2009, aceptado 30 agosto 2010
El delta del río Paraná es un importante macrosistema de humedales con características ecológicas y biogeográficas únicas dentro de Argentina (Malvárez 1999, Bó et al. 2002). La coexistencia de especies de distintos linajes, tanto de las áreas biogeográficas que lo rodean como de las ingresiones desde latitudes subtropicales a través del corredor fluvial que representa la planicie de inundación del río Paraná, junto con la yuxtaposición de diferentes comunidades, constituyen un atributo exclusivo de la región (Malvárez 1999). La riqueza ornitológica del Delta ha sido estimada en 260 especies, excluyendo los registros dudosos u ocasionales (Bó 1995, Quintana et al. 2002), un número superior al de las áreas de tierras altas fuera de la planicie de inundación entre las que discurre (Di Giacomo y Contreras 2002). Esta riqueza de aves relativamente elevada respondería a la particular ubicación geográfica, a las características climáticas únicas y a la elevada heterogeneidad ambiental que presenta la región (Bó y Quintana 1999, Quintana et al. 2002).
La heterogeneidad espacial es uno de los factores que ha sido relacionado con el incremento de la riqueza de aves (Remsen y Parker 1983, Rosenberg 1990, Junk 1997, Peterman 1997, Robinson et al. 2002). Las características locales y regionales del hábitat influencian la riqueza específica y la estructura de las comunidades (Gillespie y Walter 2001, Pearman 2002). Como resultado de esto, las diferencias en sus parámetros expresan disimilitudes entre los parches de ambientes, influidos principalmente por la estructura y fisonomía de la vegetación, así como por su asociación con recursos críticos tales como alimento, sitios de nidificación o refugio ante la presencia de predadores (Rotenberry y Wiens 1980).
En el Delta del Paraná, la heterogeneidad espacial se refleja en diferentes tipos de vegetación. En términos fisonómicos pueden distinguirse bosques y ambientes inundables dominados por vegetación herbácea, constituyendo un mosaico de ambientes. Esta estructura del paisaje es de gran importancia en el marco de la implementación de áreas protegidas, las que deberían incluir la mayor heterogeneidad de ambientes posible. Es esperable también que un alto porcentaje de especies utilicen más de una unidad ambiental dentro de un mosaico de hábitats, por lo cual la protección de solo una fracción del hábitat carece de sentido. De este modo, el conocimiento de los patrones de distribución de los organismos se vuelve esencial para cualquier estrategia de conservación.
Recientemente se han propuesto, sobre la base de la presencia de especies amenazadas y de endemismos a distintas escalas, 10 Áreas de Importancia para la Conservación de las Aves (AICAs) solamente en el tramo del delta del río Paraná (Di Giacomo 2005), lo que refleja la exclusividad biogeográfica de la región. El Parque Nacional Pre-Delta es una de estas AICAs, siendo la única ubicada en el Delta Superior, más precisamente en la unidad de paisaje "Bosques, praderas y lagunas de llanura de meandros" (Malvárez 1999). El parque contiene mayormente sectores de humedales con presencia periódica o constante de agua, prácticamente sin actividad ganadera, a diferencia de las áreas circundantes en las que ésta es una de las principales actividades humanas (Aceñolaza et al. 2004, 2005). Alberga, además, bosques ribereños inundables y no inundables, los cuales representan una fracción relativamente baja del área protegida y se presentan, a escala de la planicie de inundación del río Paraná, en creciente fragmentación por las actividades humanas (Giraudo y Arzamendia 2004), lo que adquiere aún más relevancia si se tiene en cuenta su importante rol como corredores de diversidad (Bucher et al. 1993, Giraudo y Arzamendia 2004). En el caso de los bosques ribereños no inundables, a pesar de las particularidades florísticas y faunísticas que presentan (Aceñolaza et al. 2004, 2005, Alonso y Ronchi-Virgolini 2008), incluye solo una porción reducida con sitios representativos del ambiente en las cercanías del área protegida y sujetos a intervención humana (Alonso 2008).
El Parque Nacional Pre-Delta se encuentra en una región poco estudiada y pobremente representada en el sistema nacional de áreas protegidas (Aceñolaza et al. 2004). Aunque muchos aspectos de la composición de especies y de su historia natural en la planicie de inundación del Paraná son poco conocidos (Chatellenaz 2005, Alonso y Ronchi-Virgolini 2008), existen algunos aportes generales (Di Giacomo y Contreras 2002; Giraudo y Arzamendia 2004) y estudios llevados a cabo en determinados sectores como el Paraná Medio (Beltzer y Neiff 1992, Beltzer et al. 2004, Bosisio y Beltzer 2004, Rosseti y Giraudo 2003, Chatellenaz 2005). Para la región del Delta del Paraná hay aportes a escala regional (Bó et al. 2002) y para algunos tramos específicos (Bó y Malvárez 1999, Babarskas et al. 2003), mientras que para el área del parque hay trabajos referidos principalmente a estimaciones y listados asistemáticos con referencias a ambientes y estatus de residencia de las especies de aves (Malvárez et al. 1992, Chebez et al. 1998, Aceñolaza et al. 2004, Alonso 2008, Alonso y Ronchi-Virgolini 2008). En este marco, el objetivo de este estudio es contribuir al conocimiento de la avifauna de un área protegida declarada de importancia para la conservación de las aves, a través de la descripción y comparación de los ensambles de aves de diferentes unidades ambientales incluidas en el Parque Nacional Pre-Delta en términos de composición y estructura, evaluando la relación entre la presencia y ausencia de las especies y el mosaico de ambientes característico del área, para proveer una línea de base para futuros estudios biológicos y estrategias de conservación.
MÉTODOS
Área de estudio
De acuerdo con la subdivisión de la región del delta del río Paraná realizada por Malvárez (1999), el Parque Nacional Pre-Delta (32°03'S, 60°38'O, departamento Diamante, provincia de Entre Ríos; Fig. 1) está incluido en la unidad de paisaje "Bosques, praderas y lagunas de llanura de meandros". Posee una superficie de 2458 ha y comprende una zona de islas característica de la región norte del delta o delta superior, así como un reducido sector de ambiente de barrancas. El área es de clima templado/cálido húmedo, con una temperatura promedio anual de 19 °C y precipitaciones anuales de 900 mm, que se registran principalmente en octubre-abril (73%). Durante el período de estudio la temperatura promedio mensual fue de 19 °C y las precipitaciones oscilaron entre 0.4 mm en marzo de 2007 y 142.2 mm en diciembre de 2006 (Fig. 2). El patrón hidrológico se corresponde con un régimen pulsátil anual de inundación. La época de estiaje (bajante) se produce en agosto-septiembre, mientras que el pulso de inundación suele darse hacia fines de verano y principio de otoño (Rojas y Saluso 1987). Desde el punto de vista biogeográfico, el Parque Nacional Pre-Delta se encuentra en una región con influencias de distintas corrientes florísticas, con el ingreso de especies pertenecientes a la Provincia Paranaense (Dominio Amazónico) y a las provincias Chaqueña y del Espinal (Dominio Chaqueño) (Cabrera 1976). El Paraná participa de esta confluencia actuando como un corredor biológico de gran extensión latitudinal, permitiendo la penetración de elementos subtropicales en una zona templada (Cabrera 1976, Malvárez 1999). En cuanto a la fauna, Ringuelet (1961) considera al Delta dentro del Distrito Mesopotámico (Dominio Subtropical, Subregión Guayano- Brasilera), con una influencia menor del Distrito Pampásico. En lo que refiere a las aves en particular, según Nores (1987) el área estaría caracterizada por la superposición de tres zonas ornitogeográficas: el Distrito de las Selvas (Provincia Paranaense) y las provincias Mesopotámica y Pampeana.

Figura 1. Localización de los puntos de muestreo en cada una de las nueve transectas dispuestas en el área de muestreo en el Parque Nacional Pre- Delta, provincia de Entre Ríos, Argentina. Los triángulos corresponden a transectas ubicadas en el bosque ribereño no inundable, los cuadrados a transectas ubicadas en el bosque ribereño inundable y los círculos a las transectas ubicadas en humedales.

Figura 2. Variación de la temperatura promedio mensual (círculos blancos) y de las precipitaciones mensuales (círculos negros) durante el periodo de estudio en el área de muestreo en el Parque Nacional Pre-Delta, provincia de Entre Ríos, Argentina.
El paisaje regional es el resultado de diversos procesos fluviales que le confieren una gran diversidad ambiental (Aceñolaza et al. 2004, 2005). La ubicación de los distintos ambientes está directamente relacionada con la topografía del área. Los albardones son las partes más altas de la planicie de inundación; a partir de éstos y hacia el interior de las islas se desarrolla un gradiente topográfico que termina en lagunas, generalmente extensas, que ocupan las partes más bajas. Las posiciones intermedias están ocupadas por zonas sujetas a inundaciones periódicas (zonas de media loma). El único ambiente que no es alcanzado por las grandes crecientes es la barranca, ubicada fuera de la planicie de inundación. En líneas generales, los albardones o ambientes altos están ocupados por bosques, los intermedios o de media loma por pajonales y los bajos por bañados y lagunas. Todos sufren, en mayor o menor medida, los efectos de las inundaciones. Sin embargo, durante el periodo de estudio no ocurrieron inundaciones de las medias lomas ni de los albardones. La identificación de los ambientes del área de estudio se basó en el reconocimiento en el campo (Grigera y Ubeda 2000) de unidades con límites naturales, aceptando que las comunidades naturales no son unidades discretas y que, por lo tanto, la existencia de límites es relativa. Siguiendo a Malvárez et al. (1992) y Aceñolaza et al. (2005) se delinearon tres unidades ambientales: una de ellas no inundable (bosque ribereño no inundable) y las otras dos con diferentes frecuencias de inundación (bosque ribereño inundable y humedal).
La unidad de bosque ribereño inundable es el área más elevada de la planicie de inundación. Sobre la margen del Paraná, se caracteriza por una baja diversidad arbórea, encontrándose bosques monoespecíficos de sauce criollo (Salix humboltiana) y aliso de río (Tessaria integrifolia). Los bosques ribereños ubicados sobre los arroyos internos se caracterizan por la presencia de curupí (Sapium haematospermum ), timbó blanco (Albizia inundata), seibo (Erythrina crista-galli) y, en menor medida, espinillo (Acacia caven), que se agrupan mayormente en parches monoespecíficos, de escasa altura y abierto o semiabierto. El sotobosque está dominado por formaciones cerradas de serruchetas o falso caraguatá (Eryngium sp.). En los bosques más antiguos y mejor conservados hay laurel de río (Nectandra falcifolia), ingá (Inga uruguensis), sangre de drago (Croton urucurana) y timbó colorado (Enterolobium contortisiliquum), que tienden a formar bosques más coetáneos. En el sotobosque, actualmente muy enmarañado y de difícil penetración, se destacan Urera aurantiaca, Commelina diffusa, Cestrum guaraniticum, Lippia alba, Ipomea alba y Passiflora suberosa. También hay una cantidad importante de renovales y árboles de mediano porte de canelón (Myrsine laetevirens) y tembetarí (Fagara sp.), de aparición reciente favorecida por la exclusión del ganado. Otra especie de aparición relativamente reciente es la mora (Morus spp.) y, en números mucho menores, el ligustro (Ligustrum lucidum), ambas especies exóticas y altamente invasoras de dispersión fundamentalmente ornitócora. Dependiendo de los usos históricos que ha tenido el bosque (e.g., tala, pastoreo intensivo, asentamiento humanos), éste se presenta de manera discontinua, quedando claros cubiertos por densos matorrales arbustivos, donde predominan, entre otras, las chilcas (Baccharis spp.).
En la categoría de humedales se incluyó tanto el ambiente de media loma como los bañados y lagunas, ambos dominados por herbáceas y con presencia permanente o periódica de agua. La media loma está dominada por pajonales densos de paja de techar (Panicum prionitis), cortadera (Cortaderia selloana) y otras especies como Hydrocotyle bonariensis, Jaborosa integrifolia, Eryngium nudicaule, Phyla canescen, Funastrum clausum, Cissus verticillata, Cissus palmata, Oxalis paludosa, Cyperus spp., Cynodon dactylon, con una cobertura del 80%, pudiendo aparecer también individuos dispersos de Acacia caven, Sapium haematospermun y Albizia inundata, además de otras leñosas arbustivas. En los bañados y lagunas, en las zonas más bajas del gradiente topográfico, aparecen canutillares de Panicum elephantipes y Paspalum repens, cataizales de Polygonum spp., saetales de Sagittaria montevidensis, huajozales de Thalia geniculata, juncales de Schoenoplectus californicus, totorales de Typha latifolia y otras leñosas como duraznillo blanco (Solanum glaucophyllum), rama negra (Sesbania virgata) y rosa de río (Hibiscus cisplatensis). En los bordes de las lagunas, donde pierden importancia relativa Polygonum spp. y Panicum spp., aparecen otras comunidades herbáceas con cobertura de hasta un 100%, encontrándose Ludwigia peploides, Enhydra anagallis, Panicum rivulare, Mikania periplocifolia, Aeschynomene spp., Echinodorus longiscapus y Oplismenopsis najada. En los cuerpos de agua se encuentran varias comunidades flotantes integradas por Selaginella spp., Azolla sp., Eichhornia spp., Pistia stratiotes y Salvinia spp.
El bosque ribereño no inundable, ubicado en las barrancas, fue considerado una unidad ambiental distinta debido a sus características faunísticas y florísticas únicas (Aceñolaza et al. 2004, 2005, Alonso 2008, Alonso y Ronchi- Virgolini 2008). Estos bosques presentan intervención humana, con presencia de viviendas, aunque mantienen la estructura y fisonomía de la vegetación (Alonso 2008). De fuerte pendiente y no sujeto a inundaciones, este ambiente presenta condiciones de buen drenaje y, a la vez, de gran oferta hídrica, debido tanto a la alta humedad relativa (por su proximidad con los cursos de agua) como al escurrimiento proveniente de las zonas altas. Posee tres estratos formados al menos por 20 especies de árboles, las cuales no están presentes en la otra margen del río, hacia el oeste (Burkart 1957). El estrato arbóreo alto está dominado por viraró (Ruprechtia laxiflora), canelón (Myrsine laetevirens), ombú (Phytolacca dioica), guaraniná (Bumelia obtusifolia) y mirtáceas como el arrayán (Myrcianthes cisplatensis), el ubajay (Hexaclamys edulis) y el ñangapirí (Eugenia uniflora). También están presentes Jodina rhombifolia, Prosopis alba, Scutia buxifolia y Aspidosperma quebracho-blanco. En el segundo estrato, bajo y arbustivo, son frecuentes Coccoloba argentinensis, Fagara hyemalis, Porlieria microphylia y Achaetocarpus praecox. En el tercer estrato, altamente degradado por sobrepastoreo de ganado, se encuentran Dicliptera tweediana, Sida rhombifolia, Teucrium vesicarium, Rivina humilis, Byttneria urticilfolia y Melica sarmentosa entre las herbáceas más frecuentes, y lianas y enredaderas como Mikania cordifolia, Cayaponia citrullifolia y Ephedra tweediana. La invasión de leñosas exóticas es importante, pudiéndose encontrar Ligustro (Ligustrum lucidum), Mora (Morus spp.), Paraíso (Melia azederach) y Morera de papel (Broussonetia papyrifera).
Muestreo
El muestreo fue realizado entre marzo de 2006 y marzo de 2007. Las aves fueron muestreadas estacionalmente a lo largo de tres transectas en cada unidad ambiental (bosque ribereño no inundable, bosque ribereño inundable, humedal); las transectas dentro de cada unidad ambiental estuvieron separadas por 750 m para asegurar la independencia. Cinco puntos fueron establecidos a lo largo de cada transecta, separados por 250 m (Fig. 1). Los puntos dentro de cada transecta fueron tratados como submuestras, promediándose los datos provenientes de cada uno de ellos (i.e., las transectas fueron consideradas como réplicas). Cada transecta fue muestreada dos veces durante cada estación, con 45 días entre los muestreos; las tres transectas de una misma unidad ambiental fueron muestreadas el mismo día. El orden en que se muestrearon las transectas fue rotado para reducir los efectos asociados con la relación entre la actividad de las aves y la hora del día (Verner y Milne 1989). Así, se sumó un total de 72 muestras durante el período de estudio (tres unidades ambientales, tres transectas por unidad ambiental y las transectas muestreadas dos veces durante cada una de las cuatro estaciones).
Los conteos de aves empezaron al amanecer y continuaron hasta cuatro horas después, el período de mayor detectabilidad de aves (Ralph et al. 1996, Huff et al. 2000). Todas las aves vistas u oídas dentro de un radio de 100 m fueron registradas durante periodos de 10 min en cada punto (Hutto et al. 1986, Ralph et al. 1995, Ordano 1999). Para la identificación de las especies y la asignación de las especies a grupos tróficos se siguió a Beltzer (2003), Narosky e Yzurieta (2003) y de la Peña (2006). Para el estatus de residencia se tuvo en cuenta la información provista por Alonso (2008). Con el objetivo de establecer la afinidad de las aves a las diferentes unidades ambientales, se distinguieron dos grupos de especies: las exclusivas y las adicionales (Robinson y Terborgh 1990). Las primeras fueron aquellas especies detectadas solamente en un ambiente durante el período de muestreo, mientras que las segundas fueron las que aparecieron regularmente en varias unidades ambientales.
Análisis estadístico
Para estimar el número de especies esperado a partir de las muestras se realizó una interpolación bootstrap usando el programa PRIMER (Clarke y Gorley 2002). La estructura del ensamble de aves de cada unidad ambiental fue descripta a través de los siguientes parámetros: (1) riqueza de especies, considerada como el número total de especies registrado en los diferentes muestreos y en cada unidad ambiental, (2) diversidad específica, estimada con el índice de Shannon-Wiener, y (3) abundancia total promedio (la suma de las abundancias relativas), obtenida a partir del promedio de los registros entre los cinco puntos por transecta y la sumatoria para cada unidad ambiental. La utilización de la abundancia promedio subestima la abundancia de especies poco abundantes o conspicuas, pero evita la sobreestimación causada por el uso de los números máximos, que pueden resultar de conteos dobles (Becerra Serial y Grigera 2005). Se compararon la riqueza, la abundancia promedio y la diversidad de las tres unidades ambientales mediante un ANOVA de Medidas Repetidas, debido a que las diferentes muestras no fueron totalmente independientes (una misma transecta fue muestreada a lo largo del año).
Se utilizó la información de abundancia y de frecuencia de ocurrencia de las especies en cada unidad ambiental para detectar y describir el valor que tienen las distintas especies como indicadoras de las condiciones ambientales de las unidades, mediante un Análisis de Especies Indicadoras (Dufrêne y Legendre 1997, McCune y Grace 2002). Se utilizó la prueba de Monte Carlo (Legendre y Legendre 1998), a través de 10 000 aleatorizaciones, para evaluar la significancia estadística del valor indicador máximo de cada especie. Un valor de P < 0.05 para un grupo indica que la especie tiene una baja probabilidad de estar presente en otro grupo con una abundancia similar y, por lo tanto, que es una buena indicadora.
RESULTADOS
Las curvas de acumulación de especies sugieren que la mayoría de las especies (aunque no todas) fueron registradas en cada unidad ambiental en las 24 muestras (i.e., las curvas se acercan a una asíntota en cada unidad ambiental; Fig. 3). La diferencia entre el número estimado de especies y el observado fue de 11 especies en el humedal, 3 en el bosque ribereño inundable y 3 en el no inundable. Así, con más muestras se podrían haber registrado algunas especies adicionales en cada unidad ambiental. Cuando los resultados de todas las unidades ambientales fueron combinados, la curva se acercó claramente a una asíntota (Fig. 3), con el número estimado de especies (156) ligeramente mayor que el total registrado (147).

Figura 3. Curvas de acumulación de especies basadas en la abundancia promedio de aves en el área de muestreo en el Parque Nacional Pre-Delta, provincia de Entre Ríos, Argentina. Se muestran el número de especies observado (símbolos negros) y estimado (símbolos blancos) en humedales (círculos y líneas llenas), bosque ribereño inundable (cuadrados), bosque ribereño no inundable (triángulos) y en las tres unidades ambientales en conjunto (círculos y líneas partidas) en función del número de muestras.
Se registró una abundancia promedio de 1845 individuos correspondientes a 147 especies (Tabla 1). Fueron registradas 39 especies de aves acuáticas; las 108 especies restantes fueron de hábitos terrestres o semiterrestres. Las especies más abundantes fueron Zenaida auriculata, Furnarius rufus, Plegadis chihi, Agelasticus cyanopus, Chrysomus ruficapillus y Myiopsitta monachus. Las familias mejor representadas fueron Tyrannidae con 22 especies (15%), Emberizidae con 13 especies (9%) y Furnariidae con 11 especies (7 %).
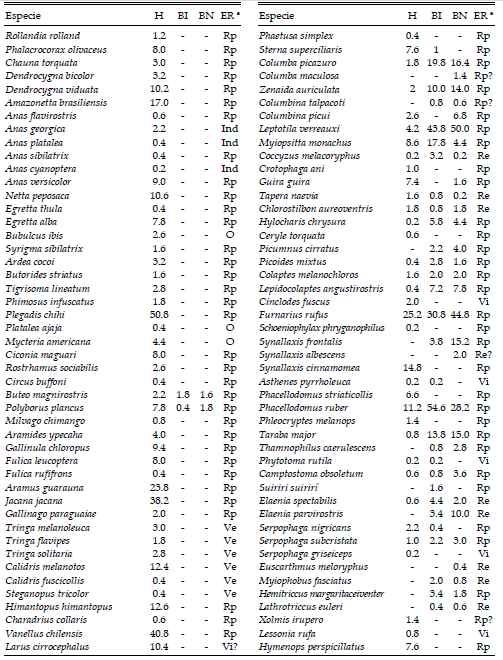
Tabla 1. Lista de las especies de aves registradas en el área de muestreo en el Parque Nacional Pre-Delta, provincia de Entre Ríos, Argentina. Para cada una se muestra la abundancia promedio en tres unidades ambientales (H: humedal, BI: bosque ribereño inundable y BN: bosque ribereño no inundable) y el estatus de residencia (ER).

La riqueza de especies por muestra, la abundancia promedio por muestra y la diversidad de aves fueron diferentes en las tres unidades ambientales (F = 11.045, P = 0.0011; F = 20.212, P = 0.0001; F = 5.554, P = 0.0157; respectivamente; Fig. 4). En total, en los humedales fueron registradas 124 especies, de las que 70 fueron exclusivas y 54 adicionales. En el bosque ribereño inundable se registraron 68 especies (4 exclusivas y 64 adicionales), mientras que en el bosque ribereño no inundable se registraron 59 especies (6 exclusivas y 53 adicionales) (Fig. 5). Un total de 80 especies (54%) fueron exclusivas de alguna de las tres unidades ambientales. En los humedales, las familias exclusivas fueron Anatidae, Ardeidae, Ciconiidae, Anhimidae, Rallidae y Jacanidae. Ambos bosques compartieron la mayoría de las especies, lo que se reflejó en el alto número de especies adicionales, y no mostraron familias exclusivas. Ambas unidades ambientales contribuyeron con especies no acuáticas, siendo Synallaxis frontalis, Vireo olivaceus, Elaenia parvirostris y Pachyramphus polychopterus las más abundantes. La abundancia se correspondió con los valores de riqueza, siendo mayor en los humedales que en el bosque ribereño inundable y en el no inundable. La diversidad promedio, por el contrario, tuvo su mayor valor en el bosque ribereño inundable (H = 2.80 ± 0.28), seguido por los humedales (H = 2.77 ± 0.36) y el bosque ribereño no inundable (H = 2.73 ± 0.27).
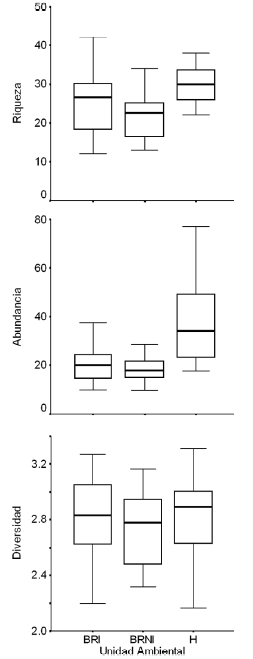
Figura 4. Riqueza de especies por muestra (a), abundancia promedio por muestra (b) y diversidad (c) en el bosque ribereño no inundable (BRNI), el bosque ribereño inundable (BRI) y los humedales (H) del área de muestreo en el Parque Nacional Pre-Delta, provincia de Entre Ríos, Argentina. La caja indica el rango del 50% de los datos, con la mediana en su interior, y los extremos delimitan el rango abarcado por el 95% de los datos.
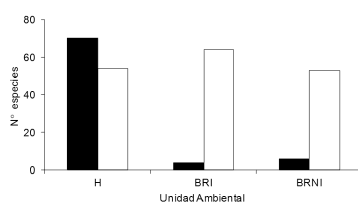
Figura 5. Número de especies exclusivas (barras negras) y adicionales (barras blancas) registradas en humedales (H), bosque ribereño inundable (BRI) y bosque ribereño no inundable (BRNI) en el área de muestreo en el Parque Nacional Pre- Delta, provincia de Entre Ríos, Argentina.
Los resultados del Análisis de Especies Indicadoras mostraron un mismo número de especies indicadoras en cada una de las tres unidades ambientales (11 especies). Las mismas se muestran en la tabla 2.
Tabla 2: Especies de aves indicadoras de cada unidad ambiental (humedal, bosque ribereño inundable y bosque ribereño no inundable) en el área de muestreo en el Parque Nacional Pre-Delta, provincia de Entre Ríos, Argentina. Se muestra el valor de significancia del Análisis de Especies Indicadoras.

DISCUSIÓN
El total de especies registradas en este trabajo representan el 61% de las reportadas por Alonso (2008) y Alonso y Ronchi-Virgolini (2008) para el área de estudio. A diferencia de lo reportado por estos autores, no se observaron representantes de las familias Tinamidae (presentes mayormente en campos de cultivos vecinos al área de estudio), Phoenicopteridae (con solo una especie reportada para el área, que carece de observaciones actuales), Cathartidae (con dos especies raras u ocasionales), Tytonidae, Strigidae y Caprimulgidae (con especies de hábitos crepusculares y nocturnos) y Passeridae (con solo una especie, Passer domesticus, que presenta registros ocasionales en el área protegida). Las especies registradas corresponden al 55% de las reportadas para la región del Delta del río Paraná (Bó et al. 2002, Quintana et al. 2002), el 40% de las 370 especies registradas en Entre Ríos (de la Peña 2006) y el 14% de las especies que estarían presentes en Argentina (Mazar Barnett y Pearman 2001). El 22% de las especies registradas presentan movimientos migratorios (Alonso 2008, Alonso y Ronchi-Virgolini 2008).
La riqueza de aves estuvo principalmente determinada por la de los humedales. El número de especies registradas fue relativamente cercano al reportado por Alonso y Ronchi-Virgolini (2008) (153 especies en ambientes acuáticos y pajonales, incluidos en la unidad ambiental humedal en este estudio). Este elevado número de especies podría ser atribuido a la heterogeneidad espacial de los humedales, que presentan cuerpos de agua, vegetación flotante, parches de arbustos y árboles. Particularmente para las aves, este tipo de ambientes ha sido frecuentemente referido por su alta diversidad (Martínez 1993, Blanco 1999). Las aves acuáticas se distribuyen diferencialmente de acuerdo a la conformación de los hábitats, con lo que la riqueza y la abundancia están asociadas con las características ambientales locales, permitiendo la presencia de un elevado número de especies (Blanco 1999).
De acuerdo con Alonso (2008), solo 11 especies son exclusivas de los ambientes de media loma. En este estudio se registró a Anthus lutescens, Anthus hellmayri, Donacospiza albifrons, Sicalis luteola y Embernagra platensis, aunque estas dos últimas aparecen también en pastizales fuera de la planicie de inundación. Donacospiza albifrons es una especie considerada con datos insuficientes en el país para establecer su estatus de conservación (Fraga 1997). Además, aunque no fueron detectadas en este trabajo, existen registros de especies con algún grado de amenaza en este ambiente, como Eleothreptus anomalus y algunas especies del género Sporophila (Malvárez et al. 1992, Chebez et al. 1998, Alonso 2008). Aunque Alonso (2008) diferenció este ambiente de pajonal de los ambientes acuáticos, reporta igualmente el mayor número de especies en esta última unidad ambiental.
Además de las especies típicas de ambientes acuáticos asociadas tanto a los cuerpos de agua (con o sin vegetación) como a la vegetación palustre que los rodea, se registraron muchas otras (principalmente paseriformes) asociadas a pequeños parches de árboles y arbustos ubicados en el ambiente de media loma, que incrementaron la riqueza de la unidad ambiental de humedal y redujeron el aporte de especies exclusivas por parte de los bosques.
Algunas de estas especies fueron Coccyzus melacoryphus, Crotophaga ani, Tapera naevia, Picoides mixtus, Lepidocolaptes angustirostris, Schoeniophylax phryganophilus, Phacellodomus ruber, Taraba major, Phytotoma rutila, Camptostoma obsoletum, Elaenia spectabilis, Myiarchus swainsoni, Tyrannus melancholicus, Cyclarhis gujanensis y Sicalis flaveola. De acuerdo con Malvárez et al. (1992), la presencia en este ambiente de árboles (aliso de río y sauce criollo) está asociada con antiguas espiras de meandros que actualmente perduran en el paisaje muy erosionadas. No obstante, algunas de las especies de aves podrían estar presentes en estos parches de leñosas por la presencia de los bosques aledaños. También se registraron en los humedales especies de hábitats abiertos (e.g., Tyrannus savana, Embernagra platensis), que resultaron exclusivas y contribuyeron tanto al elevado número de especies de los humedales como al alto número de especies exclusivas de esta unidad ambiental.
Los bosques han sido señalados en muchos estudios por su alta riqueza de especies de aves, como resultado de la complejidad estructural representada principalmente por la estratificación vertical (MacArthur y MacArthur 1961, Blake y Loiselle 1991, Giraudo y Ordano 2003). Sin embargo, los bosques ribereños inundable y no inundable exhibieron un número relativamente bajo de especies con relación a los humedales. Debe tenerse en cuenta la superficie relativa de las unidades ambientales y el decrecimiento tanto de la riqueza como de la abundancia a medida que esta superficie decrece, como ha sido documentado en distintos ambientes (Newmarck 1991, Piratelli y Blake 2006). Mientras los humedales representan la mayor parte del área de estudio, los bosques constituyen franjas angostas, fragmentadas y con una alta proporción de borde (Rosseti y Giraudo 2003). La riqueza observada en los bosques en este estudio contrasta con la mayor cantidad de especies reportada por Alonso y Ronchi- Virgolini (2008) en estos mismos ambientes. Las especies no registradas fueron las que habían sido consideradas como raras o escasas, o bien aquellas de hábitos nocturnos, en aquel estudio (Alonso y Ronchi-Virgolini 2008). Un patrón similar de valores de riqueza entre diferentes unidades ambientales fue reportado para la Reserva Otamendi, con 142 especies en los bosques y 156 en ambientes que pueden ser considerados como humedales (Babarskas et al. 2003). La abundancia mostró el mismo patrón que la riqueza, con menores valores en los bosques. La presencia de grupos tróficos exclusivos de los humedales, como las garzas (Ardeidae) y los patos (Anatidae), con especies de hábitos gregarios, contribuyó mucho a estas diferencias. A su vez, eso disminuyó la equitatividad, por lo que la diversidad promedio fue más alta en el bosque ribereño inundable.
Los dos tipos de bosque compartieron muchas especies, lo que se reflejó en las altas proporciones de especies adicionales en ambos. Los bosques en conjunto contribuyeron solamente con 29 especies que no aparecieron en los humedales. Los bosques fluviales se distribuyen linealmente a lo largo de los cursos de agua y son relativamente estrechos, lo que posiblemente provoque un elevado efecto de borde (Rosseti y Giraudo 2003). Esto favorecería a especies de borde y generalistas, las cuales también serían registradas en los humedales, reduciendo el aporte de especies exclusivas de estas unidades ambientales.
El Análisis de Especies Indicadoras señaló aquellas especies que estuvieron mejor representadas en alguna de las unidades ambientales, lo que es un complemento del conjunto de especies exclusivas registradas en cada una de ellas. En los humedales la mayor parte de las especies indicadoras estuvieron asociadas a cuerpos de agua y áreas abiertas (e.g., Agelasticus cyanopus, Chrysomus ruficapillus, Sterna superciliaris y Tachycineta leucorrhoa), mientras que las de los bosques ribereños fueron especies propias de bosques (e.g. Procacicus solitarius, Vireo olivaceus, Pachyramphus polychopterus). Un 15% de las especies fueron indicadoras de bosques aunque fueron registradas también en los humedales. Su presencia allí, así como en otras áreas abiertas, podría deberse a la particular conformación del paisaje del área de estudio, con la presencia de unidades de bosques y de ambientes acuáticos contiguas entre sí.
Los resultados de este estudio muestran que los humedales presentan una alta representatividad en cuanto a las especies de aves que sostienen dentro del mosaico de ambientes que caracteriza el área de estudio. El número de especies exclusivas fue muy elevado, incluso al considerar comparativamente el aporte de los bosques. Los humedales ocupan la mayor parte del área de estudio. La modificación de los ciclos hidrológicos por obras de impacto sobre la Cuenca del Plata sería una amenaza importante para este ambiente, con efectos sobre la planicie de inundación en general, incluido el bosque ribereño inundable, también sujeto a la dinámica de pulsos hidrológicos del río (Bó y Quintana 1999, Bonetto y Hurtado 1999, Bó 2006). La actividad ganadera en los humedales también puede ser una amenaza, aunque no hay estudios referidos a su influencia sobre la flora y la fauna allí presentes. Por su parte, los bosques ribereños presentan un elevado grado de amenaza, dado que la deforestación y la fragmentación están muy extendidas desde hace tiempo (Bucher et al. 1993, Quintana et al. 2002, Bó 2006). Situados en zonas de clima subtropical y templado, agregan biodiversidad al complejo paisaje, ya que especies de animales y plantas alcanzan latitudes relativamente altas a lo largo de ellos (Bucher et al. 1993, Giraudo y Arzamendia 2004). Algunas especies como Vireo olivaceus, Pachyramphus polychopterus o las especies del género Elaenia los utilizan como corredores para sus migraciones. Además, durante crecientes excepcionales, cuando el valle entero es cubierto por una única masa de agua, las copas de los árboles de estos bosques son las únicas estructuras emergentes (Bonetto 1986), ofreciendo sitios de refugio temporario a la fauna (Ordano 1999).
Los resultados obtenidos en este trabajo deben considerarse parciales debido a la falta de consideración de muchos otros aspectos asociados a la distribución de las especies (e.g., variación estacional, influencia de la dinámica demográfica, movimientos locales o migratorios, selección de hábitats). La dinámica del área de estudio es muy marcada y compleja por la influencia del pulso hidrológico del río, por lo que su abordaje requiere de estudios continuados a lo largo de varios años. Estos aspectos son de reconocida relevancia con relación a la importancia relativa de los ambientes. El alto número de especies adicionales registrado sugiere que una elevada proporción de las especies son relativamente generalistas. El mosaico de ambientes podría ser utilizado para diferentes propósitos por estas especies (Staicer 1992), modificando las aves su distribución como respuesta a las condiciones de éstos (Karr 1990). Esto además es consistente con la propuesta de que la biota de los ambientes ribereños debe ser estudiada desde una perspectiva ambiental o regional integral (Naiman et al. 1993).
AGRADECIMIENTOS
A J. Schnack, M. Codesido, Germán Marateo y R. Fraga por la lectura crítica del manuscrito. A R. D'Angelo, C. Cerino, E. Rodríguez y A. Frutos por el trabajo de campo realizado. A la Administración de Parques Nacionales, Sede Diamante, Entre Ríos, Argentina, por su ayuda en los muestreos y al CICyTTP-CONICET por los datos meteorológicos.
BIBLIOGRAFÍA CITADA
1. ACEÑOLAZA PG, POVEDANO HE, MANZANO AS, MUÑOZ JD, ARETA JI Y RONCHI-VIRGOLINI AL (2004) Biodiversidad del Parque Nacional Pre-Delta. INSUGEO, Miscelánea 12:169-184 [ Links ]
2. ACEÑOLAZA PG, SIONE WF, KALESNIK F Y SERAFÍN MC (2005) Determinación de unidades homogéneas de vegetación en el Parque Nacional Pre-Delta (Argentina). INSUGEO, Miscelánea 14:81-90 [ Links ]
3. ALONSO JM (2008) Inventario de las aves del Parque Nacional Pre-Delta. Administración de Parques Nacionales, Buenos Aires [ Links ]
4. ALONSO JM Y RONCHI-VIRGOLINI AL (2008) Avifauna del Parque Nacional Pre-Delta, Entre Ríos, Argentina. Cotinga 29:123-134 [ Links ]
5. BABARSKAS M, HAENE E Y PEREIRA J (2003) Aves de la Reserva Natural Otamendi. Pp. 47-113 en: HAENE E Y PEREIRA (eds) Fauna de Otamendi. Inventario de los animales vertebrados de la Reserva Natural Otamendi, Campana, Buenos Aires, Argentina. Aves Argentinas/ Asociación Ornitológica del Plata, Buenos Aires [ Links ]
6. BECERRA SERIAL R Y GRIGERA D (2005) Dinámica estacional del ensamble de aves de un bosque norpatagónico de lenga (Nothofagus pumilio) y su relación con la disponibilidad de sustratos de alimentación. Hornero 20:131-139 [ Links ]
7. BELTZER AH (2003) Aspectos tróficos de la comunidad de aves de los Esteros del Iberá. Pp. 257-272 en: ÁLVAREZ BB (ed) Fauna del Iberá. Universidad Nacional del Nordeste, Corrientes [ Links ]
8. BELTZER AH Y NEIFF JJ (1992) Distribución de las aves en el valle del río Paraná. Relación con el régimen pulsátil y la vegetación. Ambiente Subtropical 2:73-102 [ Links ]
9. BELTZER AH, QUIROGA MA Y BORTOLUZZI AL (2004) Variación estacional de la comunidad de aves en un ambiente lenítico del valle de inundación del río Paraná. Natura Neotropicalis 34/35:33-37 [ Links ]
10. BLAKE JG Y LOISELLE BA (1991) Variation in resource abundance affects capture rates of birds in three lowland habitats in Costa Rica. Auk 108:114-130 [ Links ]
11. BLANCO DE (1999) Los humedales como hábitat de aves acuáticas. Pp. 208-217 en: MALVÁREZ AI (ed) Tópicos sobre humedales subtropicales y templados de Sudamérica. Oficina Regional de Ciencia y Técnica para América Latina y el Caribe, MAB/UNESCO, Montevideo [ Links ]
12. BÓ RF (2006) Situación ambiental en la Ecoregión Delta e Islas del Paraná. Pp. 130-174 en: BROWN A, MARTÍNEZ ORTIZ U, ACERBI M Y CORCUERA J (eds) La situación ambiental argentina 2005. Fundación Vida Silvestre Argentina, Buenos Aires [ Links ]
13. BÓ RF Y MALVÁREZ AI (1999) Las inundaciones y la biodiversidad en humedales. Un análisis del efecto de eventos extremos sobre la fauna silvestre. Pp. 147-168 en: MALVÁREZ AI (ed) Tópicos sobre humedales subtropicales y templados de Sudamérica. Oficina Regional de Ciencia y Técnica para América Latina y el Caribe, MAB/UNESCO, Montevideo [ Links ]
14. BÓ RF Y QUINTANA RD (1999) Actividades humanas y biodiversidad en humedales: el caso del Bajo Delta del Río Paraná. Pp. 291-316 en: MATTEUCCI SD, SOLBRIG OT, MORELLO J Y HALFFTER G (eds) Biodiversidad y uso de la tierra. Conceptos y ejemplos de Latinoamérica. EUDEBA, Buenos Aires [ Links ]
15. BÓ RF, QUINTANA RD Y MALVÁREZ AI (2002) El uso de las aves acuáticas en la región del Delta del Río Paraná. Pp. 93-106 en: BLANCO DE, BELTRÁN J Y DE LA BALZE V (eds) Primer Taller sobre la Caza de Aves Acuáticas. Hacia una estrategia para el uso sustentable de los recursos de los humedales. Wetlands International, Buenos Aires [ Links ]
16. BONETTO AA (1986) The Paraná River system. Pp. 541-555 en: DAVIES BR Y WALKER KF (eds) The ecology of river systems. W Junk Publishers, Dordrecht [ Links ]
17. BONETTO AA Y HURTADO S (1999) Cuenca del Plata. Pp. 31-72 en: CANEVARI P, BLANCO DE, BUCHER EH, CASTRO G Y DAVIDSON I (eds) Los humedales de la Argentina. Clasificación, situación actual, conservación y legislación. Wetlands International, Buenos Aires [ Links ]
18. BOSISIO AC Y BELTZER AH (2004) Dinámica primaveroestival de un ensamble de aves en el área de inundación del río Paraná. Natura Neotropicalis 34/35:51-61 [ Links ]
19. BUCHER EH, BONETTO A, BOYLE TP, CANEVARI P, CASTRO G, HUSZAR P Y STONE T (1993) Hidrovía: examen inicial ambiental de la vía fluvial Paraguay-Paraná. Humedales para las Américas, Manomet y Buenos Aires [ Links ]
20. BURKART A (1957) Ojeada sinóptica sobre la vegetación del Delta del río Paraná. Darwiniana 11:457-561 [ Links ]
21. CABRERA AL (1976) Regiones fitogeográficas argentinas. Pp. 1-85 en: Enciclopedia argentina de agricultura y jardinería. Tomo 2. Fascículo 1. ACME, Buenos Aires [ Links ]
22. CHATELLENAZ ML (2005) Aves del valle del Río Paraná en la provincia del Chaco, Argentina: riqueza, historia natural y conservación. INSUGEO, Miscelánea 14:527-550 [ Links ]
23. CHEBEZ JC, REY NR, BABARSKAS M Y DI GIACOMO AG (1998) Las aves de los parques nacionales de la Argentina. LOLA, Buenos Aires [ Links ]
24. CLARKE KR Y GORLEY RN (2002) PRIMER 5 for Windows, Version 5.2.9. Primer- E, Plymouth [ Links ]
25. DI GIACOMO AS (2005) Áreas importantes para la conservación de las aves en la Argentina. Sitios prioritarios para la conservación de la biodiversidad. Aves Argentinas/ Asociación Ornitológica del Plata, Buenos Aires [ Links ]
26. DI GIACOMO AS Y CONTRERAS JR (2002) Consideraciones acerca de la diversidad de las aves en relación con el eje fluvial Paraguay-Paraná, en Sudamérica. Historia Natural 1:23-29 [ Links ]
27. DUFRÊNE M Y LEGENDRE P (1997) Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecological Monographs 67:345-366 [ Links ]
28. FRAGA RM (1997) La categorización de las aves de Argentina. Pp. 155-219 en: GARCÍA FERNÁNDEZ JJ, OJEDA RA, FRAGA RM, DÍAZ GB Y BAIGÚN RJ (eds) Libro rojo de mamíferos y aves amenazados de la Argentina. [ Links ]
29. FUCEMA y Administración de Parques Nacionales, Buenos Aires [ Links ]
30. GILLESPIE TW Y WALTER H (2001) Distribution of bird species richness at a regional scale in tropical dry forest of Central America. Journal of Biogeography 28:651-662 [ Links ]
31. GIRAUDO AR Y ARZAMENDIA V (2004) ¿Son las planicies fluviales de la cuenca del Plata, corredores de biodiversidad? Los vertebrados amniotas como ejemplo. Pp. 157-170 en: NEIFF JJ (ed) Humedales de Iberoamérica. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo y Red Iberoamericana de Humedales, La Habana [ Links ]
32. GIRAUDO A Y ORDANO MA (2003) Patrones de diversidad de las aves del Iberá: variación de la riqueza, abundancia y diversidad entre localidades, regiones y hábitats. Pp. 235-256 en: ÁLVAREZ BB (ed) Fauna del Iberá. Universidad Nacional del Nordeste, Corrientes [ Links ]
33. GRIGERA D Y ÚBEDA C (2000) Criterios para determinar el valor de conservación de los ambientes naturales según su fauna de vertebrados: un análisis de caso. Medio Ambiente 13:50-61 [ Links ]
34. HUFF MH, BETTINGER KA, FERGUSON HL, BROWN MJ Y ALTMAN B (2000) A habitat-based point-count protocol for terrestrial birds, emphasizing Washington and Oregon. USDA Forest Service General Technical Report PNW-GTR-501, Portland [ Links ]
35. HUTTO RL, PLETSCHET SM Y HENDRICKS P (1986) A fixed-radius point count method for nonbreeding and breeding season use. Auk 103:593-602 [ Links ]
36. JUNK WJ (1997) Structure and function of the large central Amazonian river floodplains: synthesis and discussion. Pp. 455-468 en: JUNK WJ (ed) The central Amazon floodplain: ecology of a pulsing system. Springer-Verlag, Berlín [ Links ]
37. KARR JR (1990) Birds of tropical rainforests: comparative biogeography and ecology. Pp. 215-228 en: KEAST A (ed) Biogeography and ecology of forest bird communities. SPB Academic Publishing, La Haya [ Links ]
38. LEGENDRE P Y LEGENDRE L (1998) Numerical ecology. Segunda edición. Elsevier, Amsterdam [ Links ]
39. MACARTHUR RH Y MACARTHUR JW (1961) On bird species diversity. Ecology 42:594-598 [ Links ]
40. MALVÁREZ AI (1999) El Delta del Río Paraná como mosaico de humedales. Pp. 35-54 en: MALVÁREZ AI (ed) Tópicos sobre humedales subtropicales y templados de Sudamérica. Oficina Regional de Ciencia y Técnica para América Latina y el Caribe, MAB/UNESCO, Montevideo [ Links ]
41. MALVÁREZ AI, KANDUS P Y MERLER JA (1992) Evaluación y diagnóstico del Parque Nacional Pre-Delta. Informe inédito, Universidad de Buenos Aires y Administración de Parques Nacionales, Buenos Aires [ Links ]
42. MARTÍNEZ MM (1993) Las aves y la limnología. Pp. 127-142 en: BOLTOVSKOY A Y LÓPEZ HL (eds) Conferencias de Limnología. Instituto de Limnología Dr. R. A. Ringuelet, La Plata [ Links ]
43. MCCUNE B Y GRACE JB (2002) Analysis of ecological communities. MjM Software Design, Gleneden Beach [ Links ]
44. MAZAR BARNETT JM Y PEARMAN M (2001) Lista comentada de las aves argentinas. Lynx Edicions, Barcelona [ Links ]
45. NAIMAN RJ, DÉCAMPS H Y POLLOCK M (1993) The role of riparian corridors in maintaining regional diversity. Ecological Applications 3:209-212 [ Links ]
46. NAROSKY T E YZURIETA D (2003) Guía para la identificación de las aves de Argentina y Uruguay. Edición de oro. Vázquez Mazzini Editores, Buenos Aires [ Links ]
47. NEWMARK WD (1991) Tropical forest fragmentation and the local extinction of understory birds in the eastern Usambara mountains, Tanzania. Conservation Biology 5:67-68 [ Links ]
48. NORES M (1987) Zonas ornitogeográficas de Argentina. Pp. 295-305 en: NAROSKY T E YZURIETA D. Guía para la identificación de las aves de Argentina y Uruguay. Asociación Ornitológica del Plata, Buenos Aires [ Links ]
49. ORDANO M (1999) Aves de bosque de sauce del río Paraná medio (Argentina): evaluación de la técnica de conteos de puntos. Tesis de postgrado, Instituto de Enseñanza Superior, Paraná [ Links ]
50. PEARMAN PB (2002) The scale of community structure: habitat variation and avian guilds in tropical forest understory. Ecological Monographs 72:19-39 [ Links ]
51. de la PEÑA MR (2006) Lista y distribución de las aves de Santa Fe y Entre Ríos. LOLA, Buenos Aires [ Links ]
52. PETERMAN P (1997) The birds. Pp. 419-452 en: JUNK WJ (ed) The central Amazon floodplain: ecology of a pulsing system. Springer-Verlag, Berlín [ Links ]
53. PIRATELLI A Y BLAKE J (2006) Bird communities of the southeastern Cerrado region, Brazil. Ornitología Neotropical 17:213-225 [ Links ]
54. QUINTANA RD, BÓ RF Y KALESNIK F (2002) La vegetación y la fauna silvestre de la porción terminal de la Cuenca del Plata. Consideraciones biogeográficas y ecológicas. Pp. 99-124 en: BORTHAGARAY JM (ed) El Río de la Plata como territorio. FADU, FURBAN e Infinito, Buenos Aires [ Links ]
55. RALPH CJ, DROEGE S Y SAUER JR (1995) Managing and monitoring birds using point counts: standards and applications. Pp. 161-168 en: RALPH CJ, SAUER JR Y DROEGE S (eds) Monitoring bird populations by point counts. USDA Forest Service General Technical Report PSW-GTR-149, Albany [ Links ]
56. RALPH C, GEUPEL G, PYLE P, MARTIN T, DE SANTE D Y MILA B (1996) Manual de métodos de campo para el monitoreo de aves terrestres. USDA Forest Service General Technical Report PSW-GTR-159, Albany [ Links ]
57. REMSEM JV Y PARKER TA III (1983) Contribution of river-created habitats to bird species richness in Amazonia. Biotropica 15:223-231 [ Links ]
58. RINGUELET RA (1961) Rasgos de la zoogeografía de la Argentina. Physis 22:151-170 [ Links ]
59. ROBINSON CT, TOCKNER K Y WARD JV (2002) The fauna of dynamic riverine landscapes. Freshwater Biology 47:661-677 [ Links ]
60. ROBINSON SK Y TERBORGH J (1990) Birds communities of the Cocha Cashu Biological Station in Amazonian Perú. Pp. 199-216 en: GENTRY AH (ed) Four Neotropical rainforests. Yale University Press, New Haven [ Links ]
61. ROJAS A Y SALUSO JA (1987) Informe climático de la provincia de Entre Ríos. INTA, Paraná [ Links ]
62. ROSENBERG G (1990) Habitat specialization and foraging behavior by birds of Amazonian river islands in northeastern Peru. Condor 92:427-443 [ Links ]
63. ROSSETTI MA Y GIRAUDO AR (2003) Comunidades de aves de bosques fluviales habitados y no habitados por el hombre en el río Paraná medio, Argentina. Hornero 18:89-96 [ Links ]
64. ROTENBERRY JT Y WIENS JA (1980) Habitat structure, patchiness, and avian communities in North American steppe vegetation: a multivariate analysis. Ecology 64:1228-1250 [ Links ]
65. STAICER CA (1992) Social behavior of the Northern Parula, Cape May Warbler, and Prairie Warbler wintering in second-growth forests in southwestern Puerto Rico. Pp. 308-320 en: HAGAN JM Y JOHNSTON DW (eds) Ecology and conservation of Neotropical migrant landbirds. Smithsonian Institution Press, Washington DC [ Links ]
66. VERNER J Y MILNE KA (1989) Coping with sources of variability when monitoring population trends. Annales Zoologici Fennici 26:191-199 [ Links ]














