Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
El hornero
Print version ISSN 0073-3407
Hornero vol.26 no.2 Ciudad Autónoma de Buenos Aires Dec. 2011
ARTÍCULOS
Diferencias en el canto de la ratona común (Troglodytes musculus) en ambientes con distintos niveles de influencia humana
Solange Mendes 1,2, Víctor J. Colino-Rabanal 1 y Salvador J. Peris 1
1 Departamento de Biología Animal-Zoología, Facultad de Biología, Universidad de Salamanca. Campus Miguel de Unamuno s/n, 37071 Salamanca, España.
2 solangemendes@usal.es
Recibido 12 mayo 2010
Aceptado 19 mayo 2011
RESUMEN
Se ha demostrado que algunas especies de aves son capaces de modificar sus cantos para evitar ser enmascarados por el ruido de fondo, un hecho particular que se enmarca dentro de la hipótesis de adaptación acústica al ambiente circundante. En este estudio se realizó un análisis de los parámetros físicos y temporales del canto de la Ratona Común (Troglodytes musculus) en tres ambientes acústicos diferentes (áreas urbana, periurbana y rural) dentro de la zona metropolitana de Belém (Brasil). Para evaluar el impacto acústico sobre el canto de la especie no se consideró el espectro completo del ruido ambiental sino solo aquel que se encuentra en el rango de vocalización de la especie, que es el que potencialmente puede interferir en el canto. Algunos de los parámetros del canto, como la concentración de energía en relación a las frecuencias o la duración de las notas, se correlacionaron con los niveles de ruido ambiental. Las discrepancias entre los resultados obtenidos a partir de los niveles de ruido y de la zonificación urbana pueden ser una consecuencia de diferencias en la vegetación o en las características propias del planeamiento urbanístico de la ciudad de Belém. Tales correlaciones pueden ser un indicio de la adaptación acústica pero también puede haber otros factores que las expliquen. Si estos cambios se explicaran por los niveles de ruido ambiental, se requeriría una investigación orientada a demostrar que tales cambios contribuyen a una mejora efectiva de la transmisión del canto.
PALABRAS CLAVE: Ajuste vocal; Contaminación acústica; Hipótesis de adaptación acústica; Troglodytes musculus.
ABSTRACT
Changes in the vocalization of the southern house wren (Troglodytes musculus) in environments with different levels of human disturbance. It has been shown that some bird species are able to modify their songs in order to avoid being masked by ambient noise, a particular case of the more general acoustic adaptation hypothesis to the surrounding environment. We analyzed physical and temporal parameters of the song of the Southern House Wren (Troglodytes musculus) in three different acoustic environments (urban, periurban and rural zones) in the metropolitan area of Belém (Brazil). To evaluate the acoustic impact on the song, we did not consider the complete spectrum of ambient noise but only included that within the range of vocalization of the species, which is the one that could potentially interfere with the song. Some song parameters as the concentration of energy within the range of frequencies and note duration were correlated with noise levels. Discrepancies between results from noise levels and urban zoning can be a consequence of differences in vegetation or due to the own characteristics of Belém's urban planning. These correlations could be an evidence of acoustic adaptation, but other factors could also explain them. Were noise levels the explanation for those changes, more research would be needed to demonstrate that they contribute to an effective improvement of song transmission.
KEY WORDS: Acoustic adaptation hypothesis; Acoustic pollution; Troglodytes musculus; Vocal adjustment.
El estudio de los efectos del ruido originado por las actividades humanas sobre la conservación de las especies silvestres ha concentrado un importante esfuerzo de investigación en las últimas décadas, orientándose principalmente a la identificación y cuantificación de los impactos que pueden llegar a alterar la dinámica poblacional de ciertas especies, interfiriendo en la conducta, la comunicación o en los procesos de socialización (Slabbekoorn y den Boer-Visser 2006, Wood y Yezerinac 2006). En este sentido, los medios urbanos constituyen ambientes que suponen un reto para cualquier especie, puesto que se trata de nuevos hábitats para los cuales no están adaptadas. Así, la capacidad para desenvolverse en el entorno urbano está ligada en buena medida al grado de adaptabilidad de la especie a nuevos hábitats (McKinney 2006, Bonier et al. 2007). Sin embargo, las características que permiten a ciertas especies sobrevivir en hábitats perturbados no son completamente conocidas.
Para las aves, los medios urbanos constituyen entornos acústicos que dificultan su comunicación mediante el canto debido al elevado ruido de origen humano. Las densidades poblacionales y la diversidad especifica de aves pueden ser menores en zonas típicamente ruidosas y, en ciertos casos, esta disminución está directamente relacionada con los niveles de ruido ambiental (Stone 2000, Habib et al. 2007, Slabbekoorn y Ripmeester 2008). Sin embargo, hay especies que son capaces de colonizar y desenvolverse en estos entornos acústicos. Para explicar este éxito, se ha sugerido que la plasticidad ecológica en el canto facilita un ajuste vocal que contribuye a reducir el enmascaramiento por el ruido de fondo, favoreciendo una mejor comunicación entre individuos en estos entornos (Miller 1982, Endler 1993, Wiley 1994, Brumm y Slabbekoorn 2005) y, posiblemente, acelerando un proceso de divergencia evolutiva hacia una especiación urbana (Slabbekoorn y Smith 2002). Este ajuste vocal ha sido estudiado por diversos autores (e.g., Cynx et al. 1998, Slabbekoorn y Peet 2003, Brumm 2004, Fernández- Juricic et al. 2005, Fuller et al. 2007, Parris y Schneider 2009), quienes sugieren que implica un cierto costo energético (Oberweger y Goller 2001, Thomas 2002, Ward et al. 2003).
El hecho específico de adaptación a un entorno urbano sería un caso particular de una problemática más general relacionada con la adaptación de las vocalizaciones al ambiente. Los cambios observados en la vocalización de diferentes especies en relación con las características acústicas del ambiente donde se producen se han tratado de explicar mediante la hipótesis de adaptación acústica. Esta hipótesis sostiene que, por presión selectiva ambiental, los cantos presentan una estructuración que favorece la maximización de la transmisión bajo las condiciones ambientales en las que estas señales se generan (Morton 1975, Brown y Handford 2000, Slabbekoorn 2004). La adaptación del canto a las características acústicas podría aparecer y mantenerse en el tiempo mediante el aprendizaje de los cantos si los individuos juveniles copian aquellos cantos de sus conespecíficos que mejor perciben, esto es, los que no son filtrados por el ambiente (Nottebohm 1985). Así, se ha observado para la Ratona de Carolina (Thryothorus ludovicianus) que los individuos juveniles tienden a incorporar los sonidos menos modificados a su repertorio (Morton et al. 1986).
En este estudio se pretende analizar cómo varían ciertos parámetros físicos del canto en un ave de amplia distribución neotropical: la Ratona Común (Troglodytes musculus). Una descripción del canto de esta especie puede encontrarse en Kroodsma (1977) y Tubaro (1990). Durante la búsqueda de pareja los machos emiten cantos a elevada intensidad sonora. Además, parece que no emplean el canto para comunicarse con individuos cercanos pero sí para defender su territorio (Johnson y Kermott 1991). Son capaces de variar sus respuestas vocales cualitativa y cuantitativamente de acuerdo a los estímulos externos y el contexto ambiental (Fasanella y Fernández 2009) e incluso tienen la capacidad de imitar el canto de otras especies (Tubaro 1991). Un ejemplo de audioespectrograma propio de la especie aparece en la figura 1. Se quiere comprobar, dentro del contexto de la hipótesis de adaptación acústica, si la Ratona Común, al igual que ha sido demostrado para otras especies, varía sus parámetros de canto a lo largo de los diferentes entornos acústicos en un gradiente urbano de un área metropolitana emplazada en un entorno tropical. Dichas variaciones podrían ser un indicio de adaptación a las condiciones ambientales de cada zona.

Figura 1. Audioespectrograma del canto de un individuo de Troglodytes musculus grabado en el área metropolitana de Belém de Pará, Brasil.
MÉTODOS
Área de estudio
Las grabaciones de cantos de la Ratona Común se efectuaron en el gradiente urbano del área metropolitana de Belém de Pará (Brasil), ciudad situada a orillas del río Guamá. Los puntos de muestreo se emplazaron en un radio de 100 km en torno a la ciudad. Se considera como área urbana a las zonas verdes dentro del casco urbano que soportan elevadas intensidades de ruido de fondo y que están comprendidas dentro de un radio de 20 km en torno al centro de la ciudad. Las áreas periurbanas, con un menor tráfico de vehículos, se sitúan en un espacio comprendido entre los 20-30 km desde el centro de la ciudad. Por último, las áreas rurales se emplazan fuera del área metropolitana, entre los 50-100 km del centro urbano, donde la actividad humana es mucho más restringida y, por lo tanto, también lo son los niveles de ruido de origen humano.
La ciudad cuenta con varios parques urbanos que constituyen extensas zonas verdes con vegetación propia del bosque amazónico, a la que se unen especies exóticas que producen frutos carnosos que forman parte de la dieta de la Ratona Común, especialmente los mangos (Mangifera indica). Los mayores niveles de ruido se registran en el centro urbano, que cuenta con los edificios más grandes y los mayores volúmenes de tráfico. La zona periurbana cuenta también con numerosos jardines y remanentes de vegetación natural, viviendas unifamiliares más espaciadas entre sí, con predominancia de tráfico local. La zona rural presenta características similares a los bosquetes urbanos, con un mosaico de plantaciones de frutales y palmeras de distintas especies junto a parches de bosque tropical húmedo. Se trata de zonas alejadas de la contaminación acústica urbana.
Grabación de cantos
Las grabaciones se realizaron entre septiembre y noviembre de 2008, coincidiendo con la estación reproductiva de la Ratona Común. Para registrar los cantos se empleó un micrófono unidireccional Sennheiser ME66 (con un adaptador K6 Sennheiser) y una grabadora digital Marantz PMD 671, configurada en formato PCM-48kHz-24bits con una velocidad de bits de 768 kbps con el fin de obtener una señal de audio de alta calidad. Esta grabadora tiene una especificación técnica del rango dinámico equivalente al rango dinámico del medidor de nivel sonoro utilizado (94 dB) y baja distorsión armónica total (apenas 0.03% de pérdida por entrada del micrófono XLR). El equipo se grabación se completó con un protector de viento MZW 415 y un auricular Sennheiser para comprobar la entrada de señales de audio.
Los datos se tomaron en los horarios de mayor actividad de canto para la especie, entre las 5:00 y las 7:00. Otras grabaciones fueron realizadas al final de la tarde, de 17:00 a 19:00. En total, se realizaron 400 h de trabajo de campo, obteniéndose 58 grabaciones individuales. Para evitar un exceso de ruido de fondo que pudiera interferir en el posterior análisis, solo se realizaron grabaciones en días sin lluvia y cuando la velocidad del viento era inferior a 3 m/s. Las grabaciones se tomaron a 8-50 m del individuo, ajustando el receptor de señal de la grabadora a la distancia. Se seleccionaron para el análisis las de mayor calidad y tiempo de duración, sin interferencias con otros tipos de ruido o superposición de cantos con otras especies de aves. Las condiciones de grabación fueron similares para todos los tipos de hábitat y no se encontraron indicios para sospechar de posibles diferencias entre sitios en cuanto a la calidad de la grabación. Se seleccionaron 36 grabaciones para hacer los análisis, 12 por cada área del gradiente urbano (urbana, periurbana y rural).
Como los parámetros del canto pueden verse influidos por la densidad de individuos presentes (Bibby y Burgess 2000), también se realizó para cada punto de muestreo una estimación de dicha densidad. Desde el punto fijo desde el cual se grababa, se censó el número de individuos vistos u oídos que estaban presentes en el mismo momento, teniendo cuidado de no realizar dobles conteos. Posteriormente, se calculó el tamaño del área prospectada, estimando el número de individuos por hectárea. Este sistema no sigue un método usual de registro de densidad poblacional de aves, aunque se acerca al método de punto fijo de conteo (Ralph et al. 1996).
Medición de los niveles de presión sonora
Para poder analizar la relación entre los niveles de ruido ambiental y los parámetros del canto, en cada punto de muestreo se cuantificó el ruido de fondo. Las mediciones se realizaron con un sonómetro de clase I, modelo Brüel y Kjaer 2238E, dotado de un micrófono capacitivo de 1/2", modelo ByK 4188 y filtros de 1/1 y 1/3 de octavas. El micrófono capacitivo utilizado tiene una curva de respuesta casi plana para el intervalo del rango de frecuencias de 20 Hz a 12.5 kHz. Para el ajuste del medidor se utilizó un calibrador sonoro modelo ByK 4231 de clase 1 capaz de producir una señal de 1000 Hz a 94 dB, con una exactitud de ±0.2 dB, equivalente a 1 Pa o 1 N/m2. Todo el sistema de medición sonora se calibró en conformidad con las normativas internacionales IEC 61672.
Como el sonómetro utiliza filtros seriales, el tiempo de medición y el número de barridos de todo el espectro fue ajustado en cada uno de los ambientes evaluados, para garantizar el mayor número posible de barridos completos sin comprometer la caracterización de todos los puntos de muestreo que tuvieran las mismas características. Así, el tiempo de medición fue de alrededor de 10 min en cada uno de los puntos de muestreo. El medidor se montó sobre un trípode a una altura de 1.5 m del suelo y a >2 m de distancia de cualquier obstáculo que pudiera proyectar sombra acústica o reflejar energía sonora.
Como nivel de ruido no se consideró el nivel de presión sonora en su conjunto sino solo el que se sitúa dentro del rango de frecuencia de vocalización de la Ratona Común, que es el que puede causar mayores interferencias en la comunicación de la especie (Cavalcante et al. 2008). En este sentido, el sonómetro permite el análisis del espectro de frecuencias por bandas de tercio de octava, de tal forma que registra en ponderación lineal el nivel promedio de ruido equivalente (Leq) y los niveles máximos y mínimos para cada banda de tercio de octava. Los analizadores espectrales dividen el rango de frecuencias en bandas de octava o tercio de octava de ancho. Por octava se entiende al intervalo de frecuencia entre dos frecuencias cuya relación es de 2:1. Cada banda de octavas tiene un ancho de banda de alrededor del 70% de su frecuencia central, lo que hace que las bandas de análisis se hagan más anchas en proporción a sus frecuencias. Se trabaja con niveles de ruido equivalente porque se necesita un valor que sea representativo del punto de muestreo. Así, a partir de medidas puntuales en un mismo lugar se obtiene el nivel de ruido equivalente, que representa un ruido constante con la misma energía que el ruido variable medido en el periodo de tiempo estudiado. Ese valor del nivel de ruido es lineal porque no tiene ningún tipo de ponderación en frecuencia, esto es, representa la presión sonora real presente en el ambiente y no la percepción subjetiva de la propia audición de los humanos o de cualquier otra especie. Entonces, para las mediciones del ruido ambiental se utilizó el analizador de tercio de octavas para el rango de frecuencias entre 20 Hz y 12.5 kHz. A partir de estas mediciones se elaboró el descriptor acústico Leq(Tmu) que expresa los niveles sonoros equivalentes en el rango de vocalización de la especie para cada punto de muestreo (Cavalcante 2009):
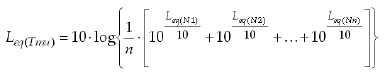
donde Leq(Tmu) es el nivel de presión sonora equivalente y lineal (sin ponderación en frecuencia) en el rango de vocalización de la Ratona Común, medido en bandas de tercio de octavas en el rango 1.6-8 kHz (se emplea una ponderación lineal porque no se conoce la curva de audición para la especie), N es el valor de presión sonora dentro del rango de vocalizaciones de la Ratona Común registrado en cada medición individual y n es el numero de mediciones realizadas a intervalos regulares de tiempo para obtener el nivel de presión sonora equivalente.
Análisis bioacústico y estadístico
Para la obtención de los parámetros del canto de los individuos de Ratona Común grabados a lo largo del gradiente urbano se utilizó el programa Avisoft-SASLab Pro versión 4.40 (Specht 1998). Los sonogramas para el análisis bioacústico se crearon con ventana Hamming, transformación rápida de Fourier (FFT) de 1024 bits, con señal de 24 bits de resolución y tasa de muestreo de 48 kHz. El ruido de fondo de las grabaciones se eliminó usando filtros FFT (Baker y Logue 2007). En los cálculos con el nivel de presión sonora se consideró la naturaleza logarítmica de la escala de dBs, por lo que se realizaron las oportunas transformaciones lineales de los valores para la obtención, por ejemplo, del promedio aritmético de los niveles en los puntos de muestreo en cada una de las tres áreas del gradiente urbano.
En cuanto a los parámetros del canto, se cuantificaron la duración y el número de notas, las frecuencias mínimas y máximas, la distribución de energía en el canto y la entropía del mismo. No se pretendió analizar la energía del canto en términos absolutos, sino cómo se distribuía ésta dentro del rango de frecuencias del canto de cada individuo. Para la entropía, que pretende cuantificar la versatilidad o complejidad del canto, se utilizó el método desarrollado por Silva et al. (2000) y Silva (2001), teniendo como base la teoría de la información (Shannon y Weaver 1949, Beecher 1982, 1988, 1989). Se designó un alfabeto para cada individuo, compuesto por N símbolos, y se consideró la probabilidad pi asignada a cada símbolo como un número calculado en función de su frecuencia relativa. Después de obtener el repertorio para el canto de cada individuo, se calculó la frecuencia de aparición de cada uno de los tipos de notas de su repertorio. En estas condiciones, se pudo calcular la información individual de cada símbolo (Shannon y Weaver 1949), teniendo en cuenta todos los símbolos N emitidos, como:

A partir de estos datos, se calculó la entropía para cada individuo:
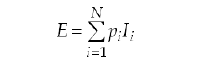
Las diferencias en los parámetros del canto en relación a las tres áreas del gradiente urbano se analizaron mediante ANOVA ya que las pruebas de Levene y de Kolmogorov-Smirnov apoyaron los supuestos de homogeneidad de varianza y normalidad de los datos. Las comparaciones a posteriori se realizaron con la Prueba de Scheffé. Los datos de los niveles de presión sonora entre las distintas áreas fueron comparados usando también un ANOVA (Fowler y Cohen 1999). El coeficiente de correlación de Pearson se empleó para determinar la relación entre los niveles de ruido de fondo y los parámetros de los cantos. El nivel de significación fue de 0.05. Los análisis estadísticos se realizaron con el programa SPSS 17.0.
RESULTADOS
El ruido ambiental disminuyó desde el ambiente urbano hasta el rural, siendo la diferencia de los valores promedio de Leq entre el área urbana y la rural de 21 dB (Fig. 2). Al considerar solo las frecuencias dentro del rango de vocalización de la Ratona Común (Leq(Tmu)), esta diferencia fue de 17.6 dB. Las áreas urbanas fueron más ruidosas que las periurbanas y las rurales (Fig. 2). Las diferencias en los valores de Leq(Tmu) fueron significativas (F2,35= 71.98, P < 0.001). Las comparaciones múltiples mostraron diferencias entre las tres áreas. Una vez definida la existencia de diferencias en los niveles de ruido ambiental entre las diferentes áreas del gradiente urbano, se analizó cómo varían los parámetros del canto entre esos ambientes con entornos acústicos diferenciados.
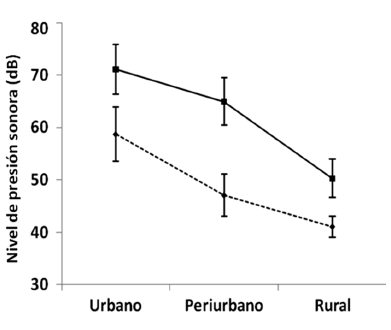
Figura 2. Niveles promedio (±DE) de presión sonora ambiental (Leq) en el espectro de frecuencias medido en escala lineal (línea llena) y considerando solo el rango de vocalización de la Ratona Común (Troglodytes musculus) (Leq(Tmu), línea discontinua) en tres áreas (urbana, periurbana y rural) a lo largo de un gradiente urbano en el área metropolitana de Belém de Pará, Brasil.
El promedio de frecuencias de vocalización de la Ratona Común está comprendido entre 1500-8000 Hz. No se encontraron diferencias significativas entre áreas en las frecuencias máximas (F2,35= 1.84, P = 0.17) ni en las mínimas (F2,35= 1.33, P = 0.28), aunque se observó una ligera tendencia en las frecuencias máximas con valores decrecientes desde el área urbana hasta la rural (Fig. 3a).

Figura 3. (a) Frecuencias máximas medidas, (b) frecuencias para las que se obtiene el 75% de la concentración de energía, (c) duración de las notas , y (d) valores de entropía, en el canto de la Ratona Común (Troglodytes musculus) en tres áreas (urbana, periurbana y rural) a lo largo de un gradiente urbano en el área metropolitana de Belém de Pará, Brasil. Las cajas indican la mediana, y primer y tercer cuartil. Las líneas son valores máximos y mínimos. Los puntos son observaciones atípicas.
El 75% de la concentración de energía del canto de la Ratona Común mostró diferencias significativas entre áreas (F2,35= 3.33, P = 0.048; Fig. 3b). Las comparaciones múltiples indicaron diferencias entre el área urbana y la rural. Se detectó una relación significativa entre el nivel de presión sonora y la concentración de energía del canto (r = 0.454, n = 36, P = 0.005).
La duración de las notas varió entre las tres áreas del gradiente (F2,35= 11.67, P < 0.001; Fig. 3c). Se encontraron diferencias entre el área urbana y la periurbana (P < 0.001) y entre ésta y la rural (P = 0.04). Las notas fueron más largas en el área urbana, intermedias en la rural y más cortas en la periurbana (Fig. 3c). La correlación entre los niveles de ruido y la duración promedio de las notas fue significativa (r = 0.336, n = 36, P = 0.04).
Se encontraron diferencias significativas en los valores de entropía entre las áreas del gradiente urbano (F2,35= 3.46, P = 0.04; Fig. 3d). Las comparaciones múltiples mostraron que los cantos de los individuos procedentes de áreas rurales tienen una entropía menor que los de las áreas periurbanas. Aunque los valores registrados en el área urbana fueron más altos que lo del área rural, las diferencias no fueron significativamente diferentes (Fig. 3d). No se encontró una correlación entre los valores de entropía del canto y los niveles de presión sonora en los puntos de muestreo (r = 0.202, n = 36, P = 0.23), aunque la entropía más baja se haya observado en los ambientes de menor nivel de ruido ambiental (Fig. 3d).
No se encontraron diferencias estadísticamente significativas en la densidad de aves observadas entre las tres áreas (F2,35= 0.211, P = 0.81). El número promedio (±DE) de individuos por hectárea registrado en el área urbana (4.25±2.63) fue similar al de la periurbana (3.83±1.80) y rural (4.33±1.43).
DISCUSIÓN
En este estudio se encontraron cambios en la estructura del canto de la Ratona Común entre ambientes con distintos niveles de influencia humana (áreas urbana, periurbana y rural) en una zona metropolitana emplazada en un ambiente tropical. Se observaron diferencias en cuanto a la duración de las notas, la entropía y en la concentración de energía del canto.
A diferencia de otros estudios en los cuales se ha demostrado que algunas especies incrementan las bajas frecuencias en zonas con elevado ruido de tráfico, lo que minimizaría el enmascaramiento (Fernández-Juricic et al. 2005, Slabbekoorn y den Boer-Visser 2006, Wood y Yezerinac 2006), en este caso no se ha encontrado ese patrón. Quizá esto se deba a que la Ratona Común posee un canto con frecuencias elevadas (1500-8000 Hz). Al ser los ruidos de origen humano preferentemente de frecuencias bajas, las aves que emplean frecuencias más altas en sus vocalizaciones tendrían una mayor facilidad para desenvolverse en el entorno urbano desde un punto de vista acústico y sufrirían menos costos energéticos como el de contracción de los músculos de la siringe (Hu y Cardoso 2009, Parris y Schneider 2009). Sin embargo, se ha detectado una tendencia a que la energía se concentre en frecuencias cada vez más altas a lo largo del gradiente urbano. Estos resultados coinciden con los obtenidos por Wood y Yezerinac (2006) para el Gorrión Cantor (Melospiza melodia), quienes encontraron, además del aumento de las frecuencias más bajas, una menor energía en el canto para el rango de 1-4 kHz en lugares ruidosos. En este sentido, cualquier variación o aumento en las frecuencias, aunque pequeño, supone un posible gasto de energía relacionado con el consumo de oxígeno y el aumento de la intensidad vocal (Oberweger y Goller 2001, Brumm y Todt 2002).
En este estudio se encontró que los individuos de áreas urbanas tienen cantos con notas más largas. Esto podría relacionarse no solo con el ruido ambiental, sino también con el hecho de que los puntos de muestreo dentro de la ciudad eran pequeños remanentes de bosques con jardines, con una estructura más cerrada que en las áreas rurales, donde el cultivo de frutales propicia hábitats más abiertos. Tubaro y Lijtmaer (2006) encontraron, para varias especies de Cardinalidae, que los cantos en los ambientes abiertos tienen notas más cortas, aunque en mayor número.
No hubo grandes diferencias en los valores de entropía entre los individuos de las áreas urbanas y periurbanas de Belém, quizá porque el entorno urbano en estas dos zonas no se diferencia mucho entre sí al tratarse de una región rica en vegetación y por la propia estructura urbana. Sin embargo, estas diferencias sí se observan del gradiente urbano al rural. Esto lleva a pensar que en ambientes en los cuales el nivel de ruido es más alto, la especie se ve obligada a diversificar su canto para lograr que sus mensajes sean recibidos por sus congéneres. Lo mismo fue comprobado para la Ballena Jorobada (Megaptera novaeangliae) al comparar la capacidad de transmisión de señales en ambientes ruidosos: la entropía promedio en condiciones de altos niveles de ruido fue significativamente mayor que en ambientes con niveles de ruido más bajos. En las ballenas, el ruido de los buques se asocia con un aumento en la tasa y repetitividad de la señal de utilización secuencial de las llamadas de alimentación (Doyle et al. 2008).
Retomando la hipótesis de adaptación acústica al entorno, una correlación entre el ruido de origen humano y los parámetros del canto podrían ser indicio de una adaptación a las condiciones ambientales. Para la concentración de la energía del canto o la duración de las notas esta correlación fue significativa, lo que estaría en consonancia con la hipótesis. Esto, sin embargo, no tuvo equivalencia en el área urbana, posiblemente por las propias características del planeamiento urbanístico de la ciudad, en la cual, a diferencia del esquema europeo de ciudad concentrada, existe un centro financiero y comercial con hábitats apenas disponibles para la especie y luego zonas residenciales con viviendas unifamiliares donde la frontera entre lo urbano y lo periurbano es, a veces, difusa. Las zonas periurbanas podrían calificarse de ecotonos, con características intermedias entre las urbanas y las rurales.
En relación a la posible influencia de la densidad poblacional, de acuerdo a los índices de abundancia registrados, los cambios detectados en los cantos no podrían explicarse por la existencia de diferencias en la misma, dado que fue similar en las tres áreas consideradas. La eficiencia del canto de la Ratona Común puede verse afectada por otros tipos de ruido de fondo. Los ruidos de alta frecuencia y los ruidos naturales, como los emitidos por otras especies de aves simpátricas, pueden disminuir la recepción de las señales territoriales. En este sentido, algunas especies de aves pueden modificar la estructura de su canto para reducir la competencia con especies coexistentes. Otras hipótesis plantean la existencia de dialectos o efectos de vecindario (efectos locales) que generaría diferencias en el canto entre poblaciones.
Otro factor diferenciado respecto a estudios similares es el de las características del área de estudio, con vegetación exuberante propia de una zona tropical tanto en el área metropolitana como en la rural. Así, el tipo y el grado de cobertura vegetal pueden modificar parcialmente los parámetros del canto, especialmente la duración de las notas, pero también las frecuencias máximas y mínimas y el rango de frecuencias. Esto es extensible a cualquier estructura que pueda generar eco. La no inclusión de las características de la vegetación en cada punto de muestreo en este estudio supone una limitación a la hora de interpretar los resultados.
Aunque se haya encontrado una correlación entre algunos parámetros del canto y los niveles de ruido ambiental, no es posible inferir si estas variaciones suponen realmente una transmisión más efectiva de la información. La comprobación de dicha mejora en la transmisión sería el paso complementario que habría que dar para concluir que existe una adaptación al entorno acústico donde se emite el canto.
Aunque algunas especies de aves canoras pueden superar las dificultades de comunicación en ambientes ruidosos mediante la modificación de los parámetro del canto en consonancia con la hipótesis de adaptación acústica, ello supone un gasto extra de energía para vocalizar (Brumm y Todt 2002). En su estudio comparativo sobre los costos metabólicos de la vocalización en passeriformes, Oberweger y Goller (2001) mostraron que un incremento de 16 dB en el nivel del canto en el Estornino Pinto (Sturnus vulgaris) condujo a un aumento del 16% en la tasa de consumo de oxígeno. Por ello, para minimizar el ruido humano deben adoptarse distintas estrategias, tanto en entornos urbanos como rurales, de modo de evitar los efectos indeseados de la contaminación acústica en las poblaciones de aves silvestres.
AGRADECIMIENTOS
Al Dr. Raimund Specht por la donación del programa Avisoft. Al Prof. Dr. Gustavo S. V. de Melo, por el préstamo del equipo de medición de ruido y a los profesores Dr. Jacques Vielliard y Dra. María Luisa Silva por las orientaciones y opiniones respecto a la especie elegida. Agradecemos la ayuda parcial provista por el proyecto FS/7-2011 de la Fundación Samuel Solórzano Barruso. Queremos agradecer también las recomendaciones de tres revisores anónimos que contribuyeron a mejorar notablemente la calidad del manuscrito.
BIBLIOGRAFÍA CITADA
1. BAKER MC Y LOGUE DM (2007) A comparison of three noise reduction procedures applied to bird vocal signals. Journal of Field Ornithology 78:240-253 [ Links ]
2. BEECHER MD (1982) Signature systems and kin recognition. Integrative and Comparative Biology 22:477-490 [ Links ]
3. BEECHER MD (1988) Kin recognition in birds. Behaviour Genetics 18:465-482 [ Links ]
4. BEECHER MD (1989) Signalling systems for individual recognition: an information theory approach. Animal Behaviour 38:248-261 [ Links ]
5. BIBBY CJ Y BURGESS ND (2000) Bird census techniques. Academic Press, Londres [ Links ]
6. BONIER F, MARTIN PR, SHELDON KS, JENSEN JP, FOLTZ SL Y WINGFIELD JC (2007) Sex-specific consequences of life in the city. Behavioral Ecology 18:121-129 [ Links ]
7. BROWN TJ Y HANDFORD P (2000) Sound design for vocalizations: quality in the woods, consistency in the fields. Condor 102:81-92 [ Links ]
8. BRUMM H (2004) The impact of environmental noise on song amplitude in a territorial bird. Journal of Animal Ecology 73:434-440 [ Links ]
9. BRUMM H Y SLABBEKOORN H (2005) Acoustic communication in noise. Advances in the Study of Behavior 35:151-209 [ Links ]
10. BRUMM H Y TODT D (2002) Noise-dependent song amplitude regulation in a territorial songbird. Animal Behaviour 63:891-897 [ Links ]
11. CAVALCANTE KV (2009) Avaliação acústica ambiental de hábitats de passeriformes expostos a ruídos antrópicos em Minas Gerais e São Paulo. Tesis de maestría, Universidade Federal de Minas Gerais, Belo Horizonte [ Links ]
12. CAVALCANTE KV, MENDES S, CORBO M Y SCHWABE WK (2008) Avaliação acústica ambiental de um hábitat urbano do pássaro Troglodytes aedon exposto ao ruído de tráfego em Campinas. Pp. 1-7 en: Anais do XXII Encontro da Sociedade Brasileira de Acústica. Sociedade Brasileira de Acústica, Belo Horizonte [ Links ]
13. CYNX J, LEWIS R, TAVEL B Y TSE H (1998) Amplitude regulation of vocalizations in noise by a songbird Taeniopygia guttata. Animal Behaviour 56:107-113 [ Links ]
14. DOYLE RL, MCCOWAN B, HANSER SF, CHYBA C, BUCCI T Y BLUE JE (2008) Applicability of information theory to the quantification of responses to anthropogenic noise by Southeast Alaskan Humpback Whales. Entropy 10:33-46 [ Links ]
15. ENDLER JA (1993) The color of light in forests and its implications. Ecological Monographs 63:1-27 [ Links ]
16. FASANELLA M Y FERNÁNDEZ GJ (2009) Alarm calls of the Southern House Wren Troglodytes musculus: variation with nesting stage and predator model. Journal of Ornithology 150:853-863 [ Links ]
17. FERNÁNDEZ-JURICIC E, POSTON R, COLLIBUS K, MORGAN T, BASTIAN B, MARTIN C, JONES K Y TREMINIO R (2005) Microhabitat selection and singing behavior patterns of male house finches (Carpodacus mexicanus) in urban parks in a heavily urbanized landscape in the western U.S. Urban Habitats 3:49-69 [ Links ]
18. FOWLER J Y COHEN L (1999) Estadística básica en Ornitología. SEO-BirdLife, Madrid [ Links ]
19. FULLER RA, WARREN PH Y GASTON KJ (2007) Daytime noise predicts nocturnal singing in urban robins. Biological Letters 3:368-370 [ Links ]
20. HABIB L, BAYNE EM Y BOUTIN S (2007) Chronic industrial noise affects pairing success and age structure of ovenbirds Seiurus aurocapilla. Journal of Applied Ecology 44:176-184 [ Links ]
21. HU Y CARDOSO GC (2009) Are bird species that vocalize at higher frequencies preadapted to inhabit noisy urban areas? Behavioral Ecology 20:1268-1273 [ Links ]
22. JOHNSON LS Y KERMOTT H (1991) The functions of song in male house wrens (Troglodytes aedon). Behaviour 116:190-209 [ Links ]
23. KROODSMA DE (1977) Correlates of song organization among North American wrens. American Naturalist 111:995-1008 [ Links ]
24. MCKINNEY ML (2006) Urbanization as a major cause of biotic homogenization. Biological Conservation 27:247-260 [ Links ]
25. MILLER EH (1982) Character and variance shift in acoustic signals of birds. Pp. 253-295 en: KROODSMA DE Y MILLER EH (eds) Acoustic communication in birds. Academic Press, Nueva York [ Links ]
26. MORTON ES (1975) Ecological sources of selection on avian sounds. American Naturalist 109:17-34 [ Links ]
27. MORTON ES, GISH SL Y VAN DER VOORT M (1986) On the learning of degraded and undegraded songs in the Carolina wren. Animal Behaviour 34:815-820 [ Links ]
28. NOTTEBOHM F (1985) Sound transmission, signal salience, and song dialects. Behavioral and Brain Sciences 8:112-113 [ Links ]
29. OBERWEGER K Y GOLLER F (2001) The metabolic cost of birdsong production. Journal of Experimental Biology 204:3379-3388 [ Links ]
30. PARRIS KM Y SCHNEIDER A (2009) Impacts of traffic noise and traffic volume on birds on roadside habitat. Ecology and Society 14:art29 [ Links ]
31. RALPH JC, GEUPEL GR, PYLE P, MARTIN TE, DESANTE DF Y MILA B (1996) Manual de métodos de campo para el monitoreo de aves terrestres. USDA Forest Service General Technical Report PSW-GTR-159, Albany [ Links ]
32. SHANNON CE Y WEAVER W (1949) The mathematical theory of communication. University of Illinois Press, Chicago [ Links ]
33. SILVA ML (2001) Estrutura e organização de sinais de comunicação complexos: o caso do sabiálaranjeira Turdus rufiventris (Aves Passeriformes Turdidae). Tesis doctoral, Universidad de San Pablo, San Pablo [ Links ]
34. SILVA ML, PIQUEIRA JC Y VIELLIARD JME (2000) Using Shannon entropy on measuring the individual variability in the rufous-bellied thrush Turdus rufiventris vocal communication. Journal of Theoretical Biology 207:57-64 [ Links ]
35. SLABBEKOORN H (2004) Singing in the wild: the ecology of birdsong. Pp. 178-205 en: MARLER P Y SLABBEKOORN H (eds) Nature's music: the science of birdsong. Elsevier, San Diego [ Links ]
36. SLABBEKOORN H Y DEN BOER-VISSER A (2006) Cities change the songs of birds. Current Biology 16:2326-2331 [ Links ]
37. SLABBEKOORN H Y PEET M (2003) Birds sing at a higher pitch in urban noise. Nature 424:267 [ Links ]
38. SLABBEKOORN H Y RIPMEESTER EAP (2008) Birdsong and anthropogenic noise: implications and applications for conservation. Molecular Ecology 17:72-83 [ Links ]
39. SLABBEKOORN H Y SMITH TB (2002) Bird song, ecology, and speciation. Philosophical Transactions of the Royal Society B 357:493-503 [ Links ]
40. SPECHT R (1998) Avisoft-SASLab Pro. Sound analysis and synthesis laboratory. Avisoft Bioacoustics, Berlín [ Links ]
41. STONE E (2000) Separating the noise from the noise: a finding in support of the "Niche Hypothesis" that birds are influenced by human-induced noise in natural habitats. Anthrozoos 13:225-231 [ Links ]
42. THOMAS RJ (2002) The costs of singing in nightingales. Animal Behaviour 63:959-966 [ Links ]
43. TUBARO PL (1990) Song descriptions of the house wren (Troglodytes aedon) in two populations of eastern Argentina, and some indirect evidences of imitative vocal learning. Hornero 13:111-116 [ Links ]
44. TUBARO PL (1991) Can Troglodytes aedon in Argentina "mimic" the song of Thryomanes bewickii? Condor 93:443-445 [ Links ]
45. TUBARO PL Y LIJTMAER DA (2006) Environmental correlates of song structure in forest grosbeaks and saltators. Condor 108:120-129 [ Links ]
46. WARD S, SPEAKMAN JR Y SLATER PJB (2003) The energy cost of song in the canary Serinus canaria. Animal Behaviour 66:893-902 [ Links ]
47. WILEY RH (1994) Errors exaggeration and deception in animal communication. Pp. 157-189 en: REAL L (ed) Behavioral mechanisms in ecology. University of Chicago Press, Chicago [ Links ]
48. WOOD WE Y YEZERINAC SM (2006) Song sparrow (Melospiza melodia) song varies with urban noise. Auk 123:650-659 [ Links ]













