Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407
Hornero vol.27 no.1 Ciudad Autónoma de Buenos Aires jun. 2012
ARTÍCULOS
Ecología y conservación del Loro Alisero (Amazona tucumana)
Luis Rivera 1,2,5, Natalia Politi 1,2,3 y Enrique H. Bucher 3,4
1 Cátedra de Desarrollo Sustentable y Biodiversidad, Facultad de Ciencias Agrarias, Universidad Nacional de Jujuy. Alberdi 47, 4600 San Salvador de Jujuy, Jujuy, Argentina.
2 Fundación para la Conservación y Estudio de la Biodiversidad (CEBio). Roca 44, 4600 San Salvador de Jujuy, Jujuy, Argentina.
3 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
4 Maestría en Manejo de Vida Silvestre, Centro de Zoología Aplicada, Universidad Nacional de Córdoba. Casilla de Correos 112, 5000 Córdoba, Córdoba, Argentina.
5 lrivera@cebio.org.ar
Recibido 1 febrero 2010, aceptado 9 enero 2012
RESUMEN.- El Loro Alisero (Amazona tucumana) es endémico de las selvas subtropicales de montaña del noroeste de Argentina y sur de Bolivia (Yungas Australes). En este trabajo se recopila información publicada y novedosa sobre aspectos ecológicos y de conservación del Loro Alisero. Se registró al Loro Alisero consumiendo semillas, frutos y flores de 18 especies nativas y 5 exóticas. Se identificaron nidos en 10 especies de árboles distribuidos entre los 1470-2200 msnm y se encontró una alta variabilidad en la densidad de nidos. Se detectaron seis dormideros que albergan la totalidad o una buena parte de las poblaciones de un área, por lo que una buena estrategia de monitoreo de sus poblaciones sería realizar conteos en ellos todos los años, de manera de tener una estimación de las tendencias poblacionales a largo plazo. Fueron registrados 7650 individuos en 26 sitios en Argentina y Bolivia. Es probable que el tamaño poblacional actual sea menor que el anterior a la década de 1980, cuando las capturas para el comercio internacional de mascotas alcanzó su máximo. Los resultados obtenidos sugieren que el Loro Alisero cumple con los criterios para ser categorizado como Vulnerable según la Lista Roja de la UICN. Dado sus requerimientos específicos de reproducción y alimentación es necesario elaborar pautas de manejo forestal y crear áreas protegidas que aseguren la conservación de la especie.
PALABRAS CLAVE: Alimentación; Amazona tucumana; Áreas prioritarias; Loro Alisero; Nidificación; Yungas Australes.
ABSTRACT. Ecology and conservation of the Alder Amazon (Amazona tucumana).- The Alder Amazon (Amazona tucumana) is an endemic parrot from the subtropical montane forests of northwestern Argentina and southern Bolivia (Austral Yungas). We collected published and novel information on the species biology, ecology, and conservation. We recorded Alder Amazon feeding on seeds, fruits, and flowers of 18 native and 5 alien species. We identified nests in 10 tree species along an elevation gradient between 1470-2200 masl and we found a high variability in nest density. We found six roosts harbouring whole or most of the populations of an area; therefore, to monitor population trends it would be a good strategy to conduct roost counts yearly. We recorded 7650 individuals in 26 sites in Argentina and Bolivia. The current population size is probably lower than the level before the 1980's when captures for the international pet trade attained a maximum. Our data suggest that Alder Amazon meets the criteria to be categorized as Vulnerable under the Red List of IUCN. Due to the specific reproductive and feeding requirements it is necessary to delineate forest management guidelines and create protected areas that can assure the species conservation.
KEY WORDS: Alder Amazon; Amazona tucumana; Austral Yungas; Feeding; Nesting; Priority areas.
Los loros del género Amazona están entre las aves más reconocibles y codiciadas como mascotas. Su colorido plumaje y habilidad para imitar la voz humana los han hecho muy requeridos por siglos y una infortunada consecuencia de esto es el estatus amenazado de la mayoría de las especies (Russello y Amato 2004). En la Lista Roja de especies amenazadas de la Unión Internacional para la Conservación de la Naturaleza, 16 especies de loros de este género están incluidas ya sea como Vulnerable, En Peligro o En Peligro Crítico (IUCN 2010). De igual manera, 16 especies están listadas en el Apéndice I de la Convención Internacional sobre el Comercio de Especies Amenazadas (CITES).
El Loro Alisero (Amazona tucumana) es una especie endémica de las selvas subtropicales de montaña del noroeste de Argentina y sur de Bolivia (Yungas Australes) (Fjeldså y Krabbe 1990; Fig. 1). Es una de las cuatro especies de loros del género Amazona citadas para Argentina (Narosky e Yzurieta 2003). Hasta hace unos años era considerada como una subespecie del Charao (Amazona pretrei) (Fjeldså y Krabbe 1990), pero actualmente se las reconoce como especies separadas, aunque estrechamente relacionadas entre ellas y, además, con el Loro Vinoso (Amazona vinacea), con quien forman posiblemente un grupo basal a todos los otros loros del género (Russello y Amato 2004).

Figura 1. Distribución de las Yungas Australes y registros de Loro Alisero (Amazona tucumana) basados en Rivera et al. (2007, 2010).
El hábitat del Loro Alisero, las Yungas Australes, presenta una alta precipitación pluvial estival (diciembre a marzo), así como una marcada estación seca (mayo a octubre). En Argentina, las Yungas Australes se distribuyen desde el norte de la provincia de Catamarca (29°S) hasta el límite con Bolivia (22°S) pasando a través de las provincias de Salta, Jujuy y Tucumán. En Bolivia, su distribución comienza en el límite con Argentina, pasando a través de los departamentos de Tarija, Chuquisaca y Santa Cruz de la Sierra y alcanzando los 18°S. Las Yungas Australes presentan un gradiente altitudinal que determina tres comunidades de plantas diferentes: (1) Selva Pedemontana, distribuida entre los 400-900 msnm, con la mayoría de las especies de árboles semideciduos; (2) Selva Montana, entre los 900-1500 msnm y constituida por árboles perennifolios que se ubican sobre laderas de pendientes pronunciadas; y (3) Bosque Montano, entre los 1500-2300 msnm, constituido principalmente por dos especies dominantes: el aliso (Alnus acuminata) y el pino del cerro (Podocarpus parlatorei). Desafortunadamente, el 90% de la Selva Pedemontana ha sido transformado para agricultura y los bosques remanentes están bajo un intenso y destructivo sistema no planificado de explotación forestal (Brown y Malizia 2004). En la Selva Montana la principal actividad económica es la explotación forestal selectiva y la ganadería extensiva, mientras que el Bosque Montano está amenazado principalmente por la extracción de pino del cerro y por los incendios para regenerar pasturas para el ganado.
Desde que el Loro Alisero fuera descrito en 1885 por Cabanis se había generado muy poca información biológica y ecológica sobre la especie y solo se conocían menciones anecdóticas sobre su historia natural aportadas por distintos autores (Orfila 1938, Wetmore 1926, Höy 1968). En este trabajo se recopila tanto información publicada como novedosa sobre aspectos ecológicos y de conservación del Loro Alisero.
ECOLOGÍA ALIMENTARIA
En las Sierras de Santa Bárbara (Jujuy, Argentina) la dieta del Loro Alisero está constituida por semillas, frutos y flores de 18 especies nativas y, al menos, 5 especies exóticas, que son consumidas a lo largo del año (Rivera 2011; Tabla 1). Siete de estas especies son dominantes, constituyendo el 87% de los registros: Podocarpus parlatorei (21%), Blepharocalix salicifolius (17%), Myrcianthes mato (16%), Acacia visco (10%), Cinnamomun porphyria (9%), Juglans australis (7%) y Cedrela lilloi (7%) (Rivera 2011). El 13% restante corresponde a especies consumidas en forma ocasional. La importancia de los distintos ítems alimenticios en la dieta del Loro Alisero varía según la época del año y el piso altitudinal. En verano aprovecha los frutos y semillas de Podocarpusparlatorei, mirtáceas como Blepharocalix salicifolius y Myrcianthes mato, Cinnamomun porphyria y flores de Cedrela lilloi. Durante el otoño y el invierno se alimenta básicamente de semillas de leguminosas como Acacia visco y Parapiptadenia excelsa, que son de los pocos ítems disponibles en esta época de escasez y que se encuentran en las partes más bajas y secas de la Selva Pedemontana o del Chaco Serrano. Durante la primavera suele aprovechar las inflorescencias de Juglans australis, que produce flores prácticamente todos los años. El Loro Alisero ha sido registrado alimentándose de flores y frutos de especies exóticas como Morus alba, Mespilus germanica y Ligustrum lucidum, especialmente durante la época desfavorable de invierno y comienzos de primavera en cercanías o incluso dentro de pueblos y ciudades (Rivera et al., datos no publicados). Aunque visita árboles frutales, esto suele ser muy ocasional y esporádico. No ha sido observado visitando plantaciones de maíz o cítricos, aunque algunos autores (Juniper y Parr 1998, Low 2005) y pobladores locales sostienen que suelen hacerlo, pero en bajas cantidades o rara vez. Esto los diferencia de otras especies de loros como el Loro Maitaca (Pionus maximiliani), el Calancate Cara Roja (Aratinga mitrata) y el Loro Hablador (Amazona aestiva), que suelen ser frecuentes visitantes de maizales (las dos primeras) y de cítricos (la última), produciendo un importante conflicto con el hombre quien los persigue y ahuyenta llegando en algunos casos a matarlos (Chediak 1991, Castillo y Sauad 1997). La mayor parte de los árboles de las Yungas Australes presentan una alta variación interanual en la producción de flores y frutos (Rivera 2011). En años de escasez marcada de los principales ítems alimenticios, el Loro Alisero puede alimentarse de recursos ocasionalmente abundantes ese año.
Tabla 1. Especies de plantas consumidas por el Loro Alisero (Amazona tucumana) en el Parque Nacional El Rey (Salta) y en la Sierra de Santa Bárbara (Jujuy) entre 2004 y 2009.

BIOLOGÍA REPRODUCTIVA
Estación reproductiva
Si bien la biología reproductiva de varias especies del género Amazona ha sido estudiada detalladamente (Snyder et al. 1987, Gnam y Burchsted 1991, Rojas 1991, Enkerlin-Hoeflich 1995, Renton y Salinas-Melgoza 1999, 2004, Koenig 2001, Seixas y Mourao 2002, Rodríguez- Castillo y Eberhard 2006, Sanz y Rodríguez- Ferraro 2006, Berkunsky y Reboreda 2009), no existía información para el Loro Alisero. Solo había un registro de un nido en Chuquisaca, Bolivia, con una hembra incubando cuatro huevos un 12 de enero (Bond y Meyer de Schauensee 1943). Durante un estudio desarrollado a lo largo de cinco años (2004-2009), se identificaron un total de 80 nidos ubicados en 10 especies de árboles en la Sierra de Santa Bárbara y en el Parque Nacional El Rey (Salta, Argentina) (Rivera 2011; Tabla 2). Algunas de las cavidades encontradas fueron reutilizadas, en algunos casos hasta cuatro temporadas reproductivas consecutivas, muy probablemente por la misma pareja, aunque esto es difícil de confirmar dado que la especie carece de patrones de coloración variables que permitan identificar individuos.
Tabla 2. Especies de árboles usados para nidificar por el Loro Alisero (Amazona tucumana) en el Parque Nacional El Rey (Salta) y en la Sierra de Santa Bárbara (Jujuy) entre 2004 y 2009, y porcentaje de nidos encontrados en cada uno de ellos (n = 80).

La estación reproductiva en los sitios estudiados en Argentina comienza a fines de noviembre o principios de diciembre, cuando las hembras empiezan a poner e incubar los huevos. La incubación dura 26-30 días (n = 3) y el período de desarrollo de los pichones desde que nacen hasta que dejan el nido dura 50-58 días (n = 2). En los pichones en cautiverio el período de desarrollo es más largo, entre 60-67 días (Low 2005). En el medio silvestre solo fueron registrados períodos más largos de 60 días en la temporada reproductiva 2006-2007, cuando el alimento aparentemente era escaso, ya que varios nidos fueron abandonados o mostraban reducción de nidada, sobreviviendo solo uno o dos pichones en las nidadas exitosas (Rivera 2011).
Sitios de nidificación y distribución altitudinal
Del total de nidos encontrados, el 92.5% correspondía a cavidades formadas por descomposición de la madera y los restantes fueron encontrados en cavidades excavadas por pájaros carpinteros, especialmente el Carpintero Lomo Blanco (Campephilus leucopogon), quien construye cavidades con entradas suficientemente grandes como para ser usadas por el Loro Alisero (Rivera 2011). Por el hecho de nidificar en cavidades secundarias, la productividad de estos loros puede estar muy limitada por la disponibilidad de cavidades.
El pino del cerro, el nogal (Juglans australis), el horco molle (Blepharocalix salicifolius) y el cedro (Cedrela lilloi) son árboles usados para nidificar por el Loro Alisero, pero también son explotados para obtener madera (el último es muy valioso desde el punto de vista forestal) (Rivera 2011). Lamentablemente, los cedros de gran tamaño que pueden contener cavidades para nidificación ya son una rareza fuera de las áreas protegidas. Los nidos se encontraron en árboles con un rango de diámetros a la altura del pecho de 35-175 cm (Rivera 2011).
Los nidos encontrados estaban distribuidos en un rango de altitud entre 1470-2200 msnm (Rivera et al., datos no publicados), aunque C Olrog sostenía que el Loro Alisero puede nidificar desde los 900 msnm (mencionado en Low 2005). Es posible que la diferencia se deba a que, a menor latitud (i.e., hacia el norte de la distribución de las Yungas Australes), el Bosque Montano está ubicado a mayor altitud debido a los cambios de las condiciones climáticas.
Tamaño de puesta
De un total de 85 nidos en los cuales se pudo registrar el contenido, el tamaño de puesta varió entre 1-5 huevos con un tamaño promedio (±DE) de 3.60±1.03 huevos (Rivera 2011). Estos valores son similares a los registrados para varias docenas de parejas de Loro Alisero en cautiverio en criaderos de Europa, en las cuales el tamaño promedio fue de 3.4 huevos (Low 2005). El tamaño promedio de puesta del Loro alisero es igual al de Amazona brasiliensis y Amazona leucocephala bahamensis (Sanz y Rodríguez-Ferraro 2006) y representa el segundo mayor tamaño para especies de este género luego de Amazona aestiva (3.7 huevos; Berkunsky et al. 2012). El peso promedio (±DE) de los huevos es de 12.6±0.9 g (n = 5). Bond y Meyer de Schauensee (1943) publicaron medidas de longitud (34.5 mm) y ancho (26.7 mm) de los huevos muy similares a las encontradas para el Loro Alisero: 34.8±0.6 mm y 26.8±0.7 mm, respectivamente (n = 6) (Rivera et al., datos no publicados).
Conducta
Si bien el Loro Alisero es monomórfico, en el género Amazona generalmente es la hembra la que incuba y el macho el que la alimenta durante la incubación (Low 2005). Por este motivo, se hizo el supuesto de que son las hembras las que incuban los huevos todo el día y solamente salen cuando el macho viene a alimentarlas, dos veces al día (en la mañana y en la última hora de la tarde). La hembra está poco tiempo afuera del nido, generalmente menos de 10 min (Rivera et al., datos no publicados), y se queda en el nido incluso hasta 15 días después de que los pichones nacieron. Los pichones mantienen el plumón hasta que empiezan a salir las primeras plumas de contorno, ya que la temperatura ambiental es baja (inferior a 10 °C durante temporales de lluvia) comparada con la de ambientes tropicales o de menor altitud. Una vez que la hembra deja el nido, ambos padres lo visitan tres veces al día para alimentar a los pichones (Rivera et al., datos no publicados).
Características morfológicas de pichones y volantones
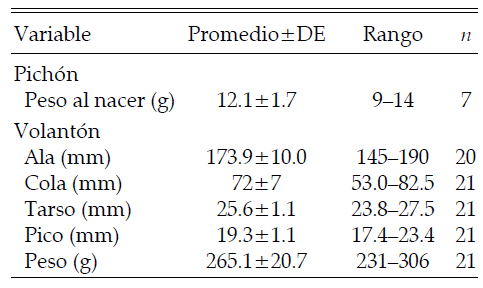
Los pichones recién nacidos alcanzan un peso promedio de alrededor de 12 g (Tabla 3), que coincide con lo registrado en cautiverio (Low 2005). En cuatro variables morfológicas que pudieron ser medidas (ala, cola, tarso y pico), los volantones mostraron valores promedio menores a los reportados por Forshaw (1989) para 19 adultos (Tabla 3). Las mediciones fueron realizadas 1-2 días antes de que los volantones abandonaran el nido, por lo que puede inferirse que los loros que dejan el nido todavía están en un proceso de desarrollo y crecimiento que se completa tiempo después, al alcanzar el tamaño típico del adulto. El peso de los volantones (unos 265 g) es similar que el de pichones de unos 70 días de edad criados en cautiverio (260-269 g) e inferior al de los adultos (280 g) (Low 2005).
Tabla 3. Variables morfológicas de pichones y volantones de Loro Alisero (Amazona tucumana) en la Sierra de Santa Bárbara (Jujuy) durante la estación reproductiva 2005-2006.
Proporción de sexos
Debido a la carencia de dimorfismo sexual, se identificó el sexo de los pichones a través de un análisis de ADN basado en dos genes conservados (chromo-helicase-DNA-binding) localizados en el cromosoma sexual (Griffiths et al. 1998). De un total de 12 nidos en los cuales había 40 pichones, se encontró un 42.5% de machos y un 57.5% de hembras, no habiendo diferencias significativas (χ2 = 1.8, gl = 1, P = 0.18) en la proporción de sexos.
Densidad de nidos y factores de mortalidad
Es común que exista una alta variabilidad entre años en la densidad de nidos de Loro Alisero. Por ejemplo, en la Sierra de Santa Bárbara en la estación reproductiva 2005-2006 se encontraron 18 nidos, mientras que en la estación 2008-2009, con el mismo esfuerzo de búsqueda, solamente se hallaron 3 (Rivera 2011). Entre las causas de fracaso de los nidos se encuentran la escasez de alimento, la inundación del nido cuando hay lluvias muy intensas, la ruptura del árbol que contiene el nido y la predación. En el estudio desarrollado entre 2004 y 2009 se registró predación de varios nidos, probablemente por monos (Cebus apella) y rapaces que fueron observados en proximidades de los nidos y de los cuales desaparecieron huevos o pichones el mismo día. Las rapaces suelen predar también sobre volantones, ya que cuando éstos dejan el nido son muy torpes y poco hábiles para volar, por lo cual pueden ser fácilmente cazados. En tres ocasiones se encontraron restos de volantones (que consistían en plumas arrancadas en manojos) en cercanía de los nidos, aparentemente predados por aves rapaces. Se registraron tres especies de rapaces (Buteo leucorrhous, Micrastur ruficollis y Harpagus diodon) merodeando nidos de Loro Alisero. El período que va desde que abandonan el nido hasta que pueden volar bien y aprender a evitar a los predadores es crítico para la demografía de algunas especies de loros, tal como ha sido demostrado para otras especies (Myers y Vaughan 2004, Salinas-Melgoza y Renton 2007).
DORMIDEROS
En Argentina se identificaron cuatro dormideros (San Andrés, El Fuerte, Parque Nacional El Rey y San Francisco) y en Bolivia dos (Villa Serrano y Reserva Natural de Flora y Fauna Tariquía). En Bolivia no se pudo ubicar el gran dormidero descripto por Fjeldså y Mayer (1996) en Montes Chapeados. El dormidero de El Fuerte (Jujuy) alberga la congregación más grande para la especie (aproximadamente 5000 individuos), tiene una superficie aproximada de 2 ha y está ubicado en un sector de forestación con Pinus patula, una especie exótica. En el dormidero de San Andrés (Salta) se encontró la segunda población más importante en número (aproximadamente 800 individuos). Todos los dormideros detectados están ubicados cerca de poblaciones humanas; esto podría deberse a que tanto los dormideros como los asentamientos están cerca de cursos de agua permanentes. Durante el invierno, el Loro Alisero tiene la costumbre de beber agua todos los días, especialmente en las primeras horas de la mañana o en las últimas horas de la tarde. Este comportamiento puede estar relacionado con el hecho de que en esta época se alimenta básicamente de semillas de leguminosas, que tienen un muy bajo contenido de agua. Algunos dormideros pueden estar activos durante todo el año, pero durante la estación reproductiva poseen generalmente pocos individuos, aparentemente no reproductivos. Los dormideros detectados pueden contener la totalidad o una buena parte de la población de un área, por lo que una buena estrategia de monitoreo de sus poblaciones sería realizar conteos en ellos todos los años, de manera de tener una estimación de las tendencias poblacionales a largo plazo.
ESTADO DE LAS POBLACIONES EN ARGENTINA Y BOLIVIA
Ridgely (1981) categorizó al Loro Alisero como una especie común en Argentina basado en la falta de evidencia que sugiriera una declinación, aunque él no pudo registrarla después de una búsqueda intensiva en mayo-junio de 1977. Entre 1985 y 1989, 18641 individuos fueron legalmente exportados desde Argentina destinados al comercio internacional de mascotas (Nores e Yzurieta 1994). En 1990 el comercio internacional de la especie fue prohibido luego de que fuera incluida en el Apéndice I de CITES. Collar y Juniper (1992) la incluyeron en su lista de especies amenazadas debido a que los niveles reportados de capturas sugerían una seria declinación. Sin embargo, ningún estudio había sido llevado a cabo desde la inclusión de la especie en el Apéndice I de CITES. En 2004 la especie era considerada de Preocupación Menor en la Lista Roja de la UICN (IUCN 2004). La falta de información sobre el tamaño de la población y el rango de distribución del Loro Alisero hacía difícil evaluar el efecto de regulaciones de manejo pasadas y determinar su estatus de conservación (Rivera et al. 2007). En 2003 se inició una evaluación exhaustiva de la información disponible, así como relevamientos de campo detallados en su rango de distribución completo en Argentina y Bolivia (Rivera et al. 2007, 2010). Se registró al Loro Alisero en 26 sitios en ambos países (Fig. 1), 16 de los cuales eran nuevas localidades para la especie. El número más alto de individuos en Argentina (4147) fue encontrado en Santa Bárbara. En Bolivia, el número más alto de individuos (786) fue registrado en el dormidero de Villa Serrano (departamento Chuquisaca).
Debido a que no existía información sobre los niveles de captura de Loro Alisero para el comercio internacional en Bolivia, se realizaron entrevistas a 13 pobladores. De acuerdo a los entrevistados, aproximadamente 5400 loros fueron capturados legalmente entre los años 1981 y 1983 en dormideros cercanos a los pueblos de Valle Grande, Postrervalle, Potrerillos y San Lorenzo (departamento Santa Cruz). Los entrevistados indicaron que desde entonces la especie no ha recuperado sus niveles anteriores. Las últimas capturas registradas tuvieron lugar en 2001, cuando 200 individuos fueron capturados con redes en Potrerillos y vendidos en Santa Cruz. En 2005, el programa de monitoreo del comercio ilegal de mascotas conducido por Asociación Armonía detectó 42 individuos en cautiverio en Santa Cruz (M Herrera, com. pers.). La captura para el comercio local, que actualmente es ilegal, parece continuar a una escala reducida. Es común observar loros cautivos en muchas casas en los pueblos de Bolivia cercanos o ubicados en las Yungas Australes. Las capturas pueden ocurrir incluso dentro de áreas protegidas (e.g., en la Reserva Natural de Flora y Fauna Tariquía, donde se capturan pichones en al menos 50 nidos anualmente, removiendo la nidada completa). Una situación similar se ha observado en otras áreas del departamento Tarija, como por ejemplo en Narváez. En nidos profundos en los cuales los pichones son inaccesibles se abren orificios para extraerlos o se corta directamente el árbol, perdiéndose el árbol con hueco y la oportunidad de que sea reusado para nidificar (Rivera et al. 2010).
En total se han registrado 7650 individuos de Loro Alisero en Argentina y Bolivia (Rivera et al. 2007, 2010). Es probable que el tamaño poblacional actual sea menor que antes de la década de 1980, cuando las capturas para el comercio internacional de mascotas alcanzó su máximo con unos 20000 individuos exportados desde Argentina (Nores e Yzurieta 1994) y al menos 5500 desde Bolivia. La abundancia actual registrada es solamente un tercio de las aves extraídas durante la década de 1980 y muy probablemente no podría sostener aquellos niveles de captura.
En Argentina, las regiones septentrional y central de las Yungas Australes albergan el 96% de las poblaciones. Hay evidencia de que vastas porciones de bosque fueron talados durante los últimos 25 años del siglo XX en la región central (Brown et al. 2001). En la parte sur de las Yungas Australes de Argentina las poblaciones parecen haber declinado considerablemente en comparación con los registros previos y la especie puede estar acercándose rápidamente a niveles de extinciones locales. Por ejemplo, Wetmore (1926) reportaba que la especie era frecuente en San Javier (provincia de Tucumán), pero actualmente es rara en esa área (Rivera et al. 2007), y la especie no pudo ser registrada en varias localidades donde había sido reportada previamente. En base a los resultados de estas evaluaciones, la especie fue recategorizada como Casi Amenazada en la Lista Roja de la UICN en 2005 (BirdLife International 2005). El número de individuos registrados en Bolivia es casi un 25% menor que el registrado en Argentina (Rivera et al. 2007). El 60% de los registros realizados en Bolivia fueron en sitios nuevos, por lo que sería posible que algunas áreas no relevadas contengan poblaciones de Loro Alisero.
En base a toda la información generada se puede afirmar que el Loro Alisero cumple con el criterio A2 (una reducción en sus poblaciones inferida o sospechada mayor o igual al 30% en las últimas tres generaciones determinada a través de una declinación en la calidad del hábitat y/o niveles reales de captura) para ser categorizada como una especie Vulnerable según la Lista Roja de la UICN (IUCN 2001). Jones et al. (2006) hicieron una evaluación de las categorías de amenaza asignadas a distintas especies de la familia Psittacidae y proponen que el Loro Alisero debería ser categorizado como En Peligro en base a un análisis que tiene en cuenta aspectos de la biología y de las características geográficas de las especies. En el Libro Rojo de los vertebrados de Bolivia de 2009, el Loro Alisero ha sido categorizado como Vulnerable (Ministerio de Medio Ambiente y Agua 2009), mientras que en Argentina fue categorizado en 2008 como Amenazado a nivel nacional (López-Lanús et al. 2008).
En Argentina y en Bolivia se han detectado cuatro amenazas como las más importantes para las poblaciones de Loro Alisero. Las mismas se analizan brevemente a continuación.
Explotación forestal comercial.- Este tipo de actividad fue muy importante en el pasado y se mantiene debido a la demanda local e internacional de maderas. Prácticamente no hay sitio de las Yungas Australes en el que no haya habido esta actividad. El sistema utilizado ha sido el de entresaca selectiva, siendo las principales especies extraídas en el Bosque Montano el cedro, el pino del cerro y el nogal, que son fuente de alimento y proporcionan sitios de nidificación para el Loro Alisero. En la actualidad, la explotación forestal continúa, en la mayoría de los casos sin planes de manejo que aseguren el mantenimiento de la biodiversidad de estos bosques. Aunque se están proponiendo esquemas de manejo forestal tendientes a lograr un aprovechamiento sostenible, es escasa la información para delinear estas pautas de manejo en estos tipos de bosque (Brown et al. 2001).
Agricultura migratoria.- Esta es una de las actividades más expandidas en las Yungas Australes, especialmente en Bolivia, incluso dentro de áreas protegidas. Las parcelas desmontadas y quemadas tienen 1-3 ha (denominadas chaqueos) y se encuentran incluso en laderas de elevada pendiente, por lo que solo pueden ser usadas por 2-3 años para luego ser abandonadas y pasar a otra parcela que es desmontada y quemada. Esta actividad se vuelve no sustentable cuando la cantidad de chaqueos es muy alta y no hay tiempo para que la vegetación natural se regenere antes de volver a utilizar la misma parcela, ya que el bosque necesita de varias décadas para recomponerse. Este tipo de actividad lleva a la pérdida y degradación de grandes extensiones de bosques y suelos.
Fuego.- Los fuegos de los chaqueos o los de la quema de pastizales para favorecer el rebrote de los pastos para alimentar el ganado en áreas cercanas a los bosques montanos pueden ocasionar incendios forestales que arrasan bosques maduros con árboles grandes y viejos.
Ganadería.- La ganadería extensiva sin manejo puede impedir la regeneración del bosque, afectando especialmente a las especies de árboles palatables y a las sensibles al pisoteo excesivo, pudiendo cambiar a largo plazo la composición y estructura del bosque.
ÁREAS PRIORITARIAS DE CONSERVACIÓN
En Argentina los esfuerzos a largo plazo para la conservación de esta especie endémica deberían volcarse prioritariamente en dos áreas: (1) Nogalar-San Francisco, que alberga el 20% de los individuos registrados y está ubicada dentro de la Reserva de Biosfera Las Yungas, que puede brindar el marco institucional y de gestión adecuado para llevar adelante las acciones de conservación necesarias, y (2) Sierra de Santa Bárbara-Parque Nacional El Rey, donde se encuentra el 75% de los individuos registrados. Estas dos áreas contienen los últimos remanentes de bosques montanos maduros no perturbados (Brown y Grau 1993). Sin embargo, ambas estuvieron y están actualmente bajo intensa explotación forestal.
En cuanto a la protección dentro de las áreas protegidas, tanto el Parque Nacional El Rey como el Parque Nacional Baritú (Salta) poseen buenos números poblacionales de la especie. El primero contiene probablemente el mejor hábitat reproductivo y en excelentes condiciones de conservación (Rivera 2011). También el Parque Nacional Los Alisos (Tucumán) contendría poblaciones de la especie, pero dado su pequeño tamaño es probable que no sean muy numerosas. Lamentablemente, el Parque Nacional Calilegua parece no tener poblaciones importantes de Loro Alisero, que usa algunos ambientes en forma ocasional (Politi y Rivera 2005). A unos pocos kilómetros del límite del parque se han detectado sitios reproductivos importantes en las inmediaciones del pueblo de San Francisco (Rivera et al., datos no publicados). Esa área se encuentra actualmente bajo una extracción forestal intensa que puede tener efectos importantes sobre la oferta de sitios de nidificación y de alimento para la especie. Es fundamental aumentar la cantidad de áreas protegidas que brinden protección a los núcleos poblacionales más importantes del sector sur de la distribución, que es la zona que presenta la mayor transformación de las Yungas Australes, junto con las poblaciones más pequeñas.
En Bolivia hay tres áreas que poseen las extensiones más grandes de hábitat adecuado para el Loro Alisero y que merecen recibir más atención en los esfuerzos de conservación.
Montes Chapeados probablemente contiene el bosque maduro más extenso de pino del cerro y aliso en Bolivia y con el menor impacto humano debido a su inaccesibilidad. En esta área Fjeldså y Mayer (1996) detectaron la población más numerosa de Bolivia en un dormidero (900 individuos). De acuerdo a información obtenida de habitantes del área los números poblacionales son elevados y se habrían mantenido estables en los últimos años. En Villa Serrano se identificó el segundo dormidero más grande de Bolivia y allí ha sido creado el Parque Nacional y Área de Manejo Integrado Serranía del Iñao. Finalmente, la Reserva Natural de Flora y Fauna Tariquía probablemente alberga buenas poblaciones de Loro Alisero, aunque presenta presiones muy fuertes por el intenso uso del bosque.
En la parte norte de la distribución de la especie en Bolivia ocurre algo similar a lo que sucede en la porción sur, en Argentina. En esta área, ubicada en el departamento Santa Cruz, se encuentran pequeñas poblaciones que han estado sujetas a importantes capturas para el comercio en décadas pasadas. La extensión de hábitat adecuado no es muy grande y está restringido a algunos parches de bosque en sectores puntuales, como en las cercanías del pueblo de Quirusillas. Sería esencial asegurar la protección de algunas poblaciones y su hábitat reproductivo en esta área.
El Loro Alisero depende para su conservación a largo plazo del mantenimiento de bosques maduros que le proporcionen suficiente alimento, especialmente semillas de pino del cerro, que parecen ser clave en su dieta. La conservación de hábitat adecuado debería implementarse a través de la creación de nuevas áreas protegidas y de la aplicación de lineamientos de manejo forestal que permitan mantener amplios sectores de bosques montanos en buen estado. Como fue mencionado más arriba, los resultados de las evaluaciones del estado de las poblaciones de Loro Alisero en Argentina y Bolivia han servido para la categorización de la especie como Vulnerable según la Lista Roja de la UICN (BirdLife International 2011).
AGRADECIMIENTOS
A los tres revisores anónimos que contribuyeron a mejorar sustancialmente el manuscrito. A Carlos Cuñado y Silvia Strelkof por el apoyo brindado durante el trabajo de campo. A Verónica Miranda, Diego Regondi, José Segovia, Pamela Fierro, Luciana Abendaño, Roberto Cáceres y Ariel Cazón. A Raúl Rojas, coordinador del Proyecto en Bolivia. Al Dr. Renato Caparroz por realizar la determinación del sexo de los pichones y a Leónidas Lizárraga por la elaboración del mapa. A la Administración de Parques Nacionales, a la Delegación Técnica Regional NOA, a las intendencias de los parques nacionales El Rey, Calilegua, Baritú y todo su personal. A la Dirección de Políticas Ambientales y Recursos Naturales de la provincia de Jujuy por otorgarnos los permisos para estudiar a la especie en la Sierra de Santa Bárbara. A Sergio Jiménez y Silvia Chalukián por su apoyo en el Parque Nacional El Rey. A los financiadores del proyecto: Manomet Center for Conservation Science, Neotropical Bird Club, BP Conservation Programme, Loro Parque Fundación, Wildlife Conservation Society, IdeaWild, Rufford Small Grants, Cleveland Metropark Zoo a través de su Scott Neotropical Fund, Fish and Wildlife Service a través de su LatinAmerican and Caribbean Programme, Fundación YPF a través de su beca doctoral José Estenssoro a L.R., Overbrook Fellowship for Career Development del Center for Environmental Research and Conservation del Earth Institute de la Universidad de Columbia y finalmente a Conservation Leadership Programme.
BIBLIOGRAFÍA CITADA
1. BERKUNSKY I Y REBOREDA JC (2009) Nest-site fidelity and cavity reoccupation by Blue-fronted Parrots Amazona aestiva in the dry Chaco of Argentina. Ibis 151:145-150 [ Links ]
2. BERKUNSKY I, RUGGERA RA, ARAMBURÚ RM Y REBOREDA JC (2012) Principales amenazas para la conservación del Loro Hablador (Amazona aestiva) en la región del Impenetrable. Hornero 27:39-49 [ Links ]
3. BIRDLIFE INTERNATIONAL (2005) Species factsheet: Amazona tucumana. BirdLife International, Cambridge (URL: http://www.birdlife.org/) [ Links ]
4. BIRDLIFE INTERNATIONAL (2011) BirdLife's globally threatened bird forums. BirdLife International, Cambridge (URL: http://www.birdlife.org/globally-threatenedbird- forums/2011/02/2011-red-list-final-decisions/ parrots-2010-2011-2/) [ Links ]
5. BOND J Y MEYER DE SCHAUENSEE R (1943) The birds of Bolivia. Part II. Proceedings of the Academy of Natural Science of Philadelphia 95:167-221 [ Links ]
6. BROWN AD Y GRAU HR (1993) Investigación, conservación y desarrollo en las selvas subtropicales de montaña. LIEY y Universidad Nacional de Tucumán, San Miguel de Tucumán [ Links ]
7. BROWN AD, GRAU HR, MALIZIA LR Y GRAU A (2001) Argentina. Pp. 623-659 en: KAPPELLE M Y BROWN AD (eds) Bosques nublados del Neotrópico. INBio, Santo Domingo de Heredia [ Links ]
8. BROWN AD Y MALIZIA L (2004) Las selvas pedemontanas de las Yungas en el umbral de la extinción. Ciencia Hoy 14:53-63 [ Links ]
9. CASTILLO M Y SAUAD JJ (1997) Evaluación de daños provocados por el Loro Choclero (Pionus maximiliani) y la Cotorra Común (Aratinga acuticuadata) en cultivos de maíz. Manejo de Fauna, Publicaciones Técnicas 4:30-32 [ Links ]
10. CHEDIAK A (1991) Etoecología de la alimentación del Loro Hablador (Amazona aestiva) durante el período no reproductivo en Burruyacu, Tucumán. Tesis de licenciatura, Universidad Nacional de Tucumán, San Miguel de Tucumán [ Links ]
11. COLLAR NJ Y JUNIPER AT (1992) Dimensions and causes of the parrot conservation crisis. Pp. 1-24 en: BEISSINGER SR Y SNYDER NFR (eds) New World parrots in crisis: solutions from conservation biology. Smithsonian Institute Press, Washington DC [ Links ]
12. ENKERLIN-HOEFLICH EC (1995) Comparative ecology and reproductive biology of three species of Amazona parrots in northeastern Mexico. Tesis doctoral, Texas A & M University, College Station [ Links ]
13. FJELDSÅ J Y KRABBE N (1990) Birds of the high Andes. Apollo Books, Stenstrup [ Links ]
14. FJELDSÅ J Y MAYER S (1996) Recent ornithological surveys in the Valles Region, southern Bolivia-and the possible role of Valles for the evolution of the Andean avifauna. Centre for Research on Cultural and Biological Diversity of Andean Rainforests, Kalo [ Links ]
15. FORSHAW JM (1989) Parrots of the world. Tercera edición. Landsdowne Editions, Willoughby [ Links ]
16. GNAM RS Y BURCHSTED A (1991) Population estimates for the Bahama Parrot on Abaco Island, Bahamas. Journal of Field Ornithology 62:139-146 [ Links ]
17. GRIFFITHS R, DOUBLE MC, ORR K Y DAWSON RJG (1998) A DNA test to sex most birds. Molecular Ecology 7:1071-1075 [ Links ]
18. HÖY G (1968) Über brutbiologie und eier einiger vögel aus nordwest-Argentinien. Journal of Ornithology 109:425-433 [ Links ]
19. IUCN (2001) 2001 categories and criteria (version 3.1). [ Links ]
20. IUCN, Gland (URL: http://www.iucnredlist.org/ static/categories_criteria_3_1) [ Links ]
21. IUCN (2004) 2004 IUCN Red List of threatened species. World Conservation Union, Cambridge [ Links ]
22. IUCN (2010) The IUCN Red List of threatened species. [ Links ]
23. IUCN, Gland (URL: http://www.iucnredlist.org/) [ Links ]
24. JONES M, FIELDING A Y SULLIVAN M (2006) Analysing extinction risk in parrots using decision trees. Biodiversity and Conservation 15:1993-2007 [ Links ]
25. JUNIPER T Y PARR M (1998) Parrots. A guide to parrots of the world. Yale University Press, New Haven [ Links ]
26. KOENIG S (2001) The breeding biology of Black-billed Parrot Amazona agilis and Yellow-billed Parrot Amazona collaria in Cockpit Country, Jamaica. Bird Conservation International 11:205-225 [ Links ]
27. LÓPEZ-LANÚS B, GRILLI P, DI GIACOMO AS, COCONIER EE Y BANCHS R (2008) Categorización de las aves de la Argentina según su estado de conservación. Aves Argentinas/AOP y Secretaría de Ambiente y Desarrollo Sustentable, Buenos Aires [ Links ]
28. LOW R (2005) Amazon parrots. Aviculture, trade and conservation. Insignis Publications, Mansfield [ Links ]
29. MINISTERIO DE MEDIO AMBIENTE Y AGUA (2009) Libro rojo de la fauna silvestre de vertebrados de Bolivia. Ministerio de Medio Ambiente y Agua, La Paz [ Links ]
30. MYERS M Y VAUGHAN C (2004) Movement and behavior of Scarlet macaws (Ara macao) during the post-fledging dependence period: implications for in situ versus ex situ management. Biological Conservation 118:411-420 [ Links ]
31. NAROSKY T E YZURIETA D (2003) Guía para la identificación de las aves de Argentina y Uruguay. Edición de oro. Vázquez Mazzini Editores, Buenos Aires [ Links ]
32. NORES M E YZURIETA D (1994) The status of Argentine parrots. Bird Conservation International 4:313-328 [ Links ]
33. ORFILA RN (1938) Los Psittaciformes argentinos. Hornero 7:1-21 [ Links ]
34. POLITI N Y RIVERA L (2005) Abundance and distribution of parrots along the elevational gradient of Calilegua National Park, Argentina. Ornitología Neotropical 16:43-52 [ Links ]
35. RENTON K Y SALINAS-MELGOZA A (1999) Nesting behavior of the Lilac-crowned Parrot. Wilson Bulletin 111:488-493 [ Links ]
36. RENTON K Y SALINAS-MELGOZA A (2004) Climatic variability, nest predation, and reproductive output of lilac-crowned parrots (Amazona finschi) in tropical dry forest of western Mexico. Auk 121:1214-1225 [ Links ]
37. RIDGELY RS (1981) The current distribution and status of mainland Neotropical parrots. Pp. 233-384 en: PASQUIER RF (ed) Conservation of New World parrots. International Council for Bird Preservation, Cambridge [ Links ]
38. RIVERA L (2011) Ecología, biología reproductiva y conservación del Loro alisero Amazona tucumana en Argentina. Tesis doctoral, Universidad Nacional de Córdoba, Córdoba [ Links ]
39. RIVERA L, POLITI N Y BUCHER EH (2007) Decline of the Tucuman parrot Amazona tucumana in Argentina: present status and conservation needs. Oryx 41:101-105 [ Links ]
40. RIVERA L, ROJAS LLANOS R, POLITI N, HENNESSEY B Y BUCHER EH (2010) Status of Tucumán parrot Amazona tucumana in Bolivia: insights for a global assessment. Oryx 44:110-113 [ Links ]
41. RODRÍGUEZ-CASTILLO AM Y EBERHARD JR (2006) Reproductive behavior of the Yellowcrowned Parrot (Amazona ochrocephala) in western Panama. Wilson Journal of Ornithology 118:225-236 [ Links ]
42. ROJAS F (1991) Biología reproductiva de la cotorra Amazona barbadensis en la Península de Macanao. Tesis de licenciatura, Universidad Central de Venezuela, Caracas [ Links ]
43. RUSSELLO MA Y AMATO G (2004) A molecular phylogeny of Amazona: implications for Neotropical parrot biogeography, taxonomy, and conservation. Molecular Phylogenetics and Evolution 30:421-437 [ Links ]
44. SALINAS-MELGOZA A Y RENTON K (2007) Postfledging survival and development of juvenile lilac-crowned parrots. Journal of Wildlife Management 71:43-50 [ Links ]
45. SANZ V Y RODRÍGUEZ-FERRARO A (2006) Reproductive parameters and productivity of the Yellow-shouldered Parrot on Margarita Island, Venezuela: a longterm study. Condor 108:178-192 [ Links ]
46. SEIXAS GHF Y MOURAO G (2002) Nesting success and hatching survival of the Blue-fronted Amazon (Amazona aestiva) in the Pantanal of Mato Grosso do Sul, Brazil. Journal of Field Ornithology 73:399-409 [ Links ]
47. SNYDER NFR, WILEY JW Y KEPLER CB (1987) The parrots of Luquillo: natural history and conservation of the Puerto Rican Parrot. Western Foundation of Vertebrate Zoology, Los Angeles [ Links ]
48. WETMORE A (1926) Observations on the birds of Argentina, Paraguay, Uruguay and Chile. Bulletin of the United States National Museum 133:1-448 [ Links ]














