Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
El hornero
Print version ISSN 0073-3407
Hornero vol.29 no.2 Ciudad Autónoma de Buenos Aires Dec. 2014
ARTÍCULOS
Evaluación del comportamiento territorial de cuatro especies de aves granívoras en el Monte central
M. Cecilia Sagario1 y Víctor R. Cueto2
1 Grupo de Investigación en Ecología de Comunidades de Desierto (ECODES), Departamento de Ecología, Genética y Evolución, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Piso 4, Pabellón 2, Ciudad Universitaria, C1428EHA Buenos Aires, Argentina. tatysagario@ege.fcen.uba.ar
2 Grupo de Investigación en Ecología de Comunidades de Desierto (ECODES), Centro de Investigación Esquel de Montaña y Estepa Patagónicas (CONICET-UNPSJB). Esquel, Chubut, Argentina.
Recibido 2 octubre 2014, aceptado 31 diciembre 2014
Resumen
El comportamiento territorial en aves es común pero en pocos trabajos se busca entender qué es lo que las aves defienden en sus territorios. Se estudió el comportamiento territorial intra e interespecífico entre cuatro especies de aves granívoras en la porción central del desierto del Monte durante dos años consecutivos, a fin de evaluar un posible escenario de interacciones y la plasticidad del comportamiento. Se realizaron experimentos de "playback" con la Monterita Canela (Poospiza ornata), la Monterita de Collar (Poospiza torquata), el Chingolo (Zonotrichia capensis) y el Pepitero Chico (Saltatricula multicolor). Todas las especies mostraron territorialidad frente a conespecíficos, la cual tendió a ser menos agresiva el año de mejores condiciones ambientales (más precipitaciones y mayor abundancia de alimento). No hubo respuesta territorial entre especies del mismo gremio de alimentación, pero sí una respuesta asimétrica entre las especies que usan los mismos sitios de nidificación. La Monterita Canela mostró un comportamiento agresivo frente a la Monterita de Collar durante la temporada reproductiva en la que la densidad de la primera especie fue alta. Los resultados y la evidencia previa sugieren que la territorialidad en las aves granívoras en el Monte central está más relacionada con la defensa de recursos reproductivos y que los conflictos por el alimento son menos importantes. Además, los resultados mostraron que las aves podrían responder de manera diferente frente a conespecíficos y heterospecíficos dependiendo de su propia abundancia y de las condiciones ambientales.
Palabras clave: Agresión; Experimentos de "playback"; Recursos alimenticios; Recursos reproductivos; Territorialidad interespecífica; Territorialidad intraespecífica.
Abstract
Evaluation of the territorial behaviour of four species of sparrows in the central Monte desert.- Territorial behaviour in birds is common, but very few studies have attempted to understand what are birds defending in their territories. We evaluated intra and interspecific territorial behaviour among four species of sparrows in the central Monte desert during two consecutive years, in order to assess possible interactions and plasticity in their behaviour. We performed playback experiments on the Cinnamon Warbling-Finch (Poospiza ornata), the Ringed Warbling-Finch (Poospiza torquata), the Rufous-collared Sparrow (Zonotrichia capensis), and the Many-coloured Chaco-Finch (Saltatricula multicolor). Every species showed conspecific territoriality, which tended to be weaker during the year of better environmental conditions (wetter and with higher food abundance). We also found a lack of territorial response among the species within the same feeding guild. However, we observed an asymmetric response between the species that use similar nest sites. The Cinnamon Warbling-Finch showed aggression towards the Ringed Warbling-Finch, and this occurred only during the year when the abundance of the former species was high. Our results and previous evidence suggest that territoriality in central Monte desert sparrows is most likely to be driven by defence of reproductive resources, and conflicts over food would be less important. Our results also hint that birds may respond different to both heterospecifics and conspecifics based both on their own abundance and on environmental conditions.
Key words: Aggression; Food resources; Interspecific territoriality; Intraspecific territoriality; Playback experiments; Reproductive resources.
La territorialidad (i.e., la defensa de un área fija) es muy común entre las aves y, en su forma más extrema, incluye la exclusión de competidores a través de un comportamiento agresivo (Newton 1998). Estos comportamientos suponen un costo que solo valdría la pena invertir para asegurar los recursos necesarios para la supervivencia y la reproducción (Brown 1969, López-Sepulcre y Kokko 2005). El alimento y los sitios de nidificación son los recursos mayormente involucrados (Orians y Willson 1964). Dado que los requerimientos son más similares entre individuos de una misma especie que con los de otra especie, la agresión y la territorialidad intraespecíficas son las interacciones más comunes y, por lo tanto, también las más estudiadas (Newton 1998, Peiman y Robinson 2010). Sin embargo, aunque la agresión interespecífica en aves puede ser resultado de un comportamiento mal dirigido hacia otras especies por confusión (Murray 1971, 1976), muchas veces está deliberadamente destinado a otras especies y no sería resultado de una confusión debido a la clara diferenciación en el canto y coloración de las especies involucradas (Gorton 1977, Savalli 1990, Martin et al. 1996). Algunos estudios han mostrado consecuencias en la adecuación biológica ("fitness") de al menos una de las especies involucradas, subrayando su valor como una interacción relevante relacionada con la competencia por interferencia (Martin y Martin 2001a, Mikami y Kawata 2004). La territorialidad interespecífica ha sido registrada a menudo en aves que pertenecen a un mismo gremio (e.g., Robinson 1989, Hoi et al. 1991, Martin y Martin 2001a, 2001b) y se ha postulado que sería más frecuente en ambientes simples y de baja productividad, que resultarían en una mayor superposición de los sitios de alimentación o nidificación y de los ítems alimenticios usados por las especies (Orians y Willson 1964, Reed 1982, Bourski y Forstmeier 2000).
La porción central del desierto del Monte, en Argentina, es un buen sistema para estudiar interacciones tanto intra como interespecíficas en aves. La estructura del ambiente es bastante simple, con solo dos o tres estratos de vegetación (Morello 1958) y con baja cobertura (< 10%) de especies leñosas, mayormente usadas por las aves para nidificar (Marone et al. 1997, Mezquida 2000). Las aves granívoras en el Monte central conforman un gremio de especies abundantes y morfológicamente similares (Marone 1992, Lopez de Casenave 2001). La Monterita Canela (Poospiza ornata), el Pepitero Chico (Saltatricula multicolor) y el Chingolo (Zonotrichia capensis) tienen dietas granívoras similares en el Monte central (Marone et al. 2008) y prefieren consistentemente semillas de gramíneas cuando éstas son ofrecidas experimentalmente (Cueto et al. 2006b). Aunque también pueden incluir artrópodos en su dieta durante la estación reproductiva, su comportamiento de alimentación indica que se alimentan principalmente de semillas durante todo el año (Lopez de Casenave 2001, Milesi et al. 2008). Por el contrario, la Monterita de Collar (Poospiza torquata) consume semillas de gramíneas durante el otoño y el invierno pero durante la estación reproductiva es principalmente insectívora (Blendinger 2005, Lopez de Casenave et al. 2008, Sánchez y Blendinger 2014). Esta especie usa sitios de nidificación similares a los de la Monterita Canela (tanto en cuanto a las especies de plantas seleccionadas como a la ubicación de sus nidos; Mezquida 2003, Mezquida y Marone 2003). En consecuencia, cabe esperar la ocurrencia de interacciones tanto intra como interespecíficas durante la estación reproductiva, cuando las aves nidifican y establecen sus territorios (Mezquida 2003, Mezquida y Marone 2003, Sagario y Cueto 2014a) pero la abundancia de semillas de gramíneas alcanza su mínimo anual (Marone et al. 2004, 2008). Las interacciones competitivas entre especies morfológicamente similares son muchas veces supuestas pero rara vez puestas a prueba. Además, no se espera que haya interacciones entre individuos de diferentes especies cuando las interacciones entre individuos de la misma especie no ocurren (Wiens 1989). Estas aves establecen territorios de uso exclusivo con respecto a individuos de su misma especie y superpuestos entre especies (Sagario 2011, Sagario y Cueto 2014a). Sin embargo, el mapeo de territorios puede no ser suficiente para evaluar interacciones, ya que aunque puede dar información acerca de la ocurrencia de territorialidad, la agresión puede darse entre individuos con territorios superpuestos (e.g., Robinson y Terborgh 1995). Por definición, la agresión es la característica distintiva de la territorialidad (Noble 1939), pero por sobre todo es el mecanismo que previene o restringe el acceso de competidores a los recursos compartidos.
A fin de evaluar un potencial escenario de interacciones competitivas y proponer cuáles son los recursos que podrían estar involucrados en el comportamiento territorial de estas aves se evaluó experimentalmente la respuesta de individuos de las cuatro especies hacia vocalizaciones grabadas (de aquí en adelante "playback") de individuos de su misma especie y de las otras especies ecológicamente similares. Los experimentos fueron realizados en dos estaciones reproductivas con condiciones ambientales contrastantes para obtener información acerca de la plasticidad del comportamiento territorial de estas aves. Este tipo de estudios ayuda a conocer la historia natural de las aves granívoras del Monte central, un elemento imprescindible para comprender los condicionantes tanto reproductivos como de alimentación de la conducta de selección del hábitat (Werner 1998).
Métodos
Sitio de estudio
El trabajo se realizó en un bosque abierto (algarrobal) de la Reserva de Biósfera de Ñacuñán (34°03'S, 67°54'O), localizada en la porción central del desierto del Monte, provincia de Mendoza, Argentina (Fig. 1). El algarrobal presenta árboles espaciados de algarrobo (Prosopis flexuosa) y chañar (Geoffroea decorticans) dentro de una matriz de jarilla (casi exclusivamente Larrea divaricata), otros arbustos altos con baja cobertura (e.g., Capparis atamisquea, Atriplex lampa, Condalia microphylla), pastos perennes e hierbas anuales. El clima de Ñacuñán es seco y templado, con veranos muy calurosos e inviernos fríos. En promedio, más del 75% de la precipitación anual (349 mm, n = 31 años) ocurre durante la primavera y el verano, y es muy variable entre años (una descripción más detallada del sitio se encuentra en Lopez de Casenave 2001).
Figura 1. Ubicación de la Reserva de Biósfera de Ñacuñán (Ñ) en la porción central del desierto del Monte (zona sombreada) en Argentina.
Especies de aves
Se trabajó con cuatro de las especies granívoras más abundantes en el sitio durante la estación reproductiva: la Monterita de Collar (peso: 10 g), la Monterita Canela (13 g), el Chingolo (18 g) y el Pepitero Chico (22 g). Como la Monterita de Collar es insectívora durante la estación reproductiva, no está incluida en el gremio de los granívoros durante esa época del año (Lopez de Casenave et al. 2008). Para facilitar la lectura, y a no ser que se aclare, cuando se menciona a las especies "intragremiales" o se habla, en general, de "las aves granívoras", se la incluye dentro de la clasificación. Las dos monteritas construyen sus nidos casi exclusivamente en Geoffroea decorticans y Atriplex lampa, el Pepitero Chico selecciona principalmente Capparis atamisquea y el Chingolo nidifica mayormente en el suelo (Mezquida 2003, Mezquida y Marone 2003). Todas las especies son residentes excepto la Monterita Canela, que está presente casi exclusivamente durante la estación reproductiva (Marone 1992, Cueto et al. 2008, 2011, Sagario et al. 2014). El arribo de la Monterita Canela es variable entre años y su abundancia varía tanto dentro como entre estaciones reproductivas probablemente asociada a la abundancia de semillas (Marone 1992, Cueto et al. 2008, 2011). Su actividad de nidificación en Ñacuñán dura menos tiempo que la de las especies residentes y comienza más tarde (Mezquida 2003, Mezquida y Marone 2003). Las aves fueron capturadas en el marco de un estudio de captura-marcado- recaptura realizado entre noviembre de 2004 y agosto de 2009 (ver Sagario 2011). Se determinó el sexo de todas las aves de acuerdo a su protuberancia cloacal, la presencia de parche de incubación o su plumaje, cuando fue posible, y fueron marcadas con anillos de aluminio y combinaciones únicas de anillos de color.
Condiciones ambientales
Durante las estaciones reproductivas de 2006 y 2007 se evaluó la precipitación y la abundancia de artrópodos durante la primavera, y se caracterizó la producción anual de semillas de gramíneas. Se registró la precipitación de primavera entre el 1 de octubre y el 31 de diciembre en la estación meteorológica de la Reserva. Se armaron trampas de semillas con frascos plásticos y embudos de acuerdo a las indicaciones de Price y Joyner (1997). Dos trampas fueron ubicadas en microhábitats sin vegetación y dos bajo cobertura de leñosas en 10 estaciones de muestreo. Las trampas estuvieron activas entre febrero y agosto, el principal período de dispersión de semillas en Ñacuñán (i.e., se muestreó el banco potencial de semillas; Marone et al. 1998). Se examinó el contenido de las trampas bajo lupa y se contabilizaron las semillas de gramíneas (i.e., las preferidas por las aves), estimándose la producción anual como la suma del promedio de semillas atrapadas en cada uno de los dos microhábitats ponderado por su cobertura relativa (Sagario 2011). A mediados de la primavera (noviembre) se estimó la abundancia de artrópodos mediante trampas de caída y recolección de ramas (Cooper y Withmore 1990). El muestreo con trampas de caída tuvo el mismo diseño y análisis que el de las trampas de semillas; las trampas estuvieron activas durante tres días consecutivos evitando condiciones de viento o lluvia. La abundancia de artrópodos se relativizó al área cubierta por las trampas y al tiempo que estuvieron activas. Para la recolección de ramas se seleccionaron al azar 10 individuos de las 6 especies leñosas más abundantes y se colectó una de sus ramas (50 cm de largo) dentro de una bolsa plástica, que luego se fumigó con insecticida (Johnson 2000). Se estimó el volumen total de cada rama colectada como el volumen de un cilindroide, usando los diámetros (máximo y mínimo) y la longitud de la rama, para luego relativizar la abundancia de artrópodos de la muestra por metro cúbico. Se examinó el contenido de las bolsas plásticas y de las trampas de caída bajo lupa y se contabilizó y midió la longitud de todos los artrópodos de más de 1 mm de longitud. La biomasa de los artrópodos fue estimada usando ecuaciones derivadas del peso seco y la longitud de artrópodos colectados en el mismo sitio (Guerra Navarro, datos no publicados). En el caso de la recolección de ramas la abundancia relativa de artrópodos fue estimada como la biomasa promedio de artrópodos por metro cúbico de cada especie leñosa, ponderada por su cobertura de acuerdo a un muestreo de cobertura horizontal (Sagario 2011).
Experimentos de "playback"
Durante las estaciones reproductivas de 2006 y 2007 se mapearon los territorios de seis machos de cada una de las cuatro especies de aves al menos una semana antes de los experimentos (ver Sagario y Cueto 2014a para detalles de los métodos). De acuerdo a observaciones y a la identificación individual de las aves se corroboró que todas las aves focales de las tres especies residentes estaban en pareja durante el período de los experimentos. Los experimentos se realizaron durante el pico de actividad reproductiva (noviembre-enero; Mezquida 2003). En 2006 se evaluó la respuesta de las aves de las cuatro especies a cantos control, intragremiales y conespecíficos. La única especie que respondió a cantos intra-gremiales fue la Monterita Canela (ver Resultados), por lo cual en 2007 se repitió el mismo diseño solo para esta especie, mientras que para el resto solamente se evaluó la respuesta a cantos control y conespecíficos.
Los aspectos generales de los experimentos de "playback" siguieron las indicaciones de Martin y Martin (2001a) y Martin et al. (1996). Se colocó un parlante cerca del centro del territorio del ave focal a 2-3 m de altura dentro del follaje de un algarrobo (estas son las perchas de despliegue más usadas por las cuatro especies; Cueto et al. 2006a, Sagario 2011). En 2006 los individuos territoriales fueron expuestos focalmente a tres ensayos de 9 min dentro de su territorio, con al menos un día de separación entre ellos. En cada ensayo se emitieron tres intervalos de 3 min consecutivos. Cada intervalo consistió en 2 min de cantos seguidos por 1 min de silencio para evitar el "arrastre" de la respuesta a los intervalos siguientes. Los estímulos en cada ensayo consistieron en cantos control de una especie taxonómicamente distante (ver más adelante), cantos intragremiales de una de las otras especies del gremio y cantos conespecíficos (i.e., la única diferencia entre los tres ensayos de cada ave focal fue la identidad del canto de la especie intragremial). La respuesta al estímulo de cantos conespecíficos debería ser la mayor y podría causar un retardo en el retorno del ave focal a su estado de reposo. Si esto es así, la secuencia de los estímulos puede sesgar los resultados debido a un "arrastre" de la respuesta a cantos conespecíficos. Por ello, el orden de los estímulos control e intragremial fueron asignados al azar mientras que el estímulo conespecífico fue siempre emitido al final. Durante o después de cada ensayo se usaron binoculares para verificar la identidad (i.e., la combinación de anillos de colores) del ave focal. En 2007 se repitió el mismo diseño para la Monterita Canela pero para las otras especies se emitieron los estímulos control y conespecífico en un único ensayo de 6 min. Las grabaciones de las diferentes especies usadas en el "playback" seguían la cadencia natural del canto, pertenecían al menos a dos individuos diferentes y fueron obtenidas durante 2005 a 0.5-1 km de distancia de los territorios estudiados. Como especie control se seleccionó al Canastero Chaqueño (Asthenes baeri), que también nidifica en el área pero pertenece a la familia Furnariidae. Estas aves son insectívoras, residentes, se alimentan principalmente en arbustos bajos y en el suelo (Remsen 2003, Lopez de Casenave et al. 2008) y construyen nidos cerrados en chañares altos (Mezquida 2001).
Durante todos los intervalos de cada ensayo se registraron cuatro variables comportamentales: (1) latencia del ave focal hasta que volaba hacia el parlante dentro de un radio de 10 m; (2) mínima distancia al parlante dentro de un radio de 10 m, o bien categorizada como 17 m (si el ave focal era vista entre 10-25 m), 37 m (si era vista entre 25-50 m) o 50 m (si no era vista ni oída durante todo el intervalo); (3) número de vuelos de más de 1 m dentro de un radio de 25 m; y (4) número de cantos dentro de un radio de 25 m. Se seleccionó un radio de 25 m porque esa era aproximadamente la distancia máxima a la cual se podía detectar a las aves que no vocalizaban o que no estaban perchadas en sitios conspicuos.
Análisis estadístico
Se construyó una variable comportamental para reflejar el grado de agresión usando un Análisis de Componentes Principales. En el ordenamiento cada caso consistió en el valor de las cuatro variables medidas para cada ave focal durante cada intervalo. Como las variables comportamentales originales estuvieron correlacionadas en todos los experimentos (P < 0.01 para todos los pares posibles; correlación de Pearson), los análisis de componentes principales combinaron las cuatro variables originales en una nueva variable ("respuesta territorial"). Se realizaron dos análisis para poner a prueba hipótesis diferentes. El primer análisis de componentes principales se realizó para evaluar diferencias en el grado de agresión ante diferentes estímulos para los experimentos que incluyeron estímulos intragremiales. La evaluación visual de los datos originales de estos experimentos mostró que, a excepción de la Monterita Canela al ser expuesta al estímulo de cantos de la Monterita de Collar, las respuestas de todas las especies dentro de cada estímulo son similares independientemente del canto intragremial que se emita durante el experimento (ver el patrón similar dentro de cada estímulo en los gráficos de la figura 2). Por ello, para el contraste estadístico de las respuestas se evaluaron separadamente aquellos ensayos en que la Monterita Canela era expuesta a cantos de la Monterita de Collar y se promedió el resto de los datos dentro de cada individuo y tipo de estímulo (ver datos en Fig. 2). Se utilizaron los puntajes ("scores") obtenidos en el primer componente en Análisis de Varianza intrasujeto (i.e., el efecto del tipo de estímulo fue evaluado dentro de cada individuo), con el individuo anidado en el factor especie (o año en el caso de la Monterita Canela). El segundo análisis de componentes principales se realizó para evaluar diferencias en las respuestas entre años e incluyó los datos de los experimentos de 2007 y únicamente los datos para los intervalos control y conespecífico de 2006. Se usaron los puntajes del primer componente para evaluar diferencias entre estímulos y entre años usando pruebas t de Student pareadas y no pareadas, respectivamente. Ambas pruebas fueron a una cola para poner a prueba las hipótesis de que la respuesta es mayor frente al estímulo conespecífico que frente al control, y que la respuesta al estímulo conespecífico es más débil durante el año de mejores condiciones ambientales. Todos los análisis estadísticos fueron realizados con el programa Infostat (2009), excepto los supuestos del ANOVA que fueron evaluados con el programa Statistica (StatSoft 2001). Cuando el supuesto de esfericidad no se cumplió se corrigieron los grados de libertad para el cálculo de F en los efectos intrasujeto del Análisis de Varianza usando el mínimo valor de épsilon ("lower bound epsilon correction", ε = 0.5; Quinn y Keough 2002). Cuando las interacciones fueron significativas se corrigieron los grados de libertad intrasujeto y los cuadrados mínimos para poder calcular apropiadamente los efectos simples y las comparaciones a posteriori de Tukey (Quinn y Keough 2002).
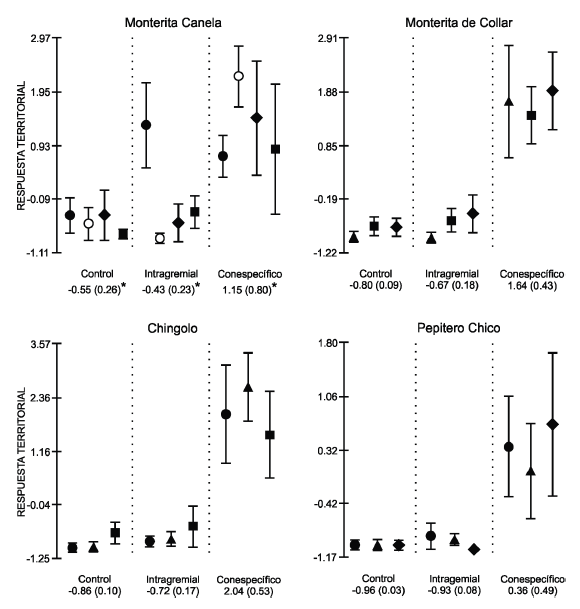
Figura 2. Respuesta territorial (promedio±EE) de la Monterita Canela (Poospiza ornata), la Monterita de Collar (Poospiza torquata), el Chingolo (Zonotrichia capensis) y el Pepitero Chico (Saltatricula multicolor) frente a tres tipos de estímulo (control, canto intragremial y canto conespecífico) en experimentos de "playback" realizados durante la estación reproductiva de 2006 (símbolos negros) y 2007 (símbolos blancos) en el Monte central. La respuesta territorial es una variable compuesta obtenida a partir de un Análisis de Componentes Principales realizado con cuatro variables de comportamiento (latencia de vuelo, distancia al parlante, número de vuelos y número de cantos). Cada experimento realizado al mismo individuo difirió en el estímulo intragremial emitido: Monterita Canela (triángulo), Monterita de Collar (círculo), Chingolo (rombo) y Pepitero Chico (cuadrado). Abajo se muestra el valor promedio (EE entre paréntesis) de la respuesta territorial de todos los ensayos. Para la Monterita Canela, el asterisco indica que los promedios excluyen los ensayos en los que se emitieron cantos de Monterita de Collar (i.e., los círculos).
Resultados
Las precipitaciones durante la primavera fueron de 155 mm en 2006 y 112 mm en 2007. La producción anual de semillas (promedio ±EE) fue de 14698±2486 semillas/m2 en 2006 y de 11951±3544 semillas/m2 en 2007. La abundancia de artrópodos en 2006 fue de 119±13 mg.m-2.h-1 en el suelo y de 273±61 mg/cm3 en el follaje, mientras que en 2007 los valores fueron 88±22 mg.m-2.h-1 y 70±21 mg/cm3, respectivamente.
Se realizaron un total de 78 experimentos de "playback" que incluyeron los tres tipos de estímulo (seis machos focales de las cuatro especies expuestos a tres experimentos en 2006 y seis machos de Monterita Canela expuestos a un experimento en 2007) y 18 experimentos adicionales incluyendo solo los estímulos control y conespecífico (seis machos de las otras tres especies en 2007). El primer componente del Análisis de Componentes Principales de los ensayos con los tres tipos de estímulo tuvo un autovalor de 2.72 (68% de la varianza explicada) con las siguientes cargas ("loadings"): -0.86 para la latencia de vuelo, -0.89 para la distancia mínima al parlante, 0.87 para el número de vuelos y 0.65 para el número de cantos. Los resultados del Análisis de Componentes Principales de los ensayos que incluían solo los estímulos control y conespecífico fueron similares (autovalor: 2.80, 70% de la varianza explicada; cargas: -0.87 para la latencia, -0.93 para la distancia, 0.88 para el número de vuelos y 0.64 para el número de cantos).
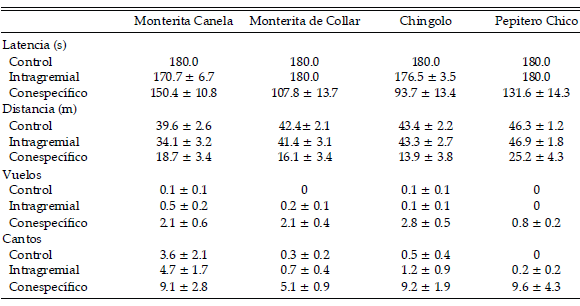
Todas las especies respondieron en menor o mayor medida al estímulo de cantos conespecíficos acercándose al parlante (latencia y distancia), aumentando su tasa de cantos y realizando vuelos cerca del parlante (Tabla 1).
Tabla 1. Valores promedio (±EE) de cuatro variables comportamentales medidas en la Monterita Canela (Poospiza ornata), la Monterita de Collar (Poospiza torquata), el Chingolo (Zonotrichia capensis) y el Pepitero Chico (Saltatricula multicolor) frente a tres tipos de estímulo (control, canto intragremial y canto conespecífico) en experimentos de "playback" realizados durante la estación reproductiva de 2006 y 2007 en el Monte central. Las variables son latencia de vuelo, distancia mínima al parlante, número de vuelos y número de cantos. En todos los casos n = 24, excepto para la respuesta intragremial de la Monterita de Collar, el Chingolo y el Pepitero Chico, en los cuales n = 18
.
La Monterita Canela (en experimentos con cantos intragremiales de Pepitero Chico y Chingolo), la Monterita de Collar, el Chingolo y el Pepitero Chico mostraron una mayor respuesta territorial frente a los cantos de conespecíficos que frente a los cantos control e intragremiales (P < 0.05 para ambas comparaciones, Prueba de Tukey; Tabla 2A, Fig. 2), siendo las respuestas a estos dos últimos estímulos bajas y similares entre sí (P > 0.05; Fig. 2).
La respuesta territorial de la Monterita Canela expuesta a cantos de la Monterita de Collar difirió entre años (interacción significativa entre año y estímulo; Tabla 2B). En 2006 el comportamiento de la Monterita Canela fue distinto frente a los diferentes estímulos (efecto simple: F2 20 = 6.12, P = 0.009), siendo menor la respuesta frente a cantos control (P < 0.05, Prueba de Tukey; Fig. 2) y respondiendo de igual manera al canto conespecífico y al de la Monterita de Collar (P > 0.05; Fig. 2). En 2007, la Monterita Canela solo mostró una respuesta territorial alta frente a cantos conespecíficos (efecto simple: F2,20 = 16.15, P < 0.0001; comparación entre el estímulo conespecífico y los otros dos estímulos: P < 0.05, Prueba de Tukey; Fig. 2).
Tabla 2. Resultados del Análisis de Varianza evaluando la respuesta territorial de la Monterita Canela (Poospiza ornata), la Monterita de Collar (Poospiza torquata), el Chingolo (Zonotrichia capensis) y el Pepitero Chico (Saltatricula multicolor) frente a tres tipos de estímulo (control, canto intragremial y canto conespecífico) en experimentos de "play-back" realizados durante la estación reproductiva de 2006 y 2007 en el Monte central. (A) Análisis de los experimentos realizados en 2006 con los tres tipos de estímulo, exceptuando aquellos en los que la Monterita Canela fue expuesta a cantos de Monterita de Collar como estímulo intragremial. (B) Análisis de los experimentos realizados en 2006 y 2007 con la Monterita Canela expuesta a cantos de la Monterita de Collar como estímulo intragremial. Se muestran los grados de libertad (gl), los cuadrados medios (CM), el valor de la prueba (F) y su probabilidad asociada (P).

En 2007 todas las especies mostraron una respuesta territorial mayor frente a cantos conespecíficos que al canto control (Monterita Canela: P = 0.005, Monterita de Collar: P = 0.002, Chingolo: P < 0.001, Pepitero Chico: P = 0.004; Prueba t de Student pareada de una cola). La respuesta territorial frente a cantos conespecíficos tendió a ser mayor en 2007 para todas las especies, aunque solo fue significativamente diferente en el caso del Pepitero Chico (Fig. 3).

Figura 3. Respuesta territorial (promedio±EE) de la Monterita Canela (Poospiza ornata), la Monterita de Collar (Poospiza torquata), el Chingolo (Zonotrichia capensis) y el Pepitero Chico (Saltatricula multicolor) frente a cantos conespecíficos en experimentos de "playback" realizados durante la estación reproductiva de 2006 (símbolos negros) y 2007 (símbolos blancos) en el Monte central. Abajo se muestra el valor de P correspondiente a la Prueba t de Student de una cola bajo la hipótesis de que la respuesta es igual o mayor en 2007 que en 2006.
Discusión
Las cuatro especies estudiadas mostraron una respuesta territorial más fuerte frente a los cantos conespecíficos que frente al control en ambas estaciones reproductivas, mientras que ninguna de las especies respondió al canto de las otras, con la excepción de la Monterita Canela que respondió frente a la Monterita de Collar en 2006. Todas las aves que se registraron cantando durante los experimentos eran machos (identificados por sus anillos de color). Solo se registraron hembras realizando voces de contacto durante los experimentos de la Monterita de Collar y el Pepitero Chico. Las hembras de Monterita de Collar seguían de cerca todos los movimientos del macho alrededor del parlante, mientras que las de Pepitero Chico generalmente se aproximaban al parlante junto con el macho pero permanecían cerca del suelo, mientras los machos cantaban o hacían vuelos cortos en la parte más alta de la vegetación. Los datos no proveen información acerca de si las hembras están involucradas en la defensa territorial pero, dadas las observaciones, el rol de las hembras de estas especies merece un estudio más detallado.
Los experimentos de "playback" mostraron que todas las especies incurren en los costos asociados con la defensa del territorio frente a conespecíficos, aumentando el número de cantos y moviéndose aceleradamente alrededor del parlante. El Chingolo, la Monterita de Collar y el Pepitero Chico son monógamos, al menos socialmente (i.e., tanto hembras como machos tienen una única pareja del sexo opuesto por vez; Reichard 2003) en el Monte central (Sagario y Cueto 2014b). Los machos están involucrados en el cuidado parental y en las últimas dos especies también alimentan a sus parejas durante la incubación (Mezquida 2000, Sagario 2011), comportamientos asociados a la defensa de la hembra para minimizar copulaciones extra-pareja (Westneat et al. 1990). La cobertura de las especies de plantas en las que nidifican la Monterita Canela, la Monterita de Collar y el Pepitero Chico es baja (<3% para Geoffroea decorticans, Capparis atamisquea y Atriplex lampa; Milesi 2006) y podrían constituir recursos limitantes. Marone et al. (1997) sugirieron que los sitios de nidificación son el principal recurso involucrado en la selección de hábitat de estas aves durante la estación reproductiva. Finalmente, la predación de nidos en las aves granívoras en el Monte central es >80% (Mezquida y Marone 2001) y las puestas consecutivas luego de la predación de una nidada son comunes para estas aves (Mezquida 2000), de hasta tres veces para la Monterita de Collar (Sagario 2011). La defensa del espacio frente a individuos con requerimientos de nidificación similares puede prevenir la atracción de predadores (Martin y Martin 2001a) y, además, puede proveer sitios de nidificación extra para varios intentos de nidificación. Toda esta evidencia sugiere que los recursos reproductivos (tanto sitios de nidificación como parejas) serían valiosos como para ser monopolizados y podrían estar involucrados en la ocurrencia de territorialidad intraespecífica entre estas aves.
Solo se registró agresión interespecífica entre las especies que poseen los mismos requerimientos de nidificación. La Monterita Canela respondió agresivamente ante la simulación de la intrusión de la Monterita de Collar en su territorio, aunque el caso inverso no ocurrió (i.e., la respuesta fue asimétrica). Una agresión mal dirigida, tal como plantea Murray (1971, 1976), es poco probable dado que el canto de las dos especies y su coloración son marcadamente diferentes (Narosky e Yzurieta 2010). La baja disponibilidad de sitios de nidificación y la alta predación en el algarrobal podrían generar conflictos interespecíficos entre las especies, tal como ha sido reportado para otras aves (e.g., Orians y Willson 1964, Martin y Martin 2001a, 2001b). La asimetría de la respuesta en otras especies ha sido explicada por una subordinación de la especie más pequeña y por diferencias en el momento de reproducción (e.g., Robinson 1989, Hoi et al. 1991, Robinson y Terborgh 1995). La Monterita de Collar es de menor tamaño que la Monterita Canela y, además, al momento de la realización de los experimentos de "playback" la mayoría de los individuos de Monterita Canela posiblemente aún necesitaban un sitio para nidificar, mientras que la Monterita de Collar ya se encontraría incubando (Mezquida 2003, Mezquida y Marone 2003). No existe evidencia previa (ni que se desprenda de este trabajo) para explicar la ocurrencia de respuesta solo en 2006. Una posible explicación es que la abundancia de la Monterita Canela fue más del triple durante ese año (2006: 8.7 individuos/100 horas de red, 2007: 2.7 individuos/100 horas red; Sagario 2011). Esta especie es localmente nómade en el Monte central (Cueto et al. 2011) y evita nidificar en Ñacuñán en períodos secos (Marone 1992), aumentando su tamaño de puesta en años húmedos (Mezquida y Marone 2003). Esta fuerte plasticidad en su comportamiento reproductivo también podría expresarse en su respuesta territorial, y la especie podría incrementar su agresividad a fin de establecerse en medio de una gran cantidad de competidores (Patterson 1980). Sin embargo, los patrones comportamentales de la Monterita Canela encontrados en este trabajo son consistentes con esta explicación para la ocurrencia de territorialidad interespecífica en 2006, pero no con la tendencia a una menor agresividad hacia los conespecíficos durante ese mismo año (ver más adelante).
En cuanto a la importancia que puede tener el alimento como disparador de la territorialidad, estudios previos muestran que la abundancia de alimento no sería un factor limitante para las aves granívoras durante la estación reproductiva en el Monte central (Blendinger y Ojeda 2001, Sagario 2011) y no está involucrada como un factor clave en la selección de hábitat (Marone et al. 1997). Además, en este trabajo no se encontró una respuesta intragremial durante 2006 y, aunque no se evaluó directamente esa respuesta en 2007, la evidencia indirecta sugiere que la territorialidad interespecífica también estaba ausente. Primero, porque los territorios de las diferentes especies estaban superpuestos (Sagario 2011), y segundo (como resultado de eso), porque durante los experimentos de "playback" en 2007 los cantos de cada especie estaban siendo emitidos dentro del territorio de las otras, pero nunca se registró el acercamiento de otra especie que no fuera la focal. Entonces, al menos en lo que concierne a la territorialidad interespecífica, la evidencia sugiere que los recursos alimenticios compartidos no estarían involucrados. Sin embargo, en cuanto a la territorialidad intraespecífica podría haber otros recursos (no compartidos con las otras especies) que puedan estar influenciando el comportamiento territorial. Pequeñas diferencias en la dieta o el comportamiento de alimentación entre las especies podrían ser suficientes para evitar conflictos interespecíficos, por lo que la inferencia de que los conflictos intraespecíficos por el alimento también estarían ausentes debe ser cuidadosa. Además, a pesar de que el alimento no sería un factor clave durante la estación reproductiva, se observó una tendencia a una respuesta territorial más débil durante el año de mejores condiciones (este trabajo) y también que el tamaño de los territorios de la Monterita de Collar, el Chingolo y el Pepitero Chico tendieron a ser más grandes durante el año de menos recursos (Sagario 2011). Varios estudios revelan que los individuos pueden mostrar cambios en su nivel de agresión de acuerdo a las condiciones ambientales e individuales actuales y futuras (Velando et al. 2006, Hall et al. 2009, Peiman y Robinson 2010). En consecuencia, aunque la evidencia sugiere que el alimento no estaría directamente asociado con la territorialidad, podría estarlo con el grado de agresión. Las variaciones interanuales en la respuesta territorial tanto inter como intraespecífica observadas en este trabajo indican que los comportamientos en estas especies son flexibles; encontrar las causas de estos cambios debería ser el foco de futuros estudios.
En resumen, los experimentos de "playback" mostraron que la agresión territorial intraespecífica es común en las aves granívoras del Monte central, mientras que la agresión interespecífica no lo es. Tanto los resultados experimentales como la evidencia previa sugieren que la territorialidad de estas aves está relacionada con la defensa de recursos reproductivos y los conflictos por el alimento son menos importantes. También se encontraron variaciones interanuales en el comportamiento territorial que podrían estar relacionadas tanto con la densidad poblacional como con las condiciones ambientales, resaltando la flexibilidad en la intensidad de las respuestas agresivas.
Agradecimientos
Estamos agradecidos con Luis Marone y Alex Jahn quienes proveyeron comentarios constructivos a versiones previas del manuscrito. El financiamiento fue provisto por el CONICET (a través del PIP 6141), la Agencia Nacional de Promoción Científica y Tecnológica (a través del PICT 01-12199) y la Universidad de Buenos Aires (a través del UBACyT X/ 144), todos de Argentina, y la Association of Field Ornithologists (a través del Bergstrom Memorial Research Awards). Esta es la contribución N° 94 del Grupo de Investigación en Ecología de Comunidades de Desierto (Ecodes) de IADIZA (CONICET) y FCEN (Universidad de Buenos Aires).
Bibliografía Citada
1. Blendinger PG (2005) Foraging behaviour of birds in an arid sand-dune scrubland in Argentina. Emu 105:67-79. [ Links ]
2. Blendinger PG y Ojeda RA (2001) Seed supply as a limiting factor for granivorous bird assemblages in the Monte Desert, Argentina. Austral Ecology 26:413-422. [ Links ]
3. Bourski OV y Forstmeier W (2000) Does interspecific competition affect territorial distribution of birds? A long-term study on Siberian Phylloscopus warblers. Oikos 88:341-350. [ Links ]
4. Brown JL (1969) Territorial behavior and population regulation in birds: a review and reevaluation. Wilson Bulletin 81:293-329. [ Links ]
5. Cooper RJ y Whitmore RC (1990) Arthropod sampling methods in ornithology. Studies in Avian Biology 13:29-37. [ Links ]
6. Cueto VR, Lopez de Casenave J y Marone L (2008) Neotropical austral migrant landbirds: population trends and habitat use in the central Monte desert, Argentina. Condor 110:70-79. [ Links ]
7. Cueto VR, Lopez de Casenave J, Sagario MC y Damonte J (2006a) Relación aves-vegetación: importancia de los algarrobales para la avifauna del desierto del Monte. Pp. 234-236 en: Brown A, Martínez Ortiz U, Acerbi M y Corcuera J (eds) La situación ambiental argentina 2005. Fundación Vida Silvestre Argentina, Buenos Aires. [ Links ]
8. Cueto VR, Marone L y Lopez de Casenave J (2006b) Seed preferences in sparrow species of the Monte desert: implications for seed-granivore interactions. Auk 123:358-367 [ Links ]
9. Cueto VR , Milesi FA, Sagario MC, Lopez de Casenave J y M arone L (2011) Distribución geográfica y patrones de movimiento de la Monterita Canela (Poospiza ornata) y el Yal Carbonero (Phrygilus carbonarius) en Argentina. Ornitología Neotropical 22:483-494 [ Links ]
10. Gorton RE Jr (1977) Territorial interactions in sympatric Song Sparrow and Bewick's Wren populations. Auk 94:701-708 [ Links ]
11. Hall ML, Molles LE, Illes AE y Vehrencamp SL (2009) Singing in the face of death: male banded wrens Thryophilus pleurostictus sing more to playback in their last breeding season. Journal of Avian Biology 40:217-224 [ Links ]
12. Hoi H, Eicher T y Dittami J (1991) Territorial spacing and interspecific competition in three species of reed warblers. Oecologia 87:443-448 [ Links ]
13. InfoStat (2009) InfoStat versión 2009. Grupo InfoStat, Universidad Nacional de Córdoba, Córdoba [ Links ]
14. Johnson MD (2000) Evaluation of an arthropod sampling technique for measuring food availability for forest insectivorous birds. Journal of Field Ornithology 71:88-109 [ Links ]
15. Lopez de Casenave J (2001) Estructura gremial y organización de un ensamble de aves del desierto del Monte. Tesis doctoral, Universidad de Buenos Aires, Buenos Aires [ Links ]
16. Lopez de Casenave J, Cueto VR y Marone L (2008) Seasonal dynamics of guild structure in a bird assemblage of the central Monte desert. Basic and Applied Ecology 9:78-90 [ Links ]
17. López-Sepulcre A y Kokko H (2005) Territorial defense, territory size and population regulation. American Naturalist 166:317-329 [ Links ]
18. Marone L (1992) Seasonal and year-to-year fluctuations of bird populations and guilds in the Monte Desert, Argentina. Journal of Field Ornithology 63:294-308 [ Links ]
19. Marone L, Cueto VR, Milesi FA y L opez de Casenave J (2004) Soil seed bank composition over desert microhabitats: patterns and plausible mechanisms. Canadian Journal of Botany 82:1809-1816 [ Links ]
20. Marone L, Lopez de Casenave J y Cueto VR (1997) Patterns of habitat selection by wintering and breeding granivorous birds in the central Monte desert, Argentina. Revista Chilena de Historia Natural 70:73-81 [ Links ]
21. Marone L, Lopez de Casenave J, Milesi FA y Cueto VR (2008) Can seed-eating birds exert top-down effects on grasses of the Monte desert? Oikos 117:611-619 [ Links ]
22. Marone L, Rossi BE y Lopez de Casenave J (1998) Granivore impact on soil-seed reserves in the central Monte desert, Argentina. Functional Ecology 12:640-645 [ Links ]
23. Martin PR, Fotheringham JR, Ratcliffe L y Robertson RJ (1996) Response of American redstarts (suborder Passeri) and least flycatchers (suborder Tyranni) to heterospecific playback: the role of song in aggressive interactions and interference competition. Behavioral Ecology and Sociobiology 39:227-235 [ Links ]
24. Martin PR y Martin TE (2001a) Ecological and fitness consequences of species coexistence: a removal experiment with Wood Warblers. Ecology 82:189-206 [ Links ]
25. Martin PR y Martin TE (2001b) Behavioral interactions between coexisting species: song playback experiments with wood warblers. Ecology 82:207-218 [ Links ]
26. Mezquida ET (2000) Ecología reproductiva de un ensamble de aves del desierto del Monte central, Argentina. Tesis doctoral, Universidad Autónoma de Madrid, Madrid [ Links ]
27. Mezquida ET (2001) La reproducción de algunas especies de Dendrocolaptidae y Furnariidae en el desierto del Monte central, Argentina. Hornero 16:23-30 [ Links ]
28. Mezquida ET (2003) La reproducción de cinco especies de Emberizidae y Fringillidae en la Reserva de Ñacuñán, Argentina. Hornero 18:13-20 [ Links ]
29. Mezquida ET y Marone L (2001) Factors affecting nesting success of a bird assembly in the central Monte Desert, Argentina. Journal of Avian Biology 32:287-296 [ Links ]
30. Mezquida ET y Marone L (2003) Comparison of the reproductive biology of two Poospiza warblingfinches of Argentina in wet and dry years. Ardea 91:251-262 [ Links ]
31. Mikami OK y Kawata M (2004) Does interspecific territoriality reflect the intensity of ecological interactions? A theoretical model for interspecific territoriality. Evolutionary Ecology Research 6:765-775 [ Links ]
32. Milesi FA (2006) Selección de sitios de alimentación por aves granívoras en el desierto del Monte. Tesis doctoral, Universidad de Buenos Aires, Buenos Aires [ Links ]
33. Milesi FA, Lopez de Casenave J y Cueto VR (2008) Selection of foraging sites by desert granivorous birds: vegetation structure, seed availability, species-specific foraging tactics, and spatial scale. Auk 125:473-484 [ Links ]
34. Morello J (1958) La provincia fitogeográfica del Monte. Opera Lilloana 2:1-155 [ Links ]
35. Murray BG Jr (1971) The ecological consequences of interspecific territorial behavior in birds. Ecology 52:414-423 [ Links ]
36. Murray BG Jr (1976) A critique of interspecific territoriality and character convergence. Condor 78:518-525 [ Links ]
37. Narosky T e Yzurieta D (2010) Guía para la identificación de las aves de Argentina y Uruguay. Edición Total. Vázquez Mazzini Editores, Buenos Aires [ Links ]
38. Newton I (1998) Population limitation in birds. Academic Press, Londres [ Links ]
39. Noble GK (1939) The role of dominance in the life of birds. Auk 56:263-273 [ Links ]
40. Orians GH y Willson MF (1964) Interspecific territories of birds. Ecology 45:736-745 [ Links ]
41. Patterson I J (1980) Territorial behavior and the limitation of population density. Ardea 68:53-62 [ Links ]
42. Peiman KS y Robinson BW (2010) Ecology and evolution of resourcerelated heterospecific aggression. Quarterly Review of Biology 85:133-158 [ Links ]
43. Price MV y Joyner JW (1997) What resources are available to desert granivores: seed rain or soil seed bank? Ecology 78:764-773 [ Links ]
44. Quinn GP y Keough MJ (2002) Experimental design and data analysis for biologists. Cambridge University Press, Cambridge [ Links ]
45. Reed TM (1982) Interspecific territoriality in the chaffinch and great tit on islands and the mainland of Scotland: playback and removal experiments. Animal Behaviour 30:171-181 [ Links ]
46. Reichard UH (2003) Monogamy: past and present. Pp. 3-25 en: Reichard UH y Boesch C (eds) Monogamy. Mating strategies and partnerships in birds, humans and other mammals. Cambridge University Press, Cambridge [ Links ]
47. Remsen JV Jr (2003) Family Furnariidae (ovenbirds). Pp. 162-357 en: del Hoyo J, Elliott A y Christie D (eds) Handbook of the birds of the world. Volume 8. Broadbills to tapaculos. Lynx Edicions, Barcelona [ Links ]
48. Robinson D (1989) Interspecific aggression and territorial behavior between scarlet robin Petroica multicolor and flame robin P. phoenicea. Emu 89:93-101 [ Links ]
49. Robinson SK y T erborgh J (1995) Interspecific aggression and habitat selection by Amazonian birds. Journal of Animal Ecology 64:1-11 [ Links ]
50. Sagario MC (2011) Limitación poblacional de las aves granívoras en la porción central del desierto del Monte. Tesis doctoral, Universidad de Buenos Aires, Buenos Aires [ Links ]
51. Sagario MC y Cueto VR (2014a) Seasonal space use and territory size of resident sparrows in the central Monte Desert. Ardeola 61:153-159 [ Links ]
52. Sagario MC y Cueto VR (2014b) Breeding territory stability of resident sparrows in the central Monte desert, Argentina. Ornitología Neotropical 25:113-118 [ Links ]
53. Sagario MC, Cueto VR y Lopez de Casenave J (2014) Movement patterns of three species of sparrow in the central Monte desert, Argentina: differences between and within species. Emu 114:268-276 [ Links ]
54. Sánchez R y Blendinger PG (2014) Trophic ecology of the Ringed Warbling-Finch (Poospiza torquata) in Neotropical semi-arid scrublands. Emu 114:229-233 [ Links ]
55. Savalli UM (1990) Interspecific aggression for food by a granivorous bird. Condor 92:1082-1084 [ Links ]
56. Stat Soft (2001) STATISTICA for Windows. Version 6.0. StatSoft Inc, Tulsa [ Links ]
57. Velando A, Drummond H y Torres R (2006) Senescent birds redouble reproductive effort when ill: confirmation of the terminal investment hypothesis. Proceedings of the Royal Society B 273:1443-1448 [ Links ]
58. Werner EE (1998) Ecological experiments and a research program in community ecology. Pp. 3-26 en: Resetarits J y B ernardo J (eds) Experimental ecology: issues and perspectives. Oxford University Press, Oxford [ Links ]
59. Westneat DF, Sherman PW y Morton ML (1990) The ecology and evolution of extrapair copulations in birds. Current Ornithology 7:331-369 [ Links ]
60. Wiens JA (1989) The ecology of birds communities. Volume 2. Cambridge University Press, Cambridge. [ Links ]














