Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero vol.31 no.1 Ciudad Autónoma de Buenos Aires ago. 2016
COMUNICACIÓN
Utilización de insectos hematófagos para la extracción de sangre en aves: el Gaviotín Golondrina (Sterna hirundo) como estudio de caso
Germán O. García1,3, Carla A. Paterlini1 y Peter H. Becker2
1 Instituto de Investigaciones Marinas y Costeras (IIMyC), CONICET–Universidad Nacional de Mar del Plata. Funes 3250, B7602AYJ Mar del Plata, Buenos Aires, Argentina.
2 Institute of Avian Research Vogelwarte Helgoland. An der Vogelwarte 21, D-26386 Wilhelmshaven, Alemania.
3 gogerman@mdp.edu.ar
RESUMEN
El objetivo de este trabajo es actualizar la descripción de una técnica de obtención de muestras de sangre en aves y mostrar su eficiencia en una colonia de Gaviotín Golondrina (Sterna hirundo) situada en el lago Banter, Alemania. Las técnicas utilizadas actualmente involucran la captura y manejo de las aves y la extracción de sangre con agujas hipodérmicas, lo cual puede causar estrés en el individuo estudiado. En este trabajo se utilizó una técnica mínimamente invasiva usando insectos hematófagos del orden Heteroptera. Se describen las modificaciones del diseño original de la técnica y se muestra que existió una alta eficiencia en el muestreo, en términos de tiempo y número de muestras tomadas.
PALABRAS CLAVE: Dipetalogaster maximus; Insecto hematófago; Periodo de incubación; Sterna hirundo.
ABSTRACT
The use of hematophagous insects for blood collection in birds: the Common Tern (Sterna hirundo) as a case study.
The objective of this study is to update the description of a technique for obtaining blood samples in birds and to show its efficiency in a colony of Common Tern (Sterna hirundo) located in Lake Banter, Germany. The techniques currently used involve the capture and handling of birds and the extraction of blood with hypodermic needles, which can cause stress in the individual studied. In this study a minimally invasive technique was used using hematophagous insects of the order Heteroptera. The modifications of the original design of the technique are described and it was shown that there was a high efficiency in the sampling, in terms of time and number of samples taken.
KEY WORDS: Blood-sucking bug; Dipetalogaster maximus; Incubation period; Sterna hirundo.
Recibido 6 octubre 2015
Aceptado 8 julio 2016
La extracción de muestras de sangre en aves representa un requisito básico para llevar adelante un gran número de investigaciones en el marco de la ornitología moderna. Sin embargo, las técnicas más utilizadas involucran la captura, el manejo de los animales y la extracción de sangre con agujas hipodérmicas, lo cual puede causar estrés en el individuo estudiado (Romero y Romero 2002, Fair et al. 2010). Esto no es deseable en especies amenazadas o durante ciertos periodos del ciclo de vida tales como la reproducción; por ejemplo, la captura de un ave durante el periodo reproductivo incrementa la probabilidad de abandono del nido (Götmark 1992, Kania 1992, Marvelde et al. 2011). Además, el estrés causado por la manipulación podría influir en los resultados cuando se miden parámetros tales como el gasto energético (Butler et al. 2004) o cuando se monitorean los niveles basales de hormonas como la corticosterona (Romero y Reed 2005).
A mediados de la década de 1980, von Helversen et al. (1986) describieron una técnica mínimamente invasiva para el muestreo de sangre en animales utilizando insectos hematófagos del orden Heteroptera. Estos insectos son capaces de obtener sangre de vasos pequeños, generalmente de manera inadvertida para el huésped, sin dejar hematomas o heridas (von Helversen et al. 1986). Desde entonces, en varios estudios se ha utilizado esta técnica, ajustándola a diferentes sistemas (ver Becker et al. 2006, Voigt et al. 2006, Bauch et al. 2010, Markvardsen et al. 2012), incluyendo una colonia de Gaviotín Golondrina (Sterna hirundo) situada en el lago Banter, puerto de Wilhelmshaven, norte de Alemania (e.g., Bauch et al. 2012, Riechert et al. 2012a, 2012b, 2014). La aplicación de esta técnica en el lago Banter fue descripta inicialmente por Becker et al. (2006), pero después de una década ha ido modificándose en busca de incrementar su eficiencia en términos de tiempo y número de muestras tomadas. El objetivo de este trabajo es actualizar la descripción de esta técnica de muestreo y mostrar la eficiencia alcanzada en esta colonia de aves marinas.
MÉTODOS
La colonia de Gaviotín Golondrina del lago Banter (53°27'N, 08°07'E), donde se reproducen aproximadamente 570 parejas (en 2014), está conformada por seis islas rectangulares artificiales (subcolonias) de igual tamaño, dispuestas linealmente a la misma distancia entre sí (Fig. 1; Wendeln y Becker 1996). Las islas tienen bordes de cemento (60 cm) y poseen 44 plataformas de descanso equipadas con balanzas y antenas (lectores electrónicos). Esta colonia es especialmente adecuada para analizar distintos rasgos de historia de vida de individuos conocidos, ya que desde 1992 todos los pichones han sido marcados con transmisores pasivos subcutáneos y anillos metálicos. La extracción de sangre de las aves de la colonia se realizó durante el periodo de incubación en las temporadas reproductivas 2013 y 2014, entre las 05:00–08:00 h preferentemente (evitando las variaciones diurnas de los parámetros a medir en sangre, como la corticosterona y la prolactina). Se utilizó uno de los estadios larvales del insecto hematófago Dipetalogaster maximus (Heteroptera) (Fig. 2). El insecto era introducido en un huevo artificial ahuecado mientras los nidos eran monitoreados con antenas portátiles. La puesta entera del nido era reemplazada por huevos falsos, uno de ellos conteniendo el insecto hematófago. Los huevos eran mantenidos en una incubadora portátil durante el tiempo requerido para la obtención de sangre. Después de 20–30 min se evaluaba si el insecto había succionado suficiente sangre (unos 250 ìl). Cuando el insecto no succionaba sangre durante los primeros 30 min, era reemplazado por otro y se esperaba otros 30 min. Finalmente, el insecto era retirado del huevo falso y se le extraía una muestra de sangre del abdomen con una jeringa; la muestra se mantenía en frío durante 4–5 h hasta llegar al laboratorio donde era procesada.

Figura 1. Colonia de Gaviotín Golondrina (Sterna hirundo) situada en el lago Banter, Alemania.
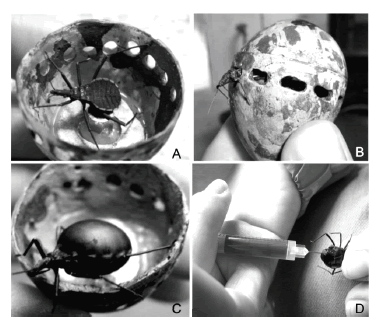
Figura 2. (A) Estadio larval del insecto hematófago Dipetalogaster maximus (Heteroptera) usado para extraer sangre de las aves de la colonia de Gaviotín Golondrina (Sterna hirundo) del lago Banter, Alemania, dentro del huevo falso. (B) Insecto sacando su cabeza por uno de los orificios del huevo falso. (C) Insecto luego de la toma de la muestra de sangre. (D) Extracción de sangre del insecto usando una jeringa.
RESULTADOS
El diseño inicial del huevo falso descripto por Becker et al. (2006) difiere notoriamente del utilizado en este trabajo. Se modificaron cuatro características del huevo: el dispositivo de sujeción, el peso del huevo, los agujeros de succión y el sistema de apertura. Durante las primeras aplicaciones de esta técnica en la colonia, el huevo falso contaba con un dispositivo de sujeción al sustrato para evitar que se perdiera al volar el ave si quedaba adherido a ella (Becker et al. 2006). Sin embargo, el dispositivo incomodaba al ave durante la toma de sangre porque ésta no podía rotar la nidada. En este trabajo se eliminó el dispositivo de sujeción pero se hizo más pesado al huevo falso, evitando su pérdida. En el diseño original, el insecto era introducido en el huevo falso por un tapón con rosca que era parte del dispositivo de sujeción (ver Fig. 1 en Becker et al. 2006). Además, el huevo tenía un solo orificio (de aproximadamente 15 mm de diámetro) cubierto con una malla por donde el insecto sacaba parte del aparato de succión para extraer sangre. El huevo falso utilizado en este trabajo cuenta con un tornillo central que permite abrirlo para introducir al insecto de una manera más cómoda y posee una gran cantidad de agujeros por los cuales el insecto saca el aparato de succión sin que pueda escaparse (Fig. 2B). Estas modificaciones permiten que el ave incube normalmente durante la toma de la muestra y que el insecto tenga más posibilidades de acceder a ella en busca de sangre.
Para este estudio se colectaron 440 muestras de sangre. Durante 2013 se colectaron 191 muestras en 22 días de trabajo (9.5±5.1 muestras por día) y durante 2014 se colectaron 249 muestras en 18 días (13.8±6.4 muestras por día). El tiempo promedio para obtener una muestra de sangre satisfactoria fue de 31±15 min (n = 435). En el 80% de los intentos se obtuvo más de 200 µl de sangre; en el 20% restante se obtuvo menos de 50 µl.
DISCUSIÓN
Los resultados obtenidos durante las temporadas reproductivas 2013 y 2014 indican una alta eficiencia en la toma de muestras, alcanzándose una colecta de aproximadamente 5 muestras por hora durante la segunda temporada. La mayor eficiencia durante las primeras horas del día podría estar relacionada con una incubación más constante de las aves durante ese momento, lo que facilitaría la ingesta de sangre por parte del insecto (Becker et al. 2006). La mayor eficiencia observada en 2014 con respecto a 2013 puede deberse a la mayor experiencia de los operarios en el trabajo de campo y en la selección de los insectos a utilizar.
La utilización de esta técnica evita el trampeo y la manipulación del ave, lo que la hace especialmente útil para el muestreo repetido de un mismo individuo en períodos cortos de tiempo del ciclo reproductivo (e.g., durante el periodo de incubación). Además, se evitan dificultades frecuentes durante la extracción de sangre tales como la coagulación previa a la extracción del total de la muestra o la aparición de hematomas en las venas. La técnica ha sido validada en varias especies para el estudio del acortamiento de telómeros (Bauch et al. 2013) y para el análisis de niveles hormonales (Riechert et al. 2014) y de otros metabolitos como colesterol, triglicéridos y ácido úrico (Bauch et al. 2010).
El insecto utilizado en este trabajo es de fácil mantenimiento durante el trabajo de campo: solo se necesita una incubadora para mantener una temperatura y una humedad óptimas para el estadio larval. El estado del insecto en términos de saciedad es clave para lograr el éxito en la toma de la muestra: el insecto debe tener hambre pero también debe tener síntomas vitales activos. Ha sido utilizado también con éxito en especies de aves de menor tamaño, como por ejemplo el Vencejo Común (Apus apus) (Bauch et al. 2013). El investigador debe ajustar el tamaño del huevo falso y el estadio larval del insecto hematófago a cada especie de ave. En Argentina hay varias especies de chinches hematófagas que podrían ser utilizadas para aplicar esta técnica de muestreo (e.g., Triatoma patagonica, Triatoma delpontei y Cimex lectularius; A Cicchino y D Porrini, com. pers.).
AGRADECIMIENTOS
Agradecemos la asistencia en el campo de Sandra, Juliane, Oscar, Götz, Sina, Natascha, Sabrina, Suenja y Joka. También agradecemos los comentarios del editor y de los revisores, que enriquecieron el manuscrito, y la revisión del abstract por Jane Ashworth. Este trabajo estuvo financiado por el Deutsche Forschungsgemeinschaft (Be 916/8, “Population ecology of the Common Tern Sterna hirundo”) y la Agencia Nacional de Promoción Científica y Tecnológica (PICT 0174, “Cleptoparasitismo en aves marinas: relación con la historia de vida y calidad individual de adultos reproductores”).
BIBLIOGRAFÍA CITADA
1. BAUCH C, BECKER PH Y VERHULST S (2012) Telomere length reflects phenotypic quality and costs of reproduction in a long-lived seabird. Proceedings of the Royal Society of London B 280:art20122540 [ Links ]
2. BAUCH C, KREUTZER S Y BECKER PH (2010) Breeding experience affects condition: blood metabolite levels over the course of incubation in a seabird. Journal of Comparative Physiology B 180:835–845
3. BAUCH C, WELLBROCK AHJ, NAGEL R, ROZMAN J Y WITTE K (2013) “Bug-eggs” for Common Swifts and other small birds: minimally-invasive and stress-free blood sampling during incubation. Journal of Ornithology 154:581–584
4. BECKER PH, VOIGT CC, ARNOLD JM Y NAGEL R (2006) A non-invasive technique to bleed incubating birds without trapping: a bloodsucking bug in a hollow egg. Journal of Ornithology 147:115–118
5. BUTLER PJ, GREEN JA, BOYD IL Y SPEAKMAN JR (2004) Measuring metabolic rate in the field: the pros and cons of the doubly labelled water and heart rate methods. Functional Ecology 18:168–183
6. FAIR JM, PAUL E Y JONES J (2010) Guidelines to the use of wild birds in research. Tercera edición. Ornithological Council, Washington DC [ Links ]
7. GÖTMARK F (1992) The effects of investigator disturbance on nesting birds. Current Ornithology 9:63–104
8. VON HELVERSEN O, VOLLETH M Y NUÑEZ J (1986) A new method for obtaining blood from a small mammal without injuring the animal: use of triatomid bugs. Experientia 42:809–810
9. KANIA W (1992) Safety of catching adult European birds at the nest. Ringers’ opinions. Ring 14:5–50
10. MARKVARDSEN SN, KJELGAARD-HANSEN M, RITZ C Y SØRENSEN DB (2012) Less invasive blood sampling in the animal laboratory: clinical chemistry and haematology of blood obtained by the Triatominae bug Dipetalogaster maximus. Laboratoy Animals 46:136–141
11. MARVELDE LT, WEBBER SL, VAN DEN BURG AB Y VISSER ME (2011) A new method for catching cavity-nesting birds during egg laying and incubation. Journal of Field Ornithology 82:320–324
12. RIECHERT J, BECKER PH Y CHASTEL O (2014) Predicting reproductive success from hormone concentrations in the common tern (Sterna hirundo) while considering food abundance. Oecologia 176:715–727
13. RIECHERT J, CHASTEL O Y BECKER PH (2012a) Is the additional effort of renesting linked to a hormonal change in the common tern? Journal of Comparative Physiology B 183:431–441
14. RIECHERT J, CHASTEL O Y BECKER PH (2012b) Why do experienced birds reproduce better? Possible endocrine mechanisms in a long-lived seabird, the common tern. General and Comparative Endocrinology 178:391–399
15. ROMERO LM Y REED JM (2005) Collecting baseline corticosterone samples in the field: is under 3 min good enough? Comparative Biochemistry and Physiology A 140:73–79
16. ROMERO LM Y ROMERO RC (2002) Corticosterone responses in wild birds: the importance of rapid sampling. Condor 104:129–135
17. VOIGT CC, PESCHEL U, WIBBELT G Y FRÖLICH K (2006) An alternative, less invasive blood sample collection technique for serologic studies utilizing Triatomine bugs (Heteroptera; Insecta). Journal of Wildlife Diseases 42:466–469
18. WENDELN H Y BECKER PH (1996) Body mass change in breeding Common Terns Sterna hirundo. Bird Study 43:85–95














