Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero vol.34 no.1 Ciudad Autónoma de Buenos Aires ago. 2019
ARTÍCULO
Nidificación de Callonetta leucophrys y Dendrocygna autumnalis en cajas nido en Corrientes, Argentina
Eugenia Montani1,8, Candelaria Cordini2,3, Marcelo Romano4, Germán Saigo1,5, Marcelo Janik6 e Ignacio Barberis3,7
1 Museo Provincial de Ciencias Naturales “Dr. Ángel Gallardo”, San Lorenzo 1949, CP2000 Rosario, Santa Fe, Argentina.
2 Subsecretaría de Recursos Naturales, Ministerio de Ambiente y Cambio Climático de la provincia de Santa Fe, Montevideo 970, CP2000, Rosario, Santa Fe, Argentina.
3 Facultad de Ciencias Agrarias, Universidad Nacional de Rosario, Campo Experimental Villarino, C.C. 14, S2125ZAA Zavalla, Santa Fe, Argentina.
4 Centro de Investigaciones en Biodiversidad y Ambiente (ECOSUR), Pje. Sunchales 329, CP2000, Rosario, Santa Fe, Argentina.
5 Facultad de Humanidades y Ciencias, Universidad Nacional del Litoral, Ciudad Universitaria, 3000 Santa Fe, Santa Fe, Argentina.
6 Estancia Don Pablo, Goya, CP3450, Corrientes, Argentina.
7 IICAR (Instituto de Investigaciones en Ciencias Agrarias de Rosario), UNR-CONICET.
8 Autor para correspondencia. Correo electrónico: euge_montani22@hotmail.com
Resumen
En Argentina, el Pato de Collar (Callonetta leucophrys) y el Sirirí Vientre Negro (Dendrocygna autumnalis) son especies abundantes, pero poco estudiadas. Para describir la distribución estacional de las nidificaciones, el número de huevos/postura y los huevos de estas especies, se trabajó durante seis temporadas reproductivas con cajas nido dispuestas en numerosos humedales del sudoeste de la provincia de Corrientes. Se registraron 389 nidificaciones de C. leucophrys y 979 nidificaciones de D. autumnalis. El pico de nidificación de C. leucophrys ocurrió en octubre-noviembre y el de D. autumnalis en enero-febrero. El tamaño de la postura de C. leucophrys fue menor que el de D. autumnalis (mediana: 10 y 14 huevos, respectivamente). El interior de las cajas nido ocupadas por C. leucophrys fue recubierto con plumón, mientras que D. autumnalis no utilizó ningún material extra para recubrirlo. Once hembras de C. leucophrys fueron recapturadas en sucesivas temporadas, en los mismos humedales e incluso en los mismos nidos en los que habían sido anilladas. Las hembras recapturadas de D. autumnalis no regresaron al mismo nido. Los huevos de C. leucophrys fueron más pequeños que los de D. autumnalis (largo: 46.19 ± 1.79 mm vs. 50.76 ± 1.95 mm; ancho: 34.04 ± 1.14 mm vs. 37.65 ± 1.19 mm; peso: 27.68 ± 2.89 g vs. 38.65 ± 3.73 g, respectivamente). Estos resultados demuestran la utilidad de las cajas nido como herramienta para aumentar el conocimiento de la biología reproductiva de patos que nidifican en cavidades.
Palabras clave: Cajas nido; Callonetta leucophrys; Dendrocygna autumnalis; Huevos; Nidificación.
Abstract
Nesting of Callonetta leucophrys and Dendrocygna autumnalis in nest boxes in Corrientes, Argentina.
In Argentina, the Ringed Teal (Callonetta leucophrys) and the Black-bellied Whistling Duck (Dendrocygna autumnalis) are common but scarcely studied species. To characterize the seasonal distribution of nesting, the number of eggs per nests, and the eggs of these duck species, nest boxes were surveyed during six reproductive seasons in several wetlands from southwestern Corrientes province. From all these surveys, 389 nesting events were recorded for C. leucophrys and 979 nesting events for D. autumnalis. The nesting peak for C. leucophrys occurred in October-November, whereas the peak for D. autumnalis was in January-February. The clutch size was smaller for C. leucophrys than for D. autumnalis (median: 10 and 14 eggs, respectively). The inside of the nest boxes occupied by C. leucophrys were covered with down, whereas D. autumnalis did not add any extra material to cover it. Eleven females of C. leucophrys were recaptured along various reproductive seasons, at the same wetlands, and even at the same nests that they had been banded. Recaptured females of D. autumnalis did not return to the same nest box. The eggs of C. leucophrys were smaller than those of D. autumnalis (length: 46.19 ± 1.79 mm vs. 50.76 ± 1.95 mm; width: 34.04 ± 1.14 mm vs. 37.65 ± 1.19 mm; weight: 27.68 ± 2.89 g vs. 38.65 ± 3.73 g, respectively). These results highlight the utility of nest boxes to increase our knowledge about the reproductive biology of duck species that nest in cavities.
Key words: Callonetta leucophrys; Dendrocygna autumnalis; Eggs; Nest boxes; Nesting.
Recibido 28 septiembre 2018
Aceptado 25 marzo 2019
Las aves de humedales exhiben gran diversidad en sus estrategias reproductivas, desde la forma de nidificación (i.e. individual o en colonias), la selección de los sitios utilizados para nidificar (e.g. suelo, árboles, pastizales, lagunas, acantilados, etc.), así como la arquitectura del nido (de la Peña 1987b, 2006a, Weller 1999, Bowler 2005). La disponibilidad de sitios de nidificación puede ser un factor limitante para la reproducción de muchas especies de aves acuáticas (Klett et al. 1988) y esta limitación suele ser notoria en aquellas especies que utilizan cavidades de árboles para nidificar (Newton 1994).
Las especies de la familia Anatidae nidifican principalmente en el suelo entre los pastos, en pajonales, juncales, espadañales, utilizando también cavidades en árboles, cuevas o nidos abandonados por otras aves (Bengtson 1970, Bowler 2005, de la Peña 2016). Generalmente cada nidada contiene varios huevos y los pichones son nidífugos (Bowler 2005, de la Peña 2016). En Argentina, varias especies de patos utilizan principalmente cavidades de árboles para anidar: el Pato de Collar (Callonetta leucophrys), el Sirirí Vientre Negro (Dendrocygna autumnalis), el Ganso de Monte (Oressochen jubatus), el Pato Real (Cairina moschata), el Pato Crestudo (Sarkidiornis melanotos), el Pato de Torrente (Merganetta armata) y el Pato Serrucho (Mergus octosetaceus) (de la Peña 2016). El Pato Barcino (Anas flavirostris) también usa cavidades de árboles, pero menos frecuentemente (de la Peña 2016). A su vez, hay especies parásitas, como el Pato de Cabeza Negra (Heteronetta atricapilla) que deposita sus huevos en los nidos de estas especies (Salvador 2012, de la Peña 2016).
En la provincia de Corrientes habitan cinco de estas especies de patos (C. leucophrys, D. autumnalis, C. moschata, S. melanotos y A. flavirostris) (Narosky e Yzurieta 2010), pero no se ha reportado nidificación para ninguna de ellas (de la Peña 2016). Esto podría atribuirse a la escasez de estudios sistemáticos de nidificación, así como también a la limitación dada por la baja disponibilidad de sitios adecuados para nidificar, tal como se ha reportado para otras especies de aves en general (von Haartman 1957) y para patos en particular (Lowney y Hill 1989). Debido a esto, en el año 2010 comenzó un programa que contempló la instalación y monitoreo de nidos artificiales en un establecimiento ubicado al sudoeste de la provincia de Corrientes. Desde el año 2011 al 2018, se ha registrado sistemáticamente la nidificación del Pato de Collar y del Sirirí Vientre Negro, y ocasionalmente del Pato Barcino. Si bien la distribución y el estado de conservación de estas especies son bien conocidos en nuestro país, son pocos los datos disponibles sobre su historia natural y en particular, sobre su biología reproductiva (de la Peña 2016). Los escasos datos disponibles se centran, principalmente, en citas sobre los períodos reproductivos y lugares de nidificación, hallándose pocos registros sobre tamaño de puesta, conformación del nidos y morfometría de los huevos (de la Peña 2016).
En este contexto, los programas de nidos artificiales han constituido y siguen siendo una excelente y valiosa herramienta exploratoria, brindando la oportunidad de realizar estudios más controlados sobre la biología reproductiva de varias especies en poblaciones silvestres (Burger et al. 1994, Major y Kendal 1996, Yahner 1996, Clawson y Rotella 1998), aunque estos resultados no implican, necesariamente, que en poblaciones naturales se desarrollen de igual manera (Balser et al. 1968, Willebrand y Marcstrom 1988). Por ello, el objetivo del presente estudio fue analizar el uso de nidos artificiales (cajas nido) por el Pato de Collar y el Sirirí Vientre Negro en humedales del sudoeste de la provincia de Corrientes. En particular, caracterizar el tamaño de la nidada, el material utilizado para la construcción, la fidelidad al nido y el tamaño de los huevos (peso, largo y ancho).
MÉTODOS
Especies estudiadas
Callonetta leucophrys. El Pato de Collar es una especie endémica de América del Sur (Olrog 1968, Elsam 2006, Carbonell et al. 2007, Bencke et al. 2010). Habita gran parte de la región noreste y centro de Argentina, hasta norte de Buenos Aires y noroeste de La Pampa (Fandiño y Giraudo 2010, Narosky e Yzurieta 2010, Brandolin et al. 2011, de la Peña 2015). Sin embargo, las áreas de cría o residencia permanente se encuentran en las provincias de Formosa, Chaco, este de Salta, Tucumán, Santiago del Estero, norte de Córdoba, centro y norte de Santa Fe (Canevari et al. 1991, de la Peña 2016), sur de Santa Fe (M. Romano, obs. pers.) y norte de Buenos Aires (de la Peña 2016). de la Peña (1997, 2006b, 2016) indica que el período reproductivo de la especie se desarrolla entre setiembre y febrero. Nidifica en cavidades de árboles (Nores e Yzurieta 1980, de la Peña 1987a, 1987b, Canevari et al. 1991, de la Peña 1997, 2006a, Elsam 2006, Figuerola y Green 2006, Rodríguez Mata et al. 2006, Romano et al. 2013, Salvador 2014, de la Peña 2015) o ni dos de Cotorra (Myiopsitta monachus) (de la Peña 2016). Utiliza plumón para la conformación del nido (de la Peña 1987b, 1997, 2006a, Rodríguez Mata et al. 2006, Romano et al. 2013, de la Peña 2015). El tamaño de la nidada varía entre 6 y 15 huevos, ovoidales y blancos, con un largo promedio de 45 mm, un ancho promedio de 35 mm y un peso promedio de 30 g (Brewer 1989, Johnsgard 1978, Brewer 2005, de la Peña 2016). El período de incubación es de 26 a 28 días (Johnsgard 1978).
Dendrocygna autumnalis. El Sirirí Vientre Negro es una especie endémica de la Región Neotropical, con distribución desde el sur de Texas (Estados Unidos), América Central y la mayor parte de América del Sur, incluyendo el norte de Argentina (Palmer 1976, Carbonell et al. 2007). En Argentina, la especie se distribuye desde el norte del país, exceptuando Misiones, hasta Santiago del Estero, sur de Córdoba, sur de Santa Fe y noreste de la provincia de Buenos Aires (de la Peña 2015). Hay registros de reproducción en Córdoba, Chaco y Formosa (de la Peña 2016). de la Peña (2016) menciona que el período reproductivo de la especie se desarrolla entre diciembre y febrero. Puede anidar tanto en cavidades de árboles como en el suelo (Bolen et al. 1964, Delnicki y Bolen 1975, Markum y Baldassarre 1989). Existe numerosa información sobre el uso de cajas nido por esta especie (Bolen 1967, Strange et al. 1971, McCamant y Bolen 1979, Urabek 1989, McCoy et al.1992). El tamaño de la nidada es de 10 a 18 huevos (Bolen 1973) ovoidales, blancos a blanco-crema, con un largo promedio de 50 mm, un ancho promedio de 38 mm y un peso promedio de 40 g (Bolen 1973, Johnsgard 1978, Bolen 2005, de la Peña 2016). En ciertas oportunidades se encuentran nidadas extra numerarias (dump nesting) con más de 100 huevos provenientes de numerosas hembras (Delnicki et al. 1976, McCamant y Bolen 1979, Markum y Baldassarre 1989, McCoy et al. 1992, National Audubon Society 2018). El período de incubación es de 28 días (Bolen 1973).
Área de estudio
La estancia “Don Pablo” (29°31’30.69”S, 59°1’1.82”O) está ubicada en la provincia de Corrientes, departamento Goya, Argentina (Fig. 1). El área se encuentra en la Ecorregión Esteros del Iberá, caracterizada por la depresión del Iberá y los ambientes palustres asociados, y a su vez, dentro del “Complejo Bañados del Río Corriente” (Matteucci 2012). Los bajos, esteros, lagunas y cañadas se encuentran casi permanentemente anegados, presentando, en general, escasa superficie de agua libre. Poseen extensas comunidades con predominancia de una o pocas especies: pajonales, pirizales, juncales, totorales y pehuajosales. Sobre los suelos medianamente drenados a mal drenados en los horizontes inferiores, se desarrollan bosques densos a semi-densos distribuidos en forma de parches en una matriz de sabanas y palmares inundables (Matteucci 2012).

Figura 1. Ubicación del área de estudio (Estancia “Don Pablo”) en los Esteros del Iberá, provincia de Corrientes, Argentina. En la imagen (derecha) se muestra un nido en una laguna y detalle de una caja nido.
El presente trabajo se desarrolló en el marco del Programa de Monitoreo de Nidos Artificiales que viene llevando adelante el establecimiento desde el año 2010. A lo largo del período de estudio la cantidad de cajas nido disponibles varió entre 250 y 333, distribuidas en diferentes tipos de humedales (Fig. 1). Anualmente, concluida la temporada reproductiva, las cajas nido son acondicionadas, limpiadas y se les coloca una cama de viruta de madera para la nidificación (McGilvrey y Uhler 1971, Ingold 1998, Davis et al. 1999, Ducks Unlimited Canada 2000, Mallory et al. 2002).
Durante seis temporadas reproductivas, entre los años 2012 y 2018, se realizaron entre dos y tres monitoreos por temporada (octubre/noviembre, enero/ febrero y abril/mayo) en los que se revisaron todas las cajas nido. En la temporada 2014-2015 se realizó un seguimiento intensivo desde el mes de agosto hasta el mes de mayo. Para todas las temporadas, en aquellas cajas nido en las que se encontró una postura de C. leucophrys o de D. autumnalis se registró la existencia de materiales extras en el nido, incluyendo la presencia o no de plumón.
Debido a la gran extensión del campo, la elevada cantidad de nidos a seguir y la complejidad para acceder a algunos de los nidos, frecuentemente no se pudo realizar el seguimiento de la nidificación. Por lo tanto, al momento de revisar los nidos, podemos encontrar tres posibles situaciones: (a) nidificación en fase de postura, (b) nidificación en fase de incubación, o (c) nidificación post-incubación/postura. Si el nido se encuentra en la primera fase y no se retorna sistemáticamente en los días sucesivos, podrá saberse que hubo una nidificación, pero no el número de huevos totales de la misma ni su resultado final (eclosión, predación o abandono). Para aquellos nidos que se encontraban en las fases (b) o (c) se registró el número total de huevos y su resultado final.
Durante tres temporadas reproductivas (2012- 2013, 2013-2014 y 2014-2015), en los casos en que fue posible se midió el ancho y el largo de cada huevo con calibre digital (precisión 0.02 mm) y se los pesó con una balanza Pesola® Micro-Line (100 g).
Anillado de individuos
Con el objeto de corroborar el comportamiento de “filopatría” (i.e. fidelidad al sitio de nacimiento o al sitio de nidificación previo), reportado por varios autores para numerosas especies anátidas (O’Kelley 1987, Pöysä et al. 1997, Semel y Sherman 2001, Ludwichowski et al. 2002, Charles 2012), a partir de la temporada reproductiva 2013-2014 se anillaron 104 individuos que pudieron ser capturados en fase de postura o incubación, durante la revisación de los nidos (51 C. leucophrys y 53 D. autumnalis).
Análisis de datos
Dado que en el área de estudio C. leucophrys y D. autumnalis utilizan las cajas nido para nidificar, que es escasa la información sobre su reproducción y que es frecuente encontrar nidos con huevos de ambas especies, es importante realizar comparaciones entre las mismas. Por ello, para evaluar si existían diferencias significativas entre especies en el número de huevos/nidada, así como en el largo, ancho y peso de los huevos se utilizó la prueba no paramétrica W de Wilcoxon mediante la función wilcox.test del paquete stats en el programa R (The R Core Team 2018). Para analizar si había diferencias entre ambas especies en las proporciones de nidificación registradas entre estaciones (primavera, verano y otoño) en los cuatro años en los que se registraron todas las estaciones se utilizó la prueba chi-cuadrado mediante la función chisq.test del paquete stats en el mismo programa R (The R Core Team 2018).
RESULTADOS
Durante las seis temporadas reproductivas se registraron 389 nidificaciones de C. leucophrys y 979 nidificaciones de D. autumnalis. En numerosos nidos se registraron posturas simultáneas de dos o más hembras de la misma especie (23 de C. leucophrys y 218 de D. autumnalis), así como de hembras de ambas especies (75). Además, se registraron tres nidificaciones de Anas flavirostris, dos en cajas nido y uno en un nido abandonado de Myiopsitta monachus.
La temporada reproductiva de C. leucophrys inició siempre antes que la de D. autumnalis (mediados de agosto y principios de octubre, respectivamente), extendiéndose ambas hasta fines de abril-principio de mayo. En los cuatro años en los que se realizaron muestreos en primavera, verano y otoño se observaron diferencias en los picos de nidificación de las especies (para cada uno de los años χ2 2 g.l. > 50; P < 0.001, Fig. 2). El pico de nidificación de C. leucophrys ocurrió más temprano (i.e. primavera: octubre-noviembre) que el de D. autumnalis (i.e. verano: enero-febrero). El tamaño de la postura para C. leucophrys fue menor que para D. autumnalis (Mediana 10 y 14, respectivamente; W = 14 284, P < 0.001, Fig. 3). Para C. leucophrys se registraron 23 posturas múltiples (5.9% del total de las nidadas de la especie) que variaron entre 17 y 31 huevos, mientras que para D. autumnalis se registraron 218 posturas múltiples (22.2% del total de las nidadas de la especie) que variaron entre 23 y 62 huevos.
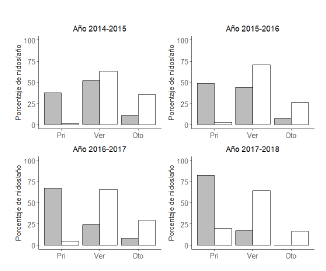
Figura 2. Distribución porcentual del número de nidificaciones registradas de ambas especies en los tres monitoreos estacionales (primavera, verano, otoño) para cuatro temporadas reproductivas. Las barras grises corresponden a Callonetta leucophrys y las blancas a Dendrocygna autumnalis.

Figura 3. Diagrama de cajas del número de huevos/nido para cada especie en las seis temporadas reproductivas. Sólo se consideraron aquellos nidos que se encontraban en fase de incubación o posterior a la misma. La caja abarca los percentiles 25–75%, la línea oscura indica la mediana, y las líneas en vertical indican el rango exceptuando los puntos atípicos (valores 1.5 veces mayores que el rango intercuartil).
El interior de las cajas nido ocupadas por C. leucophrys fue recubierto con plumón, mientras que D. autumnalis no utilizó ningún material extra para recubrir el nido (Fig. 4). Los huevos de ambas especies son ovoides, con un polo más ancho que el otro. Sin embargo, los huevos de C. leucophrys son de coloración blanco-crema uniforme y tienen la superficie lisa, suave al tacto, con brillo, aunque no muy marcado, mientras que los huevos de D. autumnalis son de coloración blanquecina uniforme y tienen la superficie ligeramente porosa, sin brillo (Fig. 4). En las tres temporadas se midieron 534 huevos de C. leucophrys y 2688 huevos de D. autumnalis y se pesaron 208 y 1059 huevos de cada especie, respectivamente. Si bien ambas especies mostraron amplias variaciones en las dimensiones de sus huevos, los huevos de C. leucophrys fueron más cortos (W = 55 855, P < 0.001), más angostos (W = 26 544, P < 0.001) y más livianos (W = 2762.5, P < 0.001) que los huevos de D. autumnalis (Fig. 5).

Figura 4. Hembras en el nido (fotos superiores) y las respectivas posturas (fotos inferiores) de Sirirí Vientre Negro (derecha) y Pato de Collar (izquierda).

Figura 5. Diagramas de caja de valores de largo, ancho y peso de huevos registrados para cada especie durante tres temporadas reproductivas. La caja abarca los percentiles 25–75%, la línea oscura indica la mediana, y los bigotes indican el rango exceptuando los puntos atípicos (valores 1.5 veces mayores que el rango intercuartil).
Se recapturaron 11 individuos (22%) de C. leucophrys previamente anillados. De ellos, el 100% se encontraron en los mismos sitios (humedales) e incluso en los mismos nidos o en nidos muy próximos a aquellos en los que habían sido anillados. Esto podría indicar que la especie posee un marcado comportamiento de filopatría. En el caso de D. autumnalis este comportamiento sólo pudo ser registrado a una escala espacial mayor, ya que pudieron recapturarse 7 individuos que regresaron al establecimiento, pero ninguno regresó al mismo nido y sólo 3 volvieron a nidificar en sitios próximos a los originales.
DISCUSIÓN
Los resultados de este estudio muestran que Callonetta leucophrys y Dendrocygna autumnalis nidifican frecuente y sistemáticamente en humedales del sur de la provincia de Corrientes. Si bien ambas especies son habitantes comunes en esta provincia (Olrog 1963, Canevari et al. 1991, Narosky e Yzurieta 2010, de la Peña 2016), estos registros de nidificación son los primeros reportados para ambas especies en Corrientes. La ausencia de registros previos de nidificación de estas especies podría atribuirse a la falta de estudios sobre reproducción de estas aves, así como a la dificultad de observar las nidificaciones en cavidades de árboles (Koch 2008). Por ello, merece destacarse la contribución de este programa de cajas nido que ha permitido identificar nuevos sitios de nidificación y realizar un relevamiento sistemático de la nidificación de ambas especies durante seis temporadas reproductivas.
Si bien en el área de estudio hemos registrado nidificaciones de ambas especies a lo largo de la primavera, verano y otoño, las hembras de C. leucophrys comienzan a nidificar más temprano y registran antes el pico de nidificación que las hembras de D. autumnalis. Estos resultados coinciden con la mayoría de los registros reportados para otras áreas de estudio (de la Peña 1997, 2006b, 2016), pero nuestros registros muestran que el período de postura de ambas especies es más extenso que lo reportado previamente (de la Peña 2016). La postura de C. leucophrys comenzó en agosto y se extendió hasta febrero-marzo. A su vez, la postura de D. autumnalis inició en octubre y finalizó en mayo, mientras que de la Peña (2016) cita para esta especie registros entre diciembre y febrero.
Varias hembras anilladas de ambas especies fueron recapturadas durante las sucesivas temporadas reproductivas. Esto nos permitió registrar algunas que nidificaron en más de una oportunidad en una misma temporada. Es importante destacar el registro de una hembra de C. leucophrys que tuvo tres nidificaciones y de dos hembras con dos nidificaciones en una misma temporada reproductiva. Esto ha sido reportado en condiciones de cautiverio (Brewer 2001), pero no conocemos registros en poblaciones silvestres. Similares observaciones han sido reporta das para D. autumnalis (Bent 1925, Johnson y Barlow 1971, James et al. 2012).
La cantidad de huevos encontrados en cada nido fue muy variable para ambas especies. Por un lado, hemos registrado nidificaciones con pocos huevos (e.g. 1-4). Si bien en algunas oportunidades se ha registrado la eclosión de estas nidificaciones, en general estas posturas son abandonadas. Esto podría atribuirse a la presencia de predadores (O’Kelley 1987, Pöysä 1999, Saigo 2016) o al desplazamiento por competencia intra o interespecífica, como se ha registrado en varias especies de anátidos (O’Kelley 1987, Semel y Sherman 2001, Pöysä et al. 2014, Andersson 2017). En este sentido, durante el estudio documentamos el desplazamiento de algunas hembras de C. leucophrys (n=35 nidos) que se encontraban en postura por hembras de D. autumnalis. Si bien no documentamos agresiones entre individuos de ambas especies, el progresivo aumento de huevos de D. autumnalis y la interrupción de la postura de C. leucophrys, así como el reemplazo de las hembras en el nido podrían estar evidenciando competencia y desplazamiento, lo cual podría explicarse si consideramos que D. autumnalis duplica o triplica el tamaño corporal de C. leucophrys.
Por otro lado, el registro de nidificaciones con numerosos huevos, producto de varias hembras poniendo en un mismo nido (nidos comunales o dump nesting), ha sido reportado por varios autores para D. autumnalis (Delnicki et al. 1976, McCamant y Bolen 1979, O’Keeley 1987, Markum y Baldassarre 1989, McCoy et al. 1992, Semel y Sherman 2001, National Audubon Society 2018), existiendo registros para C. leucophrys sólo en cautiverio (Brewer 2001). En este estudio, en 23 oportunidades pudimos registrar nidificaciones múltiples (con un máximo de 31 huevos) para C. leucophrys, en tanto que para D. autumnalis se registraron nidificaciones múltiples en 218 ocasiones (con un máximo de 62 huevos). Numerosos autores han asociado este comportamiento a competencia o “parasitismo” intraespecífico (O’Keeley 1987, Semel y Sherman 2001, Pöysä et al. 2014, Hafen y Koons 2016, Andersson 2017, Andersson et al. 2018). Se consideran como causas de este comportamiento la escasez de sitios adecuados para nidificar, la predación, y la fidelidad de las hembras a aquellos sitios en los cuales se reprodujeron exitosamente, así como al sitio de su nacimiento (filopatría). Estos factores desencadenarían una competencia entre dos o más hembras por el mismo nido. En los dos primeros casos, pueden estar involucradas hembras no emparentadas, en tanto que, en los otros, se involucran individuos emparentados (e.g. madre, hijas y/o hermanas) (Andersson 2017, Andersson et al. 2018). Dada la abundante oferta de cajas nido en nuestro sitio de estudio, consideramos que la filopatría, así como la predación podrían ser las principales causas de las nidificaciones múltiples en ambas especies. Futuros estudios serían útiles para determinar el grado de parentesco entre hembras que nidifican comunalmente.
En relación al número de huevos totales por postura, la bibliografía menciona un rango de 5 a 15 huevos para C. leucophrys y de 10 a 18 huevos para D. autumnalis (Tabla 1). En este estudio pudimos registrar 3.61% del total de las posturas de C. leucophrys con 16 huevos y 10.95% del total de las posturas de D. autumnalis con más de 18 huevos. Posiblemente estos valores pudieron ser registrados debido al elevado número de nidos relevados y a la extensión temporal del estudio.
Tabla 1. Descripción de las características de las nidadas y de los huevos de Callonetta leucophrys y Dendrocygna autumnalis de acuerdo a diversos autores. Para el presente estudio se muestra la media ± DS y el rango. N = tamaño de la muestra. Para los otros estudios, los datos entre paréntesis son números excepcionales.

Si bien ambas especies utilizan las cajas nido para nidificar, es posible distinguir fácilmente a campo las nidadas de ambas especies, dado que C. leucophrys utiliza plumón para recubrir el interior del nido, mientras que el nido de D. autumnalis no contiene ningún material extra. Similares observaciones han sido reportadas previamente (de la Peña 1987b, 1997, 2006a, Rodríguez Mata et al. 2006, Romano et al. 2013, de la Peña 2015, National Audubon Society 2018). A su vez, los huevos de C. leucophrys son más pequeños que los de D. autumnalis. Los valores registrados de ancho, largo y peso de los huevos de ambas especies son similares a los reportados previamente por varios autores (Tabla 1). Sin embargo, merece destacarse el número de huevos medidos en este estudio que muestra la gran variación que es posible encontrar en los tamaños de los huevos de ambas especies, principalmente para D. autumnalis. Estudios similares en otras localidades permitirán profundizar sobre esta variación y su prevalencia a lo largo de la distribución de estas especies.
Los resultados del presente estudio sobre la distribución estacional de las nidificaciones, el número de huevos/postura y las características morfológicas de los huevos de C. leucophrys y D. autumnalis en el sudoeste de la provincia de Corrientes destacan la utilidad de las cajas nido como herramienta para aumentar el conocimiento de la biología reproductiva de aves que nidifican en cavidades de las regiones tropicales y subtropicales de Sudamérica.
AGRADECIMIENTOS
Agradecemos la colaboración en las tareas de campo a Zuleica Marchetti, Mariana Mazzei, Ayelén Muchiutti, Agustín Vitali, Mauricio Albornoz, Jorge Gauto y Nelson Verón. A dos revisores anónimos que colaboraron para mejorar la calidad del manuscrito. Quisiéramos agradecer especialmente a Paul Tudor Jones por su compromiso y apoyo constante y a Marcelo Prodel y familia por su hospitalidad y colaboración permanente para el desarrollo del programa.
BIBLIOGRAFÍA
1. Andersson M (2017) Female-biased natal philopatry, social parallels, and conspecific brood parasitism in New World quails and waterfowl. Auk 135:25-28 [ Links ]
2. Andersson M, Åhlund M y Waldeck P(2018) Brood parasitism, relatedness and sociality: a kinship role in female reproductive tactics. Biological Reviews 94:307-327 [ Links ]
3. Balser DS, Dill HH y Nelson HK(1968) Effect of predator reduction on waterfowl nesting success. The Journal of Wildlife Management 32:669-682 [ Links ]
4. Bencke GA, Dias RA, Bugoni L, Agne CE, Fontana CS, Maurício GN y Machado DB (2010) Revisão e atualização da lista das aves do Rio Grande do Sul, Brasil. Iheringia, Série Zoologia 100:519-556 [ Links ]
5. Bengtson SA(1970) Location of nest-sites of ducks in lake Mývatn area, North-East Iceland. Oikos 21:218-229 [ Links ]
6. Bent AC (1925) Life histories of North American wild fowl. Order Anseres (Part). Bulletin / U.S. National Museum. Smithsonian Institution 130:1-373 [ Links ]
7. Bolen EG (1967) Nesting boxes for black-bellied tree ducks. Journal of Wildlife Management 31:794-797 [ Links ]
8. Bolen EG (1973) Breeding whistling ducks Dendrocygna spp. in captivity. International Zoo Yearbook 13:32-38 [ Links ]
9. Bolen E, McDaniel B y Cottam C (1964) Natural history of the black-bellied tree duck (Dendrocygna autumnalis) in southern Texas. Southwestern Naturalist 9:78-88 [ Links ]
10. Bowler J (2005) Breeding strategies and biology. Pp. 68-111 en: Kear J y Hulme M (eds) Ducks, geese and swans. Oxford University Press, Oxford [ Links ]
11. Brandolin PG Ávalos MÁ y Martori R (2011) Waterbirds from wetlands of the southeast of the Córdoba Province, Argentina. Check List 7:537-541 [ Links ]
12. Brewer GL (1989) Biparental care behaviour of captive Ringed Teal Callonetta leucophrys. Wildfowl 40:7-13 [ Links ]
13. Brewer GL (2001) Displays and breeding behaviour of captive Ringed Teal Callonetta leucophrys. Wildfowl 52:97-126 [ Links ]
14. Burger LD, Burger Jr. LW y Faaborg J (1994) Effects of prairie fragmentation on predation on artificial nests. Journal of Wildlife Management 58:249-253 [ Links ]
15. Canevari M, Canevari P, Carrizo GR, Harris G, Rodríguez Mata J y Straneck RJ (1991) Nueva guía de las aves argentinas. Tomo 1. Fundación ACINDAR, Buenos Aires [ Links ]
16. Carbonell M, Kriese K y Alexander K (2007) Anátidas de la Región Neotropical. Ducks Unlimited, Memphis [ Links ]
17. Charles A (2012) Dendrocygna autumnalis (Black-bellied Whistling Duck). The Online Guide to the Animals of Trinidad and Tobago. University of West Indies, St. Augustine. (URL: https://sta.uwi.edu/fst/lifesciences/ogatt-birds) [ Links ]
18. Clawson MR y Rotella JJ (1998) Success of artificial nests in CRP Fields, native vegetation, and field borders in Southwestern Montana. Journal of Field Ornithology 69:180-191 [ Links ]
19. Davis JB, Stephens SE, Leopold BD, Kaminski RM y Gerard PD (1999) Wood duck reproduction in small and large nest boxes in Mississippi: a continued experiment. Proceedings of the Annual Conference of the Southeastern Association of Fish and Wildlife Agencies 53:257-269 [ Links ]
20. Delnicki D y Bolen EG (1975) Natural nest site availability for black-bellied whistling ducks in south Texas. Southwestern Naturalist 20:371-378 [ Links ]
21. Delnicki D, Bolen EG y Cottam C (1976) An unusual clutch size of the Black-bellied Whistling Duck. Wilson Bulletin 88:347-348 [ Links ]
22. Ducks Unlimited Canada (2000) Nest box guide for waterfowl. Ducks Unlimited Canada [ Links ]
23. Elsam R (2006) Guía de Aves del Chaco Húmedo. Guyra Paraguay, The Natural History Museum, Fundación Moisés Bertoni y Fundación Hábitat y Desarrollo, Asunción [ Links ]
24. Fandiño B y Giraudo AR (2010) Revisión del inventario de aves de la provincia de Santa Fe, Argentina. Revista FABICIB 14:116-137 [ Links ]
25. Figuerola J y Green AJ (2006) A comparative study of egg mass and clutch size in the Anseriformes. Journal of Ornithology 147:57-68 [ Links ]
26. Hafen K y Koons DN (2016) Factors affecting conspecific brood parasitism in Wood Ducks Aix sponsa of the intermountain region of western North America. Wildfowl 66:186-196 [ Links ]
27. von Haartman L (1957) Adaptation in hole-nesting birds. Evolution 11:339-347 [ Links ]
28. Ingold DJ (1998) The influence of starlings on flicker reproduction when both naturally excavated cavities and artificial nest coxes are available. Wilson Bulletin 110:218-225 [ Links ]
29. James JD, Thompson JE y Ballard BM (2012) Evidence of double brooding by Black-bellied Whistling-Ducks. Wilson Journal of Ornithology 124:183-185 [ Links ]
30. Johnsgard P (1978) Ducks, geese and swans of the World. University of Nebraska Press, Lincoln [ Links ]
31. Johnson AR y Barlow JC (1971) Notes on the nesting of the Black-bellied Tree Duck near Phoenix, Arizona. Southwestern Naturalist 15:394-395 [ Links ]
32. Klett AT, Shaffer TL y Johnson DH (1988) Duck nest success in the prairie pothole region. Journal of Wildlife Management 52:431-440 [ Links ]
33. Koch AJ (2008) Errors associated with two methods of assessing tree hollow occurrence and abundance in Eucalyptus obliqua forest, Tasmania. Forest Ecology and Management 255:674-685 [ Links ]
34. Lowney MS y Hill EP (1989) Wood duck nest sites in bottomland hardwood forests of Mississippi. Journal of Wildlife Management 53:378-382 [ Links ]
35. Ludwichowski I, Barker R y Bräger S (2002) Nesting area fidelity and survival of female common goldeneyes Bucephala clangula: are they density‐dependent? Ibis 144:452-460 [ Links ]
36. Major RE y Kendal CE (1996) The contribution of artificial nest experiments to understanding avian reproductive success: a review of methods and conclusions. Ibis 138:298-307 [ Links ]
37. Mallory ML, Taverner A, Bower B y Crook D (2002) Wood Duck and Hooded Merganser Breeding Success in Nest Boxes in Ontario. Wildlife Society Bulletin 30:310-316 [ Links ]
38. Markum DE y Baldassarre GA (1989) Ground nesting by black-bellied whistling ducks on islands in Mexico. Journal of Wildlife Management 53:707-713 [ Links ]
39. Matteucci SD (2012) Ecorregión Esteros del Iberá. Pp. 293-308 en: Morello J, Matteucci SD, Rodríguez AF y Silva ME (ed.) Ecorregiones y complejos ecosistémicos argentinos. Orientación Gráfica Editora, Buenos Aires [ Links ]
40. McCamant RE y Bolen EG (1979) A 12-year study of nest box utilization by black-bellied whistling ducks. The Journal of Wildlife Management 43:936-943 [ Links ]
41. McCoy MB, Ramírez JM y Marenco JLA (1992) Reproductive success and population increase of Black-Bellied Whistling Ducks (Dendrocygna autumnalis) in newly placed artificial nests in a tropical freshwater marsh. Pp.653-664 en: McCullough DR y Barrett RH (eds.) Wildlife 2001: Populations. Springer, Dordrecht [ Links ]
42. McGilvrey FB y Uhler FM (1971) A Starling-Deterrent Wood Duck Nest Box. Journal of Wildlife Management 35:793-797 [ Links ]
43. Narosky T e Yzurieta D(2010) Aves de Argentina y Uruguay: guía de identificación. Edición total. 16ª ed. Vázquez Mazzini Editores, Buenos Aires [ Links ]
44. National Audubon Society (2018) Pijije alas blancas Dendrocygna autumnalis. Guía de Aves de América del Norte (URL: https://www.audubon.org/es/guia-de-aves) [ Links ]
45. Newton I (1994) The role of nest sites in limiting the numbers of hole-nesting birds: A review. Biological Conservation 70:265-276 [ Links ]
46. Nores M e Yzurieta D (1980) Aves de ambientes acuáticos de Córdoba y centro de Argentina. Secretaría de Estado de Agricultura y Ganadería de Córdoba, Córdoba [ Links ]
47. O’Kelley BL (1987) Recruitment of black-bellied whistling-ducks in South Texas with special reference to the use of nest boxes. Tesis doctoral, Texas Tech University
48. Olrog CC (1963) Lista y distribución de las aves argentinas. Opera Lilloana 9:1-377 [ Links ]
49. Olrog CC (1968) Las aves sudamericanas. Una guía de campo. Tomo Primero. Universidad Nacional de Tucumán. Fundación – Instituto “Miguel Lillo, Tucumán
50. Palmer RS (1976) Handbook of North American birds. Vol. 2: Waterfowl (Part 1). Yale University Press, New Haven [ Links ]
51. de la Peña MR (1987a) Características ecológicas y algunos ambientes que frecuentan las aves argentinas. Talleres Gráficos Lux, Santa Fe [ Links ]
52. de la Peña MR (1987b) Nidos y huevos de aves argentinas. Talleres Gráficos Lux, Santa Fe [ Links ]
53. de la Peña MR (1997) Nidos y huevos de aves argentinas. Guía de campo. Fundación Hábitat, Santa Fe [ Links ]
54. de la Peña MR (2006a) Guía de fotos de nidos, huevos y pichones de aves argentinas. L.O.L.A. – Literature of Latin America, Buenos Aires
55. de la Peña MR(2006b) Lista y distribución de las aves de Santa Fe y Entre Ríos. L.O.L.A. – Literature of Latin America, Buenos Aires
56. de la Peña MR(2015) Aves argentinas. Incluye nidos y huevos. Tomo 1. Eudeba, Buenos Aires [ Links ]
57. de la Peña MR(2016) Aves argentinas: descripción, comportamiento, reproducción y distribución. Rheidae a Pelecanoididae. Comunicaciones del Museo Provincial de Ciencias Naturales “Florentino Ameghino” (Nueva Serie) 19:1-456
58. de la Peña MR, Lorenzón R y Romano M (2017) Algunas aves de los humedales. La vida silvestre que nos rodea. Pp. 31-184 en: Caselli A y Romano M (ed.) Ciencia y comunidad en la conservación de los humedales. Tomo I: Indagaciones en el paisaje local. Universidad Nacional del Centro de la Provincia de Buenos Aires, Tandil [ Links ]
59. Pöysä H, Runko P y Ruusila V (1997) Natal philopatry and the local resource competition hypothesis: data from the common goldeneye. Journal of Avian Biology 28:63-67 [ Links ]
60. Pöysä, H. (1999) Conspecific nest parasitism is associated with inequality in nest predation risk in the Common Goldeneye (Bucephala clangula). Behavioral Ecology 10:533-540 [ Links ]
61. Pöysä H, Eadie JM y Lyon BE (2014) Conspecific brood parasitism in waterfowl and cues parasites use. Wildfowl Special Issue 4:192-219 [ Links ]
62. Rodríguez Mata J, Erize F y Rumboll M (2006) Aves de Sudamérica: guía de campo Collins. Letemendia Casa Editora, Buenos Aires [ Links ]
63. Romano MC, Barberis IM, Montani ME, Cordini MC y Muchiutti A (2013) Monitoreo y evaluación del Proyecto de Nidos Artificiales, Estancia “Don Pablo”, Corrientes, Argentina. Informe de Monitoreo 2013, Tudor Farms, USA
64. Saigo G (2016) Predación de Carpintero blanco (Melanerpes candidus) sobre huevos de patos (Dendrocygna autumnalis y Callonetta leucophrys) en nidos artificiales del establecimiento Don Pablo (Dpto. Goya - Corrientes). Tesis de licenciatura, Universidad Nacional del Litoral, Santa Fe [ Links ]
65. Salvador SA (2012) Notas sobre la reproducción de la familia Anatidae (Aves) en el departamento General San Martín, Córdoba, Argentina. Argentina. Biológica 15:11-23 [ Links ]
66. Salvador S (2014) Nidos abandonados utilizados para criar por aves en Argentina. Biológica 17:5-19 [ Links ]
67. Semel B, y Sherman PW (2001) Intraspecific parasitism and nest-site competition in wood ducks. Animal Behaviour 61:787-803 [ Links ]
68. Strange TH, Cunningham ER y Goertz JW (1971) Use of nest boxes by wood ducks in Mississippi. Journal of Wildlife Management 35:786-793 [ Links ]
69. The R Core Team (2018) The R Foundation for Statistical Computing. Versión 3.5.1 [ Links ]
70. Urabek RL (1989) Evaluation of predator guards for Black-Bellied Whistling Duck nest-boxes. Great Plains Wildlife Damage Control Workshop Proceedings [ Links ]
71. Weller MW (1999) Wetland Birds. Habitat Resources and Conservation Implications. New York: Cambridge University Press, Cambridge [ Links ]
72. Willebrand T y Marcstrom V (1988) On the danger of using dummy nests to study predation. Auk 105:378-379 [ Links ]
73. Yahner RH (1996) Forest fragmentation, artificial nest studies, and predator abundance. Conservation Biology 10:672-673Links ] Helvetica, sans-serif">














