Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero vol.35 no.1 Ciudad Autónoma de Buenos Aires ago. 2020
ARTÍCULO
Parasitismo por moscas en aves paseriformes del monte central de Argentina durante años lluviosos y secos
Eduardo T. Mezquida1,2
1Instituto de Ciencias de la Tierra y Ambientales de La Pampa, Consejo Nacional de Investigaciones Científicas y Técnicas & Centro para el Estudio y Conservación de las Aves Rapaces en Argentina, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de La Pampa. Mendoza 109, 6300 Santa Rosa, La Pampa, Argentina.
2Departamento de Ecología, Universidad Autónoma de Madrid & Centro de Investigación en Biodiversidad y Cambio Global, Universidad Autónoma de Madrid, Madrid, España.
Resumen
Los parásitos de las aves pueden ejercer una presión selectiva importante en las poblaciones de sus hospedadores, aunque su impacto puede variar dependiendo de las condiciones ambientales. Las moscas Neotropicales del género Philornis incluyen especies cuyas larvas son parásitas de los pichones de diversas especies de aves. En este estudio se analiza la prevalencia de moscas parásitas en especies de paseriformes que nidifican en una zona semiárida del Monte central de Argentina, durante cuatro temporadas reproductivas con condiciones climáticas contrastadas. Específicamente se cuantifica la prevalencia en los distintos hospedadores, su variación anual y estacional, la influencia de las precipitaciones, de la disponibilidad de hospedadores y el efecto del parasitismo en la mortalidad de los pichones. Se observó parasitismo por estas moscas en 8 de las 21 especies de paseriformes en las que se pudo seguir el desarrollo de los pichones. La prevalencia para estas especies fue, en promedio, del 15%, afectando principalmente a especies de Thraupidae (21%), Mimidae (14%) y Tyrannidae (7%). Las moscas parasitaron pichones al final de la temporada reproductiva en dos de las cuatro temporadas analizadas, que coincidieron con mayores precipitaciones al final de la primavera. Las condiciones ambientales también favorecieron una mayor disponibilidad de hospedadores. La mortalidad de pichones por causa del parasitismo de las larvas ocurrió en el 10% de los nidos parasitados. Los resultados indican que la prevalencia de este parasitismo es relativamente baja en el Monte central, y que está asociada a condiciones húmedas al final de la primavera, afectando principalmente a las especies que nidifican más tarde dentro de la temporada reproductiva. Sin embargo, los escenarios futuros de cambio global podrían incrementar el efecto negativo de estos parásitos, especialmente en aves hospedadoras con problemas de conservación.
Palabras clave: Bioma del Monte; Condiciones climáticas; Philornis; Prevalencia de parasitismo; Uso de hospedadores.
Abstract
Botfly parasitism in passerine birds in the central Argentine monte during wet and dry years.
Avian parasites may exert an important selective pressure on host populations, although their impact may vary depending on environmental conditions. The Neotropical flies of the genus Philornis include species whose larvae parasitize the nestlings of several bird species. Here, I analyze the prevalence of parasitic flies in passerine species nesting in a semiarid area in the central Monte of Argentina, during four breeding seasons with contrasting weather conditions. Specifically, I quantify the prevalence in different avian hosts, its inter-annual and seasonal variation, the influence of precipitation and host availability, and the effect of parasitism on nestling mortality. Botfly parasitism was observed in 8 of the 21 passerine species for which nestling development could be followed. Prevalence for parasitized species was, on average, 15%, mainly affecting species in Thraupidae (21%), Mimidae (14%), and Tyrannidae (7%). Botfly parasitism occurred at the end of the breeding season in two of the four years studied, coinciding with increased late spring precipitations. Environmental conditions also favored greater host availability. Nestling mortality due to botfly parasitism was found in 10% of parasitized nests. Results indicate that the prevalence of botfly parasitism is relatively low in the central Monte, and it is positively related to wet conditions during late spring, mainly affecting avian species that breed later in the season. However, future global change scenarios could increase the negative effect of this parasite, particularly in host species of conservation concern.
Key words: Monte biome; Climatic conditions; Philornis; Parasite prevalence; Host use.
Recibido 14 diciembre 2019
Aceptado 12 abril 2020
Las interacciones entre parásitos y sus hospedadores constituyen una de las principales relaciones que tienen lugar entre especies distintas (Combes 2001). Los parásitos utilizan recursos de los hospedadores generando costos directos e indirectos en los individuos parasitados, por lo que pueden ejercer una presión selectiva importante en las poblaciones de estos hospedadores (Møller et al. 1990, Lehman 1993, Møller 1997, Ursino et al. 2019). El efecto de los parásitos en sus hospedadores depende de distintos factores relacionados con las poblaciones de parásitos, como su abundancia, modo de transmisión y virulencia, y las de sus hospedadores, como su disponibilidad, resistencia y defensa ante los parásitos (Combes 2001). Además, las condiciones ambientales pueden modular estos factores que inciden en la interacción parásito-hospedador (Merino y Møller 2010, Manzoli et al. 2011, Bulgarella et al. 2019).
Las moscas del género Philornis Meinert, 1890 (Diptera: Muscidae) forman un grupo de dípteros distribuidos por el Neotrópico que incluye parásitos de aves (Couri 1999, Dudaniec y Kleindorfer 2006). De las aproximadamente 50 especies descritas, unas 20 especies de estos múscidos presentan larvas que parasitan a los pichones de diversas especies de aves (Löwenber-Neto 2008). Los adultos de estas moscas son de vida libre y se alimentan de materia orgánica en descomposición, frutas y flores (Teixeira 1999), mientras que la mayor parte de las especies parásitas tienen larvas que se alimentan de sangre y fluidos corporales de sus hospedadores (Löwenber-Neto 2008). Las larvas penetran el integumento del hospedador y se establecen entre la dermis y la superficie de los músculos donde se desarrollan y crecen (Texeira 1999, Dudaniec y Kleindorfer 2006). El desarrollo de las larvas dentro del hospedador dura 4-8 días, tras los cuales abandonan al hospedador y pupan en la base del nido (Arendt 1985b, Young 1993). Tras un período de 1-3 semanas emergen los adultos de las pupas (Young 1993).
En este trabajo se analiza la presencia e incidencia de moscas parásitas en las especies de paseriformes que nidifican en una zona semiárida del Monte central de Argentina durante cuatro temporadas reproductivas con condiciones climáticas contrastadas. Se han descrito tres especies de moscas parásitas del género Philornis en el país, aunque estudios recientes utilizando datos moleculares indican que se trataría de un complejo de especies cuya taxonomía todavía tiene que resolverse (Quiroga et al. 2016). Por otra parte, se conocen diversas especies hospedadoras de estas moscas y la lista de especies, tanto de paseriformes como de no paseriformes, se ha incrementado en los últimos años (Löwenber-Neto 2008, Salvador y Bodrati 2013), así como la cuantificación de la prevalencia del parasitismo para distintas especies (Rabuffeti y Reboreda 2007, Antoniazzi et al. 2011, Quiroga et al. 2012, Manzoli et al. 2013). No obstante, la mayoría de los estudios sobre este tipo de parasitismo se han realizado en el centro y norte de Argentina, y no existe información sobre la prevalencia de estos parásitos y su variación estacional e interanual en ambientes semiáridos del Monte, cerca del límite de distribución de estas moscas. De hecho, la incidencia de este tipo de parasitismo es variable entre regiones y años. En general, los ambientes más cálidos y lluviosos, característicos del trópico y subtrópico, favorecen la prevalencia de este parásito (Arendt 2000, Antoniazzi et al. 2011), por lo que es esperable que la incidencia de estas moscas sea menor en las regiones áridas y semiáridas. Sin embargo, las amplias variaciones anuales de las condiciones climáticas, características de la región central del Monte (Ojeda et al. 1998), podrían incrementar la prevalencia del parasitismo en años más húmedos (Nores 1995, Antoniazzi et al. 2011).
Por otra parte, la prevalencia de los parásitos depende de la presencia y abundancia de hospedadores adecuados (Hudson et al. 2002), y las condiciones ambientales favorables durante los años húmedos pueden incrementar la disponibilidad de hospedadores debido a la mayor duración e intensidad de la reproducción (Mezquida y Marone 2003, Kleindorfer y Dudaniec 2009). De esta manera, ambos factores pueden explicar la incidencia de moscas parásitas en años más húmedos (Antoniazzi et al. 2011, Manzoli et al. 2013). La infestación por moscas generalmente tiene como consecuencia un efecto negativo sobre el crecimiento o la supervivencia de los pichones parasitados (Arendt 1985a, Young 1993, Rabuffeti y Reboreda 2007, Antoniazzi et al. 2011, Segura y Reboreda 2011). La mortalidad de los pichones por efecto del parasitismo por moscas aumenta cuando la intensidad del parasitismo es mayor (Rabuffeti y Reboreda 2007, Quiroga y Reboreda 2012). Por lo tanto, si la prevalencia e intensidad de este tipo de parasitismo es baja, es esperable que la mortalidad de los pichones debida a las larvas de mosca no sea una causa importante de fracaso reproductivo.
De acuerdo con lo anterior, los objetivos específicos de este estudio fueron: (1) cuantificar la prevalencia de parasitismo por moscas en las especies de paseriformes durante cuatro temporadas reproductivas, (2) analizar la variación estacional en la incidencia de estos parásitos, (3) evaluar si las precipitaciones y la disponibilidad de hospedadores durante la época reproductiva explican las variaciones anuales en la incidencia de moscas parásitas, y (4) estimar la mortalidad de los pichones parasitados por larvas de mosca.
MÉTODOS
El trabajo se realizó en la Reserva de la Biosfera de Ñacuñán (34°03’S, 67°54’O; 12 282 ha), situada en el departamento de Santa Rosa, provincia de Mendoza, a una latitud intermedia de la Provincia Fitogeográfica del Monte (Morello 1958, Ojeda et al. 1998). El estudio abarcó cuatro temporadas reproductivas (primavera- verano australes) entre septiembre de 1995 y enero de 1999. El hábitat predominante es un bosque abierto de Algarrobo (Prosopis flexuosa) con algunos árboles de Chañar (Geoffroea decorticans), numerosos arbustos, principalmente jarillas (Larrea divaricata y L. cuneifolia), Atamisque (Capparis atamisquea), Piquillín (Condalia microphylla), Zampa (Atriplex lampa) y varias especies de arbustos bajos (Lycium spp., Verbena spp.). El estrato herbáceo está compuesto principalmente por gramíneas de los géneros Pappophorum, Trichloris, Digitaria, Aristida y Sporobolus. El clima de Ñacuñán es árido-semiárido y está caracterizado por una marcada estacionalidad, con veranos cálidos y relativamente húmedos e inviernos fríos y secos, y una alta variación anual de las precipitaciones (rango = 193-533 mm, n = 27 años).
Las condiciones climáticas fueron muy variables durante los cuatro años de estudio (Fig. 1). Las precipitaciones estuvieron en torno a la media durante la temporada 1995-1996, aunque fueron muy bajas para el mes de diciembre. En 1996-1997, y particularmente en 1997-1998, las precipitaciones fueron muy abundantes en diciembre, y por encima de la media para noviembre en la temporada 1997-1998. Finalmente, en la temporada 1998-1999, noviembre y enero fueron relativamente húmedos, pero diciembre fue muy seco (Fig. 1; ver también Mezquida y Marone 2003).

Figura 1. Precipitaciones totales para los meses de primavera y comienzos del verano en la Reserva de Ñacuñán (datos de la estación meteorológica de la reserva). Los valores promedio para 27 años (barras negras) se presentan junto a los valores de los años de estudio: 1995-1996 (barras blancas), 1996-1997 (barras con rayado oblicuo), 1997-1998 (barras grises) y 1998-1999 (barras con rayado horizontal).
En cada temporada reproductiva se realizaron búsquedas de nidos durante la primavera y el verano. Los nidos se localizaron examinando la vegetación y observando el comportamiento de los adultos (Martin y Geupel 1993), para evitar encontrar únicamente los nidos más conspicuos. Los nidos con huevos o pichones se visitaron cada 1-3 días, hasta que el nido fracasó o los pichones abandonaron el nido. Para cada nido se anotó la fecha de eclosión del primer pichón, o se estimó por la apariencia y peso de los pichones, y la duración del periodo de permanencia de los pichones para cada especie (para más detalles ver Mezquida 2003, 2004, Mezquida y Marone 2001). Los nidos fracasados con pichones parasitados por moscas muertos en el nido, sin signos de depredación o abandono debido a condiciones meteorológicas adversas, fueron considerados como fracasados debido al parasitismo.
Cuando se observó un nido parasitado, todos los pichones presentaron larvas de mosca, por lo que se indican los datos de prevalencia a nivel de nido. La prevalencia del parasitismo se estimó para cada especie, familia, o conjunto de especies parasitadas. Para examinar la prevalencia de nidos parasitados a lo largo de la estación reproductiva, se transformó la fecha de eclosión del primer pichón al calendario juliano, considerando el 1 de octubre como el día 1, y teniendo en cuenta que 1996 fue un año bisiesto. Para visualizar gráficamente la prevalencia de parasitismo durante la estación reproductiva, se ajustó una regresión local no paramétrica utilizando la función loess en programa R versión 3.5.2 (R Core Development Team). Para poner a prueba si la prevalencia de parasitismo estuvo relacionada con las condiciones climáticas y la disponibilidad de hospedadores, se obtuvieron las precipitaciones medias para los meses de noviembre y diciembre, y el total para ambos meses a partir de los datos de la estación meteorológica de la reserva, y se cuantificó el número total de nidos con pichones para toda la temporada y los que tenían pichones a partir del día 1 de diciembre. Las precipitaciones de diciembre y las de noviembre-diciembre mostraron una alta correlación (r = 0.96, P = 0.038), lo mismo que los nidos con pichones a partir de diciembre y el total de nidos con pichones (r = 0.96, P = 0.042), por lo que se utilizaron las precipitaciones de diciembre y el total de nidos con pichones como variables explicativas. Como los valores de estas variables son los mismos para todos los nidos de una temporada, se agregó el número de nidos parasitados y no parasitados por moscas para cada temporada de estudio y se ajustó un modelo lineal generalizado con una distribución binomial de los errores y una función de vínculo logit (Crawley 2007). Al agrupar el número de nidos parasitados y no parasitados por moscas para cada temporada reproductiva, el número de temporadas de estudio (n = 4) no permitió estimar adecuadamente los parámetros de un modelo con las precipitaciones y el número de nidos como predictores en un mismo modelo debido al bajo número de grados de libertad (gl = 1). Por ello, se estimaron las variables que mejor explicaron la proporción de nidos parasitados ajustando modelos con una variable como predictor. El ajuste de los modelos se evaluó de acuerdo al índice de Akaike (AIC).
Debido a la dispersión de los datos, se realizó un ajuste quasi-binomial con la función glm al modelo de las precipitaciones de diciembre como variable explicativa. Para evitar el posible sesgo de incluir especies con pocos nidos muestreados, se repitieron los modelos para las especies con, al menos, tres nidos con pichones en cada temporada, aunque los patrones fueron similares (resultados no mostrados).
RESULTADOS
En 8 de las 21 especies de paseriformes en las que se pudo seguir el desarrollo de los pichones (n = 202 nidos), se observó parasitismo por larvas de mosca (Tabla 1). La prevalencia del parasitismo fue del 14.8% (n = 142) para las ocho especies de paseriformes que fueron parasitadas. El porcentaje de nidos parasitados tendió a ser mayor en Thraupidae (21%), algo menor en Mimidae (14%) y más bajo en Tyrannidae (7%) (Tabla 1). El parasitismo por larvas de mosca se observó en dos de las cuatro temporadas reproductivas estudiadas (1996-1997 y 1997-1998; Tabla 2), y los nidos con pichones parasitados aparecieron hacia el final de la estación reproductiva (rango = 22 de diciembre - 25 de enero; Fig. 2).
Tabla 1. Especies de paseriformes para las que se observaron nidos con pichones con presencia o no de parasitismo por larvas de Philornis sp., en la Reserva de Ñacuñán durante cuatro temporadas reproductivas. Para cada una se indica el número de nidos con pichones y el porcentaje de nidos parasitados.

Tabla 2. Prevalencia de parasitismo por larvas de Philornis sp., número de nidos parasitados, nidos con pichones de las especies parasitadas y nidos observados con pichones con presencia o no de parasitismo durante cuatro temporadas reproductivas en la Reserva de Ñacuñán.

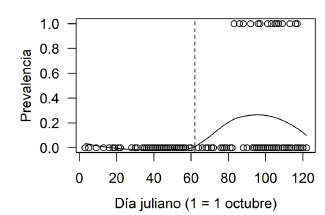
Figura 2. Prevalencia de nidos con pichones parasitados por larvas de mosca a lo largo de la estación reproductiva (expresada en días julianos), durante cuatro años consecutivos. La línea continua representa el ajuste a una regresión local no paramétrica (función loess). La línea vertical punteada indica el día 1 de diciembre (día Juliano = 61).
Las precipitaciones de diciembre se relacionaron positivamente con la proporción de nidos parasitados por larvas de mosca (Tabla 3, Fig. 3), y el modelo se ajustó mejor que el modelo para las precipitaciones de noviembre (AIC = 11.5 y 24.2, respectivamente). El número total de nidos con pichones también se asoció positivamente con la proporción de parasitismo por moscas (Tabla 3), aunque el modelo binomial para las precipitaciones (AIC = 11.5) mostró un ajuste mejor que el modelo para el número de nidos (AIC = 13.6).
Tabla 3. Coeficientes y errores estándar de los modelos lineales generalizados para la proporción de nidos infectados por larvas de moscas en función de a) las precipitaciones de diciembre y b) el número de nidos con pichones. Se muestran los valores de probabilidad para una variable respuesta de tipo binomial (Pb) y de tipo quasi-binomial (Pq) para ajustar la dispersión de los datos para el modelo con las precipitaciones de diciembre
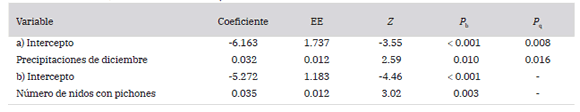
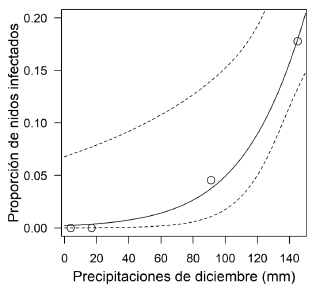
Figura 3. Proporción de nidos de paseriformes infectados con larvas de mosca en relación a las precipitaciones del mes de diciembre en la Reserva de Ñacuñán. La línea continua representa el ajuste de un modelo lineal generalizado binomial y las líneas discontinuas, el intervalo de confianza del 95%.
De los 21 nidos parasitados, 2 nidos (9.5%), uno de Piojito Trinador (Serpophaga griseicapilla) y otro de Monjita Coronada (Xolmis coronatus), fracasaron por muerte de los pichones debido a las larvas de mosca. Para el total de nidos con pichones observados de las especies de aves parasitadas (n = 142), esta causa de mortalidad representó el 1.4%.
DISCUSIÓN
El parasitismo por moscas del género Philornis ha sido documentado en diversas especies de aves neotropicales (e.g., Arendt 1985a, Young 1993, Bulgarella y Heimpel 2015, Nuñez-Rosas et al. 2018). En Argentina, en particular, también se han descrito numerosas especies como hospedadores de estas moscas (e.g., Nores 1995, Antoniazzi et al. 2011, Quiroga et al. 2012, Salvador y Bodrati 2013). En este estudio se observó parasitismo en ocho especies de paseriformes, de un total de 21 en las que se pudo seguir el desarrollo de los pichones, en una zona semiárida del Monte central, aunque la prevalencia fue muy variable entre años. El porcentaje de nidos parasitados para las ocho especies varió entre 3 y 33% (15% para todas las especies), prevalencia similar o, en general, más baja que la reportada en otras localidades (e.g., Arendt 1985a, Mason 1985, Nores 1995, Rabuffetti y Reboreda 2007, Antoniazzi et al. 2011, Segura y Reboreda 2011).
Las distintas tasas de parasitismo de las especies de aves estudiadas pueden deberse a variaciones en su respuesta inmune (Manzoli et al. 2011), o a diferentes características de su historia natural que pueden influir en la susceptibilidad de las aves al parásito, entre las que se incluyen el tamaño corporal, el tipo de nido y el uso en años consecutivos del mismo material del nido o cavidad (Kleindorfer y Dudaniec 2009, Quiroga et al. 2012). Sin embargo, en Ñacuñán las distintas tasas de parasitismo entre especies podrían deberse principalmente a la fenología reproductiva y, por lo tanto, al número de pichones disponibles cuando las hembras de mosca depositan los huevos. La presencia de moscas parásitas en Ñacuñán se observó a finales de la primavera y comienzos del verano, y muchas de las especies no parasitadas se reproducen antes. Por ejemplo, las especies de Furnariidae tienden a reproducirse más temprano (Mezquida 2001a), aunque los nidos cerrados de algunas especies dificultan el seguimiento de los pichones, por lo que la prevalencia podría ser mayor (Mason 1985, Nores 1995). El Gallito Copetón (Rhinocrypta lanceolata) inicia la puesta desde principios de primavera (Mezquida 2001b) y no se observaron pichones parasitados, mientras que algunas especies de Tyrannidae tienden a reproducirse al comienzo de la primavera (Mezquida 2002) pero únicamente se observaron pichones parasitados en los nidos más tardíos. Finalmente, las especies parasitadas de Thraupidae se reproducen más tarde en la temporada o continuaron reproduciéndose durante el verano en los años en los que se observó parasitismo por moscas (Mezquida 2003, Mezquida y Marone 2003).
La prevalencia del parasitismo por moscas en Ñacuñán aumentó a lo largo de la estación reproductiva, como en otros estudios (Arendt 2000, Rabuffetti y Reboreda 2007, Quiroga et al. 2012), tendiendo a disminuir al final de la temporada, aunque el parasitismo de los pichones se inició en torno a dos meses antes en otras localidades de Argentina (Rabuffetti y Reboreda 2007, Antoniazzi et al. 2011, Manzoli et al. 2013). Por lo tanto, la prevalencia observada en Ñacuñán podría estar relacionada con una abundancia relativamente baja de hospedadores cuando las hembras de moscas ponen los huevos (Hudson et al. 2002, Dudaniec et al. 2007, Kleindorfer y Dudaniec 2009). De hecho, el número de nidos con pichones estuvo positivamente relacionado con la prevalencia de parasitismo. El otro factor que se asoció positivamente con la incidencia de parasitismo fue la precipitación durante el mes de diciembre. Ambos factores tienden a estar correlacionados, ya que en años con mayores precipitaciones se incrementa la duración e intensidad de la reproducción en las aves hospedadoras (Kleindorfer y Dudaniec 2009, Antoniazzi et al. 2011). En Ñacuñán se observaron nidos parasitados en los dos años con precipitaciones en diciembre muy por encima de la media (especialmente en 1997-1998). La actividad reproductiva también fue mayor durante esas temporadas y algunas especies, como la Monterita Canela (Poospiza ornata), nidificaron durante el verano debido a las condiciones ambientales favorables (Mezquida y Marone 2003), incrementando la disponibilidad de hospedadores para las moscas parásitas. Los datos para Ñacuñán no permitieron evaluar de forma conjunta ambos factores, pero el modelo para las precipitaciones se ajustó mejor que el de la abundancia de hospedadores. En otros estudios no se encontró una relación entre el número de nidos con pichones y la prevalencia del parasitismo (Rabuffetti y Reboreda 2007), o la precipitación durante la estación reproductiva explicó mejor la incidencia del parásito que la disponibilidad de hospedadores (Antoniazzi et al. 2011, Manzoli et al. 2013).
Por lo tanto, las precipitaciones de finales de la primavera parecen favorecer las condiciones para una mayor incidencia de moscas parásitas en Ñacuñán. De hecho, las condiciones climáticas (e.g., humedad, temperatura y precipitaciones) explican las variaciones en la abundancia de otros grupos de moscas parásitas (Heeb et al. 2000, Martínez de la Puente et al. 2010) y no parásitas (Goulson et al. 2005). En las zonas áridas y semiáridas, la cantidad y el régimen de precipitaciones es un buen predictor de la productividad primaria y secundaria (Noy-Meir 1973, Le Houérou et al. 1988). En la zona central del Monte, los años con abundantes precipitaciones a finales de la primavera favorecen la presencia de moscas parásitas, y la mayor disponibilidad de hospedadores podría permitir el rápido crecimiento de sus poblaciones (ver también Nores 1995, Arendt 2000, Dudaniec et al. 2007). Sin embargo, durante los años con condiciones climáticas promedio o más secos, la incidencia de este parásito parece ser anecdótica, mientras que en regiones con mayores precipitaciones anuales la incidencia suele ser mayor, a pesar de las fluctuaciones entre años (Nores 1995, Arendt 2000, Rabuffetti y Reboreda 2007, Manzoli et al. 2013, Domínguez et al. 2015).
La mortalidad de los pichones por causa de este tipo de parasitismo fue muy baja en Ñacuñán, por lo que contribuyó débilmente a la mortalidad total de los nidos durante la fase de pichones (Mezquida y Marone 2001). Sin embargo, en otros estudios con una prevalencia de parasitismo mayor, ésta fue una importante causa de mortalidad de los nidos (Arendt 1985b, Nores 1995, Rabuffetti y Reboreda 2007, Antoniazzi et al. 2011). En Ñacuñán, el principal factor de mortalidad de los nidos fue la depredación (Mezquida y Marone 2001), mientras que la mortalidad causada por las moscas parásitas parece ser relativa mente baja y variable entre años, por lo que su efecto en el éxito reproductivo fue menor. En cualquier caso, se desconoce cómo influye este tipo de parasitismo en la supervivencia de los pichones que abandonan el nido (Arendt 2000, Fessl et al. 2018), por lo que el efecto negativo de los parásitos podría ser mayor al observado, particularmente en años excepcionalmente húmedos.
En conclusión, la prevalencia del parasitismo por moscas fue relativamente baja en las especies de paseriformes que nidifican en el Monte central. Sin embargo, los años húmedos, con abundantes precipitaciones al final de la primavera, mostraron una mayor incidencia de estos parásitos y mayor disponibilidad de hospedadores, lo que, a su vez, podría facilitar el rápido crecimiento de las poblaciones de estas moscas. A pesar de las grandes fluctuaciones interanuales de las precipitaciones en esta región del Monte, la tendencia de los últimos 50 años y las predicciones de escenarios futuros indican un incremento de las precipitaciones durante la estación húmeda (Maenza et al. 2017). De esta manera, el cambio climático en esta región podría incrementar la prevalencia e intensidad del parasitismo, por lo que el impacto de los parásitos en el éxito reproductivo de las aves paseriformes podría ser mayor (Manzoli et al. 2011). Además, los cambios ambientales derivados de la actividad humana también pueden incidir en la distribución espacial y abundancia de las poblaciones de aves hospedadoras y, como consecuencia, en el impacto de los parásitos (Manzoli et al. 2011, Bulgarella et al. 2019). Por lo tanto, distintos componentes del cambio global, y sus posibles interacciones, podrían incrementar el efecto negativo de estas moscas parásitas, especialmente en poblaciones de aves hospedadoras poco abundantes o con problemas de conservación (Manzoli et al. 2011, Domínguez et al. 2015, Bulgarella et al. 2019).
AGRADECIMIENTOS
L. Marone, J. Lopez de Casenave, V. R. Cueto y F. Milesi contribuyeron con su ayuda, sugerencias y compañía durante distintos periodos del trabajo de campo. Agradezco los comentarios y sugerencias de dos revisores anónimos que mejoraron la versión final del manuscrito. El trabajo de campo fue parcialmente financiado por Sigma Xi, The Scientific Research Honor Society.
BIBLIOGRAFÍA
1. Antoniazzi L, Manzoli D, Rohrmann D, Saravia M, Silvestri L y Beldomenico P (2011) Climate variability affects the impact of parasitic flies on Argentinean forest birds. Journal of Zoology 283:126–134
2. Arendt WJ (1985a) Philornis ectoparasitism of pearly– eyed thrashers. I. Impact on growth and development of nestlings. Auk 102:270–280
3. Arendt WJ (1985b) Philornis ectoparasitism of Pearly– eyed Thrashers. II. Effects on adults and reproduction. Auk 102:281–292
4. Arendt WJ (2000) Impact of nest predators, competitors, and ectoparasites on Pearly–eyed Thrashers, with comments on the potential implications for Puerto Rican Parrot recovery. Ornitologia Neotropical 11:13–63
5. Bulgarella M y Heimpel GE (2015) Host range and community structure of avian nest parasites in the genus Philornis (Diptera: Muscidae) on the island of Trinidad. Ecology and Evolution 5:3695–3703
6. Bulgarella M, Quiroga MA y Heimpel GE (2019) Additive negative effects of Philornis nest parasitism on small and declining Neotropical bird populations. Bird Conservation International 29:339–360
7. Combes C (2001) Parasitism: the ecology and evolution of intimate interactions. University of Chicago Press, Chicago [ Links ]
8. Couri MS (1999) Myiasis caused by obligatory parasites. Ia. Philornis Meinert (Muscidae). Pp. 44–70 en: Guimaraes J y Papavero N (eds) Myiasis in man and animals in the Neotropical region. Editora Pleiade, Sao Paulo
9. Crawley MJ (2007) The R Book. John Wiley & Sons, West Sussex [ Links ]
10. Dominguez M, Reboreda JC y Mahler B (2015) Impact of Shiny Cowbird and botfly parasitism on the reproductive success of the globally endangered Yellow Cardinal Gubernatrix cristata. Bird Conservation International 25:294–305
11. Dudaniec RY y Kleindorfer S (2006) Effects of the parasitic flies of the genus Philornis (Diptera: Muscidae) on birds. Emu 106:13–20
12. Dudaniec RY, Fess l B y Kleindorfer S (2007) Interannual and interspecific variation in intensity of the parasitic fly, Philornis downsi, in Darwin’s finches. Biological Conservation 139:325–332
13. Fess l B, Heimpel GE y Causton CE (2018) Invasion of an avian nest parasite, Philornis downsi, to the Galapagos Islands: colonization history, adaptations to novel ecosystems, and conservation challenges. Pp. 213–266 en: Parker PG (ed) Disease ecology. Social and ecological interactions in the Galapagos Islands. Springer, Switzerland
14. Goulson D, Derwent LC , Hanley ME, Dunn DW y Abolins SR (2005) Predicting calyptrate fly populations from the weather, and probable consequences of climate change. Journal of Applied Ecology 42:795–804
15. Heeb P, Kölliker M y Richner H (2000) Bird–ectoparasite interactions, nest humidity, and ectoparasite community structure. Ecology 81:958–968
16. Hudson P, Rizzoli A, Grenfell B, Heesterbeek H y Dobson A (2002) The ecology of wildlife diseases. Oxford University Press, Oxford [ Links ]
17. Kleindorfer S y Dudaniec RY (2009) Love thy neighbour? Social nesting pattern, host mass and nest size affect ectoparasite intensity in Darwin’s tree finches. Behavioral Ecology and Sociobiology 63:731–739
18. Le Houérou H, Bingham R y Skerbek W (1988) Relationship between the variability of primary production and the variability of annual precipitation in world arid lands. Journal of Arid Environments 15:1–18
19. Lehmann T (1993) Ectoparasites: direct impact on host fitness. Parasitology Today 9:8–13
20. Löwenberg–Neto P (2008) The structure of the parasite– host interactions between Philornis (Diptera: Muscidae) and neotropical birds. Journal of Tropical Ecology 24:575–580
21. Maenza RA , Agosta EA y Bettolli ML (2017) Climate change and precipitation variability over the western ‘Pampas’ in Argentina. International Journal of Climatology 37:445–463
22. Manzoli DE, Antoniazzi LR y Beldomenico PM (2011) Cambio ambiental global, parásitos y la salud de sus hospedadores: las moscas parásitas del género Philornis en pichones de aves. Hornero 26:45–53
23. Manzoli DE, Antoniazzi LR, Saravia MJ, Silvestri L, Rorhmann D y Beldomenico PM (2013) Multi–level determinants of parasitic fly infection in forest passerines. PloS One 8:e67104
24. Martin TE y Geupel GR (1993) Nest–monitoring plots: Methods for locating nests and monitoring success. Journal of Field Ornithology 64:507–519
25. Martínez de la Puente J, Merino S, Lobato E, Rivero de Aguilar J, del Cerro S, Ruiz de Castañeda R y Moreno J (2010) Nest–climatic factors affect the abundance of biting flies and their effects on nestling condition. Acta Oecologica 36:543–547
26. Mason P (1985) The nesting biology of some passerines of Buenos Aires, Argentina. Ornithological Monographs 36:954–972
27. Merino S y Møller AP (2010) Host–parasite interactions and climate change. Pp. 213–226 en: Møller AP, Fiedler W y Berthold P (eds) Effects of climate change on birds. Oxford University Press, New York
28. Mezquida ET (2001a) La reproducción de algunas especies de Dendrocolaptidae y Furnariidae en el desierto del Monte central, Argentina. Hornero 16:23–30
29. Mezquida ET (2001b) Aspects of the breeding biology of the Crested Gallito. Wilson Bulletin 113:104–109
30. Mezquida ET (2002) Nidificación de ocho especies de Tyrannidae en la Reserva de Ñacuñán, Mendoza, Argentina. Hornero 17:31–40
31. Mezquida ET (2003) La reproducción de cinco especies de Emberizidae y Fringillidae en la Reserva de Ñacuñán, Argentina. Hornero 18:13–20
32. Mezquida ET (2004) Nest site selection and nesting success of five species of passerines in a South American open Prosopis woodland. Journal of Ornithology 145:16–22
33. Mezquida ET y Marone L (2001) Factors affecting nesting success of a bird assembly in the central Monte Desert, Argentina. Journal of Avian Biology 32:287–296
34. Mezquida ET y Marone L (2003) Comparison of the reproductive biology of two Poospiza warbling– finches of Argentina in wet and dry years. Ardea 91:251–262
35. Møller AP (1997) Parasites and the evolution of host life history. Pp. 105–127 en: Clayton D y Moore J (eds) Host–parasite evolution: general principles and avian models. Oxford University Press, Oxford
36. Møller AP, Allander K y Dufva R (1990) Fitness effects of parasites on passerine birds: a review. Pp. 269–280 en: Blondel J, Gosler A, Lebreton JD y Mc- Cleery R (eds) Population biology of passerine birds. Springer, Berlin
37. Morello JH (1958) La provincia fitogeográfica del Monte. Opera Lilloana 2:1–155
38. Nores AI (1995) Botfly ectoparasitism of the Brown Cacholote and the Firewood–gatherer. Wilson Bulletin 107:734–738
39. Noy–Meir I (1973) Desert ecosystems: environment and producers. Annual Review of Ecology and Systematics 4:25–51
40. Nuñez–Rosas LE, Ramírez–García E, Lara C y Arizmendi M (2018) Observación del parasitismo por moscas (Philornis bellus) en tres especies de colibríes del Occidente de México. Revista Mexicana de Biodiversidad 89:847–853
41. Ojeda RA , Campos CM, Gonnet JM, Borghi CE y Roig VG (1998) The MaB Reserve of Ñacuñán, Argentina: its role in understanding the Monte Desert biome. Journal of Arid Environments 39:299–313
42. Quiroga MA y Reboreda JC (2012) Lethal and sublethal effects of botfly (Philornis seguyi) parasitism on house wren nestlings. Condor 114:197–202
43. Quiroga MA, Reboreda JC y Beltzer AH (2012) Host use by Philornis sp. in a passerine community in central Argentina. Revista Mexicana de Biodiversidad 83:110–116
44. Quiroga MA, Monje LD, Arrabal JP y Beldomenico PM (2016) New molecular data on subcutaneous Philornis (Diptera: Muscidae) from southern South America suggests the existence of a species complex. Revista Mexicana de Biodiversidad 87:1383–1386
45. Rabuffetti FL y Reboreda JC (2007) Early infestation by bot flies (Philornis seguyi) decreases chick survival and nesting success in chalk–browed mockingbirds (Mimus saturninus). Auk 124:898–906
46. Salvador S y Bodrati A (2013) Aves víctimas del parasitismo de moscas del género Philornis en Argentina. Nuestras Aves 58:16–21
47. Segura LN y Reboreda JC (2011) Botfly parasitism effects on nestling growth and mortality of Red– crested Cardinals. Wilson Journal of Ornithology 123:107–115
48. Teixeira D (1999) Myiasis caused by obligatory parasites. Ib. General observations on the biology of species of the genus Philornis Meinert, 1890 (Diptera, Muscidae). Pp. 51–70 en: Guimaraes J y Papavero N (eds) Myiasis in man and animals in the Neotropical region. Editora Pleiade, Sao Paulo
49. Ursino CA , De Mársico MC y Reboreda JC (2019) Brood parasitic nestlings benefit from unusual host defenses against botfly larvae (Philornis spp.). Behavioral Ecology and Sociobiology 73:146 [ Links ]
50. Young BE (1993) Effects of the parasitic botfly Philornis carinatus on nestling house wrens, Troglodytes aedon, in Costa Rica. Oecologia 93:256–262














