Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
El hornero
versão impressa ISSN 0073-3407versão On-line ISSN 1850-4884
Hornero vol.35 no.1 Ciudad Autónoma de Buenos Aires ago. 2020
ARTÍCULO
Efecto de la alteración del hábitat en la comunidad de aves de la localidad balnearia de Cariló, Argentina
Laura M. Haag*, Adrián Jauregui, Exequiel Gonzalez, Martín A. Colombo y Luciano N. Segura
División Zoología Vertebrados, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata. Paseo del Bosque S/N, B1904CCA La Plata, Buenos Aires, Argentina.
Resumen
Los procesos de urbanización alteran los hábitats naturales y las aves responden de manera diferente según el grado de disturbio en el ambiente. En este estudio analizamos el efecto de la alteración del hábitat en la diversidad y equidad de la comunidad de aves de Cariló, provincia de Buenos Aires, Argentina. Como muchas localidades balnearias de la costa marítima de Buenos Aires, en Cariló se han reemplazado casi por completo los hábitats naturales forestando las dunas con varias especies de pinos. Se realizaron conteo de aves estacionalmente en transectas ubicadas en relictos de ambientes naturales periféricos a Cariló y en zonas urbanas con distinto grado de alteración. En el ambiente natural los índices de diversidad y equidad fueron mayores en relación a los ambientes alterados y, dentro de este ambiente reemplazado por pinos, la diversidad de aves fue menor en los ambientes con menor grado de disturbio. Atribuimos este último resultado a que los sectores más urbanizados y céntricos, con más edificaciones y tránsito de personas y vehículos, son los que cuentan con más áreas de parques y jardines ornamentados, permitiendo una mayor heterogeneidad del paisaje que favorecería a las aves. Frente a este escenario de reemplazo de hábitat natural por plantaciones de pinos, destacamos los esfuerzos de los habitantes y gobernantes de Cariló por mantener extensas superficies parquizadas. No obstante, nuestros resultados indican un efecto negativo de este reemplazo, por lo que recomendamos a las autoridades contar con diseños estratégicos de urbanización que no perjudiquen la compleja estructura de los ecosistemas naturales ni de las aves que los habitan.
Palabras clave: Diversidad de aves; Ecorregión Pampeana; Ensamble de aves; Reemplazo del hábitat; Urbanización.
Abstract
Effect of habitat alteration in the bird community of Cariló seaside locality, Argentina.
Urbanization processes alter natural habitats and birds respond differently depending on the degree of disturbance in the environment. In this contribution we analyze the effect of habitat alteration on the diversity and evenness of bird communities in Cariló, Buenos Aires province, Argentina. Like many seaside localities on the sea coast of Buenos Aires, natural habitats of Cariló have been almost completely replaced by the replacement of natural habitats of dunes with several species of pine trees. We counted birds seasonally in transect located in relics of peripherical natural environments of Cariló and in urban areas with different degrees of alteration. We found out that in the natural environment the diversity and evenness indexes were higher in relation to the altered environments and that, within this environment replaced by pine trees, the diversity of birds was lower in the environments with less disturbance. We attribute this last result to the largest area of parks and ornate gardens that characterize the downtown area of the city, that allows a greater environment heterogeneity that would be favoring birds. Faced with this scenario of replacement of natural habitat with pine plantations, we highlight the local inhabitants’ efforts to maintain extensive large area of parks and ornate gardens. However, our results show a negative effect of this habitat replacement; therefore, we recommend the authorities to come up with strategic urbanization designs that do not harm the complex structure of natural ecosystems and the birds that inhabit them.
Key words: Bird diversity; Pampean ecoregion; Bird assembly; Habitat replacement; Urbanization.
Recibido 22 noviembre 2019
Aceptado 27 abril 2020
La estructura de la comunidad de aves de un sitio determinado brinda información sobre los diversos procesos en relación al ambiente donde viven, dado que las distintas especies muestran respuestas diferentes a las características del hábitat (Hall et al. 1997, González-Oreja 2003). Algunas de las principales características del hábitat que explican la distribución y abundancia de aves son la estructura y fisonomía de la vegetación y la heterogeneidad ambiental (Fandiño et al. 2010). Además, los ensambles de aves pueden variar en un mismo hábitat a lo largo del año debido a los recursos tróficos disponibles (H-Acevedo y Currie 2003) y a la presencia o ausencia de especies migratorias (García y Gómez-Laich 2007, Palacio y Montalti 2013). En este contexto, los estudios sobre comunidades de aves en relación al hábitat y su variación temporal nos permiten comprender mejor qué elementos son importantes para las distintas especies y los efectos que podrían provocar las alteraciones antrópicas en los ambientes naturales.
Los procesos de urbanización alteran los hábitats pre-existentes de varias maneras, incluyendo la modificación del terreno para la construcción de caminos y edificaciones, y el reemplazo de vegetación nativa por exótica (Kühn y Klotz 2006). Con respecto a la avifauna, se ha reportado que los bosques nativos suelen mostrar mayor riqueza y diversidad que los bosques con alteraciones antrópicas (Marzluff 2001, Faggi et al. 2010, Newbold et al. 2015), aunque según algunos estudios la diversidad y equidad pueden ser similares (Fandiño et al. 2010). Si bien la urbanización puede crear nuevos hábitats que son aprovechados por algunas especies de aves, la evidencia sugiere que normalmente la diversidad decrece con respecto a ambientes no urbanizados (Shochat et al. 2010, Newbold et al. 2015). Uno de los principales efectos de la urbanización es la homogeneización del hábitat, que conlleva a un reemplazo de especies especialistas o endémicas por otras generalistas o de distribución más global (Morelli et al. 2016). Asimismo, el incremento poblacional de las pocas especies que logran adaptarse a la urbanización termina generando homogeneización a nivel específico (Moffatt et al. 2004, McKinney 2006, Kark et al. 2007).
En algunos casos, la diversidad de aves puede verse favorecida por las prácticas antrópicas de ciertas zonas levemente urbanizadas, como plantaciones de diversas especies vegetales y la creación de cursos de agua artificiales (Clergeau et al. 2001). Aunque en los gradientes de urbanización, la diversidad, abundancia y riqueza específica de aves suele ser mayor cuando menos urbanizada es un área (Blair 1996), es posible que un nivel intermedio de urbanización (es decir, que mantenga la heterogeneidad del hábitat), llegue a albergar una alta diversidad comparado con niveles más altos o más bajos de urbanización (Morelli et al. 2016).
En la costa marítima de la provincia de Buenos Aires, Argentina, la vegetación nativa comprende en su mayor parte pastizales que han sido reemplazados en diversos puntos tras el establecimiento de localidades balnearias (Dadon 2002, Faggi et al. 2010). El reemplazo de estos pastizales, que albergan especies que dependen casi exclusivamente de él para su supervivencia, representa un empobrecimiento general tanto en la riqueza como en la diversidad de aves (Faggi et al. 2010, Pretelli et al. 2016). En este trabajo caracterizamos el ensamble de aves de la localidad de Cariló (Buenos Aires, Argentina), un ambiente fuertemente intervenido debido al reemplazo del hábitat nativo por plantaciones de pinos. Específicamente, debido a que en esta localidad coexisten áreas con diferente grado de urbanización (con claro predominio de zonas fuertemente alteradas y zonas periféricas con relictos de ambientes naturales, ver Segura et al. 2017), evaluamos las diferencias en la diversidad y equidad dentro del ensamble de aves en relación a las características físicas del hábitat y del momento del año.
MÉTODOS
Área de estudio
El estudio se llevó a cabo en la localidad de Cariló, ubicada al este de la provincia de Buenos Aires, Argentina, en el partido de Pinamar (37°10’S, 56°54’O; Fig. 1). Cariló es una pequeña localidad con una superficie de 1700 ha, en donde más del 80% está representado por plantaciones de pino y aproximadamente 600 ha (35%) están urbanizadas. Cuenta con una población estable de ~1500 habitantes, pero por tratarse de una reconocida localidad balnearia de la costa bonaerense, en el verano el número de visitantes crece. La temperatura media anual es de 14.6 ºC y los valores máximos absolutos superan los 38 ºC en verano y los mínimos llegan a los 5 ºC en invierno. Tiene una escasa amplitud térmica diaria y anual (como consecuencia del efecto moderador del océano) y el promedio de precipitaciones es aproximadamente de 885 mm anuales (datos del Servicio Meteorológico Nacional Argentino; SMN 2020).

Figura 1: Localización del área de estudio en la localidad de Cariló, partido de Pinamar, Buenos Aires. Se detalla la ubicación de las transectas en sectores urbanizados (hábitat alterado, transectas 1 a 6) y en ambientes naturales de dunas, lagunas y cortaderales (hábitat natural, transectas 7 y 8). A su vez, las transectas 1 y 2 representan los sectores céntricos con mayor disturbio y urbanización (‘centro’), las transectas 3 y 4 representan sectores residenciales cerca de un campo de golf (‘golf’) y las transectas 5 y 6 representan sectores periféricos con poco disturbio y urbanización (‘borde’).
El área de estudios se localiza en la porción costera de la región pampeana (Brown et al. 2006), por lo que el paisaje natural original se caracterizaba por una transición de pastizales dominados por Piptochaetium montevidense, Stipa neesiana y Bothiochloa lagurioides (entre otras especies de gramíneas), hacia ambientes como el sistema de dunas con pastizales psamófilos (ver más detalles en Dadon y Matteucci 2002, Athor y Celsi 2016, Segura et al. 2017). En las áreas con mayor humedad o inundables podemos observar cortaderales (Cortaderia selloana), juncales y totorales (Typha latifolia, Juncus tenuis, Eleocharis macrostachya, Schoenoplectus acutus y Schoenoplectus californicus). Sin embargo, debido a las actividades agrícolas- ganaderas, a la forestación a inicios del siglo XX con el objetivo de fijar las dunas, y a la consecuente urbanización, el paisaje actual se transformó en un “mosaico” de ecosistemas naturales y modificados. El bosque implantado es una de las características más sobresalientes del área de estudio. Este se compone en su mayoría por especies exóticas introducidas de gran tamaño, como: el Pino Marítimo (Pinus pinaster), el Pino Insigne o de California (Pinus radiata), el Pino Piñonero (Pinus pinea) y, en menor proporción, el Pino de Alepo (Pinus halepensis). También están presentes cipreses (Cupresus sp.), álamos (Populus sp.), eucalyptus (Eucalyptus sp.), el Abedul (Betula pendula) y el Sauce Criollo (Salix humboldtiana). La fisonomía urbana del lugar se caracteriza por construcciones bajas y espaciadas, calles angostas y sin pavimentar, amplios jardines y parques con especies vegetales exóticas de tipo ornamental (ver más detalles en Segura et al. 2017).
Muestreo de las aves
Llevamos a cabo muestreos de aves entre los meses de julio de 2016 y junio de 2017. Para ello se establecieron ocho transectas de 450 m de longitud cada una, seis de ellas ubicadas dentro de la zona urbanizada (de ahora en adelante ‘hábitat alterado’) y dos en la periferia representando ambientes naturales de dunas, lagunas y cortaderales (de ahora en adelante ‘hábitat natural’) (Fig. 1). Las transectas en el hábitat alterado se dispusieron del siguiente modo: a) dos transectas en sectores con alta densidad de residencias particulares, hoteles, posadas y complejos turísticos, con abundante circulación de vehículos y personas, en donde es frecuente observar grandes parques (~2500 m2) y abundante vegetación ornamental que acompaña a los jardines (de ahora en adelante ‘centro’); b) dos transectas en sectores con alta densidad de residencias particulares con jardines de tamaño intermedio (~1200 m2), abundante vegetación ornamental y en las inmediaciones de un gran área abierta donde funciona un campo de golf (Cariló Golf Club, de ahora en adelante ‘golf’); y c) dos transectas en sectores periféricos con baja densidad de residencias particulares, en contacto directo con un sector de pinar aún sin urbanizar y jardines con poco desarrollo de vegetación ornamental (de ahora en adelante ‘borde’) (Fig. 1).
Entre dos y tres observadores entrenados recorrieron lentamente (aproximadamente a 20 m/min) las líneas transectas durante las mañanas (primeras tres horas desde el amanecer) y las tardes (últimas tres horas antes del atardecer), en orden inverso cada día. Las transectas se recorrieron dos veces por cada estación del año: otoño (abril-mayo), invierno (julio- agosto), primavera (octubre-noviembre) y verano (enero-febrero) y estuvieron separadas en todos los casos por al menos 400 m unas de otras. Las visitas se realizaron siempre en ausencia de lluvia y con vientos menores a 25 km/h. Se registró en una única planilla la especie de ave vista u oída y el número de individuos, hasta una distancia de 200 m perpendicular a la línea transecta. Las especies se categorizaron según su estatus de residencia siguiendo a Soave et al. (1999) y según su estatus de conservación siguiendo a MAyDS y AA (2017).
Análisis de datos
Calculamos el índice de diversidad de Shannon (‘H’, de ahora en adelante ‘diversidad) como: H´= - Σ pi ln (pi), en donde ‘pi’ es la proporción de la i-esima especie en el total de individuos de la muestra. Por otro lado, calculamos el índice de equidad de Pielou (‘E’, de ahora en adelante ‘equidad’) como: E´= H’/H’max, donde H’max = ln (S), y S = número de especies (o riqueza). Debido a que la variable ‘riqueza’ estuvo correlacionada tanto con ‘diversidad’ como con ‘equidad’, solo usamos diversidad y equidad en los análisis que describimos a continuación. Para evaluar el efecto del tipo de ambiente y la estación del año sobre el ensamble de aves, analizamos los datos utilizando modelos lineales generalizados mixtos (GLMM; R Core Team 2019), en donde ‘diversidad’ y ‘equidad’ fueron incluidas como variables dependientes; ‘estación’ del año y ‘tipo de hábitat’ (natural/alterado) fueron incluidas como variables independientes y la ‘transecta’ y ‘visitas’ como variables aleatorias. En adición, incluimos en los modelos la interacción entre ‘estación del año’ y ‘tipo de hábitat’. En un segundo paso, evaluamos si dentro del ambiente alterado las características físicas del hábitat y grado de disturbio (considerando en orden creciente de disturbio: borde>golf>centro) tuvieron efecto sobre las características del ensamble de aves. En este caso, el GLMM incluyó ‘diversidad’ y ‘equidad’ como variables dependientes; el ‘tipo de pinar’ (centro/golf/ borde) como variable independiente; y la ‘transecta’ y ‘visitas’ fueron incluidas como variables aleatorias. Para ambos GLMM, asumimos una estructura de error Gaussiana y función de enlace logarítmica (R Core Team 2019).
RESULTADOS
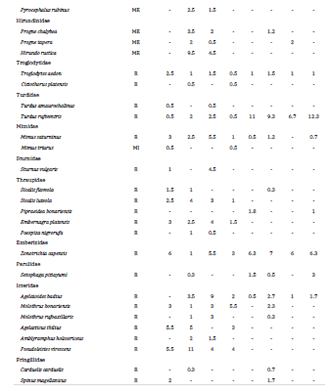
La riqueza de aves en el sitio de estudio a lo largo de un año fue de 75 especies (45 en invierno, 58 en primavera, 49 en verano y 40 en otoño; Tabla 1), que corresponden a 30 familias distribuidas en 16 órdenes. Contabilizamos un total de 3818 individuos (872 en invierno, 982 en primavera, 975 en verano y 989 en otoño). Registramos solo tres especies exóticas: la Paloma Doméstica (Columba livia), el Cardelino (Carduelis carduelis) y el Estornino Pinto (Sturnus vulgaris) y ninguna de ellas fue particularmente abundante (Tabla 1). Sesenta y ocho de las especies registradas fueron residentes permanentes, cinco visitantes estivales (Suirirí Real Tyrannus melancholicus, Tijereta Tyrannus savana, Churrinche Pyrocephalus rubinus, Golondrina Parda Progne tapera y Golondrina Doméstica Progne chalybea) y dos visitantes invernales (Sobrepuesto Lessonia rufa y Calandria Real Mimus triurus). En ninguno de los hábitats muestreados observamos especies categorizadas como amenazadas o en peligro de extinción y solo tres de las especies registradas se encuentran categorizadas como vulnerables: Gaviota Cangrejera (Larus atlanticus) en el hábitat alterado y Gavilán Planeador (Circus buffoni) y Federal (Amblyramphus holosericeus) en el hábitat natural.
Tabla 1: Número de individuos por especie registrados a lo largo del año (Inv: invierno, Pri: primavera, Ver: verano, Oto: otoño) durante los muestreos en hábitats naturales y alterados de la localidad de Cariló, provincia de Buenos Aires, entre julio de 2016 y junio de 2017. El valor presentado corresponde al promedio de individuos registrados en la repetición de los muestreos en las transectas (dos en hábitat natural y seis en el hábitat alterado). Se indica para cada especie el estatus de residencia (R: residente permanente, MI: migrante invernal, ME: migrante estival).


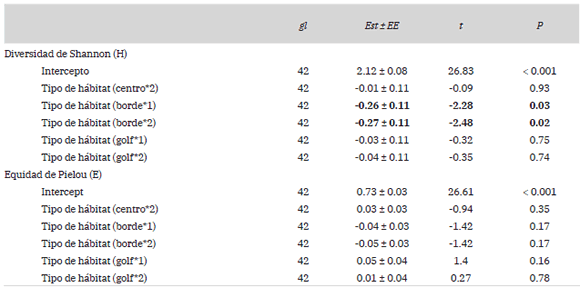
La diversidad para el sitio de estudio fue de 2.8, mientras que la equidad fue de 0.7. No observamos variación en diversidad en relación a la estación del año, aunque sí según el tipo de hábitat (Tabla 2), con tendencia a una mayor diversidad en los ambientes naturales como cortaderales, lagunas y pajonales (ambiente natural: 3.6; ambiente alterado: 2.5). Sin embargo, la interacción entre estación del año y tipo de hábitat mostró que en otoño hubo menor diversidad en los ambientes naturales (Tabla 2, Fig. 2A). Por otro lado, la equidad también tuvo un comportamiento similar a la diversidad (ambiente natural: 0.9; ambiente alterado: 0.7; Tabla 2), en donde la interacción entre las variables indicó que en otoño hubo una menor equidad en los ambientes naturales (Tabla 2, Fig. 2B).
Tabla 2: Efecto de las características del hábitat (natural/alterado) sobre la diversidad y equidad del ensamble de aves en la localidad de Cariló, provincia de Buenos Aires. Se indican los resultados de los modelos lineales generalizados mixtos (GLMM), en donde gl son los grados de libertad, Est ± EE son los valores de los estimados con su respectivo error estándar, t es el valor del estadístico y P el valor de probabilidad. En negrita se indican aquellos valores estadísticamente significativos.


Figura 2: Variación estacional de la diversidad (A) y equidad (B) promedio y su correspondiente error estándar en un ensamble de aves de la localidad de Cariló, partido de Pinamar, Buenos Aires. Las barras negras representan los valores para el hábitat alterado (bosques de pinos con urbanización) y las barras blancas los correspondientes para el hábitat natural (dunas, lagunas y cortaderales).
Por último, al comparar los tipos de hábitat dentro del ambiente alterado, la diversidad varió en relación a las características del hábitat (Tabla 3), siendo menor en el pinar sin urbanizar (‘centro’: 2.6; ‘golf’: 2.5 y ‘borde’: 2). Los índices de equidad no variaron según las características del hábitat (Tabla 3).
Tabla 3: Efecto de las características del hábitat dentro del ambiente alterado sobre la diversidad y equidad del ensamble de aves en la localidad de Cariló, provincia de Buenos Aires. Se indican los resultados de los modelos lineales generalizados mixtos (GLMM), en donde gl son los grados de libertad, Est ± EE son los valores de los estimados con su respectivo error estándar, t es el valor del estadístico y P el valor de probabilidad. En negrita se indican aquellos valores estadísticamente significativos.
DISCUSIÓN
Nuestros resultados indican que, de manera general, en el ambiente natural los índices de diversidad y equidad fueron mayores en relación a los ambientes alterados (con excepción del otoño, en donde ambos índices disminuyeron notablemente en el ambiente natural). Las plantaciones de pinos que caracterizan algunas de las localidades balnearias de la costa bonaerense tienen características ecológicas muy distintas a los ambientes nativos originales de dunas y pastizales (Dadon y Matteucci 2002, Faggi et al. 2010, Athor y Celsi 2016). Este tipo de transformaciones en los ecosistemas generan importantes disminuciones en la calidad del hábitat (ver Rickman y Connor 2003), lo que puede llevar a la reducción general de los recursos indispensables para las aves (Burke y Nol 1998, Ostfeld y Keesing 2000, Segura et al. 2019). Una primera explicación a nuestros resultados es que la formación de mosaicos de hábitat tan homogéneos como los que caracterizan a las plantaciones de pinos en estas áreas costeras, probablemente provoque un reemplazo de las especies especialistas o endémicas por otras pocas especies generalistas o de distribución más global (ver Morelli et al. 2016). Una explicación alternativa podría estar vinculada al disturbio causado por la misma urbanización, ya sea por la edificación de viviendas, los frecuentes ruidos o el tránsito de vehículos (Reijnen et al. 1996, Rottenborn 1999). Sin embargo, la localidad balnearia de Cariló presenta baja densidad de edificaciones y calles sin pavimentar en donde el tránsito de personas y vehículos no es intenso en buena parte del año. A pesar de que existe evidencia de que la urbanización puede crear nuevos hábitats que son aprovechados por algunas especies de aves (Grimm et al. 2008), nuestros resultados apoyan la idea de que la diversidad y equidad decrecen con la alteración del hábitat natural (Marzluff 2001, Leveau y Leveau 2004, Chace y Walsh 2006, Shochat et al. 2010, Newbold et al. 2015, pero ver Rossetti y Giraudo 2003, Fandiño et al. 2010).
La interacción entre la estación del año y el tipo de hábitat pone de manifiesto la complejidad de la dinámica de los ensambles de aves, no solo en relación a las características del hábitat, sino también a lo largo del año (Herrera 1981, Cueto y López de Casenave 2000a, Apellaniz et al. 2012). Si bien en el hábitat natural la tendencia general fue de mayor diversidad y equidad en relación al alterado, particularmente en el otoño encontramos que ambas variables disminuyeron significativamente en el ambiente natural. Para esta región de Argentina, ya ha sido reportado que durante el otoño es frecuente encontrar menores valores de abundancia y riqueza específica (Cueto y López de Casenave 2000a, 2000b, Palacio y Montalti 2013). Entre las principales explicaciones para este patrón, se ha propuesto que las aves migratorias podrían estar causando la disminución en la diversidad (Palacio y Montalti 2013), o que los cambios estacionales en el clima y disponibilidad de alimentos (típico de los climas templados, H-Acevedo y Currie 2003) podrían forzar a las aves a moverse a otros sitios o inclusive causar mayor mortalidad en la población (Apellaniz et al. 2012). En relación al primer punto (i.e., aves migratorias), nuestros resultados no apoyan esta hipótesis, ya que ninguna de las especies migratorias estuvo presente (migrantes invernales) o ausente (migrantes estivales) solo en el otoño, sino que lo hicieron en ambas estaciones invernales (Tabla 1). En relación al segundo punto (i.e., cambios estacionales en el clima y disponibilidad de alimento), el otoño es ciertamente una estación clave que modela la supervivencia de los juveniles que acaban de independizarse (Russell 2000, Vitz y Rodewald 2011), lo que podría resultar en una disminución en la diversidad y equidad durante los primeros meses fríos del año. Una explicación alternativa podría estar vinculada a una menor estacionalidad en los sitios urbanizados en relación a sitios con menor grado de urbanización (Leveau et al. 2015), principalmente debido a que en muchas áreas residenciales (como las que caracterizan a nuestro hábitat alterado), los jardines y parques son mantenidos artificialmente a lo largo del año (ver también Faeth et al. 2011). Sin embargo, nuestros resultados no nos permiten ser concluyentes respecto a las causas de la disminución en la diversidad y equidad durante el otoño en el ambiente natural, por lo que nuevos estudios que puedan echar luz sobre este patrón, que parece ser repetitivo entre los ensambles de aves de esta región de país, son necesarios (Apellaniz et al. 2012, Pretelli et al. 2013).
Por otro lado, dentro del ambiente reemplazado por pinos encontramos diferencias en la diversidad de aves en relación a los distintos sectores muestreados. Aquí, la variación encontrada fue opuesta a lo esperado inicialmente, dado que el ambiente alterado con menor grado de disturbio (definido como ‘borde’) fue el que presentó menor diversidad. Las transectas ubicadas en el sector de ‘borde’ limitan con una gran superficie de pinar sin urbanizar, por lo que era esperable que el bajo grado de disturbio (en relación a edificaciones y tránsito de vehículos y personas) estuviera positivamente asociado a la diversidad de aves. Por otro lado, los sectores definidos como ‘centro’ y ‘golf’ presentaron mayor número de edificaciones y mayor tránsito de vehículos y personas, pero al mismo tiempo son los sectores que presentan mayor abundancia de parques y jardines ornamentados, los cuales podrían estar ofreciendo refugio y alimento a las aves (Walker et al. 2009, Faeth et al. 2011) y así mantener alta la diversidad. En el sector de borde, por el contrario, se observa un pinar más homogéneo en donde son escasos los parques y jardines asociados a las viviendas, lo que probablemente cause la menor diversidad de aves (Faeth et al. 2011). De esta manera, el disturbio asociado a edificaciones y tránsito de personas y vehículos parece no afectar directamente al ensamble de aves, pero sí, aparentemente, la falta de vegetación ornamental asociada a parques y jardines que haría menos homogéneo el hábitat.
Nuestros resultados muestran que el ensamble de aves en este particular sector turístico de la costa bonaerense tuvo respuestas diferentes según las características del hábitat. Por un lado, la diversidad y equidad del ensamble de aves disminuyeron en el ambiente alterado en comparación con el ambiente nativo original y, por otro, dentro del ambiente alterado la presencia de parques y jardines ornamentados mejoró los índices de diversidad de las aves. Si bien la sistemática plantación de pinos durante el siglo pasado contribuyó significativamente a la homogeneización del hábitat (Segura et al. 2017), destacamos los esfuerzos de los habitantes y gobernantes de Cariló por mantener extensas superficies parquizadas que permiten aumentar la heterogeneidad de hábitats disponibles para las aves. No obstante, nuestros resultados apoyan la idea del efecto negativo del reemplazo de hábitats nativos por este tipo de plantaciones artificiales que nada tienen que ver con la fisonomía original de la zona, por lo que recomendamos a las autoridades contar con diseños estratégicos de urbanización en la costa bonaerense que no perjudiquen la compleja estructura de los ecosistemas naturales ni de las aves que los habitan.
AGRADECIMIENTOS
Agradecemos a la Fundación Cariló por su acompañamiento y respaldo, especialmente a Claudia Chacón y Ángel Torres por estar tan presentes y siempre dispuestos a ayudar. También a María Maceira por su hospitalidad y buena compañía durante los muestreos. A Facundo Palacio por sus aportes en el análisis de datos. LNS es investigador del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
BIBLIOGRAFÍA
1. Apellaniz MF, Bellocq MI y Filloy J (2012) Bird diversity patterns in Neotropical temperate farmlands: the role of environmental factors and trophic groups in the spring and autumn. Austral Ecology 37:547–555
2. Athor J y Celsi CE (2016) La costa atlántica de Buenos Aires: naturaleza y patrimonio cultural. Fundación Félix de Azara, Buenos Aires. [ Links ]
3. Blair RB (1996) Land use and avian species diversity along an urban gradient. Ecological Applications 6:506–519
4. Brown A, Martinez–Ortiz U, Acerbi M y Corcuera J (2006) Situación ambiental argentina. Fundación Vida Silvestre Argentina, Buenos Aires.
5. Burke DM y Nol E (1998) Influence of food abundance, nest site habitat, and forest fragmentation on breeding ovenbirds. Auk 115:96–104
6. Chace JF y Walsh JJ (2006) Urban effects on native avifauna: a review. Landscape Urban Plan 74:46–69
7. Clergeau P, Jokimäki J y Savard JPL (2001) Are urban bird communities influenced by the bird diversity of adjacent landscapes? Journal of Applied Ecology 38:1122–1134
8. Cueto VR y López de Casenave J (2000a) Seasonal changes in bird assemblages of coastal woodlands in east–central Argentina. Studies in Neotropical Fauna and Environments 35:173–177
9. Cueto VR y López de Casenave J (2000b) Bird assemblages of protected and exploited coastal woodlands in east–central Argentina. Wilson Bulletin 112:395–402
10. Dadon JR (2002) El impacto del turismo sobre los recursos naturales costeros en la costa pampeana. Pp. 101–121 en: Dadon JR y Matteucci SD (eds) Zona Costera de la Pampa Argentina. Lugar Editorial, Buenos Aires
11. Dadon JR y Matteucci SD (2002) Zona Costera de la Pampa Argentina. Lugar Editorial, Buenos Aires [ Links ]
12. Faeth SH, Bang C y Saari S (2011) Urban biodiversity: patterns and mechanisms. Annals of the New York Academy of Science 1223:69–81
13. Faggi A, Perepelizin P y Dadon J (2010) South Atlantic tourist resorts: predictors for changes induced by afforestation. Pp. 363–379 en: Müller N, Werner P y Kelcey JG (Eds) Urban Biodiversity and Design. Wiley, Oxford
14. Fandiño B, Berduc AJ y Beltzer AH (2010) Ensambles de aves de bosques nativos y exóticos en la estación reproductiva de un área protegida en el espinal de Entre Ríos, Argentina. Ornitología Neotropical 21:1–16
15. García GO y Gómez–Laich A. 2007. Abundancia y riqueza específica en un ensamble de aves marinas y costeras del sudeste de la provincia de Buenos Aires, Argentina. Hornero 22:9–16
16. González–Oreja JA (2003) Aplicación de análisis multivariantes al estudio de las relaciones entre las aves y sus hábitats: un ejemplo con paseriformes montanos no forestales. Ardeola 50:47–58
17. Grimm NB, Faeth SH, Golubiewski NE, Redman CL, Wu JG, Bai XM y Briggs JM (2008) Global change and the ecology of cities. Science 319:756–760
18. H–Acevedo D y Currie DJE (2003) Does climate determine broad–scale patterns of species richness? A test of the causal link by natural experiment. Global Ecology and Biogeography 12:61–73
19. Hall LS, Kraussman PA y Morrinson ML (1997) The habitat concept and a plea for standard terminology. Wildlife Society Bulletin 25:173–182
20. Herrera CM (1981) Organización temporal en las comunidades de aves. Doñana, Acta Vertebrata 8:79–101
21. Kark S, Iwaniuk A, Schalimtzek A y Banker E (2007) Living in the city: Can anyone become an “urban exploiter”? Journal Biogeography 34:638–651
22. Kühn I y Klotz S (2006) Urbanization and homogenization – Comparing the floras of urban and rural areas in Germany. Biological Conservation 127:292–300
23. Leveau LM y CM Leveau (2004) Comunidades de aves en un gradiente urbano de la ciudad de Mar del Plata, Argentina. Hornero 19:13–21
24. Leveau LM, Isla FI y Bellocq MI (2015) Urbanization and the temporal homogenization of bird communities: a case study in central Argentina. Urban Ecosystems 18:1461–1476
25. Marzluff JM (2001) Avian ecology and conservation in an urbanizing world. Kluwer Academic Publishers, Boston [ Links ]
26. MAyDS y AA (2017) Categorización de las aves de la Argentina. Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas, edición electrónica. C. A. Buenos Aires, Argentina (URL: https://avesargentinas.org.ar/sites/default/files/Categorizacion–de–aves–de–la–Argentina.pdf)
27. McKinney ML (2006) Urbanization as a major cause of biotic homogenization. Biological Conservation 127:247–260
28. Moffatt SF, McLachlan SM y Kenkel NC (2004) Impacts of land use on riparian forest along an urban–rural gradient in southern Manitoba. Plant Ecology 174:119–135
29. Morelli F, Benedetti Y, Ibáñez‐Álamo JD, Jokimäki J, Mänd R, Tryjanowski P y Møller AP (2016) Evidence of evolutionary homogenization of bird communities in urban environments across Europe. Global Ecology and Biogeography 25:1284–1293
30. Newbold T, Hudson LN, Hill SLL, Contu S, Lys enko I, Senior RA , Boerger L, Bennett DJ, Choimes A, Collen B, Day J, De Palma A, Díaz S, Echeverria–Londoño S, Edgar MJ, Feldman A, Garon M, Harrison MLK, Alhusseini T, Ingram DJ, Itescu Y, Kattge J, Kemp V, Kirkpatrick L, Kleyer M, Lagina D, Martin CD, Meiri S, Novosolov M, Pan Y, Phillips HRP, Purves DW , Robinson A, Simpson J, Tuck S, Weiher E, White HJ, Ewers RM, Mace GM, Scharlemann JPW y Purvis A (2015) Global effects of land use on local terrestrial biodiversity. Nature 520:45–50
31. Ostfeld RS y Keesing F (2000) Pulsed resources and community dynamics of consumers in terrestrial ecosystems. Trends in Ecology and Evolution 15:232–237
32. Palacio FX y Montalti D (2013) Seasonal variation and effect of non–native invasive vegetation on two bird communities in northeast of Buenos Aires province, Argentina. Ornitología Neotropical 24:157–168
33. Pretelli MG, Isacch JP y Cardoni DA (2016) Diversidad y conservación de aves de los pastizales de la costa de la provincia de Buenos Aires. Pp. 181–203 en: Athor J y Celsi CE (eds) La costa atlántica de Buenos Aires: naturaleza y patrimonio cultural. Fundación Félix de Azara, Buenos Aires
34. Pretelli MG, Isacch JP y Cardoni DA (2013) Year–round abundance, richness and nesting of the bird assemblage of tall grasslands in the south–east pampas region, Argentina. Ardeola 60:327–343
35. R Core Team (2019) R: A language and environment for statistical computing. R Foundation for Statistical Computing, Viena (URL: http://www.R–project.org/)
36. Reijnen R, Foppen R y Meeuwsen H (1996) The effects of traffic on the density of breeding birds in Dutch agricultural grasslands. Biological Conservation 75:255–260
37. Rickman JK y Connor EF (2003) The effect of urbanization on the quality of remnant habitats for leaf– mining Lepidoptera on Quercus agrifolia. Ecography 26:777–787
38. Ross etti MA y Giraudo AR (2003) Comunidades de aves de bosques fluviales habitados y no habitados por el hombre en el Río Paraná Medio, Argentina. Hornero 18: 89–96
39. Rottenborn SC (1999) Predicting the impacts of urbanization on riparian bird communities. Biological Conservation 88: 289–299
40. Russell E (2000) Avian life histories: is extended parental care the southern secret? Emu 100:377–399
41. Shochat E, Lerman SB, Anderies JM, Warren PS, Faeth SH y Nilon CH (2010) Invasion, competition, and biodiversity loss in urban ecosystems. BioScience 60:199–208
42. Segura LN, Gonzalez E, Jauregui A y Colombo MA (2017) Avifauna de Cariló. Arte Editorial Servicop, La Plata [ Links ]
43. Segura LN, Gonzalez E, Harguindeguy FM, Colombo MA y Jauregui A (2019) Food delivery rates increased with forest canopy cover and nestling growth improved with arachnids in the Masked Gnatcatcher Polioptila dumicola. Acta Ornithologica 54:2z33–241
44. SMN (2020) Servicio Meteorológico Nacional Argentino. Gobierno de la República Argentina. (URL: http://www.smn.gov.ar) [ Links ]
45. Soave GE, Marateo G, Rey P, Glaz D y Darrieu CA (1999) Evolución estacional de los ensambles de aves de un Talar del nordeste de la Provincia de Buenos Aires, Argentina. Serie Informe # 55. Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, La Plata [ Links ]
46. Vitz AC y Rodewald AD (2011) Influence of condition and habitat use on survival of post–fledging songbirds. Condor 113:400–411
47. Walker JS, Grimm NB, Briggs JM, Gries C y Dugan L (2009) Effects of urbanization on plant species diversity in central Arizona. Frontiers in Ecology and the Environment 7:465–470














