Las urbanizaciones son consideradas como una de las principales fuerzas impulsoras de la pérdida de biodiversidad (Savard et al. 2000, Gupta 2002, McKin-ney 2002). Por ejemplo, en América del Sur, aquellos países con una tasa de desarrollo más lenta y heterogénea presentan una mayor pérdida en comparación a países más desarrollados (Pauchard et al. 2006, Uni-ted Nations 2015). Como consecuencia, los diferentes tipos de hábitats naturales se han vuelto cada vez más perturbados y fragmentados (Beninde et al. 2015, Had-dad et al. 2015, Wilson et al. 2016). Varios estudios han demostrado que la composición de especies de aves en áreas urbanas, está ajustada por las características propias de una urbanización y su entorno (Blair 1996, Croci et al. 2008, Leveau e Ibañez 2022). Así, las modificaciones del uso del suelo y los impactos ambientales relacionados con la urbanización pueden favorecer o excluir a las especies, dependiendo de la composición de sus rasgos funcionales (Stagoll et al. 2010, Ikin et al. 2012, Leveau 2021). Estos rasgos están relacionados con la capacidad de las especies para prosperar en un ambiente como, por ejemplo, el comportamiento de nidificación, morfología y coloración de alas y pico, tamaño y dieta (Luck et al. 2012, Leveau e Ibañez 2022). Si bien las aves urbanas enfrentan muchos desafíos, que incluyen búsqueda de diferentes fuentes de alimento y tipos de hábitats a los de sus ambientes naturales, rangos térmicos (efecto isla de calor), exposición a nuevos depredadores y factores estresantes como la luz, el ruido y la contaminación del aire (Rodewald et al. 2013, Marzluf 2017, Reynolds et al 2019), su expansión y persistencia en los centros urbanos nos ofrecen muchas oportunidades para comprender los procesos de adaptación a la vida urbana y el desarrollo de los espacios urbanos como áreas de conservación para la vida silvestre en general.
Existe una asociación entre las urbanizaciones y diferentes aspectos de la biología reproductiva de las aves urbanas. Por ejemplo, se ha podido observar que mientras especies que nidifican en el suelo o en arbustos están negativamente asociados a áreas urbanas, otras especies que anidan en árboles, edificios o rocas se han visto favorecidas (Corrales-Moya y Sandoval 2021, Patankar et al. 2021, Leveau e Ibañez 2022). Algunos rasgos de la historia natural de las aves, como ser, tamaño de la nidada, éxito de cría, número de huevos y pichones, se han visto favorecidos en las poblaciones de aves de áreas urbanas (Thornton et al. 2017, Paton et al. 2019, Patankar et al. 2021). Mientras que también se ha podido observar que el comportamiento reproductivo, la elección del sitio de nidificación y el periodo del mismo, pueden estar influenciados por factores externos (contaminación visual, sonora, depredadores urbanos, poda del arbolado), cuyos efectos pueden incrementarse cuando las condiciones ambientales no son las adecuadas, como ser en ambientes urbanos, donde las características del paisaje pueden ser muy diferentes al natural (Reynolds et al. 2019, Leveau e Ibañez 2022). Sin embargo, a pesar de que muchas especies de aves cuentan con estudios sobre su biología de reproducción en sus ambientes naturales, el conocimiento en ambientes urbanos aún es escaso (Reynolds et al. 2019). Una de las especies de ave cuyo conocimiento sobre su reproducción en ambientes urbanos de Argentina es escaso, es el Benteveo o Que-tupí (Pitangus sulphuratus, Tyrannidae), encontrándose principalmente datos sobre biología reproductiva en ambientes naturales (Cepillo y Fitzpatrick 2020, de la Peña 2021).
El Benteveo es una especie muy común en una amplia variedad de ambientes semiabiertos y abiertos, rurales y urbanos y menos frecuente en regiones boscosas, donde se encuentra más o menos confinado a los márgenes de lagos y ríos, de ambientes tropicales y subtropicales del Neotrópico, desde el sur de Estados Unidos hasta el sur de Argentina (Cepillo y Fitzpatrick 2020). Se ha indicado que la nidificación del Benteveo en ambientes naturales, es desde septiembre a enero, el nido generalmente es construido con diversos materiales naturales (gramillas, ramas, hojas, entremezcladas con lanas, hilos y plumas), el cual tiene un aspecto desordenado, voluminoso y esférico. Los mismos son sostenidos en ramas de árboles con una entrada amplia en la parte antero-superior y la nidada suele ser de 2 a 5 huevos (Canevari et al. 1991, Llambías y Ferre-tti 2003, Cepillo y Fitzpatrick 2020, de la Peña 2021). No obstante, la información sobre dichos parámetros reproductivos y otros, como ser el potencial éxito reproductivo, número de nidada y volantones y uso de material para la construcción y alimentación de los volantones, en ambientes urbanos es escasa (Amancio et al. 2008, Pereira y Melo 2012, Corrales-Moya y San-doval 2021).
Evaluar las respuestas y cambios en el ciclo de vida, adaptaciones morfológicas y comportamentales de aves urbanas, fáciles de ser observadas y monito-readas, nos podría permitir evaluar la versatilidad ecológica de las mismas ante diferentes grados de perturbaciones y/o modificaciones en un ambiente dado (Reynaud y Thioulouse 2000, Kark et al. 2007, Croci et al. 2008, Perepelizin y Faggi 2009). Considerando la falta de conocimiento de diferentes aspectos de las comunidades de aves urbanas y de la reproducción de las mismas, el presente estudio nos lleva a preguntarnos sobre la nidificación del Benteveo en el Gran San Miguel de Tucumán. Por lo que los objetivos principales del presente estudio son evaluar si varía el número de nidos encontrados, el número de nidos exitosos, tiempo de reproducción, número de volantones, los materiales utilizados para construir los nidos y la abundancia relativa de benteveos entre los diferentes niveles de urbanización del Gran San Miguel de Tucumán. Diferentes autores han detectado una respuesta diferencial en la comunidad de aves en cuanto a patrones de reproducción y rasgos reproductivos. También se han encontrado diferencias en la diversidad y cobertura arbórea en este gradiente de urbanización (Juri 2007, Gutiérrez Angonese 2010, Nuñez Montellano et al. 2010, Haedo et al. 2017), por lo que esperaríamos encontrar respuestas diferenciales de los rasgos reproductivos del Benteveo.
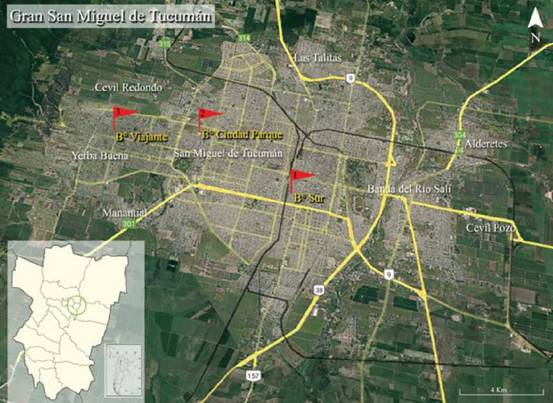
métodosEl estudio se realizó en el Gran San Miguel de Tucumán, Tucumán, Argentina, que posee 794 325 habitantes y una superficie estimada de 114 km2 (Indec 2010) (Fig. 1). El conglomerado está conformado por los departamentos de San Miguel de Tucumán, Cruz Alta, Yerba Buena, Tafí Viejo y Lules. Se caracteriza por estar limitado geográficamente por el río Salí al este y por las Sierras de San Javier al oeste y sus límites norte y sur son principalmente de campos de cultivos de caña de azúcar y limones. El clima es subtropical con régimen de lluvias monzónicas (inviernos secos y veranos lluviosos); con lluvias y temperaturas controladas fuertemente por la topografía (Grau et al. 2008). La bio-ta nativa de la región corresponde a la ecorregión de las Yungas, del piso de selva pedemontana desaparecida hacia el este del Gran San Miguel y con algunos relictos hacia el oeste (Brown et al. 2006, Haedo et al. 2010). En esta ciudad existen diferentes niveles de urbanización con disminución de este a oeste, es decir, desde el centro de la ciudad de San Miguel de Tucumán, (alta urbanización) hacia las sierras de San Javier (al oeste, baja urbanización) (Juri 2007).
Se seleccionaron tres sectores representativos de los niveles de urbanización presentes, con dirección este-oeste, en el Gran San Miguel de Tucumán: Sector 1: el sector extremo este, más urbanizado y con un nivel habitacional alto ubicado en el Barrio Sur de la ciudad de San Miguel de Tucumán; Sector 2: sector centro-oeste, urbanización intermedia y con nivel ha-bitacional medio, ubicado en el Barrio Ciudad Parque de la ciudad de San Miguel de Tucumán; Sector 3: sector extremo oeste, con menor nivel de urbanización, ubicado en el Barrio Viajante de la ciudad de Yerba Buena. En cada sector se eligió una plaza como punto central, y se subdividió en ocho cuadrantes alrededor de la misma; abarcando cada sector aproximadamente de 0.8 a 1.2 km de radio. A su vez, cada cuadrante abarcó entre tres a cuatro manzanas (0.20 ha aproximadamente). En total cada sector abarcó aproximadamente 1.6 ha.
Los cuadrantes fueron visitados durante las temporadas 2020-2021 y 2021-2022, una vez por semana desde el mes de septiembre hasta marzo, cubriendo el período de reproducción del Benteveo según bibliografía (Llambías y Ferretti 2003, Cepillo y Fitzpatrick 2020, de la Peña 2021). Para la observación de la especie se utilizaron binoculares 10x42 marca Hokenn y se complementaron con registros fotográficos. No se realizaron muestreos en condiciones climáticas adversas de vientos fuertes, niebla o lluvias (Bibby et al. 2000). En cada visita a cada cuadrante se registraron los individuos de benteveos observados, y se identificaron los nidos de Benteveo (activos o no) (Fig. 2), su altura (utilizando App Medición para Iphone), número de crías (volantones) y todo aquel episodio particular que se observe, como ser abandono del nido (aquel nido que se inició su construcción, pero no fue finalizado), traslados, parasitismo de cría, anidación en soportes no naturales. Además, se determinó la temporada de reproducción, como el momento del año donde la especie inicia su reproducción, desde la construcción del nido hasta la salida de los volantones. Debido a que los nidos eran demasiados altos para acceder, no pudimos controlar la edad y el número de huevos desde el inicio de la construcción y/o puesta, por lo que se consideró nido exitoso a aquel nido donde efectivamente se observó al menos un volantón junto a sus padres, volando y alimentándose fuera del nido. Una vez encontrado el nido, según estimaciones observacionales, se determinó el porcentaje de material utilizado para su construcción. Se definieron ocho categorías de materiales, según las mencionadas por de la Peña (2021) y se incorporaron tres nuevas según nuestras observaciones personales; quedaron en total las siguientes categorías: hojas, ramas, plumas, gramillas, plásticos, fibras sintéticas, hilos de lana, hilos de algodón.
Figura 1. Imagen satelital del Gran San Miguel de Tucumán, Tucumán, Argentina donde se muestra la ubicación de los sectores de estudio con diferentes niveles de urbanización. Referencia: Sector 1: Barrio Sur (B° Sur), San Miguel de Tucumán; Sector 2: Barrio Ciudad Parque (B° Ciudad Parque), San Miguel de Tucumán; Sector 3: Barrio Viajante (B° Viajante), Yerba Buena. Fuente: 2020 Google Earth, Cnes/Spot Images
Para evaluar la abundancia relativa de los individuos de benteveos y rasgos reproductivos de la especie (cantidad promedio de nidos encontrados por sector, cantidad promedio de nidos exitosos por sector, tiempo promedio de temporada de reproducción, porcentaje de material artificial utilizado, altura promedio de ubicación de nidos) entre los diferentes niveles de urbanización se realizaron análisis de va-rianza no paramétrico Kruskal-Wallis con un a = 0.05. En caso de encontrar diferencias se realizaron test a posteriori según los criterios de Conover 1999 (Zar 1996, InfoStat 2008). Como complemento, se identificaron las especies arbóreas utilizadas como soporte de nido. El orden de las familias y los nombres de los géneros y especies arbóreas siguieron los criterios de IBODA (2014) y Trópicos (2015).
Resultados
Se encontraron 46 nidos en total. El 21.74% del total de los nidos correspondieron al Sector 1, el 32.60% al Sector 2, y el 45.65% al Sector 3. El número total de nidos exitosos fue 27. El Sector 1 presentó 18.52% de nidos exitosos, y los sectores 2 y 3 presentaron un 40.74% (Tabla 1). No se registraron diferencias estadísticamente significativas entre el número promedio de nidos (Kruskal-Wallis H = 2.38; p = 0.281) y el número promedio de nidos exitosos (Kruskal-Wallis H = 0.98; p = 0.574) entre los distintos sitios de estudio (Fig. 2).
Se observó que la temporada de reproducción del Benteveo fue de octubre a febrero. En los sectores 1 y 3 la actividad se inició en noviembre, mientras que en el Sector 2 en el mes de octubre. La temporada de reproducción fue de 50 a 70 días; para el Sector 1 fue de 50 ± 24 días, para el Sector 2 fue de 56 ± 27 y para el Sector 3 fue de 46 ± 28 días (Material Suplementario, Apéndice). Se observó un total de 319 individuos adultos de benteveos. La abundancia relativa para el Sector 1 fue de 16 ± 3, para el Sector 2, 16 ± 6 y para el Sector 3, 13 ± 2 (Tabla 1). Los análisis arrojaron que no hubo diferencias significativas entre el número promedio de días de la temporada reproductiva (Kruskal-Wallis H = 1.45; p = 0.483) y la abundancia relativa promedio de Benteveo (Kruskal-Wallis H = 2.68; p = 0.257) entre los diferentes sectores.
Figura 2. Nido de Benteveo (Pitangus sulphuratus) en el Gran San Miguel de Tucumán, Tucumán, Argentina.
En cuanto al número de volantones se contabilizó un total de 36. El Sector 1 presentó un 19.44% de los volantones observados, el Sector 2 el 41.67 % y el Sector 3 el 38.89% (Tabla 1). En general, se observaron nidos con 1 a 3 volantones; 18 nidos tuvieron sólo un volantón, 8 nidos con 2 volantones y sólo un nido con 3 volantones (Apéndice). El análisis estadístico no mostró diferencias significativas entre el número promedio de volantones y los niveles de urbanización (Kruskal-Wallis H = 0.68; p = 0.684).
A su vez, se observaron ocho situaciones de traslados de nidos durante la temporada reproductiva dentro del mismo árbol a diferentes ramas, como así también, hacia distintos árboles cercanos al árbol original, reutilizando casi la totalidad de los materiales del primer nido. Estos traslados fueron: un nido en el Sector 1, trasladado hacia otra rama del mismo árbol; tres nidos en el Sector 2: dos de ellos hacia otros árboles cercanos, y uno hacia otra rama del mismo árbol; y en el Sector 3 se observaron cuatro situaciones de traslados, todas ellas hacia un árbol cercano, diferente del original. No se observó reutilización de nidos por parte del Benteveo en la temporada siguiente; sin embargo, se observaron dos nidos abandonados que fueron visitados en varias oportunidades en el segundo año de muestreo por el Gorrión (Passer domesticus,Fig. 3) y un nido abandonado visitado por un Tordo Renegrido (Molothrus bonariensis), todos en el Sector 2.
Del total de los 46 nidos observados, se registró que los mismos se ubicaban entre los 5 y los 15 metros de altura (Tabla 1). En el Sector 1 la altura promedio fue de 9 ± 3 metros, en el Sector 2 fue de 10 ± 2 metros y en el Sector 3 fue de 10 ± 3 metros. No se observaron diferencias estadísticamente significativas entre las alturas promedios de ubicación de los nidos y los sitios de estudios (Kruskal-Wallis H = 0.66; p = 0.709).
Sobre los materiales empleados en la construcción de los nidos, observamos tanto materiales naturales como artificiales (Figs. 2, 4A, 4B). Los naturales encontrados fueron hojas, gramillas, ramas y plumas; y en los artificiales plásticos (porciones de bolsas, cintas, tiras de escoba de plástico), hilos, algodones y fibras sintéticas. El promedio de material artificial por nido para el Sector 1 fue de 25 (n = 10), para el Sector 2 fue de 29 (n = 15) y para el Sector 3 fue de 22 (n = 21) (Apéndice). No se encontró diferencias significativas entre el porcentaje promedio de material artificial y los tres sectores de estudio (Kruskal-Wallis H = 3.57; p = 0.138). Se destaca la presencia de tres nidos en soportes no naturales. Dos de ellos ubicados en el Sector 2, en rollos de cableado urbano en postes de concreto, y uno en el Sector 1 en una antena de radio transmisión. Dos de estos nidos fueron exitosos (Figs. 4C y 4D).
Figura 3. Nido de Benteveo (Pitangussulphuratus) reutilizados por Gorrión (Passer domesticus) en poste de cableado eléctrico en el Gran San Miguel de Tucumán, Tucumán, Argentina.
El número de especies arbóreas utilizadas como soporte de nidos fue de 19. Las especies de Jacaran-dá, Ficus y Lapacho Rosado fueron las más utilizadas (9 individuos, 6 y 5 respectivamente). En el Sector 1 siete especies arbóreas fueron utilizadas (cuatro nativas, tres exóticas), en el Sector 2 fueron 10 especies (seis nativas, cuatro exóticas) y en el Sector 3 fueron 12 especies (seis nativas y seis exóticas) (Apéndice).
Figura 4. Nidos de Benteveo (Pitangussulphuratus) con material sintético (A y B), nido de Benteveo (Pitangussulphuratus) ubicado en poste de cableado urbano (C) y nido de Benteveo (Pitangus sulphuratus) ubicado en antena de radio transmisión (D) en el Gran San Miguel de Tucumán, Tucumán, Argentina.
Tabla 1: Datos generales de los rasgos reproductivos y variables generales en los diferentes sectores evaluados en el Gran San Miguel de Tucumán, Tucumán, Argentina. Referencia: valores promedios entre cuadrantes por sector entre paréntesis: media ± desvío estándar.
Discusión
Los resultados obtenidos muestran que el Ben-teveo se encuentra presente y nidificando en el Gran San Miguel de Tucumán. No se encontraron diferencias significativas entre los diferentes niveles de urbanización y los rasgos reproductivos evaluados, como ser el número de nidos, números de nidos exitosos, los materiales de construcción de los mismos, temporada de reproducción, número de volantones, y la abundancia relativa de individuos adultos de dicha especie en el presente estudio.
Estudios anteriores indican que la composición de especies de aves varía a lo largo del gradiente de urbanización (Juri y Chani 2009, Suarez- Rubio et al. 2011, Leveau et al. 2021) y que existe una respuesta diferencial en la nidificación, dependiendo del grupo que se evalúe (Leveau e Ibañez 2022). La presencia y nidificación del Benteveo en los diferentes grados de urbanización presentes en el Gran San Miguel de Tu-cumán, nos indicaría que el mismo podría ser considerado como un adaptador urbano ("urban adapter”, término en inglés utilizado por Leveau e Ibañez 2022) en la nidificación dentro de las ciudades, es decir, se comportaría de manera similar a pesar de existir diferencias urbanas. Esto mismo ya había sido mencionado por Amancio et al. (2008), donde concluyen que el Benteveo se podría adaptar a cualquier nivel de urbanización presente en los centros urbanos. Considerar al Benteveo como un adaptador urbano podría estar íntimamente relacionado a que los niveles y tipos de urbanizaciones presentes, es decir, a las condiciones edilicias, al tipo de construcción y arbolado urbano que exista, no solo desde el punto de vista de la riqueza o abundancia arbórea sino también al tipo de especie (tanto nativa como exótica), o al porte o altura que las mismas posean, no influenciaría de manera diferencial en la especie. Una evidencia de que el Benteveo podría ser considerado también, como un adaptador urbano, es el hecho de ubicar sus nidos tanto en especies arbóreas nativas (típicas de las Yungas de Tucumán) como así también de especies exóticas comunes en las ciudades, y además en soportes artificiales. Corrales-Moya y Sandoval (2021) destacan el uso positivo de soportes artificiales por parte del Benteveo para la nidificación en ambientes urbanos, como una forma de reducir la tasa de predación de nidos y ampliar el éxito reproductivo de los mismos. Si bien el uso de estos soportes en el presente estudio fueron pocos, se podría evaluar a futuro, pautas de instalación y manejo de postes eléctricos y antenas de telecomunicación que ayuden a la reproducción de la especie en ambientes urbanos.
Estudios anteriores han evidenciado respuestas diferenciales entre ambientes naturales y urbanos en relación a la nidificación como una forma de adaptarse a nuevas condiciones (Jokimaki et al. 2016, Leveau e Ibáñez 2022). Las características del ciclo reproductivo y uso de diferentes soportes para instalación de nidos observados en el Benteveo podrían responder de manera diferente a lo observado por otros autores en ambientes naturales. De la Peña (2021) menciona que la nidificación de la especie es desde julio a enero, mientras que nuestros resultados indican que la misma finalizaría entre febrero y marzo. En relación a la altura de los nidos, el presente estudio amplía la altura máxima (15 m) con respecto a los datos obtenidos por de la Peña (2021) (8 m) para nidos en Argentina, y de 10 a 27 m para Estados Unidos (Gorena 1995, Rupert 1997). Dichas diferencias de ubicación de altura de los nidos podrían estar asociadas al tipo de soporte que disponga la especie en las diferentes regiones. La mayoría de los registros de de la Peña (2021) fueron en árboles de Chañar (Geoffroea decorticans), cuya altura máxima oscila entre 3 a 10 m, mientras que los registros de Gorena (1995) y Rupert (1997) fueron en árboles de variada altura, por ejemplo, Olmo de Cedro (Ulmus crassifolia) y Fresno Mexicano (Fraxinus berlandieriana) de alturas máximas de 27 y 10 m respectivamente. Ante todo esto, los resultados obtenidos implicarían, por un lado, ampliar el período reproductivo de la especie en general. Por otro lado, que el mayor tiempo de nidificación y la mayor amplitud en ubicación de nidos que se observó estaría vinculado a que el Benteveo poseería una plasticidad comportamental a los ambientes urbanos, donde las condiciones y recursos son diferentes a un ambiente natural (Peluc et al 2008, Robertson y Olsen 2015).
Varios son los estudios donde se ha podido observar que las aves poseen una plasticidad compor-tamental durante el período reproductivo frente a diferentes escenarios o modificaciones en el ambiente. Por ejemplo, en el tiempo de cría (Svensson 1997), en la ubicación del nido (Peluc et al. 2008), en el desarrollo, cuidado parental o tamaño de nidada bajo mayor riesgo de depredación (Ghalambor y Martin 2002). El presente estudio mostraría la potencial plasticidad fenotípica adaptativa de la especie ante situaciones extremas y se proponen estudios con mayor profundidad para ampliar dicha plasticidad.
En general la biología reproductiva de la especie fue similar a lo descrito por otros autores (Cepillo y Fitzpatrick 2020, de la Peña 2021). Dichos autores hacen mención del número promedio de huevos por camada, sin embargo, ninguno hace referencia del número de volantones observados, por lo que el presente trabajo ampliaría el conocimiento sobre la reproducción del Benteveo. Considerando los antecedentes de números de huevos (entre 2-5 por nido) (de la Peña 2021), y el número de volantones observados en este estudio, nos lleva a proponer nuevas inquietudes de trabajo: ¿será que podría existir una potencial pérdida de la camada durante la temporada reproductiva? ¿Será que la mayoría de los nidos perderán un número importante de la camada? Estas inquietudes se podrían deber al posible impacto que tendrían las urbanizaciones en la nidificación de esta especie. Como, por ejemplo, a una mayor tasa de depredación de pichones y volantones (tanto por parte de rapaces, comadrejas, ratones y animales domésticos), a una mayor probabilidad de adquirir enfermedades urbanas y a la actividad humana en general (que podría estresar a la especie), como ser poda de arbolado urbano, contaminación sonora o lumínica, entre otros (Marzluf 2017, Rodewald et al. 2013, Han et al. 2019, Reynolds et al. 2019).
Se sabe que para otras aves los nidos en desuso son un recurso disponible importante (Salvador 2012) y considerando que en ambientes urbanos la disponibilidad de potenciales sitios de nidificación en árboles es menor (Leveau e Ibañez 2022), la reutilización podría ser una buena estrategia adaptativa. Es importante destacar que en el presente estudio la falta de accesibilidad a los nidos fue una limitante metodológica para confirmar o rechazar la reutilización de nidos por parte del Gorrión. Sin embargo, las numerosas visitas que realizó la especie nos podrían estar indicando que efectivamente se reutiliza el nido por parte de esta especie urbana típica. En cuanto a la observación de visita del Tordo Renegrido, no podemos inferir que la misma está parasitando al nido de Ben-teveo. Sin embargo, de la Peña (2021), hace mención de dicha actividad, por lo que consideramos que sería importante realizar nuevos estudios para confirmar que, en el Gran San Miguel de Tucumán, los Bente-veos también son parasitados por el Tordo Renegrido.
La construcción y el tipo de vegetación usada en los nidos, es coincidente con lo ya mencionado por otros autores para nidos en ambientes naturales (Cepillo y Fitzpatrick 2020, de la Peña 2021). Estudios han indicado que la mayor probabilidad de nidos exitosos dependería positivamente de una mayor variabilidad en los materiales utilizados por las aves, tanto naturales como artificiales. En la actualidad, cada vez son más los registros de nidos realizados con material sintético en varios grupos de aves, tanto paseriformes como no paseriformes (Sazima y D’An-gelo 2015, Battisti et al. 2019, O’Hanlon et al. 2019, Blettler y Mitchell 2021). Blettler and Mitchell (2021) registraron que el Benteveo usa plásticos como material para formar nidos, pero además observaron individuos adultos enredados con ellos, por lo que catego-rizaron dicho uso como de un riesgo moderado para la especie. En general, los tres sectores analizados mostraron uso de material sintético en la mayoría de los nidos evaluados. Cabe destacar que también, hubo ciertos nidos exitosos que presentaron un mayor uso de plásticos en su construcción, a pesar de estar ubicados en un bajo nivel de urbanización, y esto podría deberse al manejo inadecuado de los residuos sólidos urbanos presentes en la zona. Existen opiniones controvertidas sobre el uso de desechos plásticos como material de nidificación (Jagiello et al. 2019, Blettler y Mitchell 2021), no obstante, en el presente estudio, el alto número de nidos observados con material no natural nos lleva a reflexionar sobre el potencial impacto que se debería evaluar en las especies urbanas en general y en Benteveo en particular, y plantear pautas claras de manejo de los residuos sólidos urbanos en las ciudades.
Es imperioso realizar más estudios de ecología urbana de las aves y evaluar la respuesta de las mismas a los cambios que plantean las urbanizaciones, de forma tal de poder postular a futuro pautas acordes de manejo urbano que minimicen los potenciales efectos perjudiciales y asegurar la coexistencia de las aves en las ciudades.
agradecimientosAgradecemos a la secretaría de Ciencias y Técnica de la Universidad Nacional de Tucumán, por el financiamiento del presente trabajo mediante la Beca Estudiantil CIUNT 2021. Al Instituto de Vertebrados de la Fundación Miguel Lillo por darnos el lugar de trabajo, especialmente a su directora la Dra. Ada L. Echevarria. Al Lic. Pablo Pereyra de la Sección de Iconografía de la Fundación Miguel Lillo por la edición y compaginación de tablas y figuras. A la Srta. Marisel Pierobon en el apoyo del trabajo de toma de datos y por ceder gentilmente las fotografías. A los revisores anónimos y a la editora asociada Cynthia Ursino por sus comentarios y consejos, los cuales mejoraron sustancialmente el presente trabajo.
Recibido: 29 de junio de 2022
Aceptado: 3 de diciembre de 2022












 uBio
uBio