Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075
Arch. argent. pediatr. vol.108 no.6 Buenos Aires Nov./Dec. 2010
ARTÍCULO ORIGINAL
Efectos adversos musculoesqueléticos por el uso de fluoroquinolonas en niños: un metaanálisis
Assessing fluorquinolones as risk factor for musculoskeletal disorders in children: a systematic review and meta-analysis
Dra. María Teresa Rosanovaa, Dr. Roberto Ledea, Dr. Haroldo Capurroa, Dr. Virgilio Petrungaroa y Dr. Pablo Copertaria
a. Ministerio de Salud de la Nación. Comisión Nacional Salud Investiga. Área de Evaluación de Tecnologías.
Correspondencia:
Dra María T. Rosanova: margris2@yahoo.
com.ar
Conflicto de intereses:
Ninguno que declarar.
Recibido: 28-5-10
Aceptado: 8-9-10
RESUMEN
Introducción. Las quinolonas constituyen un
grupo de antibióticos bactericidas derivados delácido nalidíxico. En pediatría, la más usada es
la ciprofloxacina. Al momento, son la única opción
por vía oral para tratar las infecciones por
Pseudomonas aeruginosa. Está documentado que,
en individuos inmaduros de ciertas especies de
animales, la exposición a estos compuestos genera
el desarrollo de una artropatía secundaria a
alteración del cartílago de crecimiento. Esa toxicidad
en animales inmaduros fue extrapolada al
ser humano, por lo que no se recomienda su uso
en menores de 18 años. Dada la controversia relacionada
se realizó esta revisión sistemática de
las evidencias como medio de evaluación de estos
fármacos para su uso en la edad pediátrica.
Métodos. La búsqueda se realizó en la base Medline,
en la Cochrane Library y por búsqueda en
texto libre mediante los motores Google y Yahoo.
Se incluyeron trabajos aleatorizados, cohortes
y caso-control cuya variable principal fuera la
presencia de artropatía-tendinopatía. Los trabajos
se clasificaron según niveles de evidencia.
Los datos fueron volcados de acuerdo a un
protocolo prediseñado.
Resultados. La búsqueda incluyó 277 artículos,
de los cuales sólo 8 pudieron ser incluidos, que
correspondían a 23 166 pacientes. Sólo 1 trabajo
demostró asociación entre alteración musculoesquelética
y fluoroquinolonas. El cociente de probabilidades
(odds ratio) total fue 1,02 (IC 0,76-1,38).
Conclusión. Este metaanálisis no pudo probar
la relación entre el uso de fluoroquinolonas y
alteraciones musculoesqueléticas en pediatría.
Palabras clave: Quinolonas; Artropatía; Tendinopatía; Metaanálisis.
SUMMARY
Background. Joint cartilage toxicity secondary to
fluoroquinolone use has been observed in young
animals. These early observations led to the contraindication
of fluoroquinolones in children under
18 years. Nevertheless, quinolones may be
the only option for oral treatment of infections
caused by Pseudomonas aeruginosa.
Objective. To evaluate by systematic review and
meta-analysis the relation between fluoroquinolonas
and musculoskeletal disorders in children.
Methods. Data sources were Medline, Cochrane
data base, and free-text search through Google
and Yahoo. MESh terms were: quinolones and
arthropathy-tendinopathy and children. Randomized
clinical trials, cohorts and case-control
studies with a primary outcome of arthropaty
and/or tendinopathy were included. Each study
was scored and classified for methodological
key issues according to level of evidence. Data
were extracted using a predetermined protocol.
Results. The search identified 277 studies of
whom 8 were eligible for inclusion that included
23 166 patients. All except one failed to find
a significant link between fluoroquinolones use
and musculoskeletal disorders. The pooled odds
ratio was 1.02 (CI 0.76-1.38).
Conclusion. Our meta-analysis does not support
musculoskeletal disorders as a result of fluoroquinolones
use in children under 18 years. Thus,
in selected, appropriate, and mandatory cases
fluoroquinolones should not be contraindicated
in children.
Key words: Fluoroquinolones; Arthropathy; Tendinopathy; Meta-analysis.
INTRODUCCIÓN
Las fluoroquinolonas son antibióticos
de amplio espectro que derivan del ácido nalidíxico, un compuesto que comenzó a utilizarse en 1962 para tratar
infecciones urinarias en niños.1 Posteriormente,
se desarrollaron las nuevas
quinolonas, únicos agentes activos por
vía oral para el tratamiento de infecciones
por Pseudomonas aeruginosa1-3 y
una alternativa en las producidas por
gérmenes gramnegativos multirresistentes.
1-5 El uso de quinolonas en niños
ha sido limitado por su potencial
efecto de inducir artropatía secundaria
a las alteraciones del cartílago,1-5 observación
realizada en animales jóvenes
que mostraban afectación de las grandes
articulaciones. Esa toxicidad animal
fue extrapolada al ser humano,
por lo que se contraindicó su uso en
niños. En los últimos años, esto se replanteó y, en "estados de necesidad",
cuando constituyen la única opción
terapéutica, se admite su administración
en la edad pediátrica.1-11 Existen publicaciones sobre tratamientos con quinolonas
en exacerbaciones de la enfermedad fibroquística
pancreática, infecciones urinarias, otitis crónica
supurada, salmonelosis extraintestinal, neutropenia
y fiebre, entre otros.1-7 La posibilidad de generar
episodios adversos osteoarticulares en niños
es polémica. Las dos principales preocupaciones
que limitan su uso son la posibilidad de desarrollar
artropatía y daño del cartílago de crecimiento
y el advenimiento de gérmenes resistentes ante
la falta de un criterio racional para emplearlas.1-7¿Pero son tales preocupaciones suficientes para
no utilizar las fluoroquinolonas en cuadros donde
el riesgo de infección grave supera el potencial
riesgo de episodios adversos osteoarticulares?10-13 La única indicación de las fluoroquinolonas en
menores de 18 años aprobada por el organismo
federal de contralor en los EE.UU. (Food and Drug
Administration) es la infección urinaria complicada
y la inhalación de Bacillus anthracis.14 Dada la controversia
relacionada con sus potenciales efectos
tóxicos, se decidió realizar esta revisión sistemática
y metaanálisis.
OBJETIVOS
1. Evaluar el riesgo de efectos adversos musculoesqueléticos y sobre estructuras articulares y tendinosas, a las que denominaremos episodios adversos osteotendinosos comunicados por el uso de fluoroquinolonas indicadas para el tratamiento de infecciones en edad pediátrica.
2. Evaluar el riesgo asociado al desarrollo de alteraciones del crecimiento en esa población.
MATERIAL Y M ÉTODOS
Criterios de inclusión
1. Se incluyeron estudios publicados que incorporaron pacientes ≤18 años de edad que recibieron tratamiento con fluoroquinolonas por vía sistémica por cursar alguna infección o en forma empírica.
2. Estudios que informen los efectos adversos observados.
3. Estudios que comparen a las fluoroquinolonas de cualquier tipo contra cualquier otra prescripción terapéutica.
4. Ensayos clínicos aleatorizados o estudios de cohortes, prospectivos o retrospectivos, o estudios caso-control.
Criterios de exclusión
1. Pérdida no explicada de más del 20% de los participantes en alguno de los grupos por falta de seguimiento.
2. Estudios descriptivos de cualquier tipo o artículos de revisión u opinión.
Medidas de resultado
Principales
1. Presencia de artropatía o alteraciones osteotendinosas
(episodios adversos osteoarticulares)
diagnosticadas por resonancia magnética
nuclear, por histología, por ecografía o clínicamente,
luego de iniciado el tratamiento con
fluoroquinolonas.
2. Presencia de alteración de la curva de crecimiento
luego de iniciado el tratamiento con
fluoroquinolonas.
Estrategia de búsqueda bibliográfica
Se realizó en la base Medline, en la Cochrane Library
y por búsqueda en texto libre mediante los
motores Google y Yahoo. También se revisaron
las citas bibliográficas presentes en los artículos
seleccionados sin límites de inicio y hasta julio
de 2009.
La búsqueda se realizó, en primera instancia,
en forma independiente para cada uno de los términos
MESh vinculados (www.pubmed.com),
luego con ellos combinados y, posteriormente,
filtrados según diseño del estudio (ensayo clínico
aleatorizado, metaanálisis, estudio de cohorte o
estudio de casos-controles).
Se utilizaron las palabras clave: quinolon, nalidixic
acid, fluoroquin, norfloxac, pefloxac, ciprofloxac.
Se establecieron los siguientes límites:
edad ≤ 18 años, abstract y humans.
MÉTODO DE LA REVISIÓN
En primera instancia, los revisores (MTR, hC,
VP, PC) analizaron los resúmenes de los artículos
recuperados. Si cumplían los criterios de elegibilidad
se solicitaban los artículos en texto completo,
los cuales fueron analizados en detalle para determinar
si eran o no elegibles. Los revisores realizaron
su evaluación por separado y calificaron
su aceptación, así como la extracción de los datos,
con independencia de la opinión de los restantes
pares. Las discrepancias fueron resueltas por consenso
y con la opinión del coordinador (RL).
Procedimiento de análisis cualitativo
De los artículos seleccionados e incluidos se
consignaron los datos que permitían una apreciación
suficiente de sus características. Para calificar
la calidad de las evidencias se utilizaron los criterios
propuestos por el Centro para la Medicina
Basada en la Evidencia (Centre for Evidence Based Medicine), de la Universidad de Oxford, Reino
Unido (http://www.cebm.net). (Tabla 1).
Tabla 1. Niveles de evidencia para terapéutica

Procedimiento de análisis cuantitativo
Como se incluyeron estudios con diversos diseños
de investigación, como indicador del efecto
se utilizó el cociente de probabilidades (odds ratio)
(método de Der Simonian-Laird) con sus intervalos
de confianza del 95%. Se admitió la existencia
de heterogeneidad si el indicador I2 era mayor al
40%. El sesgo de publicación se estimó mediante
el índice de tolerancia de Rosenthal.15 Los cálculos
se efectuaron con el programa informático diseñado
por Joaquín Primo, del hospital de Sagunto,
España, 1996 (primo_joa@gva.es).
RESULTADOS
La búsqueda arrojó 277 citas de las que se seleccionaron
8 que reunían 23 166 pacientes, que
formaron parte de esta revisión sistemática. Las
exclusiones fueron determinadas por tratarse de
estudios desarrollados en población adulta, o en
niños y adultos sin discriminar los hallazgos o
por no ser comparativos entre fluoroquinolonas
y otros antibióticos, o ser series de casos o revisiones
no sistemáticas.
MEDIDA PRINCIPAL DE RESULTADO: DESARROLLO DE ARTROPATíA
Estudios de nivel 1 de evidencia
Richard et al.,16 en un estudio aleatorizado a
doble ciego, compararon la eficacia y seguridad
de fluoroquinolonas por vía oral frente a ceftazidima
más tobramicina intravenosas, en 108
pacientes de 5-17 años de edad con enfermedad
fibroquística pancreática y aislamiento de Pseudomonas
aeruginosa en esputo.
La valoración de la presencia de artropatía se
hizo clínicamente en todos los pacientes al comienzo,
entre el 5º y 7º días, al día 14 y a los 20
o 30 días de finalizado el tratamiento. Por ecografía
de rodillas y caderas al comienzo y al 5º y
7º día y al 14 se evaluó en 96 niños (48 de cada
grupo) y por RMN basal y final sólo en 29 pacientes.
No se evidenciaron diferencias significativas
en la aparición de episodios adversos
osteoarticulares entre ambos grupos: 4 pacientes
(7%) grupo ciprofloxacina y 6 (11%) en el control
no expuesto.
Leivobitz et al.,17 en un estudio aleatorizado
a doble ciego, evaluaron niños de 6 meses a 11
años de edad con diarrea aguda de <7 días de
evolución. Un grupo recibió ciprofloxacina oral
20 mg/k/día más placebo IM (95 pacientes) y el
otro, ceftriaxone IM más placebo oral (106 pacientes)
por 3 días. Se realizó examen clínico de articulaciones
largas y no se evidenciaron episodios
adversos osteoarticulares.
Salam et al.,18 en un estudio aleatorizado a
doble ciego, estudiaron a 143 niños con disentería
por Shigella tratados con ciprofloxacina o pivampicilina.
Evaluaron la presencia de artropatía
por examen clínico en todos. Trece pacientes en
el grupo fluoroquinolonas y 16 en el grupo no
expuesto, presentaron dolor articular.
Entre los tres estudios de nivel 1 de evidencia
hubo homogeneidad, pero no diferencias significativas
entre el grupo experimental y comparador
(Tabla 2).
Tabla 2. Análisis cuantitativo de acuerdo a niveles de evidencia

Estudios de nivel 2 de evidencia
Bethel et al.,19 en un estudio de cohorte prospectivo,
evaluaron cursos cortos de fluoroquinolonas
en 326 pacientes tratados por fiebre
tifoidea, de los cuales 173 recibieron ciprofloxacina
y 153 ofloxacina. Los compararon con 223
controles no expuestos que no habían recibido
fluoroquinolonas y no padecían fiebre tifoidea.
No evidenciaron toxicidad articular en ninguno
de los grupos.
Yee et al.,20 en un estudio de cohorte retrospectivo,
evaluaron la aparición de alteraciones clínicas
en tendones y articulaciones en 6223 niños tratados
con fluoroquinolonas y los compararon con
15 265 niños que recibieron azitromicina. No hubo
diferencias significativas entre ambos grupos y la
incidencia de episodios adversos osteoarticulares
fue: 0,80% (50/6223) en el grupo fluoroquinolonas
y 0,77% (118/15 265) grupo azitromicina.
Chalumeau et al.,21 en un estudio de cohorte
prospectivo, evaluaron clínicamente a 276 pacientes
expuestos a fluoroquinolonas y los compararon
con 249 controles no expuestos. La tasa de
incidencia para episodios adversos osteoarticulares
fue mayor en el grupo expuesto: 3,8% (11/276)
contra 0,4% (1/249) en el no expuesto.
Drosseau et al.,22 en un estudio de cohorte
prospectivo, evaluaron 116 neonatos tratados con
ciprofloxacina y los compararon con 100 neonatos
tratados con otros antibióticos. No detectaron
artropatía clínica en ninguno de los grupos hasta
el alta ni en 77 pacientes del grupo expuesto y 83
del grupo control no expuesto, que pudieron seguir
durante 1 año.
Uddin et al.,23 en un estudio de cohorte prospectivo,
evaluaron a 492 neonatos pretérmino con
sepsis (92 de ellos tratados con fluoroquinolonas).
Dada la alta mortalidad sólo pudieron ser valorados
48 pacientes del grupo expuesto y 66 del
no expuesto. Mediante evaluación clínica no detectaron
alteraciones articulares hasta los 2 años
de seguimiento.
Tampoco se detectó heterogeneidad entre los
resultados de estos estudios. Sólo el estudio de
Chalumeau et al.,21 mostró que la incidencia de
efectos adversos musculoesqueléticos era significativamente
mayor al del grupo comparador, sobre
todo en los tratados con pefloxacina.
La tasa de incidencia conjunta de episodios adversos
osteoarticulares en el nivel 2 de evidencia
alcanzó al 0,86% entre los expuestos y al 0,70%
entre los no expuestos.
Al integrar en el análisis cuantitativo los dos
mayores niveles de evidencias, no se detectó heterogeneidad.
La tasa de incidencia conjunta de episodios
adversos osteoarticulares entre los expuestos alcanzó al 1,08% y, entre los no expuestos, al 0,88%.
El intervalo de confianza del indicador del efecto
(OR) fue amplio, sin diferencias marcadas en
la magnitud del riesgo de episodios adversos osteoarticulares
entre el grupo que recibió fluoroquinolonas
y el grupo no expuesto.
El índice de tolerancia de Rosenthal estimó que se requeriría la inclusión de al menos tres
estudios con resultados nulos para que el punto
estimado del riesgo fuera igual a la unidad. La
magnitud de la diferencia absoluta de riesgo fue
de sólo 0,2 mayor en el grupo expuesto, con un
intervalo de confianza que incluyó a la nulidad.
(Tabla 2).
Alteraciones de curvas de crecimiento
estudios de nivel 1 de evidencia
No hubo estudios que consideraran este punto
final.
Estudios de nivel 2 de evidencia
Dutta et al.,25 en un estudio de cohortes retrospectivo,
estimaron el riesgo de alteraciones en la
curva de crecimiento hasta los 12 meses de edad
corregida en neonatos de muy bajo peso. Se incorporaron 61 casos y 144 controles no expuestos. No
observaron alteraciones de la curva de crecimiento
en ninguno de los grupos.
Drossou et al.,22 en un estudio de cohortes
prospectivo y al cabo de 1 año de seguimiento,
no detectaron diferencias en la proporción de niños
cuyo peso corporal se ubicara por debajo del
percentilo 10. El grupo que recibió fluoroquinolonas
tuvo una pérdida mayor de niños en el seguimiento
que el grupo control (34% contra 17%).
Para Berthel et al.,19 en un estudio de cohortes
prospectivo, no hubo diferencias en las mediciones
de los 3 grupos (173 pacientes tratados con ciprofloxacina,
163 con ofloxacina y 223 controles no
expuestos) al cabo de los 2 años de seguimiento.
En el trabajo de Uddin et al.,23 un estudio de
cohortes prospectivo, dada la alta mortalidad sólo
se evaluó el crecimiento hasta los 2 años en 48
pacientes del grupo expuesto y 66 del control no
expuesto. No hubo diferencias en el crecimiento
de ambos grupos.
Al integrar en el análisis cuantitativo los dos
mayores niveles de evidencias, no se detectó heterogeneidad
entre los resultados de los estudios.
El intervalo de confianza del indicador del efecto
(OR) fue amplio, sin diferencias marcadas en
la magnitud del riesgo de episodios adversos osteoarticulares
entre el grupo que recibió fluoroquinolonas
y el grupo control. La tasa de incidencia
conjunta de episodios adversos osteoarticulares
entre los expuestos alcanzó al 1,08% y, entre los
no expuestos, al 0,88%. El índice de tolerancia de
Rosenthal estima que se requeriría la inclusión de
al menos tres estudios con resultados nulos para que el punto estimado del riesgo fuera igual a la
unidad. La magnitud de la diferencia absoluta de
riesgo es de sólo 0,2 mayor en el grupo expuesto,
con un intervalo de confianza que incluye a la nulidad.
(Tablas 2 y 3 y Figura 1).
Tabla 3. Resultados con los niveles 1 y 2 de evidencia combinados

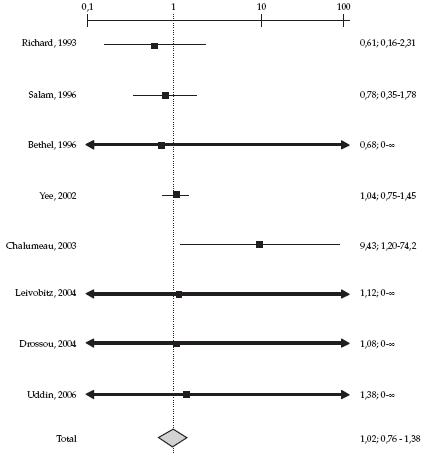
Figura 1. Representación gráfica de los resultados de los trabajos de evidencia 1 y 2
DISCUSIÓN
Dada la toxicidad articular de las fluoroquinolonas
en animales inmaduros, se extrapoló este
efecto adverso potencial a los niños y hasta los 18
años, por lo que se desaconsejó su uso. Sin embargo,
la posibilidad de episodios adversos osteoarticulares
permanece poco clara y esta revisión no
pudo documentarla fehacientemente.
La variable predeterminada de presencia de
artropatía se ha evaluado en estudios mayoritariamente
retrospectivos, con series de casos, para
el tratamiento de diferentes patologías y en distintos
huéspedes. El ácido nalidíxico fue la primera
quinolona utilizada en pacientes pediátricos con
infección urinaria complicada. Bailey et al, citados
en el artículo de Nuutinen,24 fueron los primeros,
en 1972, en comunicar artralgia reversible
en una mujer adulta que tomaba ácido nalidíxico
y que cesó con la discontinuación del tratamiento.
En algunos casos esporádicos se comunicó la
presencia de alteraciones en las articulaciones en
forma transitoria, pero en casi tres décadas de uso
no se han informado efectos musculoesqueléticos
graves secundarios al ácido nalidíxico, que es la
quinolona que demostró mayor toxicidad articular
en modelos animales. En la década de 1980 se
comienzan a utilizar las fluoroquinolonas en niños,
en particular, la ciprofloxacina. Ocasionalmente,
se han comunicado artralgias no graves
y transitorias, en muchos casos en pacientes con enfermedad fibroquística pancreática, patología
que suele provocar alteraciones osteoarticulares,
lo que dificulta definir si la presencia de tales alteraciones
está relacionada con las quinolonas. Shaad
et al.,1,2,11-27 realizaron un estudio de evaluación
clínica, radiológica y con RMN en 13 prepúberes,
seguidos por 6 meses, después de concluir un
tratamiento con fluoroquinolonas y no hallaron
evidencias de efectos adversos osteoarticulares.
Este autor comunica asimismo el estudio necrópsico
de 2 jóvenes con enfermedad fibroquística
pancreática, que recibieron tratamiento con fluoroquinolonas
por 9 y 10 meses, sin evidencia de
alteración histológica osteoarticular post-mortem.
Black et al., citados por Burckhardt et al.,28 comunican
artralgias en 5 de 200 pacientes tratados
con ciprofloxacina, 4 de ellos con enfermedad fibroquística
pancreática. Burckhardt et al.,28 realizaron
una revisión retrospectiva que comparó la probabilidad de artropatía en animales contra
la observada en 7045 pacientes pediátricos en 31
estudios, según hubieran recibido norfloxacina,
ciprofloxacina, ofloxacina o ácido nalidíxico. Concluyen
que, con observación clínica (el total de
los niños), en algunos con RMN (152 pacientes)
o con ecografía (55 pacientes) e histopatología (2
pacientes), la incidencia de condrotoxicidad sería <1 en 2348 pacientes (0,04%), siendo mayor con
pefloxacina. Sin embargo, ese estudio no explica
los criterios de selección de los 31 artículos incluidos
ni analiza la existencia de heterogeneidad entre
sus resultados. Forsythe et al.,29 realizaron una
revisión sistemática entre los trabajos publicados
desde 1980 hasta 2007, que incluyó los trabajos de
Burkhart et al.,28 y Chalumeau et al.,21 y destaca la
falta de asignación aleatoria, lo que podría haber
generado un sesgo con sobredimensionamiento
de las alteraciones musculoesqueléticas, ya que
los niños que las recibían podrían haber sido monitoreados
más exhaustivamente. También incluye
al estudio de Yee et al.,20 que fue retrospectivo
y con pocos niños <10 años, y que dada la alta
sensibilidad del método empleado para detectar
alteraciones en tendones y articulaciones podría
haber informado un porcentaje más elevado que
el real. También incluye al estudio de Drossou et
al.,22 en el que la limitante sería que la evaluación
fue clínica en neonatos, en quienes es dificultoso
detectar el compromiso articular y la evaluación
podría presentar una alta variabilidad según los
observadores. Finalmente, Forsythe et al.,29 concluyen
que no encontraron una significativa asociación
entre la lesión musculoesquelética y la
administración de quinolonas. Kubin et al.,30 que realizaron una revisión narrativa que incluyó varias
series de casos y pacientes pediátricos y adultos,
arriban a la misma conclusión.
En síntesis, la mayoría de los autores concluyen
que no existe una clara asociación entre alteraciones
musculoesqueléticas y la administración
de fluoroquinolonas, tal como lo muestra la presente
revisión sistemática. No hallar la referida
asociación no significa que la indicación pueda
ser indiscriminada, pero, cuando están indicadas,
sus beneficios terapéuticos deben ser considerados
por sobre esos posibles efectos adversos que
la evidencia no avala.
CONCLUSIONES
Este estudio no ha podido demostrar que el
tratamiento con fluoroquinolonas en niños pueda
producir artropatías por encima de lo esperado
para los grupos control no expuestos.
1. Schaad U. Role of the new quinolones in pediatric practice. Pediatr Infect Dis J 1992;11:1043-6. [ Links ]
2. Schaad U, Salam M, Aujard Y, Dagan R, et al. Use of fluoroquinolones in pediatrics: consensus report of an International Society of Chemotherapy commission. Pediatr Infect Dis J 1995;14:1-9. [ Links ]
3. Adam D. Use of quinolones in pediatric patients. Rev Inf Dis 1988;11:1113-6. [ Links ]
4. Stahlmann R. Safety profile of the quinolones. J Antimicrob Chemother 1990;26:31-44. [ Links ]
5. Shaad U, Sander E, Wedgwood J, Schaffner T. Morphologic studies for skeletal toxicity after prolonged ciprofloxacin therapy in two juvenile cystic fibrosis patients. Pediatr Infect Dis J 1992;11:1047-9. [ Links ]
6. Lumbiganon P, Pengasa K, Sookprane T. Ciprofloxacin in neonates and its possible adverse effect on the teeth. Pediatr Infect Dis J 1991;10:619-20. [ Links ]
7. Valerius M, Kosh C, holby N. Prevention of chronic Pseudomonas aeruginosa colonization in cystic fibrosis by early treatment. Lancet 1991;338:725-6. [ Links ]
8. Cross JT. Fluoroquinolones. Sem Pediat Infect Dis 2001; 12:211-28. [ Links ]
9. h ansen L, Eshen C, Brunn B. Neonatal Salmonella meningitis. Two cases reports. Acta Pediatr 1996;85:629-35. [ Links ]
10. Andriole V. The quinolones: past, present and future. Clin Inf Dis 2005;2:3113-9. [ Links ]
11. Shaad U. Will fluoroquinolones ever be recommended for common infections in children? Pediatr Infect Dis J 2007; 26:865-7. [ Links ]
12. Grady R. Safety profile of quinolone antibiotics in the pediatric population. Pediatr Infect Dis J 2003;22:1128-32. [ Links ]
13. Leibovitz E. The use of fluoroquinolones in children. Current Opinion Pediatr 2006;18:64-70. [ Links ]
14. American Academy of Pediatrics. The use of systemic fluoroquinolones. Pediatrics 2006;3:1287-92. [ Links ]
15. Rosenthal R. Meta-analytic procedures for social research. Newbury: Sage; 1991. [ Links ]
16. Richard D, Nousia-Arvanitakis S, Sollich V, hampel B, et al. Oral ciprofloxacin vs intravenous ceftazidima plus tobramycin in pediatric cystic fibrosis: comparison of antipseudomonal efficacy and assesment of safety with ultra sonography and magnetic resonace imaging. Pediatr Infect Dis J 1997;16:572-8. [ Links ]
17. Leibovitz E, Janco J, Piglansky L, Press J, et al. Oral ciprofloxacine vs intramuscular ceftriaxone as empiric treatment of acute invasive diarrhea in children. Pediatr Infect Dis J 2004;19:1060-7. [ Links ]
18. Salam MA, Dhar U, Khan WA, Bennish ML. Randomised comparison of ciprofloxacin suspension and pivmecillinam for childhood shigellosis. Lancet 1998;352:522-7. [ Links ]
19. Bethell DB, hien TT, Phi LT, Day NP, et al. Effects on growth of single short courses of fluoroquinolones. Arch Dis Child 1996;74:44-6. [ Links ]
20. Yee CL, Duffy C, Gerbino PG, Stryker S, et al. Tendon or joint disorders in children after treatment with fluoroquinolones or azithromycin. Pediatr Infect Dis J 2002;21:525-9. [ Links ]
21. Chalumeau M, Tonnelier S, D'Athis P, Tréluyer JM, et al. Fluoroquinolone safety in pediatric patients: a prospective, multicenter, comparative cohort study in France. Pediatrics 2003;111:714-9. [ Links ]
22. Drossou-Agakdou V, Roilides E, PapakyriaKidou-Koliouska. P, Agakidis C, et al. Use of ciprofloxacin in neonatal sepsis: lack of adverse effects up to one year. Pediatr Infect Dis J 2004;23:346-50. [ Links ]
23. Uddin Ahmed N, Khan N, Saha S, Chowdhury A, et al. Ciprofloxacin treatment in preterm neonates in Bangladesh: lack of effects on growth and development. Pediatr Infect Dis J 2006;25:1137-41. [ Links ]
24. Nuutinen M, Turtinen J, Uhari M. Growth and joint symptoms in children treated with nalidixic acid. Pediatr Infect Dis J 1994;13:798-800. [ Links ]
25. Dutta S, Chowdhary G, Kumar P, Mukhopadhay K, et al. Ciprofloxacin administration to very low birth weight babies has no effect on linear growth in infancy. J Trop Pediatr 2006;52:103-6. [ Links ]
26. Warren RW. Rheumatologic aspects of pediatric cystic fibrosis patients treated with fluoroquinolones. Pediatr Infect Dis J 1997;16:118-22. [ Links ]
27. Shaad U. Clinical radiologic and magnetic resonance monitoring for skeletal toxicity in pediatric patients with cystic fibrosis receiving a 3 months of cipro. Pediatr Infect Dis J 1991;10:723-9. [ Links ]
28. Burkhard JE, Walterspiel JN, Shaad UB. Quinolone arthropathy in animals versus children. Clin Infect Dis 1997; 25:1196-1204. [ Links ]
29. Forsythe C, Ernst M. Do fluoroquinolones commonly cause arthropathy in children? 2007;9:459-62. [ Links ]
30. Kubin R. Safety and efficacy of ciprofloxacin in paediatric patients-review. Infection 1993;21:413-21. [ Links ]














