Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.109 no.1 Buenos Aires ene./feb. 2011
ARTÍCULO ORIGINAL
Efectos de la administración de glucocorticoides prenatales en el desarrollo de la enterocolitis necrosante en neonatos de rata wistar
Effects of prenatal steroids in the development of necrotizing enterocolitis in wistar rat neonates
Sta. Laura Bortolind, Dr. Marcelo Boerc, Dra. Silvia Christiansenb, Dr. Hernán García Rivellob, Sta. Julieta Arbatd y Prof. Dr. Carlos Fustiñanaa,d
a. Servicio de Neonatología.
b. Servicio de Anatomía Patológica.
c. Servicio de Cirugía Pediátrica.
d. Instituto Universitario Escuela de Medicina e Instituto de Ciencias Básicas y Medicina Experimental.
Hospital Italiano de Buenos Aires.
Correspondencia: Prof. Dr. Carlos Fustiñana: carlos.fustinana@hiba.org.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 20-9-10
Aceptado: 14-12-10
RESUMEN
Objetivos. Estudiar el efecto de la administración prenatal de corticoides en la evolución clínica y el patrón histopatológico de la enterocolitis necrosante (ECN), en un modelo experimental.
Métodos. Se incluyeron neonatos de rata Wistar. El grupo de estudio (GT) recibió tratamiento con hidrocortisona (5 mg/kg) intraperitoneal, 24 y 48 h antes de la cesárea. El control (GC) recibió igual volumen de solución fisiológica. Los neonatos fueron mantenidos en incubadora a 35ºC sin exposición a leche materna. Se alimentaron por sonda orogástrica c/3 h. Se indujo ECN mediante hipoxia/hipotermia, tres veces al día durante 72 h. Se realizó resección intestinal completa e histopatología con asignación de puntaje de lesión.
Resultados. Los signos de ECN fueron irritabilidad y mal estado general, distensión abdominal, intolerancia alimentaria, eritema de pared y hematoquezia. El 60% (n= 9) del GC (n= 16) presentó al menos 1 signo clínico contra 40% (n= 6) del GT (n= 15). La aparición de signos clínicos y la evolución de los animales del GT llevó, objetivamente, un curso más leve y atenuado comparado con el GC. La mortalidad del GC fue del 40% contra 20% del GT. El estudio microscópico mostró que un 80% del GC presentaba histopatología compatible con ECN, con grados variables de lesión (50% de grado 3-4, correspondiente al máximo daño), mientras que solo 40% de los GT presentaba un patrón histológico compatible (p <0,05).
Conclusiones. El tratamiento prenatal con glucocorticoides demostró ser eficaz en la atenuación de la presentación clínica de la ECN en ratas Wistar.
Palabras clave: Enterocolitis necrozante; Modelo animal; Corticoides prenatales.
SUMMARY
Introduction. Necrotizing enterocolitis (NEC) is a frequent problem in preterm infants. Prenatal treatment with steroids proved to be effective for lung maturation and it is thought to have a protective effect on the immature bowel.
Objectives. To study the effects of prenatal treatment with steroids at the onset, clinical course and histological pattern of NEC in an animal model.
Methods. Pregnant rats received treatment with intraperitoneal hydrocortisone (5 mg/kg) 24 and 48 hrs prior to the expected date of delivery (group S). Control pregnant rats were injected with normal saline, at the same timing (group P). After term delivery by cesarean section, both groups were kept in identical conditions in a neonatal incubator at 35ºC, away from their mothers to prevent any exposure to breast milk. Pups were fed every three hours with neonatal formula via an orogastric tube. To further increase the susceptibility to NEC, pups were exposed to hypoxia followed by hypothermia three times a day for 72 hrs (H-H) or until development of clinical signs of NEC. At that point, each animal was anesthetized and euthanized. The intestine was fixed for histological analysis. Those animals which died before 72 hours were excluded to prevent false positive results in the histopathological exam.
Results. The clinical signs of NEC include oral intolerance, gastric residuals, respiratory distress, abdominal distension, wall erythema and hematochezia; 60% of animals in group P (n= 16) presented with at least one clinical sign, vs. 40% of pups in group S (n= 15). The onset of clinical signs and clinical course in group S was more benign than in group P. Mortality rate was 40% for pups in group P vs. 20% for group S (NS). Histological analysis indicated that 80% of the animals from group P showed signs of NEC, of which 50% reached grade 3-4 (maximum score of damage), whereas only 40% of the animals in group S presented with signs of NEC (p<0.05), all were of grade 0-1 (minimum histological damage).
Conclusions. Prenatal treatment with steroids was effective for amelioration of the onset and clinical presentation in this model of experimental NEC.
Key words: Necrotizing enterocolitis; Animal model; Prenatal steroids.
INTRODUCCIÓN
La enterocolitis necrosante (ECN) es una entidad grave y prevalente que afecta predominantemente a neonatos pretérmino. Los eventos desencadenantes no han sido establecidos con claridad, pero se la ha asociado con múltiples factores, como: infección, alimentación enteral, estrés, parto por cesárea e inestabilidad circulatoria como integrantes de la fisiopatología de la ECN.1,2
La ECN presenta una alta mortalidad en sus formas graves y, además, tanto por su tratamiento clínico como quirúrgico, presenta un espectro de morbilidad que incluyen: estenosis, fístulas, abscesos, síndrome de malabsorción y ECN recurrente. Otras complicaciones son secundarias a la nutrición parenteral prolongada, como la colestasis y la trombosis venosa secundaria a accesos venosos centrales; el síndrome de intestino corto, el síndrome compartimental postoperatorio, la oclusión intestinal y las complicaciones de los ostomas se asocian con su tratamiento quirúrgico.3,4
Esta entidad constituye la causa más común de morbilidad dentro del grupo de neonatos con patología quirúrgica y alcanza valores de mortalidad de hasta 60% en los grados IV;5,6 publicaciones recientes muestran valores menores, pero continúa siendo alta.7
La investigación en este campo ha sido intensa, en especial en la búsqueda de desarrollar modelos reproducibles de ECN en animales de laboratorio, con el objeto de estudiar los mecanismos fisiopatogénicos y probar estrategias de prevención y tratamiento adecuadas.
En el campo de la prevención, la terapia prenatal con glucocorticoides en pacientes embarazadas con riesgo de parto prematuro entre las 24 y las 34 semanas demostró ser un método eficaz para alcanzar un grado de maduración pulmonar fetal adecuado para disminuir la morbimortalidad fetal; asimismo, se observó un incremento de la madurez intestinal por activación de la absorción de lactosa. Un estudio multicéntrico sobre el uso de corticoides prenatales observó como resultado secundario disminución de la incidencia de ECN.8
El objetivo del presente estudio fue evaluar el efecto del tratamiento prenatal con hidrocortisona en la incidencia y gravedad de ECN en un modelo animal.
MATERIAL Y MÉTODOS
Se aleatorizaron tres grupos de animales de estudio: hembras de rata Wistar con libre acceso a agua y alimento, mantenidas en bioterio en jaula individual, con ciclos de luz-oscuridad de 12 horas y a 20 °C, preñadas (ver Figura 1).
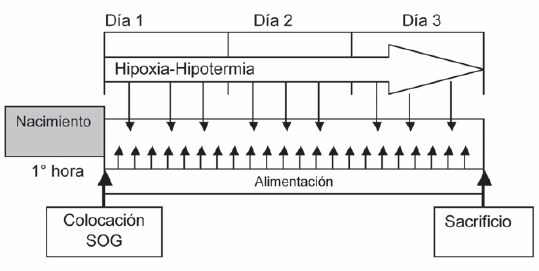
Figura 1: Diagrama con la estrategia experimental de génesis de la enterocolitis necrosante
Al Grupo Tratamiento (GT) se le administró 2 dosis de hidrocortisona (5 mg/kg) por vía intraperitoneal a las 24 y 48 horas antes de la fecha probable de parto (día 21 de gestación), mientras que al Grupo Control se le administró, simultáneamente, el mismo volumen de suero fisiológico por la misma vía. Se estableció, además, un Grupo Sin Intervención (grupo testigo simulado [sham]), hembras preñadas a las cuales se les permitió continuar con su preñez hasta el término sin intervención alguna.
Inducción de ECN (según Barlow y Santulli): al cabo de 21 días (tiempo de gestación promedio) se realizó la cesárea a las hembras preñadas de cada grupo. Se la efectuó en incubadora luego de inducción anestésica con sevofluorano inhalatorio mediante campana. Se colocó al animal en decúbito dorsal, se lo fijó y se administró anestesia intraperitoneal con xilocaína + ketamina a dosis estándar según peso. Se evaluó el estado anestésico mediante la búsqueda del reflejo palpebral y la respuesta al dolor. La antisepsia se realizó con iodopovidona y luego de la colocación de campos quirúrgicos se realizó una incisión mediana subxifoidea con diéresis por planos y hemostasia.
Luego de la localización y exteriorización del útero se realizó una incisión longitudinal, extracción manual de los fetos después de la incisión del saco amniótico y ligadura y sección del cordón umbilical.
Se procedió, por último, al inmediato secado y estimulación bajo lámpara infrarroja de las crías y la ligadura de pedículos vasculares e histerectomía, hemostasia y sutura por planos. Antisepsia y recuperación en incubadora para mantener normotermia. Todas las crías fueron secadas, estabilizadas y pesadas.
Protocolo de alimentación: se inició a los 30 minutos de vida con la colocación de sonda orogástrica (SOG) (catéter Percutáneo de Silastic, Vygon® calibre 2F) y alimentación con fórmula comercial. Para lograr un aporte de 200 Kcal/kg/ día, comparables con las aportadas por la leche de rata, se alimentó a cada animal con 0,3 ml de fórmula cada tres horas. Se realizó estimulación manual para favorecer la deglución en cada turno de alimentación. El control y registro de peso se realizó en forma diaria en balanza electrónica con error de 0,05 gramos.
Estrés por hipoxia: colocación simultánea de cada animal del grupo en cámara acrílica hermética precargada con nitrógeno gaseoso al 100% durante 60 segundos.
Estrés por hipotermia: inmediatamente después de la hipoxia, colocación de ambos grupos en cámara a 4 ºC, durante 10 minutos. Una vez finalizado el procedimiento, colocación del grupo en su jaula de origen dentro de la incubadora.
Esta secuencia se repitió tres veces al día a las 8:00, 14:00 y 20:00 horas.9
Al cabo de 72 h o ante a la aparición de uno o más signos clínicos de ECN (letargia, distensión abdominal, eritema de pared, intolerancia oral, vómitos, hematoquezia o dificultad respiratoria) se procedió a la cirugía. Los animales que presentaron mortalidad espontánea antes de completar el protocolo hipoxia-hipotermia fueron excluidos, para evitar la interpretación de fenómenos líticos postmortem como un falso positivo de lesión intestinal.
Resección intestinal: se realizó anestesia general de las crías con sevofluorano inhalatorio a través de máscara y con el animal en decúbito dorsal; mediante incisión mediana subxifoidea hasta hipogastrio se exteriorizó el intestino, se identificaron las áreas comprometidas y se efectuó la resección intestinal desde duodeno hasta recto-sigmoides. Luego se procedió al lavado de la pieza quirúrgica con solución fisiológica y fijación inmediata en formol al 10%. Por último, se procedió a la eutanasia mediante cardiotomía.
Para el estudio histopatológico se realizó tinción con hematoxilina-eosina según técnica habitual y análisis de cada muestra por un médico patólogo pediatra, ciego al grupo asignado al azar. Se otorgó el puntaje de lesión intestinal utilizado en modelos animales de ECN descripto por Jilling: 10,11 Grado 0, histología normal; Grado 1, esfacelo superficial del extremo de la vellosidad intestinal; Grado 2, necrosis vellositaria; Grado 3, pérdida vellositaria y Grado 4, destrucción completa de la mucosa con necrosis y hemorragia transmural.
El presente estudio fue aprobado por el Comité de investigación del HIBA (2006) y financiado por una Beca de la Fundación Gianantonio.
RESULTADOS
La Figura 2 muestra la distribución de las crías de los dos grupos estudiados. El Grupo Sham (no incluido en la Figura 2) no mostró lesiones compatibles con NEC; 6 crías (2 en el grupo tratado y 4 en el control) fallecieron durante la inducción de hipoxia-hipotermia y no ingresaron en el estudio.
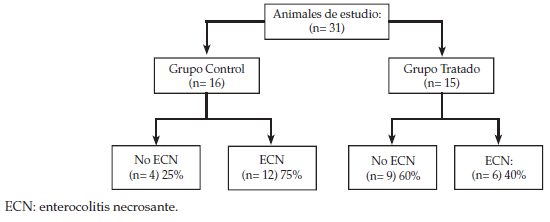
Figura 2: Distribución de los animales en estudio
El peso promedio al nacer de todos animales (término) fue de 5,7 ± 0,5 g, sin observarse diferencias significativas entre los 3 grupos. Pese al correcto cálculo del aporte calórico necesario, se registró una disminución diaria del peso de 0,5± 0,2 g en ambos grupos (NS).
En el Grupo Control (n = 16), 9 (60%) de los animales presentaron al menos 1 signo clínico de ECN, mientras que en el Grupo Tratado (n = 15), solo 6 (40%) cumplió esta condición. La aparición de signos clínicos y la evolución ulterior de los animales del Grupo Tratado llevó, objetivamente, un curso más leve y atenuado en comparación con el Grupo Control. La mortalidad antes de las 72 h del Grupo Control llegó al 40% mientras que en el Grupo tratado fue de 20% (Tabla 1). Como puede verse en la Figura 3, se observó un predominio de lesiones macroscópicas en el Grupo Control (A) en comparación con el Tratado (B).
Tabla 1: Características de la población
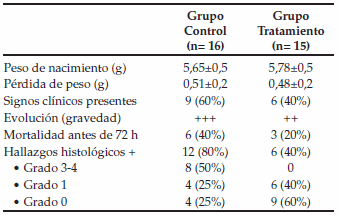
Figura 3: Vista macroscópica de pieza quirúrgica correspondiente a animal del Grupo Tratado (A). Compárese con la necrosis y la hemorragia en la pieza del Grupo Control (B)
El estudio histológico (ver Figura 4) mostró que un 80% de los animales del Grupo Control presentaba histopatología compatible con ECN, con grados variables de lesión, 50% de grado 3-4, (B) correspondiente al máximo daño, mientras que solo 6 (40%) de los tratados presentaba un patrón histológico (A) compatible con lesión intestinal y todos de grado 0-1 (mínima lesión) y el resto sin lesiones. Estas diferencias fueron significativas (p<0,05, OR= 0,17, IC 95%: 0,04-0,79).
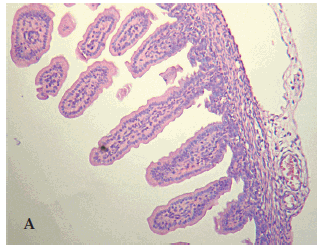
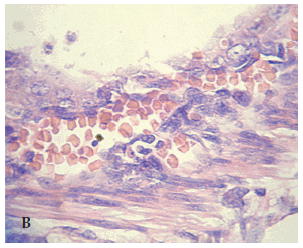
Figura 4: Histopatología correspondiente a animal del Grupo tratado (A), grado 1 y del Grupo control (B), compatible con grado 3-4 de lesión intestinal por ECN (10x)
DISCUSIÓN
Existen diversos modelos de inducción experimental de ECN, como: hipoxia generada por atmósfera de CO2,11 durante 5 minutos, seguida de reoxigenación durante 10 minutos, disminución del daño con leche humana,13-16 distensión intestinal mediante inyección de aire intrarrectal,17 hipoxia- reoxigenación sin distensión intestinal18,19 y clampeo de la arteria mesentérica superior con inyección intraluminal de PAF (factor activador de plaquetas) y sin ella.20,21
El modelo descrito por Barlow y Santulli, y sus sucesivas adaptaciones,9,20 a pesar de las dificultades técnicas para su implementación, es el más representativo de la serie de episodios que conducen a la ECN13,16,22 en los seres humanos, pues toma en cuenta la ingesta como un factor desencadenante y significativo en su fisiopatología.
Una de las dificultades para la inducción de ECN en este modelo es que presenta una alta tasa de mortalidad de las crías antes de la iniciación de la lesión. En nuestro caso, la tasa de pérdida de crías fue similar a la comunicada por otros autores y por nosotros mismos en la puesta a punto del modelo, siendo ésta dependiente de causas perinatales e instrumentales. La principal complicación es la recuperación posanestésica. La madre debe ser sometida a anestesia general, lo cual implica que las crías nazcan también anestesiadas, hecho que dificulta la adaptación a la respiración espontánea y constituye la principal causa de muerte. Además, durante la anestesia intraperitoneal y debido al desplazamiento medial del útero bicorne por la cantidad de fetos, aumenta la posibilidad de punzar directamente a un feto intraútero, con el consecuente impacto en la mortalidad fetal y materna, esta última por falta de adecuada anestesia.
La recuperación posanestésica bajo lámpara infrarroja y el traslado inmediato a incubadora se vuelven imprescindibles para prevenir la hipotermia, que se traduce clínicamente como letargia, rechazo al alimento y aumento de la mortalidad durante las primeras 24 h, signos que son también compatibles con ECN (por ello se tuvo extremo cuidado en evitarla). La pérdida de peso que se registra en los animales de estudio (pese al correcto cálculo del volumen de la fórmula y el aporte calórico), probablemente sea atribuible en parte a las dificultades que presenta la colocación de una sonda orogástrica y la consecuente alimentación con la totalidad del volumen calculado, y al rechazo del alimento como signo temprano de ECN.
Una de las principales dificultades del estudio es que se requieren controles muy estrictos y frecuentes, especialmente a partir de las 24-36 h de comenzada la inducción para resecar el intestino mientras el animal todavía vive (previo a la muerte espontánea).
La comprobación de lesión histopatológica (grados 3-4) en animales expuestos a fórmula más estrés se equipara a los resultados obtenidos por diversos grupos de investigación que inoculan LPS por vía oral, previo al inicio de la alimentación con fórmula como medio para maximizar la tasa de obtención de ECN, por lo cual este modelo muestra capacidad para producir ECN en condiciones similares a las de la clínica.
En el presente estudio, el uso de hidrocortisona mostró una capacidad de reducir el daño de la mucosa intestinal en ratas sometidas a estrés. Resta dilucidar cuál es el mecanismo de este efecto protector.22,24 Creemos que el uso prenatal de corticoides puede interferir en la lesión epitelial directa por peroxidación de la membrana e inhibir la apoptosis25 por inactivación de la procaspasa 3, evitando el daño mitocondrial por liberación del citocromo C.
1. Gabargnati CS, Ceriani Cernadas JM. Enterocolitis necrosante. En: Neonatología Práctica. 4ª Ed. Buenos Aires: Médica Panamericana, 2009: Págs. 695-703. [ Links ]
2. Gabargnati CS, Lobos P. Enetrocolitis necrosante. En: PRONEO-Programa de Actualización en Neonatología. 5° ciclo, Módulo 1. Buenos Aires: Médica Panamericana, 2002: Págs. 175-193. [ Links ]
3. Henry M, Moss L. Necrotizing enterocolitis. En: Ashcraft KW, Murphy JP, Sharp RJ, Sigalet DL, Snyder CL. Pediatric surgery. Ed W.B. Saunders Co, 2000. [ Links ]
4. Martínez Ferro M, Cannizaro C, Rodríguez S, Rabasa C. Neonatología Quirúrgica. Buenos Aires: Grupo Guía, 2004: Págs. 527-544. [ Links ]
5. Neu J. Neonatal necrotizing enterocolitis: An update. Acta Paediatric 2005; 94(Suppl 449):100-105. [ Links ]
6. Kliegman RM, Fanaroff AA. Necrotizing enterocolitis. N Eng J Med 1984; 310 (17): 1093-1103. [ Links ]
7. Stoll BJ, Hansen NI, Bell EF, Shankaran S, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics 2010; 126(3):443-56. [ Links ]
8. Bauer CR, Morrison JC, Poole WK, Korones SB, et al. A decreased incidence of necrotizing enterocolitis after prenatal glucocorticoid therapy. Pediatrics 1984; 73(5):682-8. [ Links ]
9. Barlow B, Santulli TV. Importance of multiple episodes of hypoxia or cold stress on the development of enterocolitis in an animal model. Surgery 1975; 77(5):687-690. [ Links ]
10. Jilling T, Lu J, Jackson M, Caplan M. Intestinal epithelial apoptosis initiates gross bowel necrosis in an experimental rat model of neonatal necrotizing enterocolitis. Pediatr Res 2004; 55(4):622-629. [ Links ]
11. Hsueh W, Caplan MS, Qu XW, Tan XD, et al. Neonatal necrotizing enterocolitis: Clinical considerations and pathogenetic concepts. Pediatr Dev Pathol 2003; 6:6-23. [ Links ]
12. Clark JA, Lan RH, Maclennan NK, Holubec H, et al. Epidermal growth factor reduces intestinal apoptosis in an experimental model of necrotizing enterocolitis. Am J Physiol Gastrointest Liver Physiol 2005; 288(4):G755-762. [ Links ]
13. Dvorak B, Halpern MD, Holubec H, Dvorakova K, et al. Maternal milk reduces severity of necrotizing enterocolitis and increases intestinal IL-10 in a neonatal rat model. Pediatr Res 2003; 53(3):426-433. [ Links ]
14. Halpern MD, Holubec H, Dominguez JA, Williams CS, et al. Up-regulation of IL-18 and IL-12 in the ileum of neonatal rats with necrotizing enterocolitis. Pediatr Res 2002; 51(6):733-39. [ Links ]
15. Caplan MS, Lickerman M, Adler L, Dietsch GN, Yu A: The role of recombinant platetet-activating factor in a neonatal rat model of necrotizing enterocolitis. Pediatr Res 1997; 42(6):779-783. [ Links ]
16. Kelly N, Friend K, Boyle P, Zhang XR, et al. The role of the glutathione antioxidant system in gut barrier failure in a rodent model of experimental necrotizing enterocolitis. Surgery 2004; 136(3):557-566. [ Links ]
17. Nadler EP, Dickinson E, Knisely A, Zhang R, et al. Expression of inducible nitric oxide synthase and interleukin-12 in experimental necrotizing enterocolitis. J Surg Res 2000; 92(1):71-77. [ Links ]
18. Caplan MS, Russell T, Xiao Y, Amer M, et al. Effect of polyunsaturated fatty acid supplementation on intestinal inflammation and necrotizing enterocolitis in a neonatal rat model. Pediatr Res 2001; 49(5):647-652. [ Links ]
19. Kazez A, Küçükaydin N, Küçükaydin M, Kontas O, et al. A model of hypoxia-induced necrotizing enterocolitis: the role of distension. J Pediatr Surg 1997; 32(10):1466-1469. [ Links ]
20. Okur H, Küçükaydin M, Köse K, Kontas O, et al. Hypoxiainduced necrotizing enterocolitis in the immature rat: the role of lipid peroxidation and management of vitamin E. J Pediatr Surg 1995; 30(10):1416-1419. [ Links ]
21. Akisu M, Küllahçioglu GF, Baka M, Hüsseyinov A, Kültürsay N. The role of recombinant human erythropoietin in lipid peroxidation and platelet-activating factor generation in a rat model of necrotizing enterocolitis. Eur J Pediatr Surg 2001; 11(3):167-172. [ Links ]
22. Akisu M, Baka M, Hüsseyinov A, Kültürsay N. The role of dietary supplementation with L-glutamine in inflammatory mediator release and intestinal injury in hipoxia/ reoxygenation-induced experimental necrotizing enterocolitis. Ann Nutr Metab 2003; 47(6):262-266. [ Links ]
23. Chung DH, Ethridge RT, Kim S, Owens-Stovall S, et al. Molecular mechanisms contributing to necrotizing enterocolitis. Ann Surg 2001; 233(6):835-842. [ Links ]
24. Dimmitt RA, Glew R, Colby C, Brindle M, et al. Serum cytosolic b-glucosidase activity in a rat model of necrotizing enterocolitis. Pediatr Res 2003; 54(4):462-465. [ Links ]
25. Lin PW, Stoll M. Necrotizing enterocolitis. Lancet 2006; 368(9543):1271-1283. [ Links ]














