Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.109 no.2 Buenos Aires mar./abr. 2011
ACTUALIZACIÓN
Estado actual del trasplante de células hepáticas en Pediatría
Hepatic cell transplantation in childhood. State of the art
Dr. Anselmo A. Bolognaa, Lic. Mariana R. Barbicha, Dr. Daniel D'Agostinob y Dr. Pablo F. Argibaya,b
aInstituto de Ciencias Básicas y Medicina Experimental (ICBME) del Hospital Italiano de Buenos Aires.
bHospital Italiano de Buenos Aires.
Correspondencia: Dr. Pablo F. Argibay: pablo.argibay@hospitalitaliano.org.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 22-12-10
Aceptado: 23-02-11
RESUMEN
En la actualidad, los niños que padecen insuficiencia hepática podrían beneficiarse de un método no convencional de reemplazo funcional, alternativo al trasplante hepático. El deterioro y muerte de los pacientes en lista de espera, impulsan la búsqueda de alternativas en el ámbito del trasplante. El trasplante de células hepáticas se ha constituido en un potencial recurso cuya validación como alternativa o puente al trasplante hepático seguramente resultaría en una sustancial mejoría tanto en la calidad de vida como en la supervivencia de los pacientes. En la presente revisión nos proponemos describir el estado del arte en trasplante de hepatocitos en pediatría.
Palabras clave: Hepatocitos; Trasplante; Enfermedades metabólicas; Hígado.
ABSTRACT
To date, children who suffer from a certain type of illness such as hepatic failure, could benefit with a non conventional functional replacement as an alternative to liver transplantation. Deterioration and death of patients on waiting list encourage the search for alternatives methods within transplantation. Liver cell transplantation has become a potential alternative treatment whose validation as an alternative or as a bridge until the donor appears, will probably contribute to improve the quality of life and survival of the patients. The aim of this review is to describe the state of the art of hepatocyte transplantation in pediatric patients.
Key words: Hepatocyte; Transplantation; Metabolical diseases; Liver.
INTRODUCCIÓN
El trasplante hepático constituye actualmente un tratamiento de valor comprobado para las enfermedades hepáticas terminales agudas y crónicas y para todas aquellas refractarias a otros tratamientos. 1
Existen al menos tres situaciones en las cuales los pacientes que sufren de insuficiencia hepática se beneficiarían de un método no convencional de reemplazo funcional, alternativo al trasplante hepático: la falla hepática aguda (FHA),2 la falla hepática aguda sobre enfermedad crónica (FHAsC)3 y ciertas enfermedades metabólicas.
La escasa oferta de donantes de órganos constituye un factor limitante importante en esta modalidad terapéutica.
Con el empleo de las diferentes técnicas de implantes con hígado completo, hígado reducido, hiper-reducido y el "split liver" (hígado para dos) se ha intentado paliar la escasez de órganos. Sin embargo la situación continúa y la falta de donantes apropiados provoca un largo período de espera con empeoramiento del cuadro clínico e inclusive la muerte en lista de trasplante.4
En los últimos años el trasplante de células hepáticas ha surgido como un potencial procedimiento complementario o alternativo al trasplante hepático,5-11 por lo menos en ciertas circunstancias. La aplicación de esta modalidad terapéutica se fundamenta en el concepto que el trasplante celular permitiría suplir la función del órgano afectado, ya fuera en forma transitoria, a la espera de la recuperación del órgano propio o la oportunidad de un trasplante, o permanente, evitando la necesidad de dicho procedimiento.
ASPECTOS GENERALES
El desarrollo de este recurso terapéutico significa una nueva oportunidad para los niños con enfermedad hepática y principalmente para aquellos que sufren de una enfermedad metabólica (Tabla 1) con ciertas ventajas en comparación con el trasplante hepático. Podemos destacar el hecho de ser un procedimiento menos invasivo y riesgoso, y que presenta un menor costo. Existe asimismo una mayor disponibilidad del material a trasplantar ya que se podrían utilizar como fuente de células, órganos considerados "marginales",12 material resultante de reducciones, 13,14 de hepatectomías parciales y órganos de donantes cadavéricos en paro cardíaco.15 Por otro lado, permitiría la posibilidad de utilizar un donante para varios receptores. Pese a las ventajas de disponibilidad señaladas, el contar con las células en el momento apropiado, sigue siendo un problema que quedaría definitivamente resuelto de lograrse el cultivo14,16 y la preservación de hepatocitos a gran escala17,18 y la diferenciación y proliferación de células hepáticas a partir de distintos precursores. Una modalidad importante a considerar, sería la posibilidad del autotrasplante que, a futuro, abriría las puertas a la aplicación de terapia génica, de particular importancia en el caso de aplicarse al tratamiento de los trastornos metabólicos hepáticos.
Tabla 1. Condiciones metabólicas potencialmente tratables

Las enfermedades metabólicas hepáticas pueden ser divididas en aquellas que llevan daño estructural con o sin lesión de otros tejidos (déficit de alfa 1 antitripsina, fibrosis quística del páncreas, enfermedad de Wilson, etc.) y aquellas en las que el defecto metabólico se expresa solamente o predominantemente en el hígado sin alteración de su estructura pero que pueden provocar lesión a otros órganos o sistemas (hiperoxaluria, trastornos del ciclo de la urea, hipercolesterolemia familiar, Crigler-Najjar, etc.).
El tratamiento conservador de estas enfermedades se basa fundamentalmente en la utilización de costosas dietas y numerosas medicaciones para lograr un equilibrio pero con potenciales recaídas y agravamientos, que alteran la calidad de vida y ponen en riesgo de muerte o de daño neurológico a los pacientes.19
Aunque individualmente raras, cuando son consideradas en conjunto representan la tercera causa de trasplante en la infancia y en ciertas instituciones se ubica en el segundo lugar luego de la atresia de vías biliares.20
Un aspecto interesante a destacar, es la ventaja sustancial respecto del trasplante hepático dada por el hecho de que frente a la eventualidad de una falla funcional o pérdida del injerto, la permanencia del órgano propio permitiría a este actuar como respaldo, evitando poner en riesgo la vida del paciente.
Si bien la insuficiencia hepática aguda y crónica no se descartan como condiciones potencialmente tratables,21-26 el escaso número de casos comunicados impide sacar conclusiones definitivas respecto de los resultados, así como avanzar en el conocimiento de la fisiología del trasplante en dichas condiciones o evaluar aspectos técnicos que permitan optimizar el procedimiento en tales situaciones.22 En el caso de la insuficiencia hepática aguda esta modalidad terapéutica conllevaría el beneficio de permitir, a través del restablecimiento temporal de la función hepática, la eventual recuperación del órgano propio, evitando la necesidad de un trasplante hepático y, en consecuencia, de inmunosupresión de por vida.
Antecedentes
Antecedentes preclínicos
El primer informe de trasplante de células hepáticas en el ámbito de la experimentación con animales, con el fin de modificar la capacidad funcional del hígado, data del año 1976.27
A fin de reducir la brecha entre la experimentación preclínica y clínica, los investigadores han utilizado modelos animales con alteraciones hepáticas funcionales similares a las observadas en los seres humanos. Dichos modelos han incluido animales con alteraciones del ciclo de la urea,28 trastornos del metabolismo del cobre, 29 ratas de Gunn, que emulan al síndrome de Crigler-Najjar tipo I,27 ratones deficientes en fumarilacetoacetato como modelo de tirosinemia,30 perros afectados de hiperuricemia,31 ratones con histidinemia,32 conejos de Watanabe que presentan hipercolesterolemia33 y ratas analbuminémicas.34 De la misma forma, se han desarrollado modelos de falla hepática aguda35-38 y crónica.26, 39-41
Estos modelos han puesto de manifiesto la posibilidad cierta de modificar el estatus metabólico de base de los animales tratados evidenciando, además, la capacidad de supervivencia del material trasplantado a mediano y largo plazo y permitiendo el ensayo de diferentes estrategias y la aplicación de diferentes variables a fin de perfeccionar la técnica, mejorar el implante inicial de las células, su supervivencia y posterior proliferación.42-44
Antecedentes clínicos
En el curso del desarrollo de la experimentación clínica, se han llevado a cabo aproximadamente 80 trasplantes en distintos centros45 incluyendo pacientes con trastornos metabólicos así como casos de insuficiencia hepática aguda y crónica, en fase terminal. Desafortunadamente, debido a lo diverso de los protocolos aplicados, así como a lo heterogéneo de la población tratada, resulta sumamente dificultoso extraer conclusiones definitivas a través de una valoración conjunta de los resultados. Luego del primer informe de trasplante en humanos, publicado por Mito y Kusano en 1992,46 son de destacar algunas publicaciones. Habibullah,23 en 1994, publica los casos de 5 pacientes afectados por una FHA, concluyendo que el trasplante de células fetales humanas intraperitoneales habría sido responsable de la mejoría observada en la supervivencia de los pacientes. Grossman,47 en 1995, comunica un estudio de terapia génica ex-vivo tratando pacientes, afectados de hipercolesterolemia familiar, a través del autotrasplante de células hepáticas previamente manipuladas genéticamente, logrando una modesta reducción de los niveles de colesterol, pero sin embargo demostrando la factibilidad del autotrasplante. Ira Fox y col.48 publica, en 1998, el tratamiento de una niña de 10 años portadora del síndrome de Crigler-Najjar Tipo I. En este caso, se infundieron 7,5 x 109 células, por vía portal, a través de la colocación de un catéter transparieto-hepático. El seguimiento, a través del laboratorio en los meses siguientes, evidenció una marcada reducción de las concentraciones séricas de bilirrubina, y en consecuencia una disminución de los requerimientos de horas de fototerapia diaria. Más recientemente, en 2009, Meyburg y col.49 informaron cuatro casos de niños afectados por desórdenes en el ciclo de la urea trasplantados con células hepáticas aisladas de un mismo donante. No se observaron complicaciones del método y en todos los casos se logró la estabilización de la condición metabólica de los pacientes durante el período de control que osciló entre 4 y 13 meses.
En la Tabla 2 se muestran las experiencias de trasplante más relevantes tanto pediátricas como en adultos en los últimos 5 años.
Tabla 2. Trasplante de células hepáticas en humanos
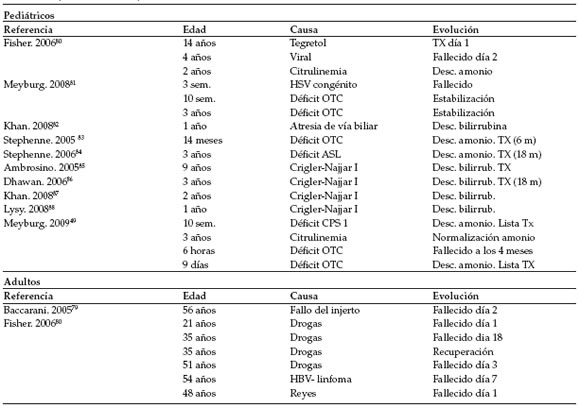
OTC: Ornitin transcarbamilasa, ASL: Arginin succinil liasa, CPS 1: Carbamoil fosfato sintetasa, TX: Trasplante hepático.
Desc: Descompensación. HSV: Virus Herpes simplex HBV: Virus de Hepatitis B, bilirrub: bilirrubina.
la problemática del trasplante celular
Los resultados obtenidos en ensayos experimentales, si bien alentadores, no han sido del todo satisfactorios. En el caso de los ensayos clínicos, aunque se lograron mejorías parciales y transitorias en los estados de base de los pacientes, en última instancia no evitaron la necesidad de un posterior trasplante como tratamiento definitivo.
Estos resultados obedecerían a la incapacidad para lograr el implante y supervivencia de suficiente cantidad de células y su posterior proliferación, impidiendo alcanzar un "volumen de masa celular crítica" capaz de determinar un cambio suficiente y sostenido del estado funcional del órgano. Ello resultaría fundamentalmente de la pérdida inicial de una importante fracción de las células trasplantadas, estimándose que solo el 30% de las mismas logra implantarse, y de la acción de factores que determinarían su posterior pérdida a través de fenómenos de necrosis, apoptosis o anoikis. Esta última consiste en una forma de muerte celular programada desencadenada por la falta de contacto de la célula con la matriz extracelular.
Dos conceptos claves, a los fines de lograr la repoblación exitosa del hígado, son los de "estímulo mitótico" y "ventaja de proliferación".
Aunque la mayoría de los procedimientos ensayados en animales probablemente no sean aplicables en el ámbito de la práctica clínica, dos de ellos, la irradiación hepática50 y la embolización parcial del órgano,51 podrían considerarse como potencialmente factibles, otorgando a las células trasplantadas ventaja de proliferación y un estímulo mitótico apropiado.
El sitio en el que se implantarán las células, el número, la vía y las condiciones del microambiente al que serán expuestas las células durante el procedimiento resultarían determinantes a los fines de lograr un trasplante exitoso.
Sitio de implante
Podría suponerse que el sitio más apropiado para trasplantar células hepáticas sería el hígado; sin embargo, en determinadas condiciones, en las que se evidenciaran profundos cambios en la arquitectura del órgano o en el microambiente hepático, podría no ser así. En dichas circunstancias seguramente la célula trasplantada encontraría un ambiente muy poco favorable tanto para el implante como para la proliferación.
Existen a la fecha comunicaciones de trasplantes en sitios distintos del hígado, tales como tejido celular subcutáneo,52,53 renal subcapsular,54 páncreas, 55 peritoneo56-59 y bazo60-62 sin resultados que evidencien ventajas de uno respecto a otro y tampoco respecto del hígado.
Número de células y administración
El número de células que deberán trasplantarse con el fin de recuperar la función perdida, variará de acuerdo con la patología considerada ya que probablemente para tratar un trastorno metabólico será mucho menor que para revertir la situación en el caso de un cuadro de insuficiencia hepática fulminante. En el primer caso, se calcula que debería trasplantarse un número de células equivalente a un 5-10% de la masa hepática del receptor.
Por otro lado, en la medida que fuera necesario, a fin de mantener la recuperación funcional del órgano, si no se lograra la repoblación celular permanente, el procedimiento de trasplante podría repetirse en forma periódica.
Vías
La vía de trasplante dependerá fundamentalmente de la elección del sitio de implante. En el caso del hígado, una de las utilizadas con mayor frecuencia es la infusión celular a través de la vena porta.
La utilización de esta vía se fundamenta en el hecho comprobado de que, una vez en la circulación portal, los hepatocitos trasplantados serían conducidos hasta los sinusoides portales desde donde migrarían para integrarse al lobulillo.
Preservación de las células
Lograr la preservación a largo plazo y a gran escala de las células conllevaría un importante avance en la estrategia de aplicación del trasplante celular, ya que permitiría disponer de las células necesarias en tiempo y forma. Si bien hasta ahora los mayores esfuerzos han tenido por objetivo mejorar las técnicas de criopreservación, los resultados obtenidos no han sido del todo satisfactorios. Las células sometidas a este procedimiento presentan una marcada disminución de su viabilidad y de su capacidad metabólica, afectando sin duda la capacidad de implante y supervivencia luego del trasplante. En la actualidad, se ensayan nuevas estrategias que, aunque basadas en la aplicación de bajas temperaturas, no utilizan el congelamiento como medio de preservación. 63,64
Origen de los hepatocitos
Como fue señalado anteriormente, las células a trasplantar pueden tener diversos orígenes: provenir de órganos considerados "marginales", del material resultante de reducciones, de hepatectomías parciales e incluso de donantes cadavéricos en paro cardíaco. En la actualidad, se están considerando otras potenciales fuentes de hepatocitos que involucrarían la diferenciación a partir de precursores tales como células progenitoras hepáticas o células madre de origen hepático65 o extrahepático.66 Células hepáticas fetales,67 células madre de origen embrionario68 y placentario, 69 junto con células mesenquimales de médula ósea,70 cordón umbilical71 y tejido adiposo72 se cuentan entre las consideradas con mayor frecuencia como potenciales fuentes , y sobre las que existe alguna experiencia.
Si bien las células madre embrionarias constituyen uno de los recursos de mayor valor en la terapia celular y la ingeniería de tejidos, existe actualmente un fuerte debate ético y científico en torno de su utilización.
El procedimiento
Aislamiento celular
El aislamiento de las células hepáticas se lleva a cabo a través del método de Seglen73 que consiste en la perfusión del órgano con una solución de lavado, seguida de la perfusión con una solución enzimática para digerir la matriz extracelular y liberar los hepatocitos.
Trasplante
Durante la infusión de los hepatocitos por vía portal se generan cambios vasculares,74-78 tanto a nivel hemodinámico como a nivel de la microcirculación hepática resultante del enclavamiento de las células a nivel sinusoidal. Ello se traduce en un aumento de la presión venosa portal que, aunque transitorio, en algunos casos ha sido de marcada intensidad y asociado a modificaciones radiológicas en el lecho vascular portal caracterizado por la amputación de las ramas portales de 2do y 3er orden.74
Sin embargo, los casos de complicaciones relacionadas a la infusión de las células por esta vía, tales como trombosis portal o hipertensión portal clínicamente significativas son sumamente raras.79
Inmunosupresión
No existe consenso acerca de cuál sería el esquema inmunosupresor más apropiado y la mayoría de los centros utilizan el mismo que para el caso del trasplante hepático. La utilización de un anticalcineurínico (en la mayoría de los caso Tacrolimus) asociado o no a esteroides y a anticuerpos monoclonales contra receptores IL-2 han sido los esquemas más utilizados.
Están siendo estudiadas nuevas técnicas y estrategias que permitan el trasplante de las células sin la necesidad de inmunosupresión.
Valoración del implante
La falta de un método apropiado que permita determinar no solo qué fracción del total de las células trasplantadas se han implantado sino el lugar en el que lo han hecho (migración) y su funcionalidad, impide la apropiada valoración del procedimiento de trasplante.
El restablecimiento de la función perdida obraría como un indicador de la presencia y funcionalidad de las células trasplantadas, sin embargo, esta expresión funcional no se lograría hasta que se alcanzara el implante de una determinada masa de células que en la mayoría de los casos se obtiene solo luego de varios procedimientos de trasplante, no siendo posible determinar cuan exitoso ha sido cada uno de los procedimientos realizados.
Así, sería necesario, contar con un método de valoración global y dinámico que permitiera salvar los inconvenientes antes señalados.
CONCLUSIONES
El trasplante de hepatocitos constituye un avance en el tratamiento de las enfermedades hepáticas de la infancia. Esta alternativa puede significar una mejor calidad de vida y supervivencia para los niños que padecen ciertas enfermedades metabólicas. Las técnicas y principios han sido establecidos y son actualmente desarrollados en diferentes centros médicos en el mundo; sin embargo, la aplicación sigue siendo aún limitada. El desafío será desarrollar nuevas técnicas de preservación y encontrar fuentes alternativas de células aptas para ser trasplantadas. En la utilización de células madre podría encontrarse la respuesta.
El trasplante de hepatocitos o de células madres será en un futuro una alternativa válida de tratamiento o un puente para llegar a un trasplante definitivo.
1. Duvoux C, Samuel D. Hepatic transplantation. Gastroenterol Clin Biol 2009; 33(8-9):868-81. [ Links ]
2. Dhawan A. Etiology and prognosis of acute liver failure in children. Liver Transpl 2008; 14(Suppl 2):S80-4. [ Links ] 3. Sarin SK, Kumar A, Almeida JA, Chawla YK, et al. Acuteon-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL). Hepatol Int 2009; 3(1):269-82. [ Links ]
4. Ransford R, Gunson B, Mayer D, Neuberger J, Christensen E. Effect on outcome of the lengthening waiting list for liver transplantation. Gut 2000; 47(3):441-3. [ Links ]
5. Lake JR. Hepatocyte transplantation. N Engl J Med 1998; 338(20):1463-5. [ Links ]
6. Strom SC, Chowdhury JR, Fox IJ. Hepatocyte transplantation for the treatment of human disease. Semin Liver Dis 1999; 19(1):39-48. [ Links ]
7. Sundback CA, Vacanti JP. Alternatives to liver transplantation: from hepatocyte transplantation to tissue-engineered organs. Gastroenterology 2000; 118(2):438-42. [ Links ]
8. Strom S, Fisher R. Hepatocyte transplantation: new possibilities for therapy. Gastroenterology 2003; 124(2):568-71. [ Links ]
9. Fox IJ, Chowdhury JR. Hepatocyte transplantation. Am J Transplant 2004; 4(Suppl 6):7-13. [ Links ]
10. Horslen SP, Fox IJ. Hepatocyte transplantation. Transplantation 2004; 77(10):1481-6. [ Links ]
11. Mizuguchi T, Mitaka T, Katsuramaki T, Hirata K. Hepatocyte transplantation for total liver repopulation. J Hepatobiliary Pancreat Surg 2005; 12(5):378-85. [ Links ]
12. Alexandrova K, Griesel C, Barthold M, Heuft HG, et al. Large-scale isolation of human hepatocytes for therapeutic application. Cell Transplant 2005; 14(10):845-53. [ Links ]
13. Mitry RR, Dhawan A, Hughes RD, Bansal S, et al. One liver, three recipients: segment IV from split-liver procedures as a source of hepatocytes for cell transplantation. Transplantation 2004; 77(10):1614-6. [ Links ]
14. Barbich M, Lorenti A, Hidalgo A, Ielpi M, et al. Culture and characterization of human hepatocytes obtained after graft reduction for liver transplantation: a reliable source of cells for a bioartificial liver. Artif Organs 2004; 28(7):676-82. [ Links ]
15. Hughes RD, Mitry RR, Dhawan A, Lehec SC, et al. Isolation of hepatocytes from livers from non-heart-beating donors for cell transplantation. Liver Transpl 2006;12(5):713-7. [ Links ]
16. Pichard L, Raulet E, Fabre G, Ferrini JB, et al. Human hepatocyte culture. Methods Mol Biol 2006; 320:283-93. [ Links ]
17. Baccarani U, Sanna A, Cariani A, Sainz M, et al. Cryopreserved human hepatocytes from cell bank: in vitro function and clinical application. Transplant Proc 2005; 37(1):256-9. [ Links ]
18. Terry C, Mitry RR, Lehec SC, Muiesan P, et al. The effects of cryopreservation on human hepatocytes obtained from different sources of liver tissue. Cell Transplant 2005; 14(8):585-94. [ Links ]
19. Hansen K, Horslen S. Metabolic liver disease in children. Liver Transpl 2008; 14(5):713-33. [ Links ]
20. Spada M, Riva S, Maggiore G, Cintorino D, Gridelli B. Pediatric liver transplantation. World J Gastroenterol 2009; 15(6):648-74. [ Links ]
21. Mendez-Sanchez N, Chavez-Tapia NC, Uribe M. Hepatocyte transplantation for acute and chronic liver diseases. Ann Hepatol 2005; 4(3):212-5. [ Links ]
22. Baccarani U, Adani GL, Sainz M, Donini A, et al. Human hepatocyte transplantation for acute liver failure: state of the art and analysis of cell sources. Transplant Proc 2005; 37(6):2702-4. [ Links ]
23. Habibullah CM, Syed IH, Qamar A, Taher-Uz Z. Human fetal hepatocyte transplantation in patients with fulminant hepatic failure. Transplantation 1994; 58(8):951-2. [ Links ]
24. Strom SC, Fisher RA, Thompson MT, Sanyal AJ, et al. Hepatocyte transplantation as a bridge to orthotopic liver transplantation in terminal liver failure. Transplantation 1997; 63(4):559-69. [ Links ]
25. Bilir BM, Guinette D, Karrer F, Kumpe DA, et al. Hepatocyte transplantation in acute liver failure. Liver Transpl 2000; 6(1):32-40. [ Links ]
26. Kobayashi N, Ito M, Nakamura J, Cai J, et al. Hepatocyte transplantation in rats with decompensated cirrhosis. Hepatology 2000; 31(4):851-7. [ Links ]
27. Matas AJ, Sutherland DE, Steffes MW, Mauer SM, et al. Hepatocellular transplantation for metabolic deficiencies: decrease of plasms bilirubin in Gunn rats. Science 1976; 192(4242): 892-4. [ Links ]
28. Michel JL, Rabier D, Rambaud C, Kamoun P, et al. Intrasplenic transplantation of hepatocytes in spf-ash mice with congenital ornithine transcarbamylase deficiency. Chirurgie 1993; 119(10): 666-71. [ Links ]
29. Yoshida Y, Tokusashi Y, Lee GH, Ogawa K. Intrahepatic transplantation of normal hepatocytes prevents Wilson's disease in Long-Evans cinnamon rats. Gastroenterology 1996; 111(6):1654-60. [ Links ]
30. Overturf K, al-Dhalimy M, Ou CN, Finegold M, Grompe M. Serial transplantation reveals the stem-cell-like regenerative potential of adult mouse hepatocytes. Am J Pathol 1997; 151(5):1273-80. [ Links ]
31. Kocken JM, Borel Rinkes IH, Bijma AM, de Roos WK, et al. Correction of an inborn error of metabolism by intraportal hepatocyte transplantation in a dog model. Transplantation 1996; 62(3):358-64. [ Links ]
32. Selden C, Calnan D, Morgan N, Wilcox H, et al. Histidinemia in mice: a metabolic defect treated using a novel approach to hepatocellular transplantation. Hepatology 1995; 21(5): 1405-12. [ Links ]
33. Wiederkehr JC, Kondos GT, Pollak R. Hepatocyte transplantation for the low-density lipoprotein receptor-deficient state. A study in the Watanabe rabbit. Transplantation 1990; 50(3): 466-71. [ Links ]
34. Rozga J, Holzman M, Moscioni AD, Fujioka H, et al. Repeated intraportal hepatocyte transplantation in analbuminemic rats. Cell Transplant 1995; 4 (2):237-43. [ Links ]
35. Sommer BG, Sutherland DE, Matas AJ, Simmons RL, Najarian JS. Hepatocellular transplantation for treatment of D-galactosamine-induced acute liver failure in rats. Transplant Proc 1979; 11(1):578-84. [ Links ]
36. Minato M, Houssin D, Demma I, Morin J, et al. Transplantation of hepatocytes for treatment of surgically induced acute hepatic failure in the rat. Eur Surg Res 1984; 16(3):162-9. [ Links ]
37. Demetriou AA, Reisner A, Sanchez J, Levenson SM, et al. Transplantation of microcarrier-attached hepatocytes into 90% partially hepatectomized rats. Hepatology 1988; 8(5):1006-9. [ Links ]
38. Takeshita K, Ishibashi H, Suzuki M, Kodama M. Hepatocellular transplantation for metabolic support in experimental acute ischemic liver failure in rats. Cell Transplant 1993; 2(4):319-24. [ Links ]
39. Cai J, Ito M, Nagata H, Westerman KA, et. Al. Treatment of liver failure in rats with end-stage cirrhosis by transplantation of immortalized hepatocytes. Hepatology 2002; 36(2):386-94. [ Links ]
40. Kobayashi N, Ito M, Nakamura J, Cai J, et al. Hepatocyte transplantation improves liver function and prolongs survival in rats with decompensated liver cirrhosis. Transplant Proc 1999; 31(1-2):428-9. [ Links ]
41. Ochenashko OV, Volkova NA, Mazur SP, Somov AY, et al. Cryopreserved fetal liver cell transplants support the chronic failing liver in rats with CCl4-induced cirrhosis. Cell Transplant 2006; 15(1):23-33. [ Links ]
42. Shani-Peretz H, Tsiperson V, Shoshani G, Veitzman E, et al. HVEGF165 increases survival of transplanted hepatocytes within portal radicles: suggested mechanism for early cell engraftment. Cell Transplant 2005; 14(1):49-57. [ Links ]
43. Malhi H, Annamaneni P, Slehria S, Joseph B, et al. Cyclophosphamide disrupts hepatic sinusoidal endothelium and improves transplanted cell engraftment in rat liver. Hepatology 2002; 36(1):112-21. [ Links ]
44. Joseph B, Malhi H, Bhargava KK, Palestro CJ, et al. Kupffer cells participate in early clearance of syngeneic hepatocytes transplanted in the rat liver. Gastroenterology 2002; 123(5):1677-85. [ Links ]
45. Fitzpatrick E, Mitry RR, Dhawan A. Human hepatocyte transplantation: state of the art. J Intern Med 2009; 266(4): 339-57. [ Links ]
46. Mito M, Kusano M, Kawaura Y. Hepatocyte transplantation in man. Transplant Proc 1992; 24(6):3052-3. [ Links ]
47. Grossman M, Rader DJ, Muller DW et al. A pilot study of ex-vivo gene therapy for homozygous familial hypercholesterolaemia. Nat Med 1995; 1(11):1148-54. [ Links ]
48. Fox IJ, Chowdhury JR, Kaufman SS, Goertzen TC, et al. Treatment of the Crigler-Najjar syndrome type I with hepatocyte transplantation. N Engl J Med 1998; 338(20):1422-6. [ Links ]
49. Meyburg J, Das AM, Hoerster F, Lindner M, et al. One liver for four children: first clinical series of liver cell transplantation for severe neonatal urea cycle defects. Transplantation 2009; 87(5):636-641. [ Links ]
50. Koenig S, Krause P, Schmidt TK, Rave-Fraenk M, et al. Irradiation as preparative regimen for hepatocyte transplantation causes prolonged cell cycle block. Int J Radiat Biol 2008; 84(4): 285-98. [ Links ]
51. Dagher I, Boudechiche L, Branger J, Coulomb-Lhermine A, et al. Efficient hepatocyte engraftment in a nonhuman primate model after partial portal vein embolization. Transplantation 2006; 82(8):1067-73. [ Links ]
52. Yokoyama T, Ohashi K, Kuge H, Kanehiro H, et al. In vivo engineering of metabolically active hepatic tissues in a neovascularized subcutaneous cavity. Am J Transplant 2006; 6(1):50-9. [ Links ]
53. Ohashi K, Waugh JM, Dake MD, Yokoyama T, et al. Liver tissue engineering at extrahepatic sites in mice as a potential new therapy for genetic liver diseases. Hepatology 2005; 41(1):132-40. [ Links ]
54. Ohashi K, Kay MA, Yokoyama T, Kuge H, et al. Stability and repeat regeneration potential of the engineered liver tissues under the kidney capsule in mice. Cell Transplant 2005; 14(9):621-7. [ Links ]
55. Vroemen JP, Buurman WA, van der Linden CJ, Visser R, et al.Transplantation of isolated hepatocytes into the pancreas. Eur Surg Res 1988; 20(1):1-11. [ Links ]
56. Wen L, Calmus Y, Honiger J, Conti F, et al. Encapsulated xenogeneic hepatocytes remain functional after peritoneal implantation despite immunization of the host. J Hepatol 1998; 29(6):960-8. [ Links ]
57. Sarkis R, Wen L, Honiger J, Baudrimont M, et al. Intraperitoneal transplantation of isolated hepatocytes of the pig: the implantable bioartificial liver. Chirurgie 1998;123(1):41-6. [ Links ]
58. Umehara Y, Hakamada K, Seino K, Aoki K, et al. Improved survival and ammonia metabolism by intraperitoneal transplantation of microencapsulated hepatocytes in totally hepatectomized rats. Surgery 2001; 130(3):513-20. [ Links ]
59. Hamazaki K, Doi Y, Koide N. Microencapsulated multicellular spheroid of rat hepatocytes transplanted intraperitoneally after 90% hepatectomy. Hepatogastroenterology 2002; 49(48):1514-6. [ Links ]
60. Nagata H, Ito M, Shirota C, Edge A, et al. Route of hepatocyte delivery affects hepatocyte engraftment in the spleen. Transplantation 2003; 76(4):732-4. [ Links ]
61. Rosenthal RJ, Chen SC, Hewitt W, Wang CC, et al. Techniques for intrasplenic hepatocyte transplantation in the large animal model. Surg Endosc 1996; 10(11):1075-9. [ Links ]
62. Aoki T, Umehara Y, Demetriou A., Rozga J, et al. Intrasplenic transplantation of encapsulated hepatocytes decreases mortality and improves liver functions in fulminant hepatic failure from 90% partial hepatectomy in rats. Transplantation 2005; 79(7):783-90. [ Links ]
63. Guibert EE, Almada LL, Mamprin ME, Bellarosa C, et al. Subzero nonfreezing storage of rat hepatocytes using UW solution and 1,4-butanediol. II- functional testing on rewarming and gene expression of urea cycle enzymes. Ann Hepatol 2009; 8(2):129-33. [ Links ]
64. Matsuda H, Yagi T, Matsuoka J, Yamamura H, Tanaka N. Subzero nonfreezing storage of isolated rat hepatocytes in University of Wisconsin solution.Transplantation 1999; 67(1):186-91. [ Links ]
65. Theise ND, Saxena R, Portmann BC, Thung SN, et al. The canals of Hering and hepatic stem cells in humans. Hepatology 1999; 30(6):1425-33. [ Links ]
66. Lagasse E, Connors H, Al-Dhalimy M, Reisma M, et al. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med 2000; 6(11):1229-34. [ Links ]
67. Schmelzer E, Zhang L, Bruce A, Wauthier E, et al. Human hepatic stem cells from fetal and postnatal donors. J Exp Med 2007; 204(8):1973-87. [ Links ]
68. Agarwal S, Holton KL, Lanza R. Efficient differentiation of functional hepatocytes from human embryonic stem cells. Stem Cells 2008; 26(5):1117-27. [ Links ]
69. Shin KS, Lee HJ, Jung J, Cha DH, Kim GJ. Culture and in vitro hepatogenic differentiation of placenta-derived stem cells, using placental extract as an alternative to serum. Cell Prolif 2010; 43(5):435-44. [ Links ]
70. Petersen BE, Bowen WC, Patrene KD, Mars WM, et al. Bone marrow as a potential source of hepatic oval cells. Science 1999; 284(5417):1168-70. [ Links ]
71. Nonome K, Li XK, Takahara T, Kitazawa Y, et al. Human umbilical cord blood-derived cells differentiate into hepatocyte- like cells in the Fas-mediated liver injury model. Am J Physiol Gastrointest Liver Physiol 2005; 289(6):1091-9. [ Links ]
72. Banas A, Teratani T, Yamamoto Y, Tukuhara M, et al. IFATS Collection: in vivo therapeutic potential of human adipose tissue mesenchymal stem cells after transplantation into mice with liver injury. Stem Cells 2008; 26(10):2705-12. [ Links ]
73. Seglen P. Preparation of isolated rat liver cells. Methods Cell Biol 1976; 13:29-83. [ Links ]
74. Gupta S, Rajvanshi P, Sokhi R, Slehria S, et al. Entry and integration of transplanted hepatocytes in rat liver plates occur by disruption of hepatic sinusoidal endothelium. Hepatology 1999; 29(2):509-19. [ Links ]
75. Muraca M, Neri D, Parenti A, Feltracco P, et al. Intraportal hepatocyte transplantation in the pig: hemodynamic and histopathological study. Transplantation 2002; 73(6):890-6. [ Links ]
76. Schneider A, Attaran M, Gratz KF, Bleck JS, et al. Intraportal infusion of 99 mtechnetium-macro-aggregrated albumin particles and hepatocytes in rabbits: assessment of shunting and portal hemodynamic changes. Transplantation 2003; 75(a):296-302. [ Links ]
77. Yuc H, Chen HL, Chen WT, Ni YH, et al. Portal hemodynamic changes after hepatocyte transplantation in acute hepatic failure. J Biomed Sci 2004; 11(6):756-63. [ Links ]
78. Wilhelm A, Leister I, Sabandal P, Krause P, et al. Acute impairment of hepatic microcirculation and recruitment of nonparenchymal cells by intrasplenic hepatocyte transplantation. Pediatr Surg 2004; 39(8):1214-9. [ Links ]
79. Baccarani U, Adani GL, Sanna A, Avelli C, et al. Portal vein thrombosis after intraportal hepatocytes transplantation in a liver transplant recipient. Transpl Int 2005; 18(6):750-4. [ Links ]
80. Fisher RA, Strom SC. Human hepatocyte transplantation: worldwide results. Transplantation 2006; 82(4):441-9. [ Links ]
81. Meyburg J, Hoerster F, Weitz J, Hoffmann GF, Schmidt J. Use of the middle colic vein for liver cell transplantation in infants and small children. Transplant Proc 2008; 40:936-7. [ Links ]
82. Khan AA, Parveen N, Mahaboob VS, Rajendraprasad A, et al. Management of hyperbilirubinemia in biliary atresia by hepatic progenitor cell transplantation through hepatic artery: a case report. Transplant Proc 2008; 40(4):1153-5. [ Links ]
83. Stephenne X, Najimi M, Smets F, Reding R, et al. Cryopreserved liver cell transplantation controls ornithine transcarbamylase deficient patient while awaiting liver transplantation. Am J Transplant 2005; 5(8): 2058-61. [ Links ]
84. Stephenne X, Najimi M, Sibille C, Nassogne MC, et al. Sustained engraftment and tissue enzyme activity after liver cell transplantation for argininosuccinate lyase deficiency. Gastroenterology 2006; 130(4): 1317-23. [ Links ]
85. Ambrosino G, Varotto S, Strom SC, Guariso G, et al. Isolated hepatocyte transplantation for Crigler-Najjar syndrome type 1. Cell Transplant 2005; 14(2-3):151-7. [ Links ]
86. Dhawan A, Mitry RR, Hughes RD. Hepatocyte transplantation for liver-based metabolic disorders. J Inherit Metab Dis 2006; 29(2-3):431-5. [ Links ]
87. Khan AA, Parveen N, Mahaboob VS, Rajendraprasad A, et al. Treatment of Crigler- Najjar syndrome type 1 by hepatic progenitor cell transplantation: a simple procedure for management of hyperbilirubinemia. Transplant Proc 2008; 40(4):1148-50. [ Links ]
88. Lysy PA, Najimi M, Stephenne X, Bourgois A, et al. Liver cell transplantation for Crigler-Najjar syndrome type I: update and perspectives. World J Gastroenterol 2008;14(22):3464-70. [ Links ]
89. Lee KW, Lee JH, Shin SW, Kim SJ, et al. Hepatocyte transplantation for glycogen storage disease type Ib. Cell Transplant 2007;16(6): 629-37. [ Links ]
90. Schneider A, Attaran M, Meier PN, Strassburg C, et al. Hepatocyte transplantation in an acute liver failure due to mushroom poisoning. Transplantation 2006; 82(8):1115-6. [ Links ]














