Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.109 no.4 Buenos Aires jul./ago. 2011
ACTUALIZACIONES
Conceptos actuales en la parálisis braquial perinatal. Parte 1: etapa temprana
Current concepts in perinatal brachial plexus palsy. Part 1: Early phase
Dr. Andrés Alejandro Dogliottia
a. Hospital Nacional de Pediatría "Prof. Dr. Juan P. Garrahan". CABA
Correspondencia: Dr. Andrés A. Dogliotti. andresdogliotti@yahoo.com.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 16-2-2011
Aceptado: 6-5-2011
RESUMEN
La parálisis braquial perinatal tiene una incidencia similar a otras patologías frecuentes de la ortopedia infantil. Su tratamiento ha sido tradicionalmente conservador, con seguimiento pediátrico y consultas a los distintos especialistas para tratar las secuelas. Existen controversias respecto de la historia natural y el tratamiento. Las secuelas comienzan cada vez más tempranamente, por lo que debe ser pesquisada en las revisaciones y ser considerada en la táctica terapéutica al mismo tiempo que la reparación de los nervios. Se analiza la clasifcación clínica y los parámetros de recuperación nerviosa, fundamentales para decidir el momento de indicar una exploración del plexo.
Palabras clave: Parálisis braquial obstétrica; Parálisis obstétrica; Parálisis braquial; Microcirugía; Exploración quirúrgica del plexo braquial.
SUMMARY
The incidence of perinatal brachial palsy is similar to that of other frequent conditions in children's orthopedics. The treatment has been traditionally conservative with pediatric follow-up and consultations with various specialists to deal with its sequelae. Its natural history and treatment are controversial. Sequelaes tend to appear earlier each time, so that it should be attended to in checkups and taken into consideration in therapeutic tactics at the same time as nerve repair. This paper includes an analysis of its clinical classifcation and nerve recovery parameters, essential to decide whent to start an exploration of the plexus.
Key words: (MeSH); Perinatal brachial plexus palsy; Brachial birth palsy; Obstetric brachial plexus palsy; Brachial plexus injuries; Microsurgery; Reconstructive surgery.
GENERALIDADES
La parálisis braquial perinatal (PBP) o lesión del plexo braquial al nacimiento1 agrupa diversas patologías con un origen común, la característica de producirse durante el proceso del parto y la de afectar todo el miembro superior o parte de él, con disminución o anulación de su movimiento activo por alteración de la transmisión eléctrica debida a la lesión mecánica de los nervios del plexo braquial (Figura 1).
Figura 1. Esquema del plexo braquial
La incidencia es variable (0,38-5,1 cada 1000 nacidos vivos) dependiendo de las diferentes regiones geográficas.2,3 A pesar de los avances en obstetricia, la incidencia no se ha modificado sustancialmente; las cifras son de 1,51 por mil nacidos vivos.4 Parece una patología poco frecuente, pero su incidencia es mayor a la del pie bot y similar a la de la displasia de cadera.
En la etapa temprana/aguda, dentro de los 12 meses de vida,5 las técnicas microquirúrgicas de reparación nerviosa se emplean con mayor frecuencia y de una manera precoz, pero no como una opción de tratamiento que compita con las cirugías secundarias (paliativas), sino como una herramienta más, complementaria de una terapéutica multidisciplinaria y prolongada durante el tiempo de crecimiento.
El déficit definitivo de inervación muscular (después de los 12-24 meses) dará lugar paulatinamente a deformidades osteoarticulares, por desequilibrio de fuerzas entre músculos activos y sus antagonistas, paralizados y retraídos. Sin embargo, esta etapa tardía/secuelar, tiende a comenzar más tempranamente y debe ser pesquisada en los controles clínicos; muchas veces, debe ser considerada en la táctica terapéutica al mismo tiempo que la reparación de los nervios. Por ello, las estrategias del tratamiento quirúrgico se han modificado, son diversas y requieren ser individualizadas para cada tipo de parálisis y sus distintas recuperaciones.
Es indispensable un abordaje multidisciplinario, liderado por obstetras/perinatólogos y pediatras/neonatólogos, que inician y ayudan a diseñar un programa de atención para el cuidado y la seguridad perinatal del paciente, de modo de prevenir las complicaciones y llevar el bienestar a la madre y el niño.6 Es muy importante coordinar todas las áreas involucradas: obstetra-obstétrica-enfermero, neonatólogo, pediatra de cabecera, ortopedista infantil, neurólogo, cirujano de mano y/o neurocirujano, neurofisiólogo, especialistas y técnicos en imágenes, psicólogos, fisiatras, kinesiólogos y terapistas ocupacionales; sin olvidar el equipo fundamental que forma el entorno familiar del bebé, junto con los grupos sociales de apoyo de otros pacientes y familiares. La información en internet debe ser consultada con el pediatra o especialista, para discernir lo que es serio y lo que no lo es; para evacuar dudas y orientar en lo que no se comprenda.
ETIOLOGÍA
Lo habitual es que se asocie a partos cefálicos dificultosos en los que existe una tracción y compresión del plexo braquial durante las maniobras de liberación del hombro anterior. También se la describe en cesáreas y partos de nalgas. Los factores de riesgo perinatal predisponentes son: el alto peso para la edad gestacional (más de 4000 g o macrosómicos); madres multíparas; un trabajo de parto prolongado o dificultoso; un parto instrumentado (fórceps) y un parto en podálica.7,8
La distocia de hombros es un término que se utiliza con mucha frecuencia asociado a la PBP, pero es muy difícil corroborar su existencia real. Significa una "falla en la salida de los hombros del bebé, luego de la salida de la cabeza, con maniobras habituales (cantidad usual de presión) en la presentación cefálica, por lo que requiere tracción y maniobras especificas para desimpactar la cintura escapular".9 Este concepto dependerá del grado de esfuerzo y el sentido de urgencia que exista en ese momento, dependiendo de cada caso en particular; y de la objetividad-juicio del obstetra a cargo.10 Es un hecho infrecuente, no anticipable e impredecible, que muchas veces no se asume ni se informa. Ocurre en el 0,37-1,01% de los partos vaginales (y desciende a 0,23% si se realiza episiotomía); y de ellos, el 6,7-15,8% tiene alguna parálisis superior.11 A su vez, la distocia puede causar otras afecciones al neonato (muerte, apoplejías, fracturas) y a la madre (hemorragias postparto, laceraciones, desgarros de 3er grado, atonía uterina, infecciones); y tiene factores de riesgo que se superponen con las de la PBP.10
El hecho de que el 50%12 o el 25%13 de los pacientes no presenten al menos 1 factor de riesgo para PBP, que se describan casos sin asociación con distocia de hombros,14,15 que puedan existir casos intrauterinos, que la cesárea también pueda generarla16 y que pueda ser también el hombro posterior el que se comprometa,14 determina el concepto de que la verdadera etiología de la PBP no es del todo conocida.12
SEMIOLOGÍA Y CLASIFICACIÓN
Los estudios sobre la "historia natural" de la enfermedad presentan defectos en la metodología o pérdida de los pacientes en el seguimiento, pero se pueden extraer ciertas conclusiones. Se estima que un 80-90% de los pacientes se recupera espontáneamente en los primeros dos meses de vida, con la consecuente función normal del miembro superior.17,19
Entre 2-3 meses de edad se pueden emplear los siguientes posibles indicadores pronósticos:
1. La naturaleza del daño (es decir el tipo de lesión nerviosa directa inicial: avulsión, ruptura o elongación de las raicillas nerviosas) (Figura 2).

Figura 2. A. Corte transversal de la salida de las raíces. B. Diferentes tipos de lesiones mecánicas que pueden coexistir en una misma raíz. Una lesión grave causa avulsión.
2. La extensión (alta o completa).
3. La ubicación de la lesión (preganglionar o postganglionar) (Figura 3).
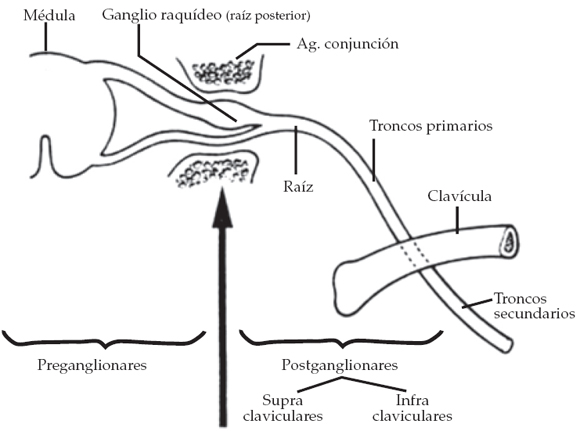
Figura 3. Lesión preganglionar y postganglionar
4. El tiempo de recuperación (mejor antes de los tres meses).
5. La presencia de signos de mal pronóstico: signo de Horner, fracturas asociadas, parálisis diafragmática y un déficit sensitivo persistente.18
Las parálisis más comunes de ver (46%) son las llamadas de Erb-Duchenne.20 Se las clasifica asimismo como del plexo superior (altas), por afectarse las raíces C5-C6. Anatómicamente, a este nivel existe un ligamento (transverso radicular) que retiene a las raíces C5-C6-C7 y evita el arrancamiento, lo cual determina un mejor pronóstico que en las otras lesiones.21 Clínicamente existe parálisis del deltoides, bíceps, supraespinoso-infraespinoso, redondo menor, braquial anterior y supinadores; pero la muñeca (generalmente flexa, porque algo de extensión se compromete) y los dedos no afectan su movilidad. A esta parálisis, puede agregarse la afectación de la raíz C7, lo cual constituye la parálisis de tipo plexo medio-superior o C5-C6-C7 (29%). En ambos tipos suelen desarrollarse lesiones postganglionares (extraforaminales) y, por ende, con posibilidad de recuperación espontánea. Al examen, además de afectarse los músculos recién descriptos, se agregan las parálisis del tríceps, pronador redondo, palmar mayor (desaparece la actitud en flexión de muñeca) y extensores de dedos.
Las raíces bajas o inferiores (C8-T1) se suelen afectar en las parálisis totales; constituyen el último tipo de lesión que puede manifestarse, son de peor pronóstico y las segundas en frecuencia (36%). Todo el miembro es fláccido y la pérdida sensitiva es mayor. Se sabe que en la mayoría de este tipo de plexo completo o C5-T1, la recuperación de la mano se da raramente y recuperan la función de bíceps, pero más allá de los 6 meses, por lo que la función del hombro es peor que en las lesiones más altas.22
La clasificación más usada es la que describe estos 3 tipos clínicos, y un cuarto tipo, más grave aun: parálisis total con signo de Horner.23,24 El síndrome de Claude Bernard-Horner es la asociación de miosis, enoftalmos y ptosis palpebral homolateral, que traduce una afeccion de la cadena simpática cervical, que tiene ramos conectados con T1 a nivel preganglionar; lo que trasunta un posible arrancamiento medular de algunas raicillas inferiores y, en principio, impide una reparación directa de los nervios.
EXÁMENES COMPLEMENTARIOS
El diagnóstico de esta entidad en la etapa aguda se hace, básicamente, sobre la anamnesis (antecedentes) y la exploración física. Los estudios complementarios dentro del primer año de vida pueden ayudar, pero no hacen diagnóstico.
El electromiograma y los potenciales evocados se han mostrado hasta la fecha incapaces de predecir la extensión de la lesión prequirúrgica y el alcance de la recuperación postquirúrgica. Su realización es difícil en los niños y, además, dependen de la capacidad del operador; no hay suficiente ni clara experiencia en bebés y presentan siempre un porcentaje de errores, por los cuales casi no se utilizan más; salvo para fines legales, descartar diagnósticos diferenciales o permitir establecer algún pronóstico.25
En los casos quirúrgicos, se solicita una resonancia magnética nuclear (RMN) de plexo braquial (bilateral) sin contraste y bajo anestesia general, para visualizar neuromas y seudo-meningoceles. La mielotomografía y la RMN pueden ayudar a la planificación prequirúrgica, pero por su gran porcentaje de falsos positivos y negativos, la existencia o no de avulsiones solamente se confirma durante la cirugía.26
TRATAMIENTOS EXISTENTES
El tratamiento inicial es conservador; es fundamental indicar la rehabilitación con kinesiólogos y terapistas ocupacionales, e insistir en los padres como principales responsables de la futura recuperación del niño. Se discute si corresponde empezar la estimulación de forma inmediata, ya que se estaría en un período de irritación nerviosa y cualquier movimiento generaría dolor, pero se puede comenzar a las 2-3 semanas con movimientos articulares suaves y estimulación senso-perceptiva. La función del movimiento pasivo es prevenir las contracturas articulares, que surgen secundariamente al disbalance muscular que ocurre por no estar afectados o recuperarse ciertos músculos y no así sus antagonistas. Es necesario mantener la amplitud del movimiento articular y estimular el movimiento activo, con distintos juegos. A medida que crecen, sigue siendo importante la rehabilitación, pues corresponde lograr incorporar el miembro al esquema corporal mediante actividades lúdicas y de integración, y reeducar la posición del miembro superior y del tronco. Finalmente, se debe recuperar la fuerza muscular (fortalecimiento), tratando de alcanzar el máximo desarrollo de actividades aun en presencia de una función neural y muscular incompletas.27
Para predecir el probable resultado final (función del miembro superior a largo plazo) y la necesidad o no de exploración primaria del plexo en los primeros meses, se utilizan tres factores: el tipo de lesión; el tiempo y grado de recuperación neurológica espontánea, y la presencia del signo de Claude Bernard-Horner. Diferentes centros emplean distintos criterios para valorar la recuperación neurológica. Uno de los indicadores de cirugía del plexo es la falta de recuperación de la función del bíceps para flexionar el codo contra la gravedad. El tiempo es discutido, pero puede ser desde los 3 meses a los 9 meses, según el tipo de parálisis y el criterio del centro de atención. Si la flexión se recupera antes de los 2-3 meses, el pronóstico es bueno y la recuperación del miembro es casi normal; aunque muchos tendrán una escápula alada y alguna limitación de la movilidad glenohumeral. Un pequeño porcentaje puede necesitar transferencias tendinosas secundarias para rotar o elevar el hombro.19
En cambio, los pacientes con déficit neurológico persistente entre los 3 y 6 meses de vida tienen un alto riesgo de disfunción neurológica definitiva, por lo que es necesario valorar la necesidad de microcirugía del plexo.28
Para enriquecer el examen físico y acertar con la mejor conducta, se agregan al bíceps, la extensión de codo, muñeca, dedos y pulgar, para formar un sistema de valoración del movimiento (Puntaje Toronto) y determinar la cirugía en base a este esquema, a los 3, 6 y 9 meses según el tipo de parálisis.17 (Tabla 1).
Tabla 1. Puntaje de movimiento activo de Toronto17

En las parálisis totales con síndrome de Horner, la recuperación es muy escasa, por lo que está indicada la microcirugía a los 3 meses, para maximizar la recuperación. Las opciones para las avulsiones son las transferencias nerviosas (neurotizaciones nerviosas)29 o la reinserción medular directa de las raíces,30 que pocos centros en el mundo realizan; en adultos, tiene los mismos resultados funcionales alejados que los logrados con las transferencias nerviosas o la reparación de raíces superiores.31 Para las lesiones extraforaminales, las posibilidades son: neurólisis, siempre asociada a la necesidad de resección del neuroma e injertos de nervio safeno de la pierna. Para las parálisis totales sin síndrome de Horner, se espera hasta los 4 meses para tomar la decisión.
En la parálisis alta, la ausencia de recuperación del bíceps al 8º-9° mes es indicación de cirugía directa del plexo. Pero para las lesiones alta-medias se espera hasta los 6-7 meses para tomar la decisión, aunque se discute mundialmente si no es mejor esperar la evolución natural y complementar con cirugías secundarias.28
Según nuestra experiencia, la mayoría de los que necesitaron cirugía directa del plexo fueron portadores de lesiones graves.32 La cirugía es larga, difícil y demandante técnicamente; las lesiones anatómicas resultaron más complejas de lo que parecían de antemano y, muchas veces, no hay correlación con los estudios prequirúrgicos o con la clínica (existen variantes anatómicas en más del 50%).32,33 Las herramientas para reconstruir completamente un plexo siguen siendo insuficientes (el grosor de las raíces supera en más de 5 veces el grosor del injerto que se coloca, no alcanzan las transferencias nerviosas para todos los nervios del plexo, etc.) y los resultados satisfactorios no superan el 70% de lo que se repara.24,30 Muchas veces aparecen las secuelas (retracciones musculares, luxaciones del hombro) cuando aún no se recuperó la flexión del codo o existan co-contracciones del bíceps y tríceps, lo que requiere una táctica diferente (por ej.: combinación de transferencias nerviosas de intercostales y accesorio espinal, con toxina botulínica y liberación anteroinferior del hombro asociada a transferencias tendinosas). Aun así, autores como Gilbert o Narakas (con más de 3000 casos operados) aconsejan operar a todos los tipos de parálisis a los 3 meses (si no tienen flexión de codo); dando la prioridad a la reconstrucción de los nervios de la mano, y aseveran que si bien necesitarán indefectiblemente cirugias paliativas a futuro, se encuentran en mejores condiciones que si no se hubiesen operado.20,34,35
CONCLUSIONES
El pediatra debe:
• Conocer la existencia de la PBP, su frecuencia, los factores de riesgo gestacionales, su fisiopatología, cómo detectarla y clasificarla (para establecer un pronóstico).
• Solicitar como estudios complementarios una radiografía y/o ecografía de tórax (para evaluar diafragma, huesos) y un EMG antes de las 3 semanas de vida si se busca descartar causas intrauterinas.
• Informar a la familia del paciente sobre la patología, los tiempos de evolución, la importancia del seguimiento y la necesidad de un enfoque multidisciplinario.
• Derivar tempranamente al especialista para comenzar el tratamiento.
• Comenzar la rehabilitación con kinesiólogía y terapia ocupacional a las 2-3 semanas de vida.
• Conocer las alternativas quirúrgicas (microcirugía, cirugías secundarias paliativas).
• Efectuar el seguimiento clínicamente y NO con estudios complementarios.
1. VanHeest A. Birth brachial plexus injury is the preferred terminology. J Hand Surg Am 2006;31(2):203. [ Links ]
2. Hoeksma AF, Wolf H, Oei SL. Obstetrical brachial plexus injuries: Incidence, natural course and shoulder contracture. Clin Rehabil 2000;14(5):523-6. [ Links ]
3. Adler JB, Patterson RL Jr. Erb's palsy. Long-term results of treatment in eighty-eight cases. J Bone Joint Surg Am 1967; 49(6):1052-64. [ Links ]
4. Foad SL, Mehlman CT, Jing J. The epidemiology of neonatal brachial plexus palsy in the United States. J Bone Joint Surg Am 2008; 90(6):1258-64. [ Links ]
5. Chuang D, Ma HS, Wei FC. A new strategy of muscle transposition for treatment of shoulder deformity caused by obstetric brachial plexus palsy. Plast Reconst Surg 1998; 101(3):686-94. [ Links ]
6. Reisner D P, Landers S. Collaboration between obstetrician and neonatologists. Perinatal safety programs and improved clinical outcomes. Clin Perinatol 2010; 37(1):179-88. [ Links ]
7. Waters PM. Obstetric brachial plexus injuries: Evaluation and management. J Am Acad Orthop Surg 1997; 5(54):205-14. [ Links ]
8. Waters PM. Parálisis pediátrica del plexo braquial. En: Green's, Cirugía de la mano. Volumen II. Nueva York: Marban Libros SL; 2007.Págs.1297-1317. [ Links ]
9. Kreitzer MS. Recognition, classifcation, and management of shoulder dystocia: the relationship to causation of brachial plexus injury. En: O'Leary JA, ed. Shoulder dystocia and birth injury prevention and treatment. Third edition. Tampa, Florida: Humana Press; 2009.Págs.179-208. [ Links ]
10. O'Leary JA. Intrapartum risk factors. En: O'Leary JA, ed. Shoulder dystocia and birth injury prevention and treatment. Third edition. Humana Press 2009.Págs.49-58. [ Links ]
11. Gross TL, Sokol RJ, Williams T, Thompson K. Shoulder dystocia: a fetal-physician risk. Am J Obstet Gynecol 1987; 156(6):1408-18. [ Links ]
12. Hale HB, Bae DS, Waters PM. Current concepts in the management of brachial plexus birth palsy. J Hand Surg 2010; 35(2):322-31. [ Links ]
13. Cohen WR, Schifrin BS. Medical negligence lawsuits relating to labor and delivery. Clin Perinatol 2007; 34(2):345-60. [ Links ]
14. Gurewitsch ED, Johnson E, Hamzehzadeh S, Allen RH. Risk factors for brachial plexus injury with and without shoulder dystocia. Am Jour of Obstet and Gynecol 2006; 194(2):486-92. [ Links ]
15. Allen RH, Gurewitsch ED. Temporary Erb-Duchenne palsy without shoulder dystocia or traction on the fetal head. Obstet Gynecol 2005; 105(5 Pt 2):1210-2. [ Links ]
16. Al-Qattan MM. Obstetric brachial plexus injuries. J Am Soc Surg Hand 2003; 1(3):41-54. [ Links ]
17. Michelow BJ, Clarke HM, Curtis CG, Zuker RM, et al. The natural history of obstetrical brachial plexus palsy. Plastic Reconstr Surg 1994; 93(4):675-80. [ Links ]
18. Waters PM. Update on management of pediatric brachial plexus palsy. J Pediatr Orthop 2005; 25(1):116-26. [ Links ]
19. Waters PM. Comparison of the natural history: the outcome of microsurgical repair, and the outcome of operative reconstruction in brachial plexus birth palsy. J Bone Joint Surg 1999; 81(5): 649-59. [ Links ]
20. Gilbert A. Long-term evaluation of brachial plexus surgery in obstetrical palsy. Hand Clin 1995; 11(4):583-94; discussion 594-95. [ Links ]
21. Herzberg G, Narakas A, Comtet JJ. Surgical approach of the brachial plexus roots. En: Alnot JY, Narakas A eds. Traumatic brachial plexus injuries. Paris:Expansion Sci-entifque Francaise; 1996.Págs.19-22. [ Links ]
22. Smith NC, Rowan P, Benson L, Ezaki M, Carter PR. Neonatal brachial plexus palsy. Outcome of absent biceps function at three months of age. J Bone Joint Surg Am 2004; 86A(10):2163-70. [ Links ]
23. Narakas A, Bonnard C. Paralysis if intrinsic muscles of the hand in lesions of the brachial plexus. Ann Chir Main 1986; 5(3):219-24. [ Links ]
24. Narakas AO. Obstetrical brachial plexus injuries. En: Lamb DW (ed). The paralysed hand. Edimburgo: Churchill Livingstone; 1987. Págs.116-35. [ Links ]
25. Van Dijk JG, Malessy MJ, Stegeman DF. Why is the electromyogram in obstetric brachial plexus lesions overly optimistic? Muscle Nerve 1998; 21(2):260-1. [ Links ]
26. Kawai H, Tsuyuguchi Y, Masada K, Kawabata H, et al. Identifcation of the lesion in brachial plexus injuries with root avulsion: A comprehensive assessment by means of preoperative fndings, myelography, surgical exploration and intraoperative electrodiagnosis. Neuro-Orthop 1989; 7:15-23. [ Links ]
27. Ma HS, Chuang DCC. Rehabilitation programs for the surgical management of obstetrical brachial plexus injuries in the early and late phases. Tech Hand Up Extrem Surg 1998; 2(2):138-45. [ Links ]
28. Waters P, Bae D. Brachial plexus birth palsy: rationale for a multicenter prospective study. Semin Plast Surg 2004; 18:(4): 377-84. [ Links ]
29. Mackinnon SE, Colbert SH. Nerve transfers in the hand and upper extremity surgery. Tech Hand Up Extrem Surg 2008; 12(1):20-33. [ Links ]
30. Carlstedt T. Spinal nerve root injuries in brachial plexus lesions: basic science and clinical application of new surgical strategies. Microsurgery 1995; 16(1):13-6. [ Links ]
31. Carlstedt T. Outcomes. En: Carlstedt T (ed). Central nerve plexus injury. Londres: Imperial College Press; 2007. Págs.139-166. [ Links ]
32. Dogliotti A. Plexo infantil. Disertación en simposio: Lesiones del plexo braquial. 44° Congreso Argentino de Ortopedia y Traumatología, 12-14 de diciembre, Mar del Plata; 2007. [ Links ]
33. Uysal II, Seker M, Karabulut AK, Büyükmumcu M, Ziylan T. Brachial plexus variations in human fetuses. Neurosurgery 2003; 53(3):676-84. [ Links ]
34. Gilbert A, Razaboni R, Amar-Khodja S. Indications and results of brachial plexus surgery in obstetrical palsy. Orthop Clin North Am 1988; 19(1):91-105. [ Links ]
35. Gilbert A, Whitaker I. Obstetrical brachial plexus lesions. J Hand Surg Br 1991; 16(5):489-91. [ Links ]














