Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.109 no.6 Buenos Aires nov./dic. 2011
http://dx.doi.org/10.5546/aap.2011.479
ARTICULO ORIGINAL
Pesquisa audiológica y molecular para pérdida auditiva por mutación 35delG en el gen de la conexina 26 e infección congénita por citomegalovirus
Audiologic and molecular screening for hearing loss by 35delG mutation in connexin 26 gene and congenital cytomegalovirus infection
Bioqco. Edgardo Raúl Streitenbergera, Bioqco. Ariel Ignacio Suáreza, Bioqca. María Verónica Masciovecchioa, Lic. en Fonoaudiología Diana Laurnagarayb y Dr. Ernesto Aldac
a. IACA Laboratorios.
b. Hospital Privado del Sur, Servicio de Fonoaudiología.
c. Hospital Privado del Sur, Servicio de Neonatología. Bahía Blanca, Buenos Aires, Argentina.
Correspondencia: Bioqco. Edgardo Raúl Streitenberger: bmolecular@iaca.com.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 9-6-2011
Aceptado: 12-10-2011
RESUMEN
Introducción. Las pérdidas auditivas pueden ser atribuidas a factores genéticos o ambientales. Las mutaciones en el gen de la proteína Cx26 (conexina 26) son responsables de un 30-80% de los casos de pérdida auditiva profunda no sindrómica. La variante 35delG es la prevalente en la población caucásica. Entre los factores ambientales, el citomegalovirus (CMV) es la principal causa de infección congénita.
Objetivos. Determinar la prevalencia de infección congénita por CMV y la frecuencia de la mutación 35delG en recién nacidos. Identifcar aquellos con riesgo de pérdida de audición con el fn de realizar un seguimiento audiológico para detectar precozmente las hipoacusias.
Material y métodos. Se analizaron 1020 muestras de sangre seca, en papel, de recién nacidos, por PCR convencional y en tiempo real. Se efectuaron las otoemisiones acústicas antes del alta hospitalaria a todos los niños. El seguimiento audiológico se realizó tanto a los portadores de 35delG como a los que tuvieron infección congénita por CMV.
Resultados. De los pacientes estudiados, 15 fueron heterocigotas para la mutación 35delG. No se detectaron homocigotas. Seis de las muestras fueron positivas para CMV (resultados confirmados en orina); de ellos, solo un neonato fue sintomático. A todos estos niños se les realizaron las evaluaciones audiológicas; presentaron hipoacusia tres niños con infección congénita por CMV y dos portadores de la mutación 35delG.
Conclusión. Se detectó un 1,3% de portadores de la mutación 35delG y una frecuencia de infección congénita por CMV del 0,6%. El seguimiento audiológico de estas dos poblaciones permitió la detección de hipoacusias tardías.
Palabras clave: Hipoacusia congénita; Conexina 26; CMV; PCR.
ABSTRACT
Introduction. Hearing loss may be attributed to genetic and environmental factors. Mutations in the gene of the CX26 protein (connexin 26), are responsible for 30-80% of all cases of non-syndromic profound hearing loss. The 35delG is the most frequent variant in the caucasian population. As to environmental factors, the cytomegalovirus (CMV) is the main cause of congenital infection.
Objetives. To determine the prevalence of congenital CMV infection and the frequency of the 35delG mutation in newborns. To identify those at risk of suffering hearing loss in order to do an audiologic follow-up of detected cases.
Materials y methods. One thousand and twenty samples of dry blood spots corresponding to newborns were tested using conventional and real time PCR. Audiologic screening was performed to all newborns before hospital discharge.
Results. Fifteen out of 1020 subjects were heterozygous for the mutation. No homozygous patients were found. Six out of the samples tested positive for CMV (confrmed by a urine sample), out of which only one newborn was symptomatic. The auditory brainstem response was recorded in all these children. Hearing loss was found in three children with congenital CMV infection and two with 35delG mutation.
Conclusion. The frecuency of 35delG mutation carriers in our population was 1.3% and the CMV congenital infection prevalence was 0.6%. Audiologic monitoring of these two populations allowed detection of hearing loss of late onset.
Key words: Congenital hearing loss; Connexin 26; CMV; PCR.
doi:10.5546/aap.2011.479
INTRODUCCION
La pérdida de audición es una de las discapacidades sensoriales más frecuentes. Puede aparecer a cualquier edad y con distinto grado de gravedad. Es de suma importancia la detección precoz ya que, si el defecto es grave y se presenta a temprana edad, tiene un profundo impacto en la adquisición del lenguaje y en el desarrollo cognitivo y psicosocial. El diagnóstico temprano permite una recuperación más rápida de los niños con pérdida auditiva y un mejor desarrollo en todas las áreas del desenvolvimiento.
Se estima que tres de cada mil recién nacidos presentarán pérdidas auditivas clínicamente significativas de distinto grado; no obstante, estos valores varían en las distintas poblaciones estudiadas, dependiendo de la presencia de factores ambientales que son de naturaleza epidémica o de la prevalencia de causas genéticas específicas de cada población.1,2 En países no desarrollados, los factores ambientales suelen tener mayor impacto que los genéticos.
Las pérdidas auditivas pueden ser atribuidas a factores genéticos en el 50% de los casos y a factores ambientales en el 50% restante. Entre las causas genéticas, las formas no sindrómicas (sordera como único hallazgo clínico), representan el 70% de los casos, mientras que las sindrómicas (sordera asociada a otros hallazgos clínicos), el 30% restante.3
En países desarrollados, en los cuales se ha logrado un mayor control de los factores ambientales, se calcula que más del 80% de todas las pérdidas auditivas congénitas son de origen genético.4
El sistema auditivo es complejo, se requiere la interacción de múltiples genes y sus productos para tener una audición normal. Numerosas alteraciones genéticas pueden ser las responsables de la pérdida auditiva; no obstante esta heterogeneidad, se ha observado que las mutaciones que ocurren en el gen GJB2 (gap juntion beta-2 protein) son responsables de un 30-80% de todos los casos de pérdida auditiva profunda no sindrómica.5,6
El gen GJB2 codifica para la proteína Cx26 (conexina 26) localizada en el oído interno, que favorece la homeostasis y la producción del potencial endococlear. Las mutaciones en este gen causan defectos estructurales y funcionales en la Cx26 que dañan el mecanismo que permite una adecuada respuesta de las células ciliadas a los estímulos auditivos.7
Se han comunicado más de 90 variantes en el gen GJB2; no obstante, en cada población hay una que es la predominante; el origen étnico y racial es un factor importante que afecta a esta distribución.8 La variante denominada 35delG es la que se presenta con mayor frecuencia en la población caucásica. El 70-80% de las mutaciones recesivas patogénicas son de este tipo. En países europeos se ha comunicado una prevalencia de portadores del 2-4%.
En cuanto a los factores ambientales, el citomegalovirus (CMV) es la principal causa de infección congénita, con una prevalencia del 0,2-2,2%.9 Solo un 10% de los neonatos infectados presentará síntomas al nacimiento.10 Las infecciones virales, como la provocada por CMV, afectan las estructuras del oído interno y dañan la audición. El daño es mayor cuando la infección ocurre en el período prenatal.11 Las pérdidas auditivas son parte de las secuelas que suelen presentarse en los infectados, con una prevalencia del 36% en el grupo de los recién nacidos sintomáticos y del 11% en los asintomáticos.12 Es altamente probable que un niño con infección por CMV sintomática desarrolle una hipoacusia bilateral neurosensorial, de moderada a profunda. La probabilidad no es tan alta en los casos de CMV asintomáticos, pero cuando adquieren la hipoacusia, la gravedad de la presentación es igual de intensa.13 Otro factor importante a tener en cuenta es que la forma de presentación de la pérdida auditiva es fluctuante, con distinto grado de gravedad (profundas, graves o moderadas), progresiva y de comienzo tardío, lo que hace que estas pérdidas auditivas puedan no detectarse en la pesquisa universal.14
Como no se han realizado estudios que indiquen la prevalencia de la infección congénita por CMV en nuestra población, se planteó como uno de los objetivos determinar el porcentaje de recién nacidos infectados. Considerando, además, que la frecuencia de la mutación 35delG varía según los distintos grupos étnicos analizados, sería de utilidad conocer este dato en nuestra región. Se propone realizar el seguimiento audiológico de todos aquellos niños con riesgo de hipoacusia con el fin de realizar su detección precoz.
El uso de las herramientas moleculares, junto con la pesquisa audiológica, permitiría la detección de los niños que desarrollarán una hipoacusia tardía y que no son detectados por las pruebas audiológicas al momento del nacimiento.15
La identificación por métodos moleculares y el posterior seguimiento audiológico de todos los recién nacidos con infección congénita por CMV que están en riesgo de desarrollar pérdida auditiva, resultaría de gran utilidad para un pronto tratamiento y recuperación de los niños afectados.16
MÉTODOS
Población
Entre septiembre de 2008 y junio de 2009, en el Hospital Privado del Sur (HPS) de Bahía Blanca, se registraron 1335 nacimientos. No se aplicaron criterios de exclusión ni de inclusión, con la excepción de la negativa de los progenitores a firmar el consentimiento informado. De esta manera se analizaron muestras de sangre seca en papel provenientes de 1020 recién nacidos. Las muestras fueron obtenidas por punción del talón, entre el 3er y 5to días de vida, mediante el procedimiento del Programa de Pesquisa Neonatal de Enfermedades Congénitas (leyes Nacional 26.279 y Provincial 13.905). Este estudio fue aprobado por el Comité de Ética del HPS.
Evaluación audiológica y seguimiento
De acuerdo con el Programa Nacional de Identificación e Intervención temprana de hipoacusias (ley 25.415), todos los niños fueron evaluados con otoemisiones acústicas por productos de distorsión previo al alta institucional. Para ello se utilizó un equipo de otoemisiones acústica ERO-SCAN MAICO Etymotic research. Las frecuencias estudiadas fueron: 2.0, 3.0, 4.0 y 5.0 kHz y los niveles F1 & F2 65 and 55 dB SPL (decibeles de precisión sonora; sound pressure level), amplitud de producto de distorsión (DP): 3 dB; relación señal ruido (SNR): 6 dB.
La evaluación audiológica se llevó a cabo mediante el protocolo vigente para hipoacusias infantiles (Ontario infant hearing protocol). Luego de efectuar las otoemisiones acústicas antes del alta hospitalaria, todos los niños que fueron detectados positivos en la prueba molecular fueron derivados para realizar potenciales evocados auditivos (por clics y por frecuencias específicas: 0,5 k; 1 k; 2 k y 4 k). Las amplitudes de referencia de pérdida auditiva utilizadas fueron: hipoacusia leve: umbrales entre 25-40 dB; moderada: entre 40-55 dB; moderadamente grave: entre 55-70 dB; grave: umbrales 70-90 dB; profunda: más de 90 dB. Previo a su realización, se efectuó a todos los niños una otoscopia, para visualizar el conducto auditivo externo, con el fin de descartar la posibilidad de obstrucción por cerumen. En el Anexo 1 se adjuntan los parámetros técnicos utilizados.
Todos los niños que tuvieron resultados negativos, con umbrales auditivos fuera de los considerados normales, fueron derivados al especialista con los estudios realizados más la timpanometría e impedanciometría correspondientes. Según el protocolo utilizado, los umbrales auditivos se consideraron dentro de los límites de audición normal cuando las respuestas estuvieron entre 0 y 25 dB e HL (decibeles estimados de nivel auditivo; estimated hearing level) en las frecuencias: 0,5 k ; 1 k; 2 k y 4 k.
En los casos de infección congénita por CMV se indicó el seguimiento audiológico que consiste en potenciales evocados auditivos cada seis meses hasta los dos años de edad y uno en el tercer año de vida, y audiometría por refuerzo visual durante el segundo año de vida. Se efectuó timpanometría e impedanciometría para descartar patología de oído medio.
Detección de infección por CMV y de la mutación 35delG en gen de conexina 26
La extracción de ADN viral y genómico se realizó según la técnica descripta por Barbi y cols.17 Se analizaron las muestras de sangre seca en papel por PCR convencional y en tiempo real.18,19 Los detalles técnicos se especifican en el Anexo 2.
RESULTADOS
De los 1020 pacientes estudiados, 15 fueron heterocigotas para la mutación 35delG. No se detectaron pacientes homocigotas. Seis de las 1020 muestras fueron positivas para CMV; de ellos, solo un neonato fue sintomático. Los 6 resultados positivos para CMV obtenidos a partir de sangre seca en papel fueron confirmados en una muestra de orina. Los resultados fueron informados a los padres y pediatras de seguimiento.
De estos 15 niños portadores de la mutación 35delG, dos que inicialmente presentaron respuestas positivas a las otoemisiones tuvieron resultados negativos en los potenciales evocados auditivos en el transcurso del seguimiento. Uno de estos niños presentó hipoacusia bilateral moderada-grave y se encuentra con equipamiento de amplificación. El otro requiere controles frecuentes pues presentó una hipoacusia unilateral moderada. En la Tabla 1 se observan los resultados de los umbrales auditivos.
Tabla 1. Umbrales auditivos expresados en dB e HL de los dos casos detectados con hipoacusia entre los 15 niños portadores de la mutación 35delG

En la Tabla 2 se presenta un resumen de los resultados de los estudios audiológicos realizados a los seis niños con infección congénita por CMV.
Tabla 2. Resultados de los estudios audiológicos realizados a los seis niños con infección congénita por CMV
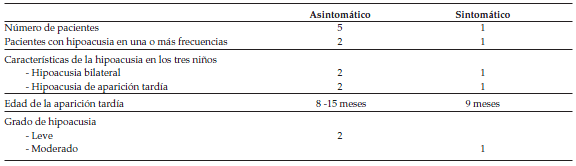
Ambas hipoacusias detectadas en los casos asintomáticos son bilaterales y leves. Los umbrales obtenidos para cada frecuencia y caso se muestran en la Tabla 3, en la que se adicionan, además, los resultados del caso sintomático. Los resultados están expresados en dB e HL, en las correcciones de los valores obtenidos en los potenciales evocados en dB n HL (normalized hearing level). Las correcciones utilizadas son las estandarizadas de acuerdo al protocolo (Infant Hearing Protocol) de Ontario, Canadá.20
Tabla 3. Los umbrales obtenidos en dB e HL para cada frecuencia en los tres casos de infección congénita por CMV que desarrollaron hipoacusia

DISCUSION
La infección congénita por CMV y las mutaciones en la conexina constituyen, respectivamente, las principales causas adquirida y genética de pérdida auditiva de comienzo tardío. La pesquisa universal permite identificar un 85% de las pérdidas auditivas neurosensoriales de niños en edad preescolar; el 15% restante correspondería a pérdidas auditivas de comienzo tardío.21 Una de las limitaciones de la pesquisa universal es que no detecta pérdidas auditivas prelinguales que no se expresen al nacimiento. La implementación de esta pesquisa molecular, como complemento del estudio auditivo, permitiría detectar a estos niños en riesgo.22
De acuerdo a la información obtenida cabría esperar para nuestra población una frecuencia de portadores para la mutación 35delG del 1,3%. Estos datos justifican la investigación de esta mutación como testeo inicial en todo individuo con pérdida auditiva no sindrómica, ya que permitiría la detección de un número significativo de afectados. Teniendo en cuenta la frecuencia de portadores 35delG encontrada se podría estimar que en nuestro país nacerían 29 niños por año con sordera congénita por homocigosis para esta mutación.
En el seguimiento de los 15 niños portadores de la mutación 35delG se encontró que dos de ellos desarrollaron hipoacusia. Es probable que estos niños sean heterocigotas compuestos, es decir, que portarían una segunda mutación además de la 35delG. La realización del estudio molecular permitió el diagnóstico temprano de estos casos.
La prevalencia de infección congénita por CMV fue del 0,6%. De los niños con infección congénita solo uno presentó sintomatología neonatal, el 84% restante no mostró al nacimiento ninguna alteración auditiva. Este último grupo es el que resultaría particularmente beneficiado con el diagnóstico precoz, ya que de no ser detectado al nacimiento resulta difícil realizar luego un diagnóstico retrospectivo. La detección de infección por CMV permite el seguimiento audiológico, el diagnóstico temprano de pérdidas auditivas y una mejor recuperación de los niños afectados.
Desde el punto de vista técnico, la pesquisa realizada presenta como ventajas la utilización de la misma muestra de sangre seca en papel recolectada para la detección precoz de enfermedades metabólicas y genéticas, y su fácil almacenamiento, conservación y transporte. La PCR en tiempo real permitió acortar los tiempos de procesamiento.
Partiendo de la base de que, en una pareja sin diagnóstico molecular, cada progenitor tiene una probabilidad de 1/77 de portar el alelo mutado y, a su vez, una probabilidad de transmitirlo de 1/2, la chance de que esta pareja tenga un hijo homocigota 35delG es 1/23 716 (1/77 x 1/2 x 1/77 x 1/2). De los 15 portadores de la mutación, 2 desarrollaron hipoacusia, por lo tanto, es importante que, en aquellos casos donde se encuentre solo un alelo mutado y el resultado de la otoemisión sea normal, se realice el seguimiento audiológico, ya que puede tratarse de pacientes heterocigotas compuestos sin diagnóstico, que desarrollarán hipoacusia en el tiempo.
Una vez detectados los niños con hipoacusia se interviene en forma temprana y adecuada, esto permite a los profesionales tomar ventaja de este período crítico para la adquisición del lenguaje. El sistema nervioso se adapta y se reorganiza ante los estímulos que recibe ("plasticidad del sistema nervioso") y esta forma de adaptarse juega un papel de suma importancia, principalmente en los dos primeros años de la vida.
CONCLUSIONES
La búsqueda del ADN del CMV en los recién nacidos permitió establecer que la frecuencia de infección congénita en nuestra población es del 0,6%. El seguimiento audiológico mostró que la mitad de este grupo desarrolló pérdida auditiva, aun cuando no se evidenciaron alteraciones en la pesquisa auditiva neonatal.
La frecuencia de la mutación 35delG fue del 1,3%, lo que permite establecer una frecuencia de portadores estimada de 1/77, teniendo en cuenta la tasa de natalidad anual de nuestro país.
Parámetros técnicos de potenciales evocados auditivos de tronco cerebral con clics y frecuencias específcas
Filtros
High pass: tonos 25 hz; clic 300 hz
Low pass: tonos 1500 hz; clic 3000 hz
Promediación: 2000
Análisis offset 0 o 1 mseg
Estímulo
Tonos: Ventana 20 mesg
Tonos: 2-1-2 (rise/plateau/fall)
Polaridad alternada
Repetición 39,1 pps
Clic: polaridad alternada, rarefacción y condensación según se especifica.
Repetición: 20,7 pps.
Detección de la infección por CMV y de la mutación del gen 35delG (conexina 26)
Sobre diez (10) trozos de sangre seca en papel de 1 mm2 se agregaron 45 uL de Medio Esencial Mínimo (MEM) y se sometió a 55°C durante 60 minutos, 100°C 7 minutos y luego se enfrió a 4°C. El ADN extraído se conservó a -20°C hasta su utilización en ambas reacciones de PCR (sigla en inglés de Reacción en Cadena de la Polimerasa).
Se amplificó un segmento de 126 bp comprendido en la región IEA (Immediatly Early Antigen) del CMV. Para ello se utilizaron cebadores específicos y una sonda Taqman (Genbiotech SRL, Buenos Aires, Argentina). La amplificación y detección del ADN viral se realizó por PCR en tiempo real mediante un termociclador LightCycler 2,0 (Roche Applied Science, Penzberg, Alemania). La mezcla de reacción utilizada consistió en 4 uL de Taqman Master (Roche), 500 nM de cada cebador, 100 nM de sonda y 5 uL de templado. Las condiciones de ciclado fueron: 95°C 10 minutos y 45 ciclos de 95°C 1s, 60°C 20 seg. Como control positivo se utilizó una mancha de sangre seca en papel, obtenida a partir de una muestra a la que se le adicionó ADN de CMV de un stock viral.
Con los cebadores (primers) y sonda utilizados se pudo lograr una amplificación eficiente de diluciones seriadas del ADN de CMV. Sobre la base de estos estudios de dilución, la sensibilidad del ensayo fue de, aproximadamente, 1000 copias/ml, lo que equivale a 50 copias por reacción. La especificidad fue probada con ADN de diferentes virus pertenecientes a la familia Herpesviridae. No se observó amplificación con HSV-1 y HSV-2, VZV, EBV, HHV6. Además, se evaluó la variación interensayo mediante un estándar de 1000 copias/ul. El CT promedio fue de 27,8, con un coeficiente de variación (CV%) 1,91.
Para la detección de la mutación 35delG se realizó PCR convencional seguida de digestión enzimática.
Se utilizaron cebadores mutagénicos que introducen un sitio de corte enzimático dependiendo de la presencia de cinco o seis G en el templado. Los cebadores EcoRII y EcoDdeI se utilizaron en combinación con el cebador CX26-P1 para generar un sitio de corte EcoRII o DdeI, respectivamente. La reacción de PCR se efectuó en un termociclador Perkin Elmer 2400, bajo las siguientes condiciones: 95°C 5 minutos, seguido de 45 ciclos de 95°C 1 minuto, 55°C 1 minuto y 72°C 1 minuto. Mediante los cebadores EcoRII/Cx26-P1 (que solo origina sitio de corte en presencia del alelo salvaje) y DdeI/CX-26-P1 (que solo origina un sitio de corte en presencia del alelo mutado) se obtuvo un producto de amplificación de 89 bp. Luego de la digestión enzimática se obtuvieron dos fragmentos de 60 y 29 bp. Los productos de digestión fueron separados en un gel de acrilamida al 10%, teñido con bromuro de etidio y revelado con luz UV.
1. Morton, NE. Genetic epidemiology of hearing impairment. Ann N Y Acad Sci 1991; 630:16-31. [ Links ]
2. Nance WE, Dadson K. How can newborn hearing screening be improved? Audiology Today 2007; 19 (4): 14-19. [ Links ]
3. ACMG Genetics Evaluation Guidelines for the Etiologic Diagnosis of Congenital Hearing Loss. Genetic Evaluation of Congenital Hearing Loss Expert Panel. ACMG Statement. Genet Med 2002 4(3): 162-71. [ Links ]
4. Scriver CR, Beaudet AL, Sly WS and Valle D. The metabolic and molecular bases of inherited disease. 8th Ed. Hereditary hearing Loss. New York: McGraw Hill, 2001:6281-6327. [ Links ]
5. Denoyelle F, Martin S, Weil D, Moatti L, et al. Clinical features of the prevalent form of childhood deafness, DFNB1, due to a connexin 26 gene defect: implications for genetic counselling. Lancet 1999; 353 (9161):1298-303. [ Links ]
6. Estivill X, Fortina P, Surrey S, Rabionet R, et al. Connexin-26 mutation in sporadic and inherited sensorineural deafness. Lancet 1998; 351(9100):394-8. [ Links ]
7. Willems PJ. Genetic causes of hearing loss. N Engl J Med 2000;342(15):1101-9. [ Links ]
8. Kenneson A, Van Naarden Braun K, Boyle C. GJB2 (Connexin 26) variants and nonsyndromic sensorineural hearing loss. A HUGE review. Genet Med 2002;4(4):258-74. [ Links ]
9. Demmler GJ. Summary of a workshop on surveillance for congenital cytomegalovirus infection. Rev Infect Dis 1991; 1113: 315-29. [ Links ]
10. Revello MG, Giuseppe G. Diagnosis and management of human cytomegalovirus infection in the mother, fetus and newborn infant. Clin Microbiol Rev 2002; 15(4):680-715. [ Links ]
11. Bess FH. Viruses that deafness. En: Childhood deafness: causation, assessment and management. Nueva York: Grune & Stratton, 1977; 53-59. [ Links ]
12. Fowler KB, Dahle AJ, Boppena SB. Newborn hearing screening: will children with hearing loss caused by congenital cytomegalovirus infection be missed? J Pediatrics 1999;135:60-64. [ Links ]
13. Fowler K, McCollister F, Dahle A, Boppana S, et al. Progressive and fuctuating sensorineural haring loss in children with asymptomatic congenital cytomegalovirus infection. J Pediatr 1997;130(4):624-30. [ Links ]
14. Nance WE, Lim BG, Dodson KM. Importance of congenital cytomegalovirus infections as a cause for prelingual hearing loss. Journal of Clinical Virology 2006;35:221-225. [ Links ]
15. Morton CC, Nance WE. Newborn hearing screening-A silent revolution. N Engl J Med 2006;354:2151-64. [ Links ]
16. Stehel EK, Shoup AG, Owen KE, Jackson GL, et al. New-born hearing screening and detection of congenital cyto-megalovirus infection. Pediatrics 2008;5(21):970-75. [ Links ]
17. Barbi M, Binda S, Primache V, Luraschi C, et al. Diagnosis of congenital cytomegalovirus infection by detection of viral DNA in dried blood spots. Clin Diagnos Virol 1996;6:27-32. [ Links ]
18. Kalpoe JS, Kroes ACM, de Jong MD, Schinkel J. Validation of clinical application of cytomegalovirus plasma dna load measurement and defnition of treatment criteria by analysis of correlation to antigen detection. J Clin Micro-biol 2004;42:1498-1504. [ Links ]
19. Wilcox SA, Osborn AH, Dahl HM. A simple PCR test to detect the common 35delG mutation in the connexin 26 gene. Mol Diagn 2000;5(1):75-78. [ Links ]
20. Ontario Infant Hearing Program. Audiologic Assessment Protocol. Version 3.1, January 2008. Otologic Function Unit, Mount Sinai Hospital, Toronto, Ontario. [Acceso: noviembre de 2011]. Disponible en: http://www.moun-tsinai.on.ca/care/infant-hearing-program/documents/ IHPAudiologicAssessmentProtocol3.1FinalJan2008.pdf. [ Links ]
21. Schrijver I. Hereditary non-syndromic sensorineural hearing loss. Transforming silence to sound. J Mol Diagn 2004;6(4):275-284. [ Links ]
22. Boppana SB, Shannon AR, Ross MD, Shimamura M, et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med 2011;364:2111-8. [ Links ]














