Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075
Arch. argent. pediatr. vol.110 no.1 Buenos Aires Jan./Feb. 2012
http://dx.doi.org/10.5546/aap.2012.46
ACTUALIZACIÓN
Ventajas y desventajas de los distintos tipos de anfotericina en pediatría: revisión de la bibliografía
Advantages and drawbacks of amphotericin formulations in children: literature review
Dr. David F. Besa, Farm. Norma Sbernaa y Dra. María Teresa Rosanovaa
a. Hospital Nacional de Pediatría "Prof. Dr. Juan P. Garrahan". Buenos Aires.
Correspondencia: Dr. David F. Bes: davidfbes@hotmail.com
Conflicto de intereses: Ninguno que declarar.
Recibido: 11-8-2011
Aceptado: 15-11-2011
http://dx.doi.org/10.5546/aap.2012.46
RESUMEN
Las infecciones fúngicas han aumentado últimamente y el espectro de especies se ha modifcado, en especial por el aumento del número de pacientes inmunocomprometidos. La anfotericina B es un antimicótico de amplio espectro; ha sido, durante los últimos 50 años, el fármaco de elección para el tratamiento antifúngico empírico y frente al aislamiento de hongos sensibles. Sin embargo, su uso se asocia con efectos adversos como febre, escalofríos, náuseas y vómitos (dependientes de la infusión) y, más signifcativamente, con nefrotoxicidad. Existen en la actualidad tres presentaciones farmacéuticas con lípidos que aumentan el índice terapéutico. A pesar de su uso extenso, existen aún interrogantes acerca de las dosis óptimas y costos que justifquen su empleo en la edad pediátrica. No hay trabajos de alta calidad de evidencia sobre infecciones fúngicas documentadas en pediatría que comparen las cuatro presentaciones farmacéuticas disponibles. No obstante, pareciera que todas tienen similar efcacia. Los elevados costos de las anfotericinas asociadas a lípidos limitan su uso; sin embargo, la reducción de costos asociados a la menor nefrotoxicidad debería considerarse cuando se analizan los aspectos económicos de su indicación.
Palabras clave: Anfotericina; Toxicidad; Pediatría; Farmacoeconomía; Riñón.
SUMMARY
Fungal infections have increased in morbidity, and the range of fungal species causing disease in humans has expanded, mainly due to the rise in number of immunocompromised patients. Am-photericin B is a broad spectrum antifungal agent that has been the standard therapy for many life-threatening mycoses for the past 50 years. However, the use of this drug is commonly associated with infusion related events (such as chills, fever, headache, nausea, vomiting), and most signif-cantly to dose limiting nephrotoxicity. Three lipid formulations that increase the therapeutic index have been approved for use. However, questions regarding dose, cost-effectiveness and indications exist in the pediatric setting. Although no high quality evidence studies in children comparing the four types of amphotericin in culture-positive fungal infections currently exist, all four preparations are believed to have similar effectiveness. High drug costs limit the use of lipid formulations; however, renal toxic side effects should be taken into account when costs are considered.
Key words: Amphotericin; Side effects; Toxicity; Children; Pharmacoeconomics; Kidney.
INTRODUCCIÓN
Las infecciones fúngicas son importantes causas de morbimortalidad en pediatría.1-4 El aumento de estas infecciones se relaciona con el mayor número de pacientes con quimioterapias intensivas, trasplantados y con sida.3 Asimismo, el espectro de especies de hongos causantes de patología en seres humanos también se ha modificado.4
Desde el siglo pasado el desoxicolato de anfotericina B ha sido el fármaco de elección para tratar las infecciones fúngicas sistémicas. Con el fin de disminuir los efectos adversos, se ha combinado la anfotericina con emulsiones lipídicas; sin embargo, dicha combinación no ha demostrado más eficacia, ni menor nefrotoxicidad.4 Debido a esto, se desarrollaron formulaciones de anfotericina asociada a lípidos, que comenzaron a autorizarse en 1995.
Actualmente, existen cuatro tipos de anfotericina de uso comercial: la anfotericina B desoxicolato, la anfotericina B dispersión coloidal, la anfotericina B complejo lipídico y la anfotericina B liposomal.
El objetivo de este trabajo es hacer una revisión del uso de las diferentes anfotericinas en pediatría.
Anfotericina B desoxicolato (anfotericina B)
Espectro de acción
La anfotericina B es un antifúngico de amplio espectro producido por Streptomyces nodosus. Tiene muy buena actividad in vitro contra la mayoría de Candida spp, Aspergilus spp y otros hongos filamentosos. Se acepta que las anfotericinas asociadas a lípidos tienen el mismo espectro in vitro que la anfotericina B.4
Mecanismo de acción
La anfotericina se fija al ergosterol de la membrana citoplasmática fúngica y altera su permeabilidad, ocasionando la pérdida de moléculas intracelulares. Este mecanismo impide la viabilidad del hongo.1,5-8 También ejerce efectos sobre la oxidación celular que incrementan su actividad antifúngica.6
Farmacocinética
La anfotericina se combina con el desoxicolato para hacerla soluble. Una vez en el torrente sanguíneo se disocia y se liga a lipoproteínas para luego distribuirse a los tejidos, principalmente el sistema reticuloendotelial.1,5 Luego reingresa a la circulación en forma lenta.1,6,9,10 Se acepta que concentraciones séricas de 0,3 µg/ml son terapéuticas.11
Se ha descripto que la farmacocinética en pediatría difiere de la de los adultos2,12 y a algunos de sus aspectos se le han atribuido las diferencias en la nefrotoxicidad observadas entre ambos grupos.13
En adultos, se ha reportado que en la fase inicial del tratamiento la vida media es de alrededor de 24-40 h,11,14 prolongándose a 15 días en la fase final.9 En la edad pediátrica se han descripto vidas medias que oscilan entre 10-18 h,11,15-17 habiéndose observado vidas medias más largas en pacientes prematuros extremos.15 En lactantes y niños más grandes se ha descripto correlación inversa entre edad y vida media.11
En lactantes y niños mayores la depuración de la anfotericina se correlaciona en forma inversa con la edad.17 También se han informado concentraciones séricas menores en pediatría que en adultos con dosis comparables.15 En esta publicación también describen correlación entre la depuración y el peso, señalando que los pacientes prematuros extremos tenían una gran variabilidad en la depuración.15 Se ha descripto que la depuración de la anfotericina en pediatría es mayor que en adultos.5 Sin embargo, el valor comunicado en adultos es 0,43 ml/min/kg9 y en niños, 0,43 ml/min/kg,11 0,46 ml/min/kg17 y 3,36 ml/min/kg.15
De los estudios anteriores pareciera ser que los prematuros extremos tienen vida media más larga y menor depuración de la anfotericina que los lactantes y niños mayores; en éstos la depuración aumenta y la vida media disminuye con la edad.1,11,17 Esto podría deberse a una maduración del metabolismo e indicar que los pacientes prematuros extremos podrían necesitar intervalos más largos entre dosis y que los pacientes más grandes requerirían menores dosis que los lactantes.15,17
Sin embargo, al analizar los resultados farmacocinéticos es importante tener en cuenta la variabilidad en los métodos de medición de la anfotericina, el momento del tratamiento (inicio o luego de finalizado) en el cual se efectuó el estudio, el número de casos de las series, como así también la variabilidad interpacientes de las publicaciones.1,11,15-17
Todos estos aspectos hacen que en pediatría sea difícil basarse en estudios farmacocinéticos para evaluar las dosis óptimas que tomen en cuenta la efectividad y la nefrotoxicidad de la anfotericina B.
Las concentraciones sanguíneas no se alteran cuando existe fallo hepático o renal.
Efectos adversos
Los principales efectos adversos son los relacionados con la infusión y la nefrotoxicidad.3,4,6 Los primeros incluyen escalofríos, fiebre, náuseas, vómitos, flebitis, dolores generalizados, convulsiones, cefaleas.3,6 La nefrotoxicidad es el efecto adverso más relevante,1,3,4,7,8,13 por estar asociada con mayor morbimortalidad, requerimiento de hemodiálisis, prolongación de la estadía hospitalaria y mayores costos.4,7.18-21
Se ha descripto que los pacientes pediátricos tienen menor toxicidad renal que los adultos,1,5,,6,13 pero las series difieren en cuanto a la gravedad y la incidencia.1 Starke describió que la nefrotoxicidad fue leve, transitoria y sin significación clínica.11 Baley observó variaciones significativas en la función renal, pero las describió como leves y que mejoraron al concluir el tratamiento.16 Koren encontró diferencia estadísticamente significativa en las creatininemias pretratamiento y durante el tratamiento.11 Sandler informó nefrotoxicidad en 52%,22 Goldman en 58%13 y Prentice en 21% de los pacientes pediátricos.23 Lee observó nefrotoxicidad en 16% de neonatos que se resolvió en el 99%.24
Se ha sugerido que el menor compromiso renal se debe a una mayor depuración del compuesto que en los adultos.5,15 Sin embargo, esos resultados no son concluyentes.9,11,15-17
Tres aspectos a tener en cuenta son: la definición de nefrotoxicidad según los diferentes autores;20 que la creatininemia puede subestimar el filtrado glomerular25 y que no hay estudios a largo plazo sobre la evolución del compromiso renal.
La nefrotoxicidad ha sido definida como un aumento de la creatininemia de 0,4 mg/dl,24 si se duplica,18 si se duplica y es mayor a 1,2 mg/dl19 y un aumento de más del 20% de la depuración de creatinina.13
El compromiso renal es glomerular y tubular. La afectación glomerular se evidencia por aumento de la concentración plasmática de urea y creatinina, y el tubular por acidosis tubular distal, hipocaliemia, hipomagnesemia y menor concentración de la orina.3,12 Debido a la tubulopatía, existe pérdida urinaria de potasio, magnesio y bicarbonato. Asimismo, hay menor producción de eritropoyetina.26
Son varios los mecanismos por los cuales se postula que la anfotericina B produce compromiso renal.12 Se verifica disminución del flujo plasmático renal que produciría isquemia renal y reducción del filtrado glomerular por aumento de la resistencia arteriolar. La anfotericina también interactuaría con los esteroides de las membranas de las células renales y aumentaría la permeabilidad a diferentes moléculas intracelulares.3 Finalmente, podría producir apoptosis de las células tubulares y de las células intersticiales de la médula renal. El desoxicolato también sería tóxico.3,12
Existen factores que aumentan la morbilidad renal de la anfotericina, como la presencia de hipoflujo renal, hiponatremia y el uso de otros fármacos nefrotóxicos (por ej., inhibidores de la calcineurina, furosemida, aminoglucósidos, cisplatino e ifosfamida, entre otros).
Diversos autores han sugerido que, para prevenir el daño renal, se puede infundir 10-15 ml/ kg de solución salina previo a la administración de anfotericina B.3,12,13 El aporte de ClNa también ha sido descripto como protector de la función renal en prematuros.1,3
Duración del tratamiento y dosis
La duración depende del tipo y localización de la micosis, de la enfermedad de base del huésped, de la resolución de la neutropenia, de la función del injerto si existe trasplante y de la evolución de la infección.1,8
En neonatos, la duración oscila entre 14-21 días luego de negativizados los cultivos; pudiéndose prolongar de acuerdo al foco.1,27
Inicialmente, la anfotericina B se infunde a 0,25 mg/kg en 6 h y se la aumenta diariamente 0,25 mg/kg hasta llegar a la dosis deseada. En casos graves, el aumento diario puede ser más rápido. En pediatría, la dosis de mantenimiento se puede infundir en 2-6 h15,17,28 y oscila entre 0,75 mg y 1,5 mg/kg/día. (Tabla 1).
Tabla 1. Dosis diaria, administración, presentación y costos de diferentes tipos de anfotericina
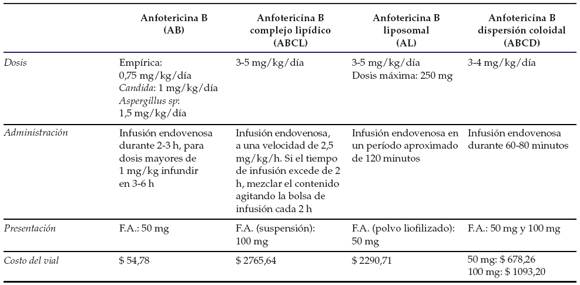
Costos de formulaciones de anfotericinas: octubre 2011. Manual Farmacéutico. Alfa Beta SACIF y S y Alfa Beta Sistemas SA.36 F.A.: frasco ampolla.
ANFOTERICINAS ASOCIADAS A LÍPIDOS
Ventajas
Las formulaciones de anfotericina B asociadas a lípidos permiten un aumento de la dosis y tienen mejor distribución en el sistema reticuloendotelial,1,5,29.30 en general tienen menores efectos adversos asociados a la infusión y, en teoría, menor toxicidad renal que la anfotericina B,1,3,5,7,12,20,29,30 A pesar de estas ventajas que permitirían un índice terapéutico más alto, no está claro aún si alguna formulación es mejor que las otras, cuál es la indicación de comenzar el tratamiento con alguna de ellas y si los parámetros farmacoeconómicos justifican su uso en lugar de la anfotericina B.29
ANfOTERICINAS EN fORMULACIÓN LÍPIDA
Anfotericina B liposomal
Es una formulación liofilizada de anfotericina B incorporada dentro de un pequeño liposoma unilamelar.
Espectro: Tiene muy buena actividad contra la mayoría de Candida spp, Aspergillus spp y otros hongos filamentosos.7
Esta forma farmacéutica es más efectiva que la anfotericina B para infecciones como histoplasmosis sistémica en pacientes adultos con sida. La dosis es 3-5 mg/kg/día y la dosis máxima es 250 mg/día. (Tabla 1).
Efectos adversos: Blyth en base a estudios de Walsh, describe que pacientes pediátricos tratados con anfotericina liposomal tenían menos efectos relacionados con la infusión que los tratados con anfotericina B.2 No hallaron diferencia en cuanto a nefrotoxicidad.2
Anfotericina B complejo lipídico
Es una suspensión de anfotericina B que forma complejos con 2 fosfolípidos en una proporción molar fármaco: lípido 1:1.
Espectro: Es más efectiva contra candidiasis, aspergilosis, criptococosis, fusariosis, coccidioidomicosis, zigomicosis y blastomicosis.29 La dosis recomendada en pediatría es 3-5 mg/kg/día.31 La velocidad de infusión es 2,5 mg/kg/h. (Tabla 1).
Anfotericina B de dispersión coloidal
Es una dispersión coloidal de un complejo estable de anfotericina B y colesteril sulfato sódico, que forman micropartículas uniformes discoides.32
El espectro antifúngico in vitro es similar al de la anfotericina B contra Blastomyces, Coccidioides, Histoplasma, Paracoccidiodes, Candida albicans y Cryptococcus, pero tiende a ser menos eficaz contra Candida glabrata y Aspergillus fumigatus y A. flavus. Además, tiene mayores efectos asociados a la infusión que la anfotericina B.33 En pediatría, la dosis es de 3-4 mg/kg/día.34,35 (Tabla 1).
Costos
Los costos de las anfotericinas varían entre sí, siendo muchísima más económica la anfotericina B (Tabla 1). A modo de ejemplo, en la Argentina, en octubre de 2011, para un paciente de 10 kg, el costo aproximado diario del tratamiento es: para la anfotericina B: $11; anfotericina B complejo lipídico: $840-1400: anfotericina B dispersión coloidal: $340-450 y anfotericina B liposomal: $1400-2300.36 Sin embargo, al indicar el fármaco, corresponde considerar también el costo del compromiso renal, que potencialmente puede variar de uno leve a otro de tal gravedad que requiera diálisis.4 En adultos se ha descripto un 15% de pacientes tratados con anfotericina B que requirieron hemodiálisis.18 En pediatría, solo una serie describe la necesidad de diálisis en 2,4% de 531 pacientes tratados con anfotericina B complejo lipídico.37
¿Cuál de las anfotericinas elegir en pediatría?
No hay trabajos con alta calidad de evidencia sobre infecciones fúngicas documentadas en pediatría que comparen las diferentes formas comerciales de anfotericinas, en cuanto a efectividad, efectos relacionados con la infusión y la toxicidad renal. Diferentes dosis, duraciones de tratamiento, definiciones de compromiso renal, como así también diferentes poblaciones pediátricas tornan difícil efectuar comparaciones entre las distintas series.30
En la revisión sistemática de Blyth et al.2 se analizaron 4 trabajos, aleatorizados y controlados que incluían 395 pacientes pediátricos. En ellos se comparó anfotericina B liposomal o anfotericina B dispersión coloidal con anfotericina B en el contexto de neutropenia febril y sospecha de infección fúngica. El número total de infecciones fúngicas comprobadas fue del 1,3%.
Al comparar efectividad, en el contexto de neutropenia febril por infección fúngica invasiva, no hubo diferencias estadísticamente significativas en la mortalidad entre pacientes tratados con anfotericina asociadas a lípidos y anfotericina B. El escaso número de infecciones documentadas impide extraer conclusiones válidas al analizar este aspecto. Al comparar efectos adversos, los pacientes tratados con anfotericina liposomal comunicaron menos escalofríos que los medicados con anfotericina B, mientras que los tratados con anfotericina dispersión coloidal presentaron más.
Con respecto al compromiso renal, pareciera ser menor con la anfotericina liposomal y anfotericina dispersión coloidal con respecto a la anfotericina B. Al hacer el metaanálisis, el tratamiento con preparados formulados con lípidos disminuía el riesgo de nefrotoxicidad en un 57% en relación a anfotericina desoxicolato (RR 0,43 IC95% 0,21-0,90 P< 0,02).2 Sin embargo, la heterogeneidad de los trabajos incluidos y la posible duplicación de casos le resta validez para sacar conclusiones definitivas.
Blyth concluye que, dada la escasez de datos y los resultados de metaanálisis previos, es razonable indicar anfotericinas asociadas a lípidos si los costos lo permiten.2
En el tratamiento empírico del paciente neutropénico febril, las Clinical Practice Guidelines for the Management of Candidiasis del 2009 sugieren que dada la toxicidad que presenta la anfotericina desoxicolato, se debería indicar anfotericinas asociadas a lípidos.27 Esta posición contrasta con la de Allen, que afirma que la anfotericina B es una alternativa válida de tratamiento y reserva las asociadas a lípidos para casos de intolerancia o uso concomitante de medicación nefrotóxica.38
Dismukes sugiere que la mayoría de los pacientes con candidiasis sistémicas, criptocococis y micosis endémicas (blastomicosis, histoplasmosis, coccidioidomicosis y paracoccidioidomicosis) pueden ser tratados con anfotericina B o, en su defecto, imidazólicos según el tipo de huésped.29
En pacientes trasplantados con órganos sólidos, la profilaxis antifúngica es controvertida; sin embargo, la anfotericina B desoxicolato ha dejado de ser una opción.38
La Food and Drug Administration (FDA) aprueba el uso de las anfotericinas asociadas a lípidos en pacientes con micosis sistémica, en especial infección por Aspergillus sp. si existe evidencia de intolerancia a la anfotericina B, definida como compromiso renal (creatinina sérica igual o mayor a 1,5 mg/dl), presencia de efectos adversos graves relacionados con la infusión a pesar de estar premedicado y/o progresión de infección fúngica a pesar de haber recibido una dosis acumulativa igual o mayor a 10 mg/kg de anfotericina B.28,29
En pacientes con infección por Aspergillus spp., la recomendación actual es iniciar tratamiento con voriconazol y son alternativas las anfotericinas asociadas a lípidos, pero no con la anfotericina B.39,40
Goldman sugiere que dadas las consecuencias graves que puede producir la nefrotoxicidad en el desarrollo del niño, deberían usarse anfotericinas asociadas a lípidos en caso de que el paciente esté recibiendo otros fármacos nefrotóxicos.12 En una publicación posterior, sugiere la sobrecarga hídrica como prevención de la nefrotoxicidad y reservar la anfotericina B para infecciones fúngicas documentadas con cultivos o por cuadro clínico altamente sugestivo de micosis y limitándola como profilaxis.13
La recomendación en el neonato es usar anfotericina B desoxicolato con aporte de ClNa, iniciando el tratamiento a 1 mg/kg/día con monitoreo estrecho de la función renal y caliemia.1 En caso de nefrotoxicidad, cuando no haya infección urinaria, se puede cambiar a un preparado asociado a lípidos.1
CONCLUSIONES
En pediatría no existen trabajos de alto grado de evidencia que comparen las 4 anfotericinas en cuanto a efectividad y toxicidad, pero se considera que la efectividad es equivalente y que la nefrotoxicidad es un efecto adverso que debería ser considerado en la elección del tipo de anfotericina por emplear.
En la población neonatal, la anfotericina B desoxicolato es el antifúngico de elección. Si bien fuera del período neonatal, las últimas recomendaciones sugieren usar anfotericinas asociadas a lípidos, sus precios son una limitante importante para su empleo.
La anfotericina B es adecuada para comenzar el tratamiento antimicótico en el paciente neutropénico febril y para la mayoría de los pacientes con candidiasis sistémicas, criptocococis y micosis endémicas.
En pacientes pediátricos que requieran tratamientos antifúngicos prolongados o que tengan factores de riesgo aumentados para el compromiso renal, las anfotericinas asociadas a lípidos son una alternativa que debe considerarse.
Se requieren más estudios para efectuar recomendaciones definitivas sobre el uso de los distintos tipos de anfotericina en Pediatría.
1. Turkova A, Roilides E, Sharland M. Amphotericin B in neonates: deoxycholate or lipid formulation as frst-line therapy-is there a 'right' choice? Cur Opin Infect Dis 2011;24(2):163-71. [ Links ]
2. Blyth C, Hale K, Palasanthiran P, O`Brien T, Bennett M. Antifungal therapy in infants and children with proven, probable or suspected invasive fungal infections. Cochrane Database Syst Rev 2010;(2):CD006343. [ Links ]
3. Sabra R, Branch R. Amphotericin B nephrotoxicity. Drug Saf 1990;5(2):94-108. [ Links ]
4. Dupont B. Overview of the lipid formulations of amphotericin B. J Antimicrob Chemother 2002;49(Suppl 1):31-6. [ Links ]
5. Steinbach W, Perfect J. Antifungal Agents. En: Yaffe J, Aranda J, Editors. Neonatal and pediatric pharmacology: therapeutic principles in practice. 3rd ed. Filadelfa: Lippincot Williams & Willkins; 2005. Págs.459-62. [ Links ]
6. Stevens D. Systemic antifungal agents. En: Goldman L, Ausiello D (ed). Cecil, Tratado de Medicina Interna. Edición 23. Amsterdam: Elsevier, 2007:2333-9. [ Links ]
7. Moem M, Lyseng-Williamson A, Scott L. Liposomal amphotericin B: a review of its use as empirical therapy in febrile neutropenia and in the treatment of invasive fungal infections. Drugs 2009;69(3):361-92. [ Links ]
8. Steinbach W. Antifungal agents in children. Pediatr Clin North Am 2005;52(3):895-915. [ Links ]
9. Atkinson AJr., Bennett J. Amphotericin B pharmacokinetics in humans. Antimicrob Agents Chemother 1978;13(2):271-6. [ Links ]
10. Bindschadler D, Bennett J. A pharmacologic guide to the clinical use of amphotericin B. J Infect Dis 1969;120:427-36. [ Links ]
11. Koren G, Lau A, Klei J, Golas C, et al. Pharmacokinetics and adverse effects of amphotericin B in infants and children. J Pediatr 1988;113(3):559-63. [ Links ]
12. Goldman R, Koren G. Amphotericin B nephrotoxicity in children. J Pediatr Hematol Oncol 2004;26(7):421-6. [ Links ]
13. Goldman R, Ong M, Wolpin J, Doyle J, et al. Pharmacological risk factors for amphotericin B nephrotoxicity in children. J Clin Pharmacol 2007;47(8): 1049-54. [ Links ]
14. Feldman H, Hamilton J, Gutman R. Amphotericin B therapy in an anephric patient. Antimicrob Agents Chemother 1973;4(3):302-5. [ Links ]
15. Starke J, Mason EJr., Kramer W, Kaplan S. Pharmacokinetics of amphotericin B in infants and children. J Infect Dis 1987;155(4):766-74. [ Links ]
16. Baley J, Meyers C, Kliergman R, Jacobs M, Blumer J. Pharmacokinetics, outcome of treatment, and toxic effects of amphotericin B and 5-fuorcytosine in neonates. J Pediatr 1990;116(5):791-7. [ Links ]
17. Benson J, Nahata M. Pharmacokinetics of amphotericin B in children. Antimicrob Agents Chemother 1989;33(11):1989-93. [ Links ]
18. Wingard J, Kublis P, Lee L, Yee B, et al. Clinical signifcance of nephrotoxicity in patients treated with amphotericin B for suspected or proven aspergillosis. Clin Infect Dis 1999;29(6):1402-07. [ Links ]
19. Cagnoni P, Walsh T, Prendergast M, Bodensteiner D, et al. Pharmacoeconomic analysis of liposomal amphotericin B versus conventional amphotericin B in the empirical treatment of persistently febrile neutropenic patients. J Clin Oncol 2000;18(12):2476-83. [ Links ]
20. Safdar A, Ma J, Saliba F, Dupont B, et al. Drug-induced nephrotoxicity caused by amphotericin B lipid complex and liposomal amphotericin B: a review and meta-analysis. Medicine (Baltimore) 2010;89(4):236-44. [ Links ]
21. Bates D, Su L, Yu D, Chertow G, et al. Mortality and costs of acute renal failure associated with amphotericin B therapy. Clin Infect Dis 2001;32(5):686-93. [ Links ]
22. Sandler ES, Mustafa MM, Tkczewski L, Graham M, et al. Use of amphotericin B colloidal dispersion in children. J Pediatr Hematol Oncol 2000;22(3):242-6. [ Links ]
23. Prentice H, Hann I, Herbrecht R, Aoun M, et al. A randomized comparison of liposomal versus conventional amphotericin B for the treatment of pyrexia of unknown origin in neutropenic patients. Brit J Haematol 1997;98(3):711-8. [ Links ]
24. Lee J, Adler-Sohohet F, Nguyen C, Lieberman J. Nephrotoxicity associated with amphotericin B deoxycholate in neonates. Pediatr Infect Dis J 2009;28(12):1061-3. [ Links ]
25. Levey A, Bosch J, Lewis J, Greene T, et al. A more accurate method to estimate glomerular fltration rate from serum creatinine: a new prediction equation. Modifcation of Diet in Renal Disease Study Group. Ann Intern Med 1999;130(6):461-70. [ Links ]
26. MacGregor R, Bennet J, Erslev A. Erythropoietin concentration in amphotericin B-induced anemia. Antimicrob Agent Chemother 1978;14(2):270-3. [ Links ]
27. Pappas P, Kaufman C, Andes D, Benjamin DJr., et al. Clinical Practice Guidelines for the Management of Candidiasis: 2009 Update by the Infectious Disease Society of America. Clin Infect Dis 2009;48(5):503-35. [ Links ]
28. Takemoto C, Hodding J, Kraus D. Manual de Prescripción Pediátrica. 16ª ed. Hudson OH; Sistemas Inter: Lexi-Comp; 2011. Págs.118-23. [ Links ]
29. Dismukes WE. Introduction to antifungal agents. Clin Infect Dis 2000;30(4):653-7. [ Links ]
30. Williams K, Kearns G. Lipid amphotericin preparations. Pediatr Infect Dis J 2000;19(6):567-9. [ Links ]
31. Martino r. Effcacy, safety and cost-effectiveness of ampho-tericin B lipid complex (ABLC): a review of the literature. Curr Med Res Opin 2004;20(4):485-504. [ Links ]
32. Amphocil ®. Prospecto. Agencia española de medicamentos y productos sanitarios. Ministerio de Sanidad, Política Social e Igualdad. Disponible en: https://siraem4.agemed.es/.../especialidad.do? [ Links ]
33. Bowden R, Chandrasekar P, White MH, Li X, et al. A double-blind, randomized, controlled trial of amphotericin B colloidal dispersion versus amphotericin B for treatment of invasive aspergillosis in immunocompromised patients. Clin Infect Dis 2002;35(4):359-66. [ Links ]
34. Brogden R, Goa K, Coukell A. Amphotericin-B colloidal dispersion. A review of its use against systemic fungal infections and visceral leishmaniasis. Drugs 1998;56(3):365-83. [ Links ]
35. Micromedex Thomson Reuters Healthcare`s 2002-2011. [ Links ]
36. Manual Farmacéutico online. Alfa Beta S.A.C.I.F y S y Alfa Beta Sistemas S.A. [Acceso: 13 octubre de 2011]. Disponible en: http://www.alfabeta.net. [ Links ]
37. Wiley J, Seibel N, Walsh T. Effcacy and safety of amphotericin B lipid complex in 548 children and adolescents with invasive fungal infections. Pediatr Infect Dis J 2005;24(2):167-74. [ Links ]
38. Allen U, Bow E, Doyle J, Richardson S, et al. Pediatric antifungal therapy. Part I: focus on febrile neutropenia, invasive aspergillosis, combination antifungal therapy and invasive candidiasis in immunocompromised pediatric patients. Minerva Pediatr 2010;62(1):57-69. [ Links ]
39. Pappas P, Silveira F, AST Infectious Diseases Community of Practice. Candida in solid organ transplants recipients. Amer J Transplant 2009;9(4):S173-S9. [ Links ]
40. Steinbach W. Invasive aspergillosis in pediatric patients. Curr Med Res Opin 2010;26(7):1779-87. [ Links ]














