Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075
Arch. argent. pediatr. vol.110 no.3 Buenos Aires May./June 2012
ARTÍCULO ORIGINAL
Capacidad del período oligoanúrico para predecir secuela renal en niños con síndrome urémico-hemolítico asociado a diarrea
Capacity of the oligoanuric period in the prediction of renal sequelae in patients with postdiarrheal hemolytic uremic syndrome
Dr. Alejandro Balestraccia, Dra. Sandra Mariel Martina, Dr. Ismael Toledoa, Dra. Silvia Cortia y Dra. Raquel Wainszteina
a. Unidad de Nefrología. Hospital General de Niños Pedro de Elizalde. Ciudad Autónoma de Buenos Aires. Argentina.
Correspondencia: Dr. Alejandro Balestracci: abalestracci@yahoo.com.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 15-11-2011
Aceptado: 31-1-2012
http://dx.doi.org/10.5546/aap.2012.221
Resumen
Introducción. La duración del período oligoanúrico es el principal marcador pronóstico de secuela renal en pacientes con síndrome urémico-hemolítico asociado a diarrea (SUH D+). Realizamos este estudio con el objetivo de determinar la capacidad del período oligoanúrico para predecir secuela renal en niños con SUH D+.
Pacientes y métodos. Revisamos los datos de todos los pacientes internados en el Hospital Elizalde con SUH D+ entre 1998-2008 e incluimos sólo a aquellos seguidos más de 1 año. Consideramos secuela renal a la presencia de albuminuria y/o proteinuria patológicas y/o hipertensión arterial y/o caída de fltrado glomerular. Ingresaron al estudio 80 pacientes, que se dividieron en 2 grupos (con secuela y sin ella). Se determinó si tenían diferencias en la duración del período oligoanúrico y se calculó la capacidad de dicha variable para predecir secuela mediante curva ROC.
Resultados. 32 pacientes presentaron secuela renal (prevalencia 40%), quienes tuvieron un período oligoanúrico signifcativamente más prolongado [mediana 7 días (intervalo 0-14) contra mediana 0 días (intervalo 0-30); p= 0,0003] que aquellos sin secuela. Mediante curva ROC (área bajo la curva de 0,73) se estableció en ≥ 4 días como mejor punto de corte del período oligoanúrico para predecir secuela renal (sensibilidad 68,75%, especifcidad 70,83%).
Conclusión. La curva ROC no permitió identifcar un punto de corte de la duración del período oligoanúrico que permita predecir secuela renal con sensibilidad y especifcidad adecuadas. Esta observación refuerza la importancia del seguimiento periódico y a largo plazo de todos los niños afectados por SUH D+.
Palabras clave: Síndrome urémico-hemolítico; Secuela; Período oligoanúrico; Capacidad predictiva; Curva ROC.
SUMMARY
Introduction. Length of the oligoanuric period is the main predictor of renal sequelae in children with postdiarrehal hemolytic uremic syndrome (D+ HUS). We aimed to determine the capacity of the oligoanuric period in the prediction of renal sequelae in children with D+ HUS.
Patients and methods. We reviewed data from all patients with D+ HUS admitted at Hospital Elizalde between 1998-2008, including only those with at least 1 year of follow-up. Renal sequelae were defned by the presence of pathologic albuminuria and/or proteinuria and/or arterial hypertension and/or chronic renal failure; 80 patients were included, belonging to one of two groups (with or without sequelae). Difference in the duration of the oligoanuric period between groups was determined, and the diagnostic capacity of the oligoanuric period to identifed renal sequelae was assessed by ROC curve.
Results. 32 patients presented sequelae, representing a prevalence of 40%. Oligoanuric period was signifcantly longer in patients with sequelae [median 7 days (range 0-14) vs median 0 days (range 0-30); p= 0,0003]. Using ROC curve (aucROC= 0.73) we identifed an oligoanuric period ≥ 4 days as the best threshold to predict renal sequelae (sensitivity 68.75%, and specifcity 70.83%).
Conclusions. By ROC curve analysis we were unable to identify a cut-off point on the length of the oligoanuric period which predicts renal sequelae with optimum sensitivity and specifcity. This observation emphasizes the need of periodic and long-term surveillance of all children who suffered from D+ HUS.
Key words: Hemolytic uremic syndrome; Sequelae; Oligoanuric period; Predictive capacity; ROC curve.
INTRODUCCIÓN
El síndrome urémico-hemolítico (SUH) se caracteriza por anemia hemolítica microangiopática, trombocitopenia y injuria renal aguda.1 La forma prevalente en la Argentina es la asociada a diarrea (SUH D+) y su incidencia es la más alta del mundo.2,3 Si bien la mortalidad de la etapa aguda es 3-5%,1,4 25-50% de los casos presentan secuela renal manifestada por albuminuria patológica, proteinuria y/o hipertensión arterial (HTA) con riesgo de evolucionar a enfermedad renal crónica.4-7 En nuestro país, el SUH D+ representa el 14,4% de los pacientes con enfermedad renal crónica y sólo es superado por la uropatía obstructiva y la nefropatía por reflujo.8
Debido a que la progresión a enfermedad renal crónica es variable y a que algunos pacientes presentan un período silente sin manifestaciones clínicas ni de laboratorio,5 diversos estudios han intentado identificar factores de riesgo del período agudo asociados al desarrollo posterior de secuelas. Así, se ha reconocido a la duración del período oligoanúrico como el principal marcador pronóstico de secuela renal en pacientes con SUH D+.4,9-12 En base a estas observaciones, y considerando la importancia de detectar precozmente a los pacientes con secuela renal para realizar intervenciones terapéuticas oportunamente,13,14 llevamos a cabo este estudio con el objetivo de determinar la capacidad del período oligoanúrico para predecir secuela renal en niños con SUH D+.
POBLACIÓN, MATERIAL Y MÉTODOS
Pacientes
Fueron revisadas todas las historias clínicas de pacientes internados en el Hospital General de Niños Pedro de Elizalde con diagnóstico de SUH D+ entre enero de 1998 y diciembre de 2008. Para evaluar la presencia de secuela, se incluyeron sólo los seguidos durante más de un año. Se analizaron las historias clínicas de 138 pacientes, 3 fallecieron en el período agudo (1,6%) y 55 (30%) tuvieron seguimiento menor a un año, por lo que la muestra de estudio quedó conformada por 80 pacientes (Figura 1).

Figura 1. Evolución a largo plazo de 138 pacientes con síndrome urémico-hemolítico asociado a diarrea (SHU D+)
Métodos
Se registraron las siguientes variables de las historias clínicas: género, edad, peso, duración del período oligoanúrico, necesidad de diálisis y tiempo de seguimiento. Durante el seguimiento se registró la aparición de albuminuria y/o proteinuria patológicas y/o HTA y/o caída de filtrado glomerular.
Defniciones
El SUH D+ fue definido como la presencia de pródromo diarreico asociado al desarrollo de trombocitopenia (<150 000/mm3), anemia hemolítica microangiopática (hemoglobina menor al percentilo 3 para edad y género con eritrocitos fragmentados) e injuria renal aguda.1
Se definió como período oligoanúrico a los días, constatados durante la internación, en que el niño presentó una diuresis menor a 1 ml/kg/h.4
Se consideró secuela renal a la presencia de albuminuria o proteinuria patológicas y/o HTA y/o caída de filtrado glomerular. Se consideró con secuela a los pacientes con seguimiento mayor de 1 año, que presentaron dichas alteraciones en forma sostenida luego de pasados 6 meses del egreso hospitalario o a aquellos que habiéndolas normalizado tuvieron reaparición de alguna de ellas. De esta forma, los niños con alteraciones post-alta que normalizaron todos los parámetros dentro de los 6 meses y que, seguidos más de un año, no volvieron a presentar alteraciones fueron asignados al grupo sin secuela. Se utilizaron las siguientes definiciones:
• Albuminuria patológica: la mayor a 20 µg/min en orina de 12 h o al índice albuminuria/creatininuria mayor a 2 µg/µmol en muestra aislada de orina. Se consideró como secuela a la persistencia de 3 valores consecutivos de albuminuria patológica.15,16
• Proteinuria patológica: la mayor a 5 mg/kg/día en orina recolectada durante 24 h o el índice proteinuria/creatininuria mayor a 0,5 (en <2 años) o mayor a 0,2 (en >2 años) en muestra aislada de orina.17,18
• HTA al registro de presión sistólica y/o diastólica tomada con esfingomanómetro mayor al percentilo 95 para edad, talla y sexo según los valores de referencia del Cuarto Informe para el Diagnóstico, Evaluación y Tratamiento de la Hipertensión Arterial en Niños y Adolescentes de la Academia Estadounidense de Pediatría.19
• Caída de filtrado glomerular por depuración de creatinina: el filtrado glomerular estimado menor a 90 ml/min/1,73 m2, calculado según fórmula de Schwartz [(talla en cm x K/creatinina (mg/dl), donde K= 0,45 en lactantes de 0-24 meses, 0,55 en mujeres, 0,55 en varones de 2-13 años y 0,70 en varones de 13-18 años].18,20
Consideraciones éticas: El estudio fue aprobado por los Comités de Investigación y de Ética del Hospital General de Niños Pedro de Elizalde y registrado en el Consejo de Investigaciones en Salud del GCBA.
Análisis estadístico: Para el análisis la muestra se dividió en dos grupos, con secuela y sin ella. La estadística descriptiva se presenta como mediana (intervalo) o como porcentaje, según corresponda. Dado que el promedio de duración del período oligoanúrico no ajustaba a normalidad (Shapiro-Wilk), la comparación entre ambos grupos se realizó con la prueba de Wilcoxon. Posteriormente, por medio de curva ROC, se identificó el mejor punto de corte de la duración del período oligoanúrico para predecir secuela renal. A partir de dicho punto se evaluó la asociación entre duración de oligoanuria y secuela renal (ji al cuadrado, OR con sus IC 95%) y se calculó sensibilidad, especificidad, valores predictivos positivo y negativo. Por último, se calcularon las razones de verosimilitud (probabilidad de que el resultado de una prueba se observe en un paciente con la enfermedad de interés, comparado con la probabilidad de que el mismo resultado se observe en un paciente sin dicha enfermedad) positiva y negativa. En todos los casos un valor p <0,05 se consideró estadísticamente significativo. Los datos fueron analizados con los programas Statistix 7 (IBM version; Analytical Software, Tallahasee, FL) y MedCalc para Windows 9.3.2.0 (MedCalc Software, Mari akerke, Bélgica).
RESULTADOS
En el período estudiado se registraron 138 pacientes con SUH D+, 3 fallecieron y 55 tuvieron un seguimiento menor a un año (Figura 1). Para el presente estudio se analizaron los datos de los 80 pacientes (56,2% varones) con seguimiento superior a un año. La mediana de edad fue de 2 años (0,25-11,8), el peso 12,35 kg (5,2-58) y la talla de 89 cm (61-148) al momento del período agudo. La duración del período oligoanúrico tuvo una mediana de 1,5 días (0-30), y 50% de los casos requirió diálisis. No se encontraron diferencias entre los pacientes incluidos en el estudio con aquellos seguidos menos de un año, ni en la duración (p= 0,40), ni en la distribución de pacientes en función del período oligoanúrico (Tabla 1).
Tabla 1. Comparación en la distribución de pacientes con síndrome urémico-hemolítico asociado a diarrea con seguimiento menor a un año y los incluidos en el estudio en función del período oligoanúrico

La mediana de tiempo de seguimiento del grupo en estudio fue de 2,75 años (1-13,8) y la aparición de algún signo de secuela renal durante el seguimiento permitió dividir a la muestra en dos grupos: A) sin secuela, formado por 48 pacientes (60%); y B) con secuela, constituido por 32 pacientes (40%) (Figura 1). Por consiguiente, la prevalencia de secuela renal en nuestra serie fue de 40%. La secuela fue detectada a los 2 años (0,5-11) de seguimiento y estuvo determinada por caída del filtrado glomerular en 8 pacientes, proteinuria significativa en 25 y albuminuria patológica en 7 casos. Tres de los pacientes con caída del filtrado glomerular también presentaron HTA.
Los pacientes del grupo con secuela tuvieron un período oligoanúrico significativamente más prolongado que los del grupo sin secuela [mediana 7 días (intervalo 0-14) contra mediana 0 días (intervalo 0-30); p= 0,0003]. Por medio de la curva ROC se identificó que 4 o más días eran el mejor punto de corte de duración de la oligoanuria para predecir secuela renal luego del episodio agudo (área bajo la curva 0,73; IC 95% 0,66-0,82). La secuela renal fue significativamente más frecuente en los pacientes con un período oligoanúrico ≥ 4 días que en aquellos con menor duración (61,11% contra 22,72%, p= 0,0005; OR 2,68, IC 95% 2,01-14,13).
Un período oligoanúrico ≥ 4 días permitió predecir secuela renal con sensibilidad de 68,75% (IC 95% 49,86-83,25), especificidad de 70,83% (IC 95% 55,74-82,6), valor predictivo positivo de 61,11% (IC 95% 43,53-76,38) y negativo de 77,27% (IC 95% 61,78-88,01) y razón de verosimilitud positiva de 2,36 (IC 95% 1,43-3,88) y negativa de 0,44 (IC 95% 0,26-0,76) (Figura 2).
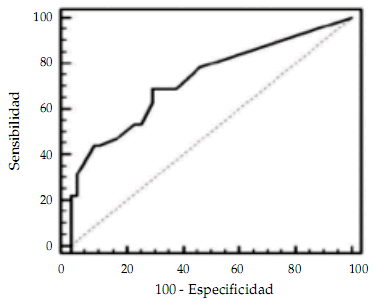
Figura 2. Evaluación de la capacidad del período oligoanúrico para predecir secuela renal en niños con síndrome urémicohemolítico asociada a diarrea. Curva ROC: área bajo la curva 0,73, mejor punto de corte ≥ 4 días (sensibilidad 68,75%, especifcidad 70,83%)
DISCUSIÓN
La enfermedad renal crónica en pacientes que presentaron SUH D+ se debe a disminución de la masa renal funcionante con daño secundario a lesión por hiperfiltración.5,6,21 Su prevalencia varía según las distintas series, entre un 25 y un 50%.5,6,22 Así, un metaanálisis9 que incluyó datos de 3476 pacientes halló 25% de secuela renal, Lumbreras Fernández23 35,1% y tanto Siegler10 como Schifferli24 comunicaron 39%. En la Argentina, Gianantonio detectó secuela renal en el 51,6%25 y Spizzirri en el 37%.4 En nuestra serie de 80 niños observamos una prevalencia de secuela de 40%, luego de un período de seguimiento de entre 1 y 13,8 años.
Debido a la alta posibilidad de desarrollar enfermedad renal crónica luego de la fase aguda es importante identificar a aquellos niños con riesgo de secuela al momento del egreso hospitalario para asegurar su adecuado seguimiento. El monitoreo de estos niños incluye el control de la función renal, de la tensión arterial y la búsqueda de proteinuria y albuminuria patológicas.5,26 En relación a la utilidad de la albuminuria como marcador de progresión, cabe mencionar que pese a ser un reconocido marcador temprano de hiperfiltración en distintas nefropatías crónicas, aún no existen trabajos prospectivos que hayan determinado su relevancia clínica a largo plazo en niños con SUH D+.27
Distintos factores han sido asociados con peor pronóstico a largo plazo, como la presencia de complicaciones extrarrenales graves, la existencia de HTA y la duración del período oligoanúrico, pero este último se reconoce como el de mayor importancia.4,9-12,28-30 En acuerdo con esto, en nuestra serie, la gravedad del fallo renal durante la fase aguda evaluada por la duración del período oligoanúrico, fue significativamente mayor en el grupo con secuela. Gianantonio, en el año 1973, ya había establecido una clara relación entre la duración del período oligoanúrico y el desarrollo de secuela.25 Posteriormente, distintos estudios demostraron hallazgos similares. Spizzirri comunicó que el 7,5% de los pacientes con diuresis conservada, el 38,4% de aquellos con 1-10 días de anuria y el 69,2% de aquellos con 11 o más días presentaron progresión de la enfermedad renal.4 Siegler observó que todos los pacientes con oliguria >15 días o anuria >8 días presentaron daño renal alejado, y el mismo grupo médico, años más tarde, observó en un número mayor de pacientes que la duración de la oliguria >10 días o de la anuria >5 días se asociaron con mayor riesgo de secuela.10,11 Lumbreras Fernández también informó que la anuria >5 días se asocia significativamente con el desarrollo de secuela,23 en tanto que Garg comunicó que ningún paciente recupera la función renal luego de 4 semanas de diálisis.9
La curva ROC arrojó en el punto de corte ≥ 4 días de oligoanuria una sensibilidad de 68,75% y una especificidad de 70,83% del período para predecir secuela, lo cual evidencia que los pacientes con período oligoanúrico de menor duración o aun con diuresis conservada pueden desarrollar secuela.
Como fue previamente mencionado, observamos mayor porcentaje de pacientes con secuela a medida que aumenta la duración de la oligoanuria. En nuestra serie, presentaron secuela el 20,5% de los pacientes sin oligoanuria, el 42% de los pacientes con oligoanuria de entre 1 y 6 días, el 50% de los que la presentaron entre 7 y 14 días y todos aquellos que la presentaron 15 días o más. Si bien ante períodos oligoanúricos prolongados la especificidad es muy alta, por ejemplo, con más de 10 días de oligoanuria la curva ROC arroja una especificidad del 95% y alcanza el 100% con 14 días, la especificidad diagnóstica global de esta variable sólo alcanza el 70,83%.
Asimismo, el período oligoanúrico tampoco presenta una adecuada sensibilidad diagnóstica (68,75%) para predecir secuela. Es destacable que un considerable porcentaje de nuestros pacientes con diuresis conservada presentó daño renal alejado, hallazgo comunicado también por Oakes11 y Cobeñas,31 quienes observaron secuela en el 36% de sus pacientes con diuresis conservada. Asimismo, Caletti observó que de 91 pacientes sin necesidad de diálisis, 39 (42,8%) tuvieron durante el seguimiento proteinuria significativa, 22 (24,1%) la negativizaron con dieta normoproteica normosódica y 17 (18,6%) con dieta más el agregado de enalapril.32
Nuestro estudio presenta algunas limitaciones que deben ser consideradas. Por un lado, se trata de un estudio retrospectivo, pero las pautas de diagnóstico y seguimiento de estos pacientes fueron las mismas en todo el grupo. Por otro lado, la proporción de pacientes perdidos en el seguimiento impresiona como elevada y podría llevar a pensar que se trataba de individuos con enfermedad más leve y, por lo tanto, menor riesgo de secuelas; sin embargo, la duración del período oligoanúrico no difirió de la de los que fueron incluidos en el estudio (Tabla 1).
En conclusión, por medio de curva ROC no pudimos identificar un punto de corte de la duración del período oligoanúrico que permita predecir secuela renal con sensibilidad y especificidad adecuadas. Esta observación refuerza la importancia del seguimiento periódico y a largo plazo de todos los niños que presentaron SUH D+.
Agradecimiento
Al Dr. Fernando Ferrero y a la Dra. Fabiana Ossorio por el asesoramiento para la realización del presente estudio.
1. Gianantonio C, Vitacco M, Mendilaharzu F, Rutty A, Mendilaharzu J. The hemolytic uremic syndrome. J Pediatr 1964; 64: 478-91. [ Links ]
2. Rivas M, Miliwebsky E, Chinen I, Deza N, Leotta GH. Epidemiología del síndrome urémico-hemolítico en Argentina. Diagnóstico del agente etiológico, reservorios y vías de transmisión. Medicina (B Aires) 2006; 66 (supl 3): 27-32. [ Links ]
3. Novillo AA, Voyer LE, Cravioto R, Freire MC, et al. Haemolytic uraemic syndrome associated with faecal cytotoxin and verotoxin neutralizing antibodies. Pediatr Nephrol 1988; 2(3):288-90. [ Links ]
4. Spizzirri FD, Rahman RC, Bibiloni N, Ruscasso JD, Amoreo OR. Childhood hemolytic uremic syndrome in Argentina: long-term follow-up and pronostic features. Pediatr Nephrol 1997; 11(2): 156-60. [ Links ]
5. Repetto HA. Long-term course and mechanisms of progression of renal disease in hemolytic uremic syndrome. Kidney Int 2005; (97):S102-6. [ Links ]
6. Siegler RL. Postdiarrheal Shiga Toxin-Mediated Hemolytic Uremic Syndrome. JAMA 2003; 290 (10): 1379-81. [ Links ]
7. Exeni RA. Hemolytic uremic syndrome. Clinical manifestations. Treatment. Medicina (B Aires) 2006; 66 (S) 3:6-10. [ Links ]
8. Grimoldi IA, Briones LM, Ferraris JR, Rodríguez Rilo L, et al. Enfermedad renal crónica, diálisis y trasplante. Estudio multicéntrico: 1996-2003. Arch Argent Pediatr 2008; 106 (6):552-59. [ Links ]
9. Garg AX, Suri RS, Barrowman N, Rehman F, et al. Longterm renal prognosis of diarrhea-associated hemolytic uremic syndrome: a systematic review, meta-analysis, and meta-regression. JAMA 2003, 290 (10):1360-70. [ Links ]
10. Siegler RL, Milligan MK, Burningham TH, Christofferson RD, et al. Long-term outcome and prognostic indicators in the hemolytic-uremic syndrome. J Pediatr 1991;118:195-200. [ Links ]
11. Oakes RS, Kirkhamm JK, Nelson RD, Siegler RL. Duration of oliguria and anuria as predictors of chronic renal-related sequelae in post-diarrheal hemolytic uremic syndrome. Pediatr Nephrol 2008; 23:1303-8. [ Links ]
12. Tönshoff B, Sammet A, Sanden I, Mehls O, et al. Outcome and prognostic determinants in the hemolytic uremic syndrome of children. Nephron 1994; 68:63-70. [ Links ]
13. Caletti MG, Gallo G. Síndrome urémico hemolítico: Tratamiento de la glomerulopatía secundaria. Medicina (B Aires) 2005; 65:528-32. [ Links ]
14. Caletti MG, Missoni M, Vezzani C, Grignoli M, et al. Effect of diet, enalapril, or losartan in post-diarrheal hemolytic uremic syndrome nephropathy. Pediatr Nephrol 2011; 26(8): 1247-54. [ Links ]
15. Assadi FK. Quantification of microalbuminuria using random urine samples. Pediatr Nephrol 2002; 17(2):107-10. [ Links ]
16. Ruggenenti P, Remuzzi G. Time to abandon microalbuminuria? Kidney Int 2006; 70(7): 1214-22 [ Links ]
17. Bergstein JM. A practical approach to proteinuria. Pediatr Nephrol 1999; 13(8):697-700. [ Links ]
18. Hogg RJ, Furth S, Lemley KV, Portman R, et al. National Kidney Foundation's Kidney Disease Outcomes Quality Initiative Clinical Practice Guidelines for Chronic Kidney Disease in Children and Adolescents: Evaluation, Classifcation, and Stratifcation. Pediatrics 2003; 111(6 pt 1):1416-21. [ Links ]
19. National High Blood Pressure Education Program Working Group on Hypertension Control in Children and Adolescents. The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics 2004; 114(2 Suppl 4th Report):S555-76. [ Links ]
20. Schwartz GJ, Haycock GB, Edelmann CM Jr, Spitzer A. A simple estimate of glomerular fltration rate in children derived from body length and plasma creatinine. Pediatrics 1976, 58(2): 259-63. [ Links ]
21. Caletti MG, Gallo G, Gianantonio CA. Development of focal segmental sclerosis and hyalinosis in hemolytic uremic syndrome. Pediatr Nephrol 1996; 10(6): 687-92. [ Links ]
22. Siegler RL, Pavia AT, Christofferson RD, Milligan MK. A 20-year population-based study of postdiarrheal hemolytic uremic syndrome in Utah. Pediatrics 1994; 94 (1): 35-40. [ Links ]
23. Lumbreras Fernández J, Cruz Rojo J, Iñigo Martín G, Muley Alonso R, et al. Síndrome hemolítico-urémico: afectación renal a largo plazo. An Pediatr (Barc) 2010; 72(5): 309-16. [ Links ]
24. Schifferli A, von Vigier RO, Fontana M, Spartà G, et al. Hemolytic-uremic syndrome in Switzerland: a nationwide surveillance 1997-2003. Eur J Pediatr 2010; 169(5): 591-8. [ Links ]
25. Gianantonio CA, Vitacco M, Mendilaharzu F, Gallo GE, et al. The hemolytic-uremic syndrome. Nephron 1973; 11(2):174-92. [ Links ]
26. Lou-Meda R, Oakes RS, Gilstrap JN, Williams CG, Siegler RL. Prognostic signifcance of microalbuminuria in postdiarrheal hemolytic uremic syndrome. Pediatr Nephrol 2007; 22(1):117-20. [ Links ]
27. Garg AX, Salvadori M, Okell JM, Thiessen-Philbrook RH, et al. Albuminuria and estimated GFR 5 years after Escherichia coli O157 hemolytic uremic syndrome: an update. Am J Kidney Dis 2008; 51(3):435-44. [ Links ]
28. Scheiring J, Andreoli SP, Zimmerhackl LB. Treatment and outcome of Shiga-toxin-associated hemolytic uremic syndrome (HUS). Pediatr Nephrol 2008; 23(10):1749-60. [ Links ]
29. Gianviti A, Tozzi AE, De Petris L, Caprioli A, et al. Risk factors for poor renal prognosis in children with hemolytic uremic syndrome. Pediatr Nephrol 2003; 18(2): 1229-35. [ Links ]
30. Siegler R, Oakes R. Hemolytic uremic syndrome; pathogenesis, treatment and outcome. Curr Opin Pediatr 2005; 17(2): 200-4. [ Links ]
31. Cobeñas CJ, Alconcher LF, Spizzirri AP, Rahman RC. Longterm follow-up of Argentinean patients with hemolytic uremic syndrome who had not undergone dialysis. Pediatr Nephrol 2007; 22(9): 1343-7. [ Links ]
32. Caletti MG, Balestracci A, Missoni M, Viñuela M. Seguimiento a largo plazo de niños con síndrome urémico hemolítico con compromiso renal leve en la fase aguda. Medicina Infantil 2010; 17(1): 3-7. [ Links ]














