Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075
Arch. argent. pediatr. vol.111 no.2 Buenos Aires Apr. 2013
http://dx.doi.org/10.5546/aap.2013.148
ARTÍCULO ESPECIAL
Vigilancia epidemiológica de rotavirus en la Argentina: 2009-2011
Rotavirus epidemiology and surveillance in Argentina: 2009-2011
Bioq. Juan Ignacio Degiuseppea, Lic. Carlos Giovacchinib, Bioq. Juan Andrés Stupkaa y Red Nacional de Vigilancia de Gastroenteritis Virales*
a. Laboratorio de Gastroenteritis Virales. Instituto Nacional de Enfermedades Infecciosas (INEI) - ANLIS Dr. Carlos G. Malbrán.
b. Área de Vigilancia. Dirección de Epidemiología. Ministerio de Salud de la Nación. Buenos Aires, Argentina.
* Integran la Red Nacional de Vigilancia de Gastroenteritis Virales los siguientes investigadores:
Alejandra Amarilla (Htal. Heller, Neuquén); Carmen Ayala (Htal. Perón, Formosa); Juan Beltramino (Htal. Alassia, Santa Fe); María Fernanda Bulgheroni (Htal. Heller, Neuquén); María José Cabral (Htal. Eva Perón, Catamarca); Ernesto Caillou (Htal. del Niño Jesús, Tucumán); Norma Camacho (Htal. Castellanos, Salta); Fernando Canna (Laboratorio Central, Córdoba); Silvia Correa (Htal. San Luis, San Luis); Darío di Prátula (Htal. Zatti, Río Negro); Rogelio Espejo (Htal. Rawson, San Juan); Ana Ferrari (Htal. Rawson, San Juan); Leopoldo Fierro (Htal. Rawson, San Juan); Sandra Grucci (Htal. Notti, Mendoza); Silvia Larini (Htal. Vilela, Santa Fe); Elena Lozano (Htal. Quintana, Jujuy); Noelia Lucero (Htal. Schestakow, Mendoza); Carlos Pérez Labarthe (Htal. de la Madre y el Niño, Formosa); Carlos Roldán (Htal. Garrahan, CABA); Ivana Silveyra (Htal. Centeno, La Pampa) y Alejandra Vera (Htal. Río Gallegos, Santa Cruz).
Correspondencia: Bioq. Juan Ignacio Degiuseppe: jdegiuseppe@anlis. gov.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 28-8-2012
Aceptado: 3-12-2012
Resumen
Se estima que, en la Argentina, rotavirus produce entre 80 000 y 100 000 consultas médicas por año y es responsable del 40% de las internaciones por diarrea aguda en los menores de 5 años. El objetivo del presente trabajo es analizar los datos del período 2009-2011 en relación con la vigilancia nacional de rotavirus. Se estudió la prevalencia y distribución según el grupo etario, la frecuencia temporal y los genotipos circulantes.
Resulta fundamental conocer la epidemiología y la carga de esta enfermedad para el diseño de estrategias e intervenciones en salud con el propósito de prevenir y controlar las enfermedades que tienen un alto impacto en la población.
Palabras clave: Diarrea; Rotavirus; Vigilancia epidemiológica; Argentina.
Summary
It has been estimated that in Argentina, rotavirus causes approximately 80 000 to 100 000 clinic consultations annually and is responsible for 40% of acute diarrhea related hospital admissions in children under 5 years. In this study, national rotavirus surveillance data from 2009-2011 was consulted to asses prevalence, seasonality, agegroup distribution as well as the national and regional genotypes circulating.
It is essential to get deeper insight into the epidemiology and burden of rotavirus diarrhea for design of strategies and health interventions in order to prevent and control high impact human diseases.
Key words: Diarrhea; Rotavirus; Epidemiological surveillance; Argentina.
http://dx.doi.org/10.5546/aap.2013.148
Introducción
La diarrea aguda representa la segunda entidad clínica más común después de las infecciones respiratorias; la infección por rotavirus es la causa más importante de diarrea en los niños. 1,2 A nivel mundial, el rotavirus afecta anualmente a 110 millones de niños, de los cuales 2 millones requieren hospitalización y se calcula que las muertes por este agente superan los 500 000 casos.3 Estos últimos ocurren principalmente en países en desarrollo, debido a la dificultad en el acceso a los servicios de salud, y representan el 10% de las muertes prevenibles de la infancia.4 En la Argentina se estima que el rotavirus produce entre 80 000 a 100 000 consultas médicas por año y es responsable del 40% de las internaciones por diarrea aguda en los menores de 5 años.5
A partir de 2009, la Organización Mundial de la Salud recomienda la incorporación de una vacuna antirotavirus a los calendarios nacionales de inmunización, intensamente en los países cuya tasa de mortalidad asociada a la diarrea en menores de 5 años sea mayor del 10%.6 En la Argentina, de aproximadamente 1 millón de casos de diarrea aguda notificados anualmente, 50% ocurren en menores de 5 años. Asimismo, esta enfermedad origina alrededor del 10% de las internaciones en la primera infancia y 100 muertes promedio al año, representando el 1,2% de ellas en este grupo etario.2,7
El Laboratorio Nacional de Referencia para Gastroenteritis Virales del Instituto Nacional de Enfermedades Infecciosas (INEI-ANLIS Dr. Carlos G. Malbrán), con el objetivo específico de implementar la vigilancia de rotavirus a nivel nacional, adoptó desde el año 2009 el Sistema de Vigilancia Laboratorial (SIVILA) como herramienta para el manejo de la información con los nodos participantes.
El SIVILA constituye el módulo de notificación de laboratorios del Sistema Nacional de Vigilancia de la Salud (SNVS), un sistema en línea que contempla dos modalidades de notificación: individual/ nominal y agrupada/numérica. La primera se utiliza para informar los casos que requieren acciones de control o seguimiento. La segunda, en cambio, para registrar la frecuencia absoluta y relativa de casos positivos sobre el total de estudiados para un evento determinado, según grupos de edad y semana epidemiológica.8
El objetivo del presente trabajo es analizar la frecuencia, estacionalidad, distribución por grupos de edad y diversidad de genotipos circulantes de rotavirus en los nodos que conforman el sistema de vigilancia epidemiológica en la Argentina.
Material y métodos
Los datos utilizados para este estudio se obtuvieron de las siguientes herramientas de la sección Consultas del SIVILA-SNVS para el evento Diarreas virales: a) condensado de notificación agrupada, para analizar la proporción de casos positivos con respecto al total de muestras estudiadas y la distribución por grupos de edad, y b) Curva de eventos agrupados por semana epidemiológica, para determinar la frecuencia temporal. La mayor actividad (pico estacional) del evento en estudio se definió como el período de 3 o más semanas en el cual la frecuencia de los casos positivos era superior a la media anual para cada año. Con el propósito de analizar el papel de este enteropatógeno viral en la internación, en el año 2011 se discriminó la totalidad de la información en pacientes ambulatorios e internados. Para el análisis comparativo de estos dos grupos, se utilizó el paquete estadístico PASWStatistics 18, considerando un nivel de significación de p <0,05.
Para todas las consultas mencionadas, solo se contemplaron los datos provenientes de la notificación agrupada en el período 2009-2011, a nivel nacional, y desagregados por provincias para regionalizar el país en tres áreas: Norte, Centro y Sur. En la modalidad agrupada, los nodos integrantes de la red cargan en línea, semanalmente, un informe condensado de las determinaciones positivas de rotavirus sobre la cantidad total de muestras estudiadas para este agente, según grupos de edad y semana epidemiológica. La cantidad de determinaciones surge de la demanda particular del diagnóstico de certeza que cada nodo presenta.
Para estudiar los genotipos circulantes se utilizaron todas las muestras de materia fecal positivas para rotavirus recibidas de acuerdo con el protocolo de vigilancia. El diagnóstico etiológico fue realizado por los nodos de vigilancia utilizando metodologías de ELISA o inmunocromatografía, que detectan antígenos virales en las heces.9 La caracterización molecular binaria se llevó a cabo mediante técnicas de retrotranscripción y amplificación por reacción en cadena de la polimerasa (RT-PCR), con posterior PCR multiplex anidada de los genes que codifican las proteínas VP7 y VP4 (G y P tipo, respectivamente).10-12
Resultados
Prevalencia y distribución por grupo etario.
Durante el período 2009-2011 se ingresaron en la estrategia SIVILA 15 515 muestras para estudio de las diarreas virales. De estas, 4415 resultaron positivas para rotavirus (28,5%). Considerando la prevalencia global de rotavirus desagregada por año, fue de 33,3%, 26,9% y 28,2% para los años 2009, 2010 y 2011, respectivamente. En los tres años de estudio, la población con mayor cantidad de muestras testeadas fue la constituida por los menores de 2 años, que representó el 72,9% para 2009, el 61,4% para 2010 y el 56,9% para 2011. La distribución según el grupo etario entre los casos positivos de rotavirus y las muestras estudiadas se detallan en la Tabla 1.
Tabla 1. Distribución por grupo etario de la relación entre casos positivos de rotavirus y muestras estudiadas. Período 2009- 2011

Prevalencia y distribución por región. El estudio de la prevalencia de rotavirus para cada región del país demuestra que las tasas de detección se mantuvieron relativamente constantes en los tres años estudiados. Sin embargo, se observaron diferencias sustanciales en el momento de comparar esas tasas entre las regiones. La zona en la que se observó mayor prevalencia fue la del norte argentino, en todos los años estudiados; las que registraron la menor relación de positividad en cada período fueron la región sur en los primeros dos años de estudio (2009-2010) y la región centro en 2011. La distribución por región de la relación entre casos positivos de rotavirus y muestras estudiadas se describe en la Tabla 2.
Tabla 2. Distribución por región de la relación entre casos positivos de rotavirus y muestras estudiadas. Período 2009-2011

Frecuencia temporal. En el año 2009 los períodos con mayor registro de la actividad fueron los comprendidos entre las semanas epidemiológicas (SE) 18-21, 25-29, 36-40 y 44-48. Estos se corresponden con los meses de mayo, julio, septiembre y noviembre (Figura 1). En los años 2010 y 2011, por otra parte, se observó un solo pico estacional comprendido entre las SE 18-35 (mayo-agosto) y 17-36 (fines de abril y principios de septiembre), respectivamente.

Figura 1. Frecuencia temporal de los casos estudiados de rotavirus. 2009-2011
Análisis en la población ambulatoria e internada.
A partir de la modificación realizada en agosto de 2010, la notificación agrupada del evento Diarreas virales discrimina entre la población ambulatoria e internada. En el año 2011, se obtuvo una prevalencia global de rotavirus de 29,6% en los pacientes internados y de 26,5% en los pacientes ambulatorios (valor de la prueba de la χ2p= 0,0049). Para ambos grupos, la mayor cantidad de muestras analizadas se concentró en la población de menores de 2 años, con una relación de positividad del 31,8% y del 32,7% para los pacientes internados y ambulatorios, respectivamente. La información del año 2011, discriminada según grupo de pacientes, se detalla en la Tabla 3.
Tabla 3. Distribución por grupo etario de la relación entre casos positivos de rotavirus y muestras estudiadas. Pacientes internados y pacientes ambulatorios. Año 2011

Circulación viral. Se caracterizaron molecularmente 1453 muestras de materia fecal con diagnóstico positivo de rotavirus (338, 526 y 589 en los años 2009, 2010 y 2011, respectivamente). Las asociaciones de genotipos más prevalentes en el año 2009 fueron G3P[8] y G12P[8], con un 54,1% y 29,6% de detección, respectivamente (Tabla 4). Al año siguiente, G3P[8] mantuvo una elevada frecuencia de detección (68,1%) seguido de G1P[8] (9,5%). En 2011 las asociaciones G2P[4] y G3P[8] fueron las mayormente detectadas (44,0% y 30,4%, en ese orden). Asimismo, es importante destacar que el patrón de distribución regional de los genotipos circulantes en cada año no fue homogéneo. En la zona norte, hubo elevada detección de G12P[8] en el año 2009, mientras que en las zonas centro y sur, la asociación G3P[8] fue la más prevalente. En el año 2010 se detectó G3P[8] en forma mayoritaria en las tres regiones, aunque en diferentes frecuencias relativas. En 2011, G2P[4] fue detectado con mayor frecuencia en el centro y norte del país, mientras que en la región sur la asociación predominante fue G3P[8]. La distribución de los genotipos circulantes según las regiones se detalla en la Figura 2.
Tabla 4. Distribución porcentual global de los genotipos circulantes de rotavirus. Período 2009-2011

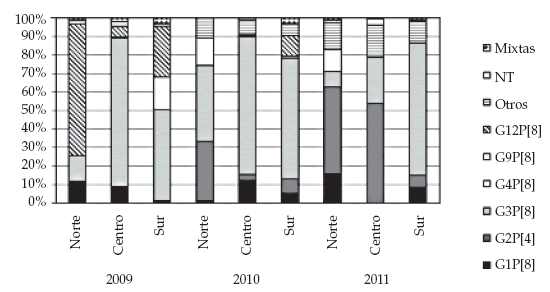
Figura 2. Distribución de genotipos circulantes de rotavirus por región. Años 2009-2011
Discusión
Rotavirus es el principal agente causal de diarrea aguda en los menores de 5 años en todo el mundo y es responsable de la mayoría de las internaciones a causa de esta patología.
El presente estudio analiza la información de la vigilancia epidemiológica de rotavirus en el período 2009-2011 a nivel nacional.
En la Argentina, la diarrea aguda causa el 1,2% de las muertes en menores de 5 años. Es importante destacar que en la región norte del país esta proporción se duplica (2,1%) en relación con la media nacional y casi llega a triplicar el porcentaje observado en las regiones centro y sur (0,8%).2,7 Considerando la actividad del rotavirus en los tres años estudiados y estos datos oficiales, provenientes del Sistema Nacional de Vigilancia en Salud (SNVS) y la Dirección de Estadística e Información en Salud (DEIS), se podrían estimar alrededor de 150 000 casos de diarrea, 15 000 internaciones y 30 muertes anuales en menores de 5 años a causa de este enteropatógeno. Tales datos destacan la importancia del rotavirus como principal agente causal de diarrea infantil.
Al analizar la distribución regional, la mayor prevalencia se observó en el norte del país. Cabe hacer notar que en esta estrategia de vigilancia para ese evento en particular pueden observarse sesgos en la selección de muestras estudiadas que inciden en las proporciones de positividad obtenidas.
Igualmente, estos resultados se complementan con el estudio de Bok y cols., que describió un mayor impacto del rotavirus en las provincias del norte del país.13
El grupo etario con mayor tasa de detección del rotavirus fue el constituido por los menores de 2 años. Sin embargo, la proporción de muestras estudiadas de las cuales no se disponía del dato de la edad (sin especificar) fue incrementándose significativamente. En 2009, esta proporción era del 9,3%, pero para el año 2011 esta cifra aumentó más de dos veces, ascendiendo al 20,9%. Esta dificultad impacta en forma negativa en la especificidad de la información y, por lo tanto, es necesario repensar una adecuada articulación entre el equipo de salud involucrado para subsanar esta clase de inconvenientes.
En relación con el patrón estacional de la enfermedad, la mayor actividad de rotavirus se produjo en los meses de otoño e invierno (mayoagosto) en los tres años estudiados. Resulta llamativo que en la región norte del país se observó el mismo patrón de estacionalidad que en las regiones centro y sur, en contraposición a lo esperado para una zona en la cual prevalece el clima cálido. Por otra parte, el incremento de los casos positivos en los meses de septiembre y noviembre de 2009 pudo haber obedecido a un aumento de la sensibilidad en la notificación por la incorporación de nuevos laboratorios en la red.
La posibilidad de la notificación del evento Diarreas virales desagregado por pacientes ambulatorios e internados proporciona una mayor especificidad en la información acerca del impacto de este virus. En este estudio se observó una mayor proporción de casos de diarrea aguda por rotavirus en los pacientes internados que en los ambulatorios. Asimismo, estos resultados deben ser interpretados cuidadosamente debido a las limitaciones de la estrategia de vigilancia empleada. Se consideran necesarios futuros estudios con un muestreo debidamente protocolizado para poder inferir, con mayor validez, el papel que cumple este agente en la internación con respecto a otros enteropatógenos, así como la magnitud que presenta entre los pacientes internados y ambulatorios En relación con las estrategias de prevención, se ha demostrado que las mejoras en las condiciones higiénico-sanitarias no impactan de manera sustancial en la disminución de las muertes e internaciones asociadas a este virus.14 Este es uno de los principales motivos por el cual la Organización Mundial de la Salud ha priorizado la inmunoprevención como estrategia.15 En la Región de las Américas, 14 países han incorporado alguna de las dos vacunas licenciadas (Rotarix® y RotaTeq®) a su calendario oficial. En la Argentina se comercializan ambas, pero aún no han sido implementadas en el programa nacional de inmunizaciones. Se ha estimado su administración sólo en el 10% de la cohorte anual de nacidos vivos, principalmente en el subsector privado. Estas vacunas han mostrado una reducción significativa de la mortalidad asociada a la diarrea aguda en numerosos países en desarrollo de la región, como Brasil, El Salvador, México, Nicaragua y Panamá.16-19Asimismo, en los países desarrollados han logrado gran éxito en la disminución de la internación a causa de esta patología.20-21 En los Estados Unidos permitieron una reducción del 98% de este parámetro, con el consiguiente impacto en los costos directos e indirectos asociados a la hospitalización.22
Frente a una estrategia de inmunoprevención, el estudio de la circulación viral resulta importante no solo para analizar su eficacia sino para conocer su posible efecto sobre la ecología del virus. En los países que implementaron la vacuna monovalente (Rotarix®), de los casos residuales de diarrea por rotavirus, se observó un aumento en la detección de G2P[4] y un aumento de G3P[8] en los que utilizaban como estrategia la vacuna pentavalente (Rotateq®), lo que sugiere posibles derivas génicas y mecanismos de selección.23-28
En nuestro país, se observó la cocirculación de distintos genotipos, con una fluctuación anual en la prevalencia. El aumento en la frecuencia de G3P[8] a inicios del período estudiado se produjo a expensas de una disminución en la circulación de G9P[8], genotipo que emergió y predominó en el período 2006-2008.29 El genotipo G12P[8], por otra parte, fue detectado por primera vez en el año 2008 con una elevada frecuencia, que se mantuvo hasta el año siguiente.30 En 2011, las asociaciones predominantes fueron G2P[4] y G3P[8]. Considerando la población pediátrica de la Argentina como no vacunada, la elevada frecuencia de G2P[4] podría deberse más a una fluctuación natural del virus que al resultado de una presión selectiva vacunal.31 Esta variación refuerza el concepto de la compleja dinámica que presenta este virus para diseminarse en la población.
Los patrones heterogéneos de circulación de genotipos, temporales y geográficos, el alto impacto de la enfermedad diarreica por rotavirus y su importante papel en la internación, en un contexto en el cual la principal estrategia de prevención es la inmunización, destacan la necesidad de un sistema de vigilancia epidemiológica continua e intensiva.
Un sistema de vigilancia de la salud actualizado y eficiente fortalece y facilita el trabajo de las diferentes áreas respecto de la prevención, el control de enfermedades y la promoción de la salud. Es un requisito fundamental para alcanzar mayores niveles de salud y mejorar la calidad de vida de la población.
1. Organización Mundial de la Salud. Centro de prensa. Enfermedades diarreicas. 2009; nota descriptiva nº 330. [Acceso: 4 de junio de 2012]. Disponible en: http://www.who. int/mediacentre/factsheets/fs330/es/
2. Ministerio de Salud de la Nación. Boletín Epidemiológico Anual 2010. Argentina, 2011. [Acceso: 4 de junio de 2012]. Disponible en http://msal.gov.ar/htm/site/sala_situacion/PANELES/bep-anual-2010/BEPANUAL_2010.pdf.
3. Parashar UD, Burton A, Lanata C, Boschi-Pinto C, et al. Global mortality associated with rotavirus disease among children in 2004. J Infec Dis 2009;200(Suppl 1):S9-S15.
4. OPS/Sabin Institute. Simposio Regional de Nuevas Vacunas. Perú, 2009. [Acceso: 12 de junio de 2012]. Disponible en: http://www.sabin.org/files/attachment/Simposio%20 Regional%20de%20Nuevas%20Vacunas.pdf.
5. Gómez JA, Sordo ME, Gentile A. Epidemiologic patterns of diarrheal disease in Argentina: estimation of rotavirus disease burden. Pediatr Infect Dis J 2002;21(9):843-50. [ Links ]
6. World Health Organization. Rotavirus vaccines:an update. Weekly Epidemiolog Record 2009;84(50):533-40. [ Links ]
7. Dirección de Estadísticas e Información en Salud. Indicadores básicos 2011. Argentina, 2012. [Acceso: 4 de junio de 2012]. Disponible en http://www.deis.gov.ar/publicaciones/ archivos/indicadores_2011.pdf.
8. Ministerio de Salud de la Nación. SIVILA. Argentina, 2011. [Acceso: 6 de junio de 2012]. Disponible en http:// www.msal.gov.ar/index.php/home/funciones/area-devigilancia/ sivila
9. Department of Immunization, Vaccines and Biologicals (WHO). Manual of rotavirus detection and characterization methods. Switzerland, 2009;1-9.
10. Gouvea V, Glass RI, Woods P, Taniguchi K, et al. Polymerase chain reaction amplification and typing of rotavirus nucleic acid from stool specimens. J Clin Microbiol 1990;28(2):276-82. [ Links ]
11. Das BK, Gentsch JR, Cicirello HG, Woods PA, et al. Characterization of rotavirus strains from newborns in New Delhi, India. J Clin Microbiol 1994;32(7):1820-2.
12. Gentsch JR, Glass RI, Woods P, Gouvea V, et al. Identification of group A rotavirus gene 4 types by polymerase chain reaction. J Clin Microbiol 1992;30(6):1365-73.
13. Bok K, Castagnaro N, Borsa A, Nates S, et al. Surveillance for rotavirus in Argentina. J Med Virol 2001;65(1):190-8. [ Links ]
14. Velázquez FR, Garcia-Lozano H, Rodriguez E, Cervantes Y, et al. Diarrhea morbidity and mortality in Mexican children: impact of rotavirus disease. Pediatr Infect Dis J 2004;23(10 Suppl):S149-55.
15. World Health Organization. Rotavirus vaccines. Weekly Epidemiological Record 2007;82(32):285-95.
16. Lanzieri TM, Costa I, Shafi FA, Cunha MH, et al. Trends in hospitalizations from all-cause gastroenteritis in children younger than 5 years of age in Brazil before and after human rotavirus vaccine introduction, 1998-2007. Pediatr Infect Dis J 2010;29(7):673-5. [ Links ]
17. de Palma O, Cruz L, Ramos H, de Baires A, et al. Effectiveness of rotavirus vaccination against childhood diarrhoea in El Salvador: case-control study. BMJ 2010;340:c2825.
18. Patel M, Pedreira C, De Oliveira LH, Tate J, et al. Association between pentavalent rotavirus vaccine and severe rotavirus diarrhea among children in Nicaragua. JAMA 2009;301(21):2243-51.
19. Molto Y, Cortes JE, De Oliveira LH, Mike A, et al. Reduction of diarrhea-associated hospitalizations among children aged < 5 Years in Panama following the introduction of rotavirus vaccine. Pediatr Infect Dis J 2011;30(1 Suppl):S16-20.
20. Boom JA, Tate JE, Sahni LC, Rench MA, et al. Effectiveness of pentavalent rotavirus vaccine in a large urban population in the United States. Pediatrics 2010;125(2):e199-207. [ Links ]
21. Buttery JP, Lambert SB, Grimwood K, Nissen MD, et al. Reduction in rotavirus-associated acute gastroenteritis following introduction of rotavirus vaccine into Australia's National Childhood vaccine schedule. Pediatr Infect Dis J 2011;30(1 Suppl):S25-9.
22. Curns AT, Steiner CA, Barrett M, Hunter K, et al. Reduction in acute gastroenteritis hospitalizations among US children after introduction of rotavirus vaccine: analysis of hospital discharge data from 18 US states. J Infect Dis 2010;201(11):1617-24.
23. Ruiz-Palacios GM, Perez-Schael I, Velazquez FR, Abate H, et al. Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis. N Engl J Med 2006;354 (1):11-22.
24. Vesikari T, Karvonen A, Prymula R, Schuster V, et al. Efficacy of human rotavirus vaccine against rotavirus gastroenteritis during the first 2 years of life in European infants: randomised, double-blind controlled study. Lancet 2007;370(9601):1757-63. [ Links ]
25. Ciarlet M, Schodel F. Development of a rotavirus vaccine: clinical safety, immunogenicity, and efficacy of the pentavalent rotavirus vaccine, Rota Teq. Vaccine 2009;27(Suppl 6):G72-81.
26. Vesikari T, Karvonen A, Ferrante SA, Kuter BJ, et al. Sustained efficacy of the pentavalent rotavirus vaccine, RV5, up to 3.1 years following the last dose of vaccine. Pediatr Infect Dis J 2010;29(10):957-63. [ Links ]
27. Kirkwood CD, Boniface K, Barnes GL, Bishop RF. Distribution of rotavirus genotypes after introduction of rotavirus vaccines, Rotarix® and RotaTeq®, into the National Immunization Program of Australia. Pediatr Infect Dis J 2011;30(1 Suppl):S48-53.
28. Hull JJ, Teel EN, Kerin TK, Freeman MM, et al. United States rotavirus strain surveillance from 2005 to 2008: genotype prevalence before and after vaccine introduction. Pediatr Infect Dis J 2011;30(1 Suppl):S42-7. [ Links ]
29. Stupka JA, Carvalho P, Amarilla AA, Massana M, et al. National rotavirus surveillance in Argentina: high incidence of G9P[8] strains and detection of G4P[6] strains with porcine characteristics. Infect Genet Evol 2009;9(6):1225-31.
30. Stupka JA, Degiuseppe JI, Parra GI. Increased frequency of rotavirus G3P[8] and G12P[8] in Argentina during 2008- 2009: whole-genome characterization of emerging G12P[8] strains. J Clin Virol 2012;54(2):162-7.
31. Gurgel RQ, Cuevas LE, Vieira SC, Barros VC, et al. Predominance of rotavirus P[4]G2 in a vaccinated population, Brazil. Emerg Infect Dis 2007;13(10):1571-3.














