Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075
Arch. argent. pediatr. vol.111 no.2 Buenos Aires Apr. 2013
SOCIEDAD ARGENTINA DE PEDIATRÍA SUBCOMISIONES, COMITÉS Y GRUPOS DE TRABAJO
Seguimiento neumológico de los niños con displasia broncopulmonar al alta de la Unidad de Cuidados Intensivos Neonatal Parte 1: Epidemiología, fisiopatología y clínica
Follow-up of infants with bronchopulmonary dysplasia after NICU discharge. Part I: epidemiology, pathophysiology and clinical
http://dx.doi.org/10.5546/aap.2013.165
Coordinadores: Dra. Verónica Giubergia, Dr. Fernando Renteria.
Colaboradores: Dra. Gabriela Bauer, Dra. Hebe González Pena, Dr. Fernando Vila, Dra. Verónica Giubergia, Dra. Alicia Michelini, Dra. Verónica Aguerre, Dr. Conrado Llapur, Dra. Diana Fariña, Dra Dora Haag y Dra. Virginia D´Alessandro.
Conflicto de intereses: Ninguno que declarar.
Recibido: 25-10-2012
Aceptado: 31-1-2013
Introducción
La displasia broncopulmonar (DBP) es la enfermedad pulmonar crónica más frecuente del lactante; se expresa con una importante morbilidad en los primeros años de vida, e implica un riesgo de secuela pulmonar a largo plazo o de resultados adversos en el neurodesarrollo.
Se presenta durante el período neonatal en recién nacidos de parto prematuro que necesitaron tratamiento por insuficiencia respiratoria en las primeras semanas de vida. Después del egreso neonatal, los prematuros con DBP requieren una atención pediátrica programada e interdisciplinaria.
Esta guía está dirigido a pediatras neumólogos, pediatras en general y otros profesionales de la salud y afines vinculados al seguimiento y la atención de los niños nacidos de parto prematuro.
Breve reseña histórica
La DBP fue descrita en 1967 por William Northway en recién nacidos prematuros con síndrome de dificultad respiratoria (SDR) o enfermedad de la membrana hialina (EMH), que recibieron tratamiento con ventilación mecánica y altas concentraciones de oxígeno y, en lugar de evolucionar a la curación, presentaban signos de enfermedad pulmonar crónica.1
En 1979, Eduardo Bancalari y cols. propusieron criterios diagnósticos más precisos para DBP.2
Más tarde, se sugirieron otros criterios en cuanto al momento del diagnóstico.3 Finalmente, en 2001, el grupo de expertos reunidos por los Institutos Nacionales de Salud de los Estados Unidos (NIH), coordinado por Alan Jobe y Eduardo Bancalari, propusieron la definición actualmente vigente.4
Definición
Se diagnostica DBP cuando el recién nacido persiste con necesidad de suplemento de oxígeno al menos 28 días después del nacimiento.4 Esta definición no incluye los signos clínicos y radiológicos. Incorpora en forma complementaria la categorización de la gravedad de la DBP, de acuerdo con el sostén respiratorio que requiere el recién nacido según la edad postconcepcional y la edad gestacional. 5-7 El momento de la evaluación depende de la edad gestacional al nacer (Tabla 1).
Tabla 1. Momento de la evaluación

Es importante determinar la gravedad, ya que ello permite anticipar las necesidades terapéuticas y el grado de vulnerabilidad de cada paciente.
El desafío futuro es estandarizar los criterios para la indicación de oxigenoterapia basada en la oximetría de pulso. Hasta el presente, el criterio de "requerimiento de oxigenoterapia" continúa vigente tanto en la práctica asistencial como en los estudios de investigación que incorporan a pacientes con DBP.6
Su utilidad ha sido validada al comprobarse una mayor morbilidad en los pacientes con las formas graves que en aquellos con las formas leves o moderadas (Tabla 2).8
Tabla 2. Criterios para establecer la gravedad de la DBP

Incidencia y epidemiología de la displasia broncopulmonar
En las Tablas 3 y 4 se muestra el pronóstico y supervivencia de recién nacidos de muy bajo peso (<1500 g al nacer) en dos períodos. Los datos comparativos confirman que a menor edad gestacional y peso, mayor es la incidencia de DBP.9
Tabla 3. Supervivencia y complicaciones en prematuros de muy bajo peso al nacer en UCIN. Neonatal Research Network Sites, 1995-1996 vs. 1997-2002*

Tabla 4. Supervivencia y complicaciones en prematuros de muy bajo peso al nacer en UCIN. Neonatal Research Network Sites, 1997-2002*
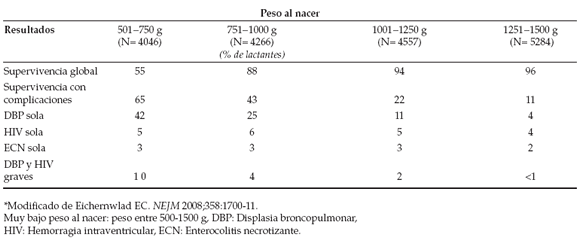
Se dispone de pocos datos sobre la epidemiología de la DBP en América Latina. Las cifras publicadas recientemente por el grupo NEOCOSUR, con información proveniente de la Argentina, Chile, Paraguay, Perú y Uruguay, correspondiente al período 2002-2007, indican una frecuencia de DBP en prematuros de muy bajo peso al nacer de 27,8% en el grupo que no había recibido corticosteroides antenatales (n= 1126) y de 24,7% en el grupo que los recibió (n= 3225).5 Estos datos destacan la importancia de esta patología en la región y son similares a lo comunicado por países más desarrollados.6
Datos no publicados correspondientes al programa de "Prevención de IRA en prematuros" del Ministerio Salud de la Nación informan una prevalencia del 27% de DBP en 1540 prematuros <1500 g de peso al nacer (nacidos en 2011).10
Fisiopatología
Los avances en el cuidado intensivo neonatal han configurado nuevos patrones de alteraciones pulmonares en recién nacidos más inmaduros que los descritos al principio por Northway. En la actualidad, los recién nacidos sobreviven a edades gestacionales de 23 a 26 semanas (8 a 10 semanas más pequeños que la edad de aquellos recién nacidos de la época en que se describió inicialmente la DBP).
El espectro epidemiológico ha cambiado en estos 40 años. Se han jerarquizado otros factores involucrados en su patogenia, como inflamación o infección, administración excesiva de líquidos, edema pulmonar, persistencia o reapertura del conducto arterioso, aumento de la resistencia de las vías aéreas, inmadurez de los sistemas antioxidantes, deficiencias nutricionales, insuficiencia suprarrenal temprana y predisposición genética.11-14
La etiopatogenia de la DBP es multifactorial. Muchos factores contribuyen a su aparición y es probable que actúen de forma aditiva o sinérgica para promover la lesión.4
Se reconocen dos entidades clínicas: la "DBP clásica" y la "nueva DBP".
DBP clásica: se presenta en RN prematuros sobrevivientes a una dificultad respiratoria grave, que han requerido ventilación mecánica con parámetros elevados, altas concentraciones de oxígeno y presiones inspiratorias. Este tipo de DBP es cada vez menos frecuente en las unidades neonatales con altos estándares de cuidado integral del prematuro.4,8,14
Nueva DBP: cuanto menor sea la edad gestacional del recién nacido prematuro mayor será el daño pulmonar por inmadurez y mayor la probabilidad de aparición de la nueva DBP. Distintos mecanismos de lesión interrumpen el desarrollo normal del pulmón y detienen la alveolización y la vascularización.9,13 Las alteraciones son parcelares y se encuentra tejido normal adyacente.15,16
Factores potencialmente dañinos y lesión pulmonar
Los recién nacidos prematuros suelen estar expuestos a diversas fuentes de lesión, tanto antes como después del nacimiento. Durante las primeras semanas de vida, distintos factores asociados al huésped, sumados a los tratamientos instituidos, pueden ocasionar daño pulmonar (Figura 1).

Figura 1. Factores dañinos que pueden estar involucrados en la patogenia de la DBP
Estos factores que intervendrían en la patogenia de la DBP pueden agruparse según correspondan al huésped o a los agentes de daño.
Vulnerabilidad del huésped
Prematuridad-inmadurez pulmonar: la mayor vulnerabilidad está dada por un pulmón que se encuentra en la fase sacular, junto con la deficiencia del surfactante.14 La regulación de los mecanismos de reparación está alterada, lo que favorece la aparición de fibrosis. El pulmón inmaduro puede ser fácilmente dañado por el oxígeno y la ventilación mecánica artificial, habitualmente necesarios para la supervivencia de estos niños muy prematuros.
Factores genéticos: existiría una predisposición genética para la aparición de la DBP. Avala este concepto la variabilidad observada en la incidencia y la gravedad de la enfermedad entre prematuros con similares factores de riesgo. Según algunos estudios, ciertos factores genéticos y epigenéticos desempeñarían un importante papel en su patogenia.4,11,15
Agentes de daño
Inflamación: es uno de los principales factores de riesgo para el desarrollo de la DBP. Niveles elevados de diversas citocinas proinflamatorias, como IL-6, IL-8, IL-1ß y TNF-a en el líquido amniótico antes del parto prematuro, se han asociado con mayor riesgo.11 La inflamación puede ser desencadenada por factores infecciosos y no infecciosos. 14
Oxígeno: la administración de oxígeno puede alterar la permeabilidad capilar, con necrosis de células alveolares de tipo 1, hiperplasia escamosa epitelial, y hemorragia intersticial y alveolar. A esto se suma la inmadurez de los sistemas antioxidantes del prematuro.4,11
Asistencia ventilatoria mecánica: configura un daño potencial por la posibilidad de "volutrauma",
"barotrauma" y "atelectrauma". El volutrauma es el daño asociado a la sobredistensión de las estructuras pulmonares por utilización de grandes volúmenes inspiratorios durante la ventilación mecánica. Actualmente, es el mayor problema asociado a la ventilación mecánica en la "DBP nueva". El barotrauma es la lesión producida por las altas presiones durante la ventilación mecánica. 11 El atelectrauma se refiere al colapso con posterior reexpansión alveolar. La ventilación con PEEP previene el daño alveolar difuso durante la ventilación con altos volúmenes.
Infección: hay una clara relación entre infección prenatal y posnatal y la aparición de la DBP.12 Los RN prematuros nacidos de madre con corioamnionitis tienen mayor predisposición a presentar DBP. Uno de los agentes infecciosos que produce una respuesta inflamatoria es Ureaplasma urealyticum.4,11,13
Conducto arterioso permeable o persistente. Manejo de los líquidos: el conducto arterioso permeable es una complicación frecuente en las primeras semanas de vida en los prematuros extremos con insuficiencia respiratoria. Ocasiona aumento del flujo sanguíneo pulmonar con edema intersticial, reduciendo la distensibilidad pulmonar y aumentando la resistencia de las vías aéreas.13
Nutrición y déficits carenciales: la afectación del estado nutricional altera la estructura pulmonar de las fibras elásticas y colágenas.12
Manifestaciones clínicas La presentación clínica y la gravedad de la DBP varían desde una forma leve sin requerimientos de oxígeno, otra que requiere bajos niveles de oxígeno suplementario y ventilación mecánica por pocas semanas, hasta las formas más graves de los niños que necesitan asistencia ventilatoria durante meses o años, o mueren por falla cardiopulmonar grave.6
Según la evidencia disponible, el pronóstico a largo plazo es favorable para la mayoría de los lactantes, aunque todavía no hay datos suficientes sobre la evolución en la vida adulta.6
En cada paciente, la DBP se manifestará de acuerdo con el tipo y la gravedad de la lesión pulmonar.
La manifestación clínica (Tabla 5) también dependerá de la edad a la que se considere el paciente con DBP.
Tabla 5. Manifestaciones clínicas de la DBP

Si en etapas tempranas de la DBP el niño ha presentado fundamentalmente compromiso de la vía aérea, durante la infancia predominarán los episodios de sibilancias recurrentes, hiperreactividad bronquial o tos persistente.
Si la lesión que ha predominado inicialmente fue la falla en la alveolización y en la vascularización pulmonar, la manifestación clínica predominante durante la infancia será taquipnea e
insuficiencia respiratoria, con mayor riesgo de hipertensión pulmonar.
En un gran número de niños van a coexistir ambos patrones.
Debe considerarse la presencia de comorbilidades, como reflujo gastroesofágico, patología subglótica y traqueal (estenosis laríngea asociada o no a estenosis traqueal, traqueomalacia y broncomalacia), cortocircuitos sistémico-pulmonares y trastornos deglutorios.17
Función pulmonar en el paciente con displasia broncopulmonar establecida
El impacto de la prematuridad per se sobre el pulmón, sumado a los efectos de las intervenciones terapéuticas, como oxigenoterapia y asistencia ventilatoria mecánica, determina una alteración de la función pulmonar, que con mayor o menor repercusión clínica, puede persistir toda la vida. El nacimiento prematuro se produce en una etapa del desarrollo embrionario en la que la anatomía de la vía aérea ya se ha establecido. Por lo tanto, el mayor impacto de la prematuridad será sobre la estructura de esta, así como sobre el desarrollo de los alvéolos y los vasos sanguíneos pulmonares.
Las modificaciones estructurales de la vía aérea se expresarán funcionalmente en el lactante como una disminución de los flujos espiratorios medidos mediante pruebas de función pulmonar (compresión toracoabdominal con volumen corriente o elevado) que se mantienen bajos por lo menos durante los primeros años de vida.18,19 También se describieron alteraciones ventilatorias, y disminución de la distensibilidad y de la capacidad residual funcional durante el primer año de vida. En algunos estudios se observó hiperreactividad bronquial y respuesta broncodilatadora
en lactantes con DBP.20,21
Estos hallazgos funcionales explicarían la presencia de sibilancias recurrentes, tos crónica y riesgo aumentado de reinternaciones por causa respiratoria en los primeros años de vida en los niños prematuros con DBP o sin ella. Algunos estudios longitudinales muestran que en los lactantes con DBP, la distensibilidad pulmonar mejora con el tiempo, mientras que la disminución de los flujos espiratorios puede persistir durante toda la infancia.20,22
En los prematuros con compromiso predominante del desarrollo alveolar, se observó una disminución de la superficie de intercambio gaseoso. Esta última fue evaluada por el método de difusión de monóxido de carbono, que puso de manifiesto la afectación parenquimatosa en los prematuros extremos.23
El patrón funcional de los niños con DBP no es patognomónico. Los hallazgos deben analizarse teniendo en cuenta el contexto clínico particular de cada paciente.
Las espirometrías realizadas en niños que fueron prematuros pueden ser normales o mostrar una limitación al flujo aéreo de distinta gravedad. Estos hallazgos son aún más frecuentes en los niños que padecieron DBP. Generalmente el volumen espiratorio forzado en el primer segundo (VEF1) se encuentra normal o ligeramente disminuido, y el compromiso de la vía aérea se expresa en una disminución de la relación VEF1/CVF y en las medidas de flujos espiratorios forzados (FEF25-75%).24,25 Se describió respuesta a los broncodilatadores en un 32% de los niños que presentaron DBP.24 La hiperreactividad de la vía aérea puede, asimismo, estar presente en un porcentaje significativo de adolescentes con antecedentes de DBP.26 Las alteraciones funcionales también se observan durante el ejercicio, con aumento de la frecuencia respiratoria y bajo volumen corriente, y menor consumo pico de oxígeno.27 En estos pacientes la obstrucción de la vía aérea puede persistir durante la edad escolar y la adolescencia.
Actualmente existen métodos que permiten evaluar la función pulmonar en el lactante, el preescolar y el niño en edad escolar. En todo niño con antecedente de prematuridad, con DBP o no, debería realizarse por lo menos un estudio espirométrico y la evaluación de la respuesta a los broncodilatadores a partir de la edad escolar. La gran disponibilidad de equipos, la facilidad con que se realiza técnicamente el estudio y la valiosa información que provee justifican esta indicación.
Los estudios de función pulmonar en el lactante requieren sedación, son prolongados y su accesibilidad es menor. Están destinados casi siempre a los estudios de investigación. Este tipo de estudio en la práctica clínica se limitaría a los pacientes con patrones clínicos no habituales y a la evaluación de la respuesta terapéutica, y debe ser indicado por el neumólogo.
La decisión de realizar, en los preescolares, estudios (Rint, IOS, espirometría) que no requieren sedación, pero sí una mínima colaboración por parte del paciente, se tomará en función de la clínica, las características del paciente y la disponibilidad para efectuarlos.
Circulación pulmonar en el paciente con displasia broncopulmonar establecida
La hipertensión pulmonar se define con la presencia de una presión media en la arteria pulmonar ≥ 25 mm Hg, presión capilar normal (≤15 mm Hg) e incremento en las resistencias vasculares pulmonares (> 3 unidades Wood/m2). En los pacientes pediátricos suele utilizarse la relación entre la presión pulmonar sistólica o media y la presión sistémica media o sistólica; se considera anormal una relación ≥ 0,4.28
El diagnóstico de enfermedad vascular pulmonar en esta población es dificultoso y requiere un alto índice de sospecha, dado que los síntomas de hipertensión pulmonar pueden ser sutiles y los signos clínicos ser atribuidos a la enfermedad pulmonar crónica.
La hipertensión pulmonar en la DBP se manifiesta por episodios de cianosis recurrentes, edema de pulmón, insuficiencia cardíaca derecha, exacerbaciones respiratorias frecuentes, mayor número de rehospitalizaciones y un incremento de la muerte súbita. Su pronta detección provee una información pronóstica importante y permite un tratamiento más temprano y eficaz.29,30
El electrocardiograma puede identificar la hipertrofia ventricular derecha como un marcador de la hipertensión pulmonar, aunque tiene una sensibilidad del 67% y un valor predictivo positivo del 69%.30 El ecocardiograma Doppler color es un método no invasivo utilizado para el diagnóstico y la evaluación de la gravedad de la hipertensión pulmonar. En comparación con el cateterismo cardíaco, tiene una sensibilidad del 68% y una especificidad del 48%. De lo que se puede observar, la morfología del septum interventricular es lo más objetivo. La evaluación ecocardiográfica permite también estimar la función del ventrículo izquierdo, descartar cardiopatías asociadas y la presencia de colaterales aortopulmonares que, al aumentar el flujo pulmonar, empeoran la insuficiencia respiratoria.30
Al inicio del seguimiento se recomienda efectuar un ecocardiograma en las siguientes situaciones:
• Prematuridad extrema: edad gestacional ≤28 semanas.
• Restricción del crecimiento intrauterino.
En cualquier momento si el paciente presenta:
• Inadecuado incremento de peso a pesar de recibir las calorías suficientes.
• Enfermedad respiratoria grave que no mejora a pesar del tratamiento.
• Persistencia del requerimiento de oxigenoterapia.
• Episodios de cianosis o deterioro respiratorio recurrentes.
• Hipercapnia persistente.
La evaluación de los pacientes que requieren oxigenoterapia se debe realizar inicialmente con el aporte de oxígeno que el niño recibe. Si no se evidencia hipertensión pulmonar, se suspende el oxígeno por 15 a 20 minutos y se estima nuevamente la presión pulmonar.
El cateterismo cardíaco está reservado para:
1) Medir el flujo pulmonar en el paciente que presenta un cortocircuito sistémico-pulmonar y definir la necesidad de corrección quirúrgica cuando la evaluación mediante el ecocardiograma no es óptima.
2) Ante signos de hiperflujo pulmonar sin cortocircuito sistémico-pulmonar detectable por ecocardiograma, para descartar colaterales aortopulmonares significativas, y eventual tratamiento.
3) Estudiar los signos de hipertensión pulmonar detectados en el ecocardiograma que no se correlacionan con la clínica del paciente.
4) Descartar una obstrucción venosa pulmonar o disfunción del VI que puede contribuir a la hipertensión pulmonar y al edema pulmonar recurrente.
La prueba de vasorreactividad pulmonar en este grupo de pacientes tiene sólo un valor pronóstico, dado que las terapias vasodilatadoras (prostaciclinas, bloqueantes de las endotelinas, bloqueantes de la fosfo-5-diesterasa) que requieren su realización se encuentran en fase experimental.
En los niños con DBP, la hipertensión pulmonar evoluciona hacia una gradual resolución durante el primer año de vida. La persistencia de hipertensión pulmonar moderada o grave, que es un signo ominoso y se asocia con mayor morbimortalidad, se relaciona con deterioro y claudicación del ventrículo derecho.31
Participaron en la discusión y redacción de esta Guía:
Comité Nacional de Neumonología: Dra. Virginia Dalessandro Dr. Víctor Pawluk, Dra. Beatriz Reches, Dra. Silvia Pereyro, Dra. Cecilia Lepera, Dra. Anahí Krügen, Dra. María Marta Quiñones, Dra. Graciela Luque, Dra. Karina Melillo, Dra. Karina Moncada, Dra. Nora Díaz, Dra. Araceli Luz Benítez, Dra. Verónica Aguerre, Dra. Hilda Giugno, Dra. Patricia Paba, Dra. Analía Stadelman, Dra. Corina Magadan, Dra. Ana Castiñeiras, Dra. Silvina Smith, Dr. Julio Nadeo, Dra. Marcela Fraga, Dr. Pablo Bodas, Dra. Selva Di Coste, Dra. Sandra Baratta, Dra. Ana Balanzat, Dra. Marcela Capellino, Dra. Gisela Martinchuk, Dra. Yanina Loto, Dra. Alicia Michelini, Dr. Fernando Vila, Dra. Verónica Giubergia, Dr. Daniel Álvarez, Dr. Juan Gagneten, Dra. María Eugenia Bonilla, Dr. Diego Dagnino, Dr. Santiago Vidaurreta, Dra. María Elena Andreottola, Dr. Hernán Talamoni, Dr. Ángel Bonina, Dr. Maximiliano Salim, Dr. Fernando Renteria, Dr. Juan Finocchiaro, Dr. Fernando Adot, Dr. Raúl Robles, Dra. Lina Abram, Dra. Sandra Inwentarz, Dra. Mariela Bonini, Dr. Fernando Ferrero, Dra. Norma González, Dr. Claudio Castaños, Dr. Mario Grenoville, Dr. Federico Gini Cambaceres, Dra. Gabriela Surman, Dra. Nadia Tucci, Dra. Teresita Solís, Dra. Judit Pierini, Dr. Damián Taire, Dra. Sandra Barria, Dr. Néstor Pisapia, Dra. Silvina Prates, Dra. Elena Bonifacich, Dr. Luis Parra, Dr. Gastón Bolognese, Dr. Mauricio Borda, Dra. Silvia Cipriani, Dr. Gonzalo Colombres, Dr. Fernando Meneghetti, Dr. Patricio Pérez, Dra. Catalina Pinchak, Dra. Clarisa Ferreyra, Dra. María Alejandra Zárate, Dra. Liliana Gallardo, Dra. Alejandra Meneguzzi, Dra. Elsa Bisero, Dr. Mauro González Ross, Dra. Daniela Petti, Dra. Patricia Andreossi, Dra. Vivian Leske, Dra. Patricia Meyer, Dra. Gabriela Bauer, Dr. Conrado Llapur, Dra. Hebe González.
Comité Nacional de Estudios Fetoneonatales (CEFEN): Dra. Daniela Satragno.
Comité Nacional de Cardiología: Dra. Dora Haag.
1. Northway WH Jr, Rosan RD, Porter DY. Pulmonary disease following respiratory therapy of hyaline membrane disease: Bronchopulmonary dysplasia. N Engl J Med 1967;276(7):357-68. [ Links ]
2. Bancalari E, Abdenour GE, Feller R, Gannon J. Bronchopulmonary dysplasia: clinical presentation. J Pediatr 1979;95(5 Pt 2):819-23. [ Links ]
3. Shennan AT, Dunn MS, Ohlsson A, Lennox K, Hoskins E. Abnormal pulmonary outcomes in premature infants: prediction from oxygen requirement in the neonatal period. Pediatrics 1988;82(4):527-32. [ Links ]
4. Jobe A, Bancalari E. Bronchopulmonary Dysplasia-NICHD/ NHLBI/ORD Workshop Summary. Am J Respir Crit Care Med 2001;163(7):1723-9. [ Links ]
5. Fehlmann E, Tapia J, Fernández R, Bancalari A, et al. Impacto del síndrome de dificultad respiratoria en recién nacidos de muy bajo peso de nacimiento: estudio multicéntrico sudamericano. Arch Argent Pediatr 2010;108(5):393-400.
6. Desarrollo temprano - Consenso del grupo de seguiSIBEN para el seguimiento del neurodesarrollo en niños prematuros de MBPN. En: Bauer G, Borbonet D, Morgues M, Sola A. Niños prematuros y sus primeros años de vida. Recomendaciones del grupo de seguimiento de recién nacidos de alto riesgo: SeguiSIBEN. Buenos Aires: Edimed; 2011.
7. Walsh MC, Yao Q, Gettner P, Hale E, et al. Impact of a physiologic definition on bronchopulmonary dysplasia rates. Pediatrics 2004;114(5):1305-11. [ Links ]
8. Ehrenkranz RA, Walsh MC, Vohr BR, Jobe AH, et al. Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatrics 2005;116(6):1353-60.
9. Eichenwald EC, Stark AR. Management and outcomes of very low birth weight. N Engl J Med 2008;358(16):1700-11.
10. Ministerio de Salud de la Nación. Programa de prevención de IRA en prematuros de alto riesgo atendidos en el sector público de salud. 2011.
11. Bancalari A. Actualización en presentación y patogénesis de la displasia broncopulmonar. Rev Chil Pediatr 2009;80 (3):213-24. [ Links ]
12. Biniwale M, Ehrenkranz R. The role of nutrition in the prevention and management of bronchopulmonary dysplasia. Semin Perinatol 2006;30(4):200-8.
13. Chess PR, D'Angio CT, Pryhuber GS, Maniscalco WM. Pathogenesis of bronchopulmonary dysplasia. Semin Perinatol 2006;30(4):171-8.
14. Bancalari E, Claure N, Sosenko IR. Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition. Semin Neonatol 2003;8(1):63-71.
15. Lavoie P, Pham Ch, Jang K. Heritability of bronchopulmonary dysplasia, defined according to the Consensus Statement of the National Institutes of Health. Pediatrics 2008;122:(3)479-85. [ Links ]
16. Guardia C, Moya FR, Maturana A. Incidence of "New" BDP among premature infants receiving prophylactic surfactante therapy. PAS 2008. 2-6 May, Honolulu, Hawaii. E-PAS2008:63520.
17. Tiscornia C, Botto H, Rodríguez H. Patología de la vía aérea quirúrgica. En: Martínez Ferro M, Cannizaro C, Rodríguez S, Rabasa C. Neonatología Quirúrgica. Buenos Aires: Grupo Guía; 2004. Págs.267-83.
18. Friedrich L, Stein R, Pitrez P, Corso A, Jones M. Reduced lung function in healthy preterm infants in the first months of life. Am J Respir Crit Care Med 2006;173(4):442-7. [ Links ]
19. Friedrich F, Pitrez P, Stein R, Goldani M, et al. Growth rate of lung function in healthy preterm infants. Am J Respir Crit Care Med 2007;176(12):1269-73.
20. Tepper RS, Morgan WJ, Cota K, Taussig LM. Expiratory flow limitation in infants with bronchopulmonary dysplasia. J Pediatr 1986(6);109:1040-6. [ Links ]
21. Motoyama EK, Fort MD, Klesh KW, Mutich RL, Guthrie RD. Early onset of airway reactivity in premature infants with bronchopulmonary dysplasia. Am Rev Respir Dis 1987;136(1):50-7.
22. Baraldi E, Filippone M, Trevisanuto D, Zanardo V, Zacchello F. Pulmonary function until two years of life in infants with bronchopulmonary dysplasia. Am J Respir Crit Care Med 1997;155(1):149-55.
23. Balinotti J, Chakr V, Tiller Ch, Kimmel R, et al. Growth of lung parenchyma in infants and toddlers with chronic lung disease of infancy. Am J Respir Crit Care Med 2010;181(10):1093-7.
24. Fawke J, Lum S, Kirkby K, Hennessy E, et al. Lung function and respiratory symptoms at 11 years in children born extremely preterm: the EPICure study. Am J Respir Crit Care Med 2010;182(2):237-45. [ Links ]
25. Lum S, Kirkby J, Welsh L, Marlow N, et al. Nature and severity of lung function abnormalities in extremely pre-term children at 11 years of age. Eur Respir J 2011;37(5):1199-207.
26. Halvorsen T, Skadberg BT, Eide GE, Roksund OD, et al. Pulmonary outcome in adolescents of extreme preterm birth: a regional cohort study. Acta Paediatr 2004;93(10):1294-300. [ Links ]
27. Welsh L, Kirkby J, Lum S, Odendaal D, et al. The EPICure study: maximal exercise and physical activity in school children born extremely preterm. Thorax 2010;65(2):165-72.
28. Barst RJ, Ertel SI, Beghetti M, Ivy DD. Pulmonary arterial hypertension: a comparison between children and adults. Eur Respir J 2011;37(3):665-77.
29. Abman SH, Groothius JR. Pathophysiology and treatment of DBP. Current issues. Pediatr Clin North Am 1994; 41(2):277-315. [ Links ]
30. Khemani E, McElhinnney DB, Rhein L, Andrade O, et al. Pulmonary Artery Hypertension in Formerly Premature Infants With Bronchopulmonary Dysplasia: clinical features and outcomes in the surfactant era. Pediatrics 2007;120(6):1260-9.
31. Parker TA, Abman SH. The pulmonary circulation in bronchopulmonary dysplasia. Semin Neonatol 2003;8(1):51-61.














