Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.111 no.5 Buenos Aires oct. 2013
http://dx.doi.org/10.5546/aap.2013.e125
PRESENTACIÓN DE CASOS CLINICOS
http://dx.doi.org/10.5546/aap.2013.e125
Sarcoma de Kaposi por virus del herpes humano de tipo 8 en un receptor de trasplante hepático pediátrico. Caso clínico
Human herpesvirus 8 related Kaposi's sarcoma in a pediatric liver transplant recipient. Case report
Dra. Ivone Mallaa, Bq. Celeste Pérezb, Dra. Yu Cheanga y Dr. Marcelo Silvac
a. Hepatología y Trasplante Hepático Pediátrico, Hospital Universitario Austral. Pilar, Buenos Aires, Argentina.
b. Virología. INEI-ANLIS Dr. CG Malbrán. Ciudad Autónoma de Buenos Aires, Argentina.
c. Hepatología y Trasplante Hepático, Hospital Universitario Austral. Pilar, Buenos Aires, Argentina.
Correspondencia: Dra. Ivone Malla: imalla@cas.austral.edu.ar
Conflicto de intereses: Ninguno que declarar.
Recibido: 7-4-2013
Aceptado: 31-7-2013
RESUMEN
Los pacientes que reciben tratamiento inmunosupresor están en riesgo de desarrollar tumores malignos. La infección primaria o reactivación del virus del herpes humano de tipo 8 (HHV-8) puede predisponer al sarcoma de Kaposi después del trasplante de un órgano sólido. En los receptores de trasplantes pediátricos, este sarcoma tiene baja incidencia y mal pronóstico. Se informa la presentación clínica de un sarcoma de Kaposi en un ganglio linfático luego de una infección por HHV-8 en un niño a los 4 meses del trasplante hepático. El paciente tuvo buena evolución con suspensión del tacrolimus y conversión a sirolimus un mes después del diagnóstico. En nuestro conocimiento, este es el primer caso de sarcoma de Kaposi en un receptor pediátrico de trasplante hepático informado en nuestro país y creemos que esta entidad debería considerarse como diagnóstico diferencial en las complicaciones postrasplante.
Palabras clave: Trasplante hepático, Pediatría, Virus del herpes humano de tipo 8, Malignidad, Sarcoma de Kaposi.
SUMMARY
Patients under immunosuppressive treatment are at risk of developing malignant tumors. Primary infection or reactivation of human herpesvirus 8 (HHV-8) may predispose to Kaposi's sarcoma (KS) after solid organ transplantation. KS in pediatric liver transplant recipients has low incidence and poor prognosis. We report the clinical presentation of a KS in lymph node following HHV-8 infection in a pediatric patient presenting four months after liver transplantation. He had a good outcome with suspension of tacrolimus and conversion to sirolimus one month after diagnosis. To our knowledge, this is the frst KS reported case in our country after liver transplant in a pediatric recipient and we believe that this entity should be taken into consideration in the differential diagnosis of post-transplant complications.
Keywords: Liver transplantation, Pediatrics, Human herpesvirus 8, Malignancy, Kaposi sarcoma.
INTRODUCCIÓN
El riesgo de aparición de un tumor maligno aumenta después del trasplante de un órgano sólido debido a la bien conocida asociación entre el uso de inmunosupresores y las infecciones virales. El HHV-8 está asociado con el desarrollo de sarcoma de Kaposi (SK) en receptores de trasplante. En un análisis de la base de datos nacional de trasplante de los Estados Unidos, 12 de 1918 tumores postrasplante fueron SK.1 En un estudio poblacional italiano, el período postrasplante temprano fue un factor de riesgo de aparición de SK en receptores de órganos sólidos, en comparación con la población general.2 Algunos reportes mencionan una alta mortalidad3,4 y otros describen buenas evoluciones de esta complicación con la conversión del tratamiento inmunosupresor a sirolimus, debido a sus propiedades antiproliferativas y antitumorales.5-7
Informamos sobre un caso de SK en un receptor pediátrico que se presentó 4 meses postrasplante hepático y mostró buena evolución con suspensión del tacrolimus y conversión a sirolimus como tratamiento inmunosupresor.
En nuestro conocimiento, esta es la primera comunicación de un SK en un receptor pediátrico de trasplante hepático en nuestro país y lo consideramos útil para resaltar esta complicación en los niños que reciben un tratamiento inmunosupresor.
CASO CLÍNICO
Paciente varón, de 4 años, trasplantado con donante vivo relacionado (madre) por una falla hepática fulminante secundaria a hepatitis A. El período postrasplante inmediato transcurrió sin complicaciones. Recibió inmunosupresión habitual con meprednisona más tacrolimus (nivel anterior a este episodio 8,9 ng/ml).
A los 4 meses del trasplante presentó un cuadro de dolor abdominal, distensión y fiebre de 5 días de evolución, y fue internado con ascitis y poliadenomegalias. En el momento del ingreso se constató anemia, disfunción renal, leucocitosis en el líquido peritoneal y función hepática normal (Tabla 1). Con diagnóstico de peritonitis, se inició tratamiento antibiótico luego de tomar muestras para cultivo de sangre y líquido peritoneal (que resultaron negativas). Paralelamente se discontinuó el tratamiento inmunosupresor. En el lapso de 3 días, el estado general del paciente mejoró, aunque continuaba con ascitis y poliadenomegalias. Se decidió efectuar la biopsia de un ganglio axilar, en la que se constataron características histológicas de SK (Figura 1). Se investigó HHV-8 por reacción en cadena de la polimerasa (open reading frame 26 PCR)8 en la saliva, los linfocitos periféricos y el ganglio linfático del receptor, así como en la saliva y los linfocitos periféricos de la donante. Los resultados fueron positivos en todas las muestras, se negativizaron dos meses después en el receptor y permanecieron positivos en la donante. Se detectaron anticuerpos anti-HHV-8 por inmunofluorescencia indirecta (IFA),9 en el receptor eran negativos pretrasplante (título < 1:40) y positivos durante este episodio (título > 1:640); la donante mostró títulos > 1:640 persistentes. Con estos resultados, se arribó al diagnóstico de SK por HHV-8.
Tabla 1. Datos de laboratorio al ingreso

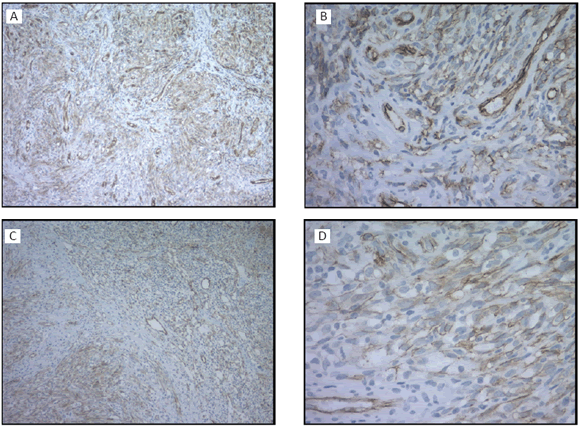
Figura 1. Histología de un ganglio linfático: estructura reemplazada por proliferación neoplásica maligna de aspecto fusocelular que desarrolla espacios vasculares rudimentarios. Inmunohistoquímica marcación CD34 positiva (A: 100×, B: 400×) y CD31 positiva (C: 100×, D: 400×)
El paciente mostró buena evolución, con desaparición de la ascitis y las poliadenomegalias sin tacrolimus. Un mes más tarde, comenzó tratamiento con sirolimus en dosis de 1 mg/m2/ día (niveles séricos entre 5 y 8 ng/ml).
Actualmente, después de 7 años de seguimiento, tiene un examen clínico y humoral normal, y recibe monoterapia con sirolimus.
DISCUSIÓN
El SK es la neoplasia maligna más común asociada a la infección por el virus de la inmunodeficiencia humana (HIV) en áreas endémicas, como el África subsahariana.10-12 De los niños infectados con HIV en Uganda, 1,7% presentaron malignizaciones, de las cuales 90% fueron SK, con una mortalidad del 30%.10 La presentación clínica como linfadenopatía es especialmente frecuente en los niños pequeños de esa zona.11 No hay evidencia adecuada en los niños que permita determinar si la terapia antirretroviral es suficiente o si es necesario agregar esquemas de quimioterapia para tratar estos tumores.12
El aumento del riesgo de aparición de un tumor maligno después del trasplante de un órgano sólido en relación con la terapia inmunosupresora y las infecciones virales es bien conocido y se ha confirmado en publicaciones recientes.1,13 El SK por HHV-8 se observó en receptores de órganos sólidos y con mayor riesgo en la población italiana.2 Aseni y cols., informaron una prevalencia de 1% para SK en receptores adultos de trasplante hepático con alta mortalidad (4 de 5 pacientes murieron por esta complicación).3 Di Benedetto y cols., describieron un 2,1% de incidencia de SK en receptores adultos de trasplante hepático en Italia, con una mortalidad del 50%.4
Algunos informes de SK en trasplante hepático describen buena evolución con quimioterapia, con antivirales14 o con conversión del tratamiento inmunosupresor a sirolimus.6 En receptores
adultos de trasplante renal, el sirolimus inhibió la progresión de SK y mantuvo, además, una inmunosupresión adecuada.5 En su revisión de 2009, Mónaco sostuvo que los receptores de trasplante con malignidades de novo postrasplante deberían convertir sus esquemas inmunosupresores a inhibidores mTOR, ya que estos fármacos tienen efectos antineoplásicos.15
También se describieron casos de SK por HHV-8 en receptores pediátricos de trasplante hepático, con buena evolución luego de la conversión a sirolimus.7 Esto coincide con nuestro informe que es, pensamos, el primer caso descrito en la Argentina. Creemos que comunicar este caso resulta útil para considerar esta grave complicación postrasplante y revisar su manejo.
Agradecimiento
Agradecemos a los Dres. Cecilia Lagues y Alberto San Román, anatomopatólogos del Hospital Universitario Austral, su invalorable aporte en el proceso e interpretación de la histología.
1. Sampaio M, Cho Y, Qazi Y, et al. Posttransplant Malignancies in Solid Organ Adult Recipients: An Analysis of the U.S. National Transplant Database. Transplantation 2012;94(10):990-8. [ Links ]
2. Piselli P, Busnach G, Cittero F, et al: Risk of Kaposi Sarcoma after Solid-Organ Transplantation: Multicenter Study in 4767 Recipients in Italy, 1970-2006. Transplant Proc 2009;41(4):1227-30.
3. Aseni P, Vertemati M, Minola E, et al. Kaposi's Sarcoma in Liver Transplant Recipients: Morphological and Clinical Description. Liver Transpl 2001;7(9):816-23. [ Links ]
4. Di Benedetto F, Di Sandro S, De Ruvo N, et al. Kaposi's sarcoma after liver transplantation. J Cancer Res Clin Oncol 2008;134(6):653-8. [ Links ]
5. Stallone G, Schena A, Infante B, et al. Sirolimus for Kaposi's Sarcoma in Renal-Transplant Recipients. N Engl J Med 2005;352(13):1317-23. [ Links ]
6. Ho C, Huang S, Hu R, et al. Sirolimus-induced signaling modifications in Kaposi's sarcoma with resolution in a liver transplant recipient. Clin Transplant 2010; 24(1):127-32. [ Links ]
7. Celtik C, Ünüvar A, Aydogan A, et al. Human herpes virus type 8-associated Kaposi sarcoma in a pediatric liver transplant recipient. Pediatr Transplant 2011;15(5):E100-4. [ Links ]
8. Perez C, Tous M, Zala N. Human herpesvirus 8 in healthy blood donors, Argentina. Emerg Infect Dis 2010;16(1):150-1. [ Links ]
9. Perez C, Tous M, Gallego S, et al. Seroprevalence of human herpesvirus-8 in blood donors from different geographical regions of Argentina, Brazil, and Chile. J Med Virol 2004;72(4):661-7. [ Links ]
10. Tukei V, Kektiinwa A, Beasley P. Prevalence and outcome of HIV-associated malignancies among children. AIDS 2011;25:1789-93. [ Links ]
11. Gantt S, Kakun A, Wald A, et al. Clinical presentation and outcome of epidemic Kaposi sarcoma in Ugandan children. Pediatr Blood Cancer 2010;54:670-4. [ Links ]
12. Molyneux E, Davidson A, Orem J, et al. The Management of Children With Kaposi Sarcoma in Resource Limited Settings. Pediatr Blood Cancer 2013;60:538-42. [ Links ]
13. Engels E, Pfeiffer R, Fraumeni J Jr, et al. Spectrum of Cancer Risk among U.S. Solid Organ Transplant Recipients: The Transplant Cancer Match Study. JAMA 2011;306(17):1891-901. [ Links ]
14. Amante M, Cejas N, Krowicki E, et al. Complete remission of visceral and cutaneous Kaposi's sarcoma after liver-kidney transplantation. Ann Hepatol 2010;9(4):455-6. [ Links ]
15. Monaco A. The Role of mTOR Inhibitors in the Management of Posttransplant Malignancy. Transplantation 2009;87(2):157-63. [ Links ]














