Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075
Arch. argent. pediatr. vol.113 no.6 Buenos Aires dic. 2015
http://dx.doi.org/10.5546/aap.2015.538
COMUNICACIÓN BREVE
http://dx.doi.org/10.5546/aap.2015.538
Utilidad del diagnóstico por componentes en el seguimiento de niños con alergia a alimentos vegetales
Lic. Olga Villarreal Balza De Vallejoa, Lic. Marta Velasco Azagraa, Lic. Amanda López Picadob, Lic. Nagore Bernedo Belara, Dra. Olga Uriel Villatea, Lic. Marta Frías Jiméneza, Dra. Maite Audicana Berasateguia, Lic. Daniel Muñoz Lejarazua†, Lic. Nagore Arruti Oyarzabala, Lic. Italo N. Girao Popolizioa, y Lic. Ana Martínez Arcedianoa
Colaboradores: Lic. Natividad Longo Areso y Lic. Eduardo Fernández Ibanez
a. Servicio de Alergología, Hospital Universitario Araba, Vitoria-Gasteiz, España.
b. Unidad de Investigación Araba. Hospital Universitario Araba, Vitoria-Gasteiz, España.
Correspondencia: Lic. Olga Villarreal: mariaolga.villarrealbalzadevallejo@osakidetza.net
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 8-1-2015
Aceptado: 19-6-2015
RESUMEN
La alergia a los alimentos representa un problema importante en la edad pediátrica. El diagnóstico por componentes detecta la alergia a proteínas aisladas de los alimentos.
Este estudio descriptivo analiza la utilidad de las recomendaciones individualizadas y estandarizadas en una muestra de 22 niños de entre 2 y 16 años con alergia a alimentos vegetales y evalúa la sensibilidad a 4 panalergenos vegetales.
Según los resultados del diagnóstico por componentes, se personalizó el tratamiento, se aconsejaron pautas de evitación de determinados alimentos o componentes y se explicaron cofactores que favorecían las reacciones alérgicas alimentarias. No refirieron nuevas reacciones 20/22 casos. Presentaron síndrome alérgico oral 2/22 pacientes alérgicos a profilina por no seguir las recomendaciones dadas.
El diagnóstico por componentes resultó útil en el diagnóstico y manejo de estos niños. Las recomendaciones estandarizadas; basadas en el diagnóstico por componentes implicado en cada paciente; evitaron reacciones alérgicas alimentarias graves.
Palabras clave: Diagnóstico por componentes; Panalergeno; Alergia; Proteína transportadora de lípidos; Niño.
INTRODUCCIÓN
Las reacciones alérgicas a alimentos vegetales representan un desafío en la práctica alergológica pediátrica. Clásicamente, las recomendaciones se basan en la evitación del alimento causante de la alergia,1 lo que, en pacientes pediátricos, es difícil de aplicar y dificulta la adhesión al tratamiento.
El diagnóstico por componentes (component-resolved diagnosis; CRD, por sus siglas en inglés) permite detectar la alergia a proteínas individuales presentes en los alimentos y, en función de sus características fisicoquímicas, predecir los síntomas y evitarlos.1-4 Algunas de las proteínas alergénicas están expresadas en múltiples alimentos vegetales y en pólenes, y se denominan panalergenos vegetales. Entre ellos, se encuentran las proteínas de defensa de las plantas. Actualmente, solo algunas de ellas están disponibles para su aplicación en la clínica:
• Las proteínas transportadoras de lípidos (lipid transfer proteins; LTP, por sus siglas en inglés) presentes en pieles y cubiertas son resistentes a la pepsina y al calor, y pueden causar reacciones alérgicas en alimentos cocinados y procesados.5,6
• La proteína de polen de abedul Bet vi (PR-10) se relaciona con la alergia a la manzana, a la avellana, al apio y a la soja.7 Esta y la profilina4,8 son sensibles al calor y a la digestión, y por ello, los alimentos cocinados o procesados son tolerados. La manifestación clínica predominante es el síndrome de alergia oral.
• Las glicoproteínas de las plantas e invertebrados contienen glucanos con determinantes carbohidratos capaces de inducir síntesis de IgE específica en humanos. Esta sensibilización raramente se asocia a síntomas clínicos. Su existencia puede explicar algunos perfiles con amplia reactividad a diferentes alimentos.9
En los niños pequenos, las causas principales de alergia alimentaria son la leche (2,5%), el huevo (1,3%) y el cacahuete o maní (0,8%), y en la mayoría, desaparecen en la edad escolar.10 En niños mayores, la alergia alimentaria es un problema importante10-12 de difícil manejo y comprensión para el médico y la familia, y muchas veces, es causa de retirada innecesaria de alimentos y anade riesgo de dificultad nutricional.
El objetivo principal de este estudio es describir la aplicación de las recomendaciones alimentarias basadas en el diagnóstico por componentes en 22 pacientes pediátricos.
MATERIAL Y MÉTODOS
Este es un estudio descriptivo retrospectivo, en el que incluimos a todos los pacientes consecutivos de entre 2 y 16 años que consultaron por reacciones adversas con alimentos vegetales con sospecha de base alérgica en la Unidad de Alergología del Hospital Universitario Araba (septiembre de 2009-marzo de 2011).
En la primera consulta de estos pacientes, se realizó un anamnesis, exploración, tests cutáneos, petición de analítico y cuestionario de tolerancia, y se indicaron normas dependiendo de los resultados preliminares. En la segunda, según el resultado del estudio alérgico, se entregaron normas de evitación/ingesta. A los 6 meses, en la consulta de revisión, se evaluó la respuesta a las indicaciones y cada paciente y/o cuidador fueron interrogados sobre los síntomas previamente relacionados y se realizó una anamnesis dirigida para detectar alergias alimentarias, definidas como la presencia de síntomas respiratorios, gástricos, cutáneos o anafilaxia en las 4 horas tras la ingesta del alimento. Si no había incidencias, los niños eran citados al año y, si se producían nuevas reacciones, eran derivados nuevamente.
La evolución y respuesta a las recomendaciones fueron evaluadas mediante la consulta presencial o la revisión de la historia clínica. En caso de que el paciente no hubiera acudido a la consulta o en los casos dudosos, se contactó telefónicamente a los familiares para constatar la evolución (marzo de 2013). La adherencia a las normas y la presencia de reacciones alérgicas alimentarias fue referida por el cuidador.
Se consideraron alérgicos si los pacientes presentaban prueba cutánea (pápula de, al menos, 3 mm x 3 mm) y/o por IgE específica positiva (mayor de 0,36 kU/L)1 al alimento sospechoso de ser causante de la reacción. Las pruebas cutáneas utilizadas fueron el prick test y el prick-prick. El prick test consiste en depositar una gota del extracto alergénico que se va a probar sobre la piel del antebrazo y perforar la piel a través de esa gota mediante una lanceta. El prick-prick consiste en la punción cutánea tras hacerla en el alimento.
Para cada paciente, se determinó IgE específica y prueba cutánea (Tabla 1). Se aplicó un cuestionario de tolerancia a diferentes alimentos vegetales (más de 100 ítems) y se especificó el alimento y su estado (crudo/cocinado, pelado), junto con la anamnesis de cada reacción alérgica. Se anotaron los alimentos tolerados después y se evaluaron los cofactores, como ejercicio o toma de antiinflamatorios no esteroideos concomitantemente y antecedentes de polinosis.
Tabla 1. Pruebas cutáneas y determinaciones de IgE realizadas a los participantes 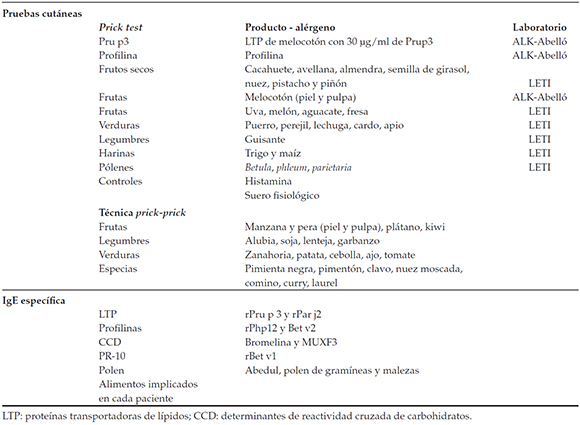
Se clasificó a los pacientes en cuatro grupos según su sensibilización. Se consideró paciente sensibilizado a LTP a aquel con prueba cutánea positiva a LTP o con IgE específica frente a rPru p3 o rPar j. De igual manera, los pacientes con prueba cutánea positiva para profilina o con IgE específica positiva frente a rPhl p12 o rBet v2 se consideraron sensibilizados a profilina, y aquellos con respuesta positiva en IgE específica frente a rBet v1 fueron clasificados como sensibles a Bet v1. Finalmente, los pacientes con IgE frente a bromelina o MUXF3 se etiquetaron de sensibles a determinantes de reactividad cruzada de carbohidratos. Se definió como paciente monosensible si demostraba sensibilidad a uno de los cuatro panalergenos vegetales y como paciente polisensibilizado en caso de sensibilización concomitante a varios.
Sobre la base de la bibliografía previa,4,6,12,13 se entregaron por escrito normas de evitación de alimentos (completos o partes), condiciones de ingesta y evitación de cofactores14,15 según el panalergeno implicado (Tabla 2). En caso de no presentar sensibilidad a ninguno de los panalergenos, se recomendó eliminar de la dieta el alimento que tuvo una prueba cutánea positiva.
Tabla 2. Recomendaciones según el panalergeno 
Las variables continuas se describieron mediante su media, mediana, desviación estándar y rango, y las categóricas, mediante su frecuencia y porcentaje. Todo el análisis se realizó con el programa SPSS Statistics (v. 19).
RESULTADOS
Se incluyeron en el estudio 22 pacientes; 13/22 eran varones con edad media de 11,4 ± 4,6 años. 8/22 tenían historia previa de alergia a alimentos y, en 7/22 de los casos, se debía a frutos secos y/o frutas rosáceas; y el otro paciente (1/8) presentaba alergia al plátano. La mediana del seguimiento fue de 3 años (1,6-3,9 años) y no hubo pérdidas durante el mismo.
En 20/22 casos, no se refirieron nuevas reacciones alérgicas a alimentos; los 2 pacientes que sí las presentaron eran alérgicos a la profilina y tuvieron reacciones tipo síndrome de alergia oral, sin necesidad de tratamiento de urgencia. Los episodios de alergia se debieron al incumplimiento de las normas indicadas. Los resultados principales se recogen en la Tabla 3.
Tabla 3. Descripción de los pacientes y su evolución 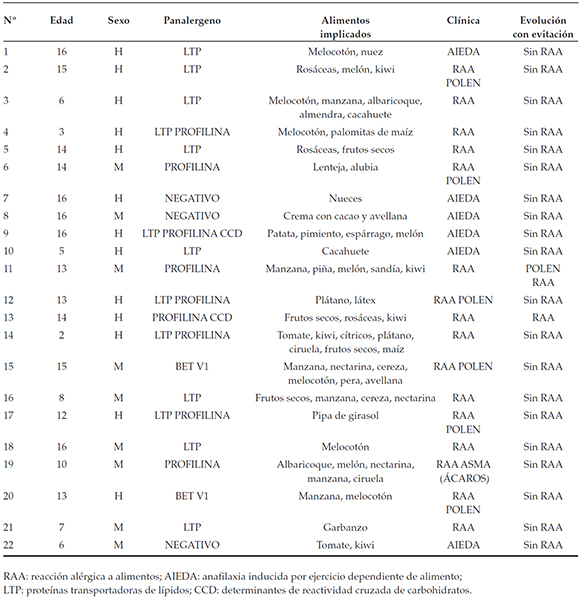
El panalergeno más prevalente fue LTP (13/22), solo o en polisensibilización, seguido de profilina (9/22); 13/22 fueron monosensibles (Tabla 4). En 3/22 pacientes, no se detectó sensibilización a los panalergemo valorados. La sensibilización a las frutas rosáceas y a los frutos secos fue la más frecuente y su asociación se produjo en 7/22 de los pacientes.
Tabla 4. Distribución de la sensibilización de los pacientes incluidos (n= 22) 
En los casos de alergia a LTP, los alimentos causantes de alergia fueron frutas rosáceas en 9/22 niños y frutos secos en 5/22. En los casos de alergia a la profilina, en 2 de los 3 niños estuvieron implicadas las frutas rosáceas.
DISCUSIÓN
El diagnóstico por componentes aplicado a la población pediátrica ha sido utilizado en el estudio de la alergia a alimentos concretos1,2 o para el estudio de la alergia a pólenes, pero no hemos encontrado estudios que reflejaran la evolución de los pacientes tras el diagnóstico de alergia a alérgeno vegetal y aplicación de recomendaciones.
Los consejos han resultado eficaces, en especial los pacientes con alergia a LTP. La adhesión es alta, posiblemente porque no suponen alteraciones significativas en los hábitos o por los antecedentes de reacciones graves. Las reacciones referidas en pacientes con alergia a la profilina pueden deberse a que las recomendaciones son genéricas e implican prescindir de alimentos vegetales crudos. Como principalmente provocan síndrome de alergia oral, puede que los pacientes asuman estos síntomas con tal de no alterar sus hábitos, aunque, dada la limitada muestra, es difícil establecer conclusiones.
En nuestra muestra, como en el sur de Europa,6 la sensibilización más frecuentemente encontrada es frente a LTP, seguido de la profilina. Los pocos casos de pacientes con alergia a Bet vi son monosensibles.
Entre los pacientes monosensibles, se observó gran variabilidad en la respuesta clínica frente a alimentos vegetales. Por ello y por el escaso número de pacientes, no se pudo definir un patrón común de respuesta de cada grupo que sugiriera algún conjunto de alimentos de mayor o menor riesgo para pacientes alérgicos a cada panalergeno estudiado, exceptuando frutas rosáceas y frutos secos en casos de alergia a LTP.
En este estudio, no se estableció ninguna técnica de enmascaramiento ni grupo control.
CONCLUSIONES
Estos resultados preliminares sugieren que la utilización del diagnóstico por componentes aplicado en esta patología en la edad infantil podría ser útil para la reducción de las reacciones alérgicas alimentarias, especialmente graves. Son necesarios estudios con muestras y seguimientos más prolongados para confirmar esta hipótesis.
1. Borres MP, Ebisawa M, Eigenmann PA.Use of allergen components begins a new era in pediatric allergology. Pediatr Allergy Immunol 2011;22(5):454-61. [ Links ]
2. Wolthers OD. Component-Resolved Diagnosis in Pediatrics. ISRN Pediatrics 2012;2012:806920. [ Links ]
3. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, et al. A WAO - ARIA - GA2LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J 2013;6(1):17. [ Links ]
4. Hauser M, Roulias A, Ferreira F, Egger M. Panallergens and their impact on the allergic patient. Allergy Asthma Clin Immunol 2010;6(1):1. [ Links ]
5. Pastorello EA, Robino AM. Clinical role of lipid transfer proteins in food allergy. Mol Nutr Food Res 2004;48(5):356-62. [ Links ]
6. Fernández-Rivas M, Bolhaar S, González-Mancebo E, Asero R, et al. Apple allergy across Europe: how allergen sensitization profiles determine the clinical expression of allergies to plant foods. J Allergy Clin Immunol 2006;118(2):481-8. [ Links ]
7. Cudowska B, Kaczmarski M. Diagnostic value of birch recombinant allergens (rBet v 1, profilin rBet v 2) in children with pollen-related food allergy. Rocz Akad Med Bialymst 2004;49:111-5. [ Links ]
8. Asero R, Monsalve R, Barber D. Profilin sensitization detected in the office by skin prick test: a study of prevalence and clinical relevance of profilin as a plant food allergen. Clin Exp Allergy 2008;38(6):1033-7. [ Links ]
9. Soh JY, Huang CH, Lee BW. Carbohydrates as food allergens. Asia Pac Allergy 2015;5(1):17-24. [ Links ]
10. Sicherer SH, Sampson HA. Food allergy. J Allergy Clin Immunol 2010;125(2 Suppl 2):S116-25. [ Links ]
11. García BE, Lizaso MT. Cross-reactivity syndromes in food allergy. J Investig Allergol Clin Immunol 2011;21(3):162-70. [ Links ]
12. Vieira T, Cunha L, Neves E, Falcao H. Diagnostic usefulness of component-resolved diagnosis by skin prick tests and specific IgE to single allergen components in children with allergy to fruits and vegetables. Allergol Immunopathol (Madr) 2014;42(2):127-35. [ Links ]
13. Berni Canani R, Leone L, D'Auria E, Riva E, et al. The effects of dietary counseling on children with food allergy: a prospective, multicenter intervention study. J Acad Nutr Diet 2014;114(9):1432-9. [ Links ]
14. Cardona V, Luengo O, Garriga T, Labrador-Horrillo M, et al. Co-factor-enhanced food allergy. Allergy 2012;67(10):1316-8. [ Links ]
15. Niggemann B, Beyer K. Factors augmenting allergic reactions. Allergy 2014;69(12):1582-7. [ Links ]














