Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.1 Buenos Aires Feb. 2016
http://dx.doi.org/10.5546/aap.2016.e25
PRESENTACIÓN DE CASOS CLÍNICOS
http://dx.doi.org/10.5546/aap.2016.e25
Blastoma pleuropulmonar. Caso clínico
Pleuropulmonary blastoma, case report
Dr. Juan J. Boscha, Dr. Martín Medína, Dra. Patricia Garridoa, Dr. Jorge Martíneza y Dr. Alejandro Tepera
a. Hospital de Niños Ricardo Gutiérrez, Ciudad Autónoma de Buenos Aires, Argentina.
Correspondencia: Dr. Juan J. Bosch: drjjbosch@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 22-7-2015
Aceptado: 20-8-2015
RESUMEN
El blastoma pleuropulmonar es un tumor pulmonar raro de la infancia, que puede manifestarse con lesiones quísticas o sólidas, como un hallazgo radiológico o con clínica respiratoria. Presentamos el caso de un niño de 2 años de edad que consultó en su primer cuadro obstructivo con imagen sospechosa de malformación pulmonar en el lóbulo superior izquierdo en la radiografía y la tomografía de tórax. Se realizó cirugía, que evidenció una malformación quistica en el segmento ápico posterior del lóbulo superior izquierdo. Recibimos el informe de anatomía patológica con diagnóstico de blastoma pleuropulmonar tipo I. Comenzó el seguimiento por Oncología e inició el tratamiento con ciclofosfamida y vincristina, con buena tolerancia.
Actualmente, existe controversia acerca del manejo de los quistes pulmonares congénitos, y se inclina la balanza hacia la conducta quirúrgica debido a serias dificultades en diferenciar quistes pulmonares benignos del blastoma pleuropulmonar, sin la revisión histopatológica.
Palabras clave: Malformaciones del sistema respiratorio; Blastoma pleuropulmonar; Neoplasias torácicas; Niños.
ABSTRACT
Pleuropulmonary blastoma is a rare lung tumor of childhood that can occur with cystic or solid lesions, as a radiological finding with or without respiratory symptoms. We report the case of a 2 year old toddler in his first pulmonary obstructive episode with suspected toracic malformation of the left upper lobe in his chest x-ray and tomography. Surgery was performed showing cystic malformation of the left upper lobe. We received the pathology report with diagnosis of type I pleuropulmonary blastoma. He began follow-up with Oncology initiating treatment with cyclophosphamide and vincristine, well tolerated.
Currently, there is controversy about the management of congenital lung cysts, tilting the balance towards the surgical procedure because of serious difficulties in differentiating benign pulmonary cysts from pleuropulmonary blastoma without histopathologic review.
Key words: Respiratory system abnormalities; Pleuropulmonary blastoma; Thoracic neoplasms; Children.
INTRODUCCIÓN
El blastoma pleuropulmonar (BPP) es un tumor pulmonar maligno primario raro, que ocurre exclusivamente en la edad pediátrica, sobre todo en menores de 6 años.1 Descrito por primera vez en 1952 por Barnard,2 se trata de una entidad diferente del blastoma pulmonar del adulto. El BPP es un tumor disembriogénico análogo al tumor de Wilms, al neuroblastoma y al hepatoblastoma en niños, que se origina del mesénquima toracopulmonar.1-4
Puede aparecer sobre lesiones congénitas pulmonares, como la malformación adenomatoidea quística (MAQ). Hasta en un 25% de las ocasiones, puede presentarse en familias asociado a otros tipos de neoplasias, como nefromas quísticos, sarcomas, meduloblastomas, tumores de células germinales, neoplasias hematológicas e histiocitosis de células de Langerhans. La forma de presentación más frecuente es la de una masa solitaria de gran tamano, localizada en la periferia del pulmón sin sintomatología precoz, o dificultad respiratoria con o sin neumotórax.1-4
REPORTE DE CASO
Paciente de 2 años y medio que consultó por sospecha de malformación broncopulmonar como hallazgo en la radiografía de tórax realizada por su primer cuadro broncoobstructivo. En el momento de la consulta, el paciente se encontraba ligeramente taquipneico, su saturación de oxígeno era 98% respirando aire ambiente con ligera hipoventilación en el campo superior izquierdo y con escasas sibilancias aisladas bilaterales. No presentaba signos de hipoxia crónica.
Era el menor de 3 hermanos sanos, de padres no consanguíneos. No tenía antecedentes familiares ni personales de relevancia.
Se le había tomado una radiografía de tórax de frente donde se observaba una imagen redondeada hiperlúcida en el campo superior izquierdo (Figura 1). Por sospecha de malformación pulmonar se realizó una tomografía de tórax, que evidenció lóbulo superior izquierdo hiperlúcido con finos tabiques en su interior (Figura 2).
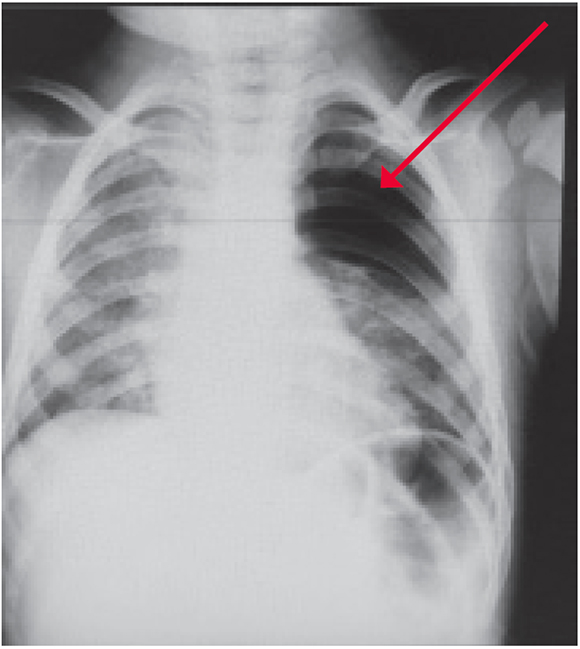
Figura 1. Radiografía de tórax de frente: imagen redondeada hiperlúcida en el campo superior izquierdo

Figura 2. Tomografía de tórax: lóbulo superior izquierdo hiperlúcido con finos tabiques en su interior
Se efectuó una cirugía y se realizó segmentectomía apical izquierda. Evidenció una malformación quística multiloculada pediculada (Figura 3). El informe de anatomía patológica fue de blastoma pleuropulmonar tipo I (Figura 4).

Cirugía: segmentectomía apical izquierda; malformación
quística multiloculada pediculada

Figura 3.

Pieza de segmentectomía pulmonar: lesión quística que
mide 11 cm, de superficie externa lisa con vasos congestivos.

Quiste abierto, multiloculado, con contenido aéreo.
Superficies internas lisas.

Hematoxilina/eosina; 20 aumentos: tabiques revestidos por
epitelio cúbico, que presentan estroma con elevada densidad
de células con núcleos redondos con escaso citoplasma.
Figura 4. Anatomía patológica: blastoma pleuropulmonar tipo I
Comenzó un seguimiento por el Servicio de Oncología. Se realizaron estudios por imágenes para descartar otras neoplasias asociadas y se inició un tratamiento con ciclofosfamida y vincristina, que presentó buena tolerancia aproximadamente en la mitad de su tratamiento.
Se realizó el consejo genético e investigación familiar con radiografía de tórax y ecografía abdominal y renal a sus dos hermanos, y se envió a ambos padres a un hospital de adultos para realizar dichos estudios. Todos los estudios fueron normales.
DISCUSIÓN
La dificultad para hacer el diagnóstico de BPP basado solamente en imágenes genera controversia en el manejo de lesiones quísticas, motivo por el cual muchas de ellas son removidas aun siendo asintomáticas. Se han descrito más de 300 casos en todo el mundo. Es una neoplasia muy infrecuente con tendencia a la asociación familiar y a otras neoplasias en hasta 25%. Los tumores renales quísticos son los que más se han relacionado con esta patología.1-4
El BPP fue clasificado por Dehner en 1995 en 3 grupos: quístico (tipo I), mixto (tipo II) y sólido (tipo III).5
El cuadro clínico es inespecífico y se presenta en la radiografía o la tomografía computada (TC) como una masa solitaria de gran tamano, de localización periférica, que, con frecuencia, se diagnostica como una infección respiratoria baja. Raramente, se presenta cavitado, calcificado o múltiple. El diagnóstico sobreviene al observarse que no hay respuesta al tratamiento. Los síntomas más comunes incluyen tos, dificultad respiratoria, sonidos respiratorios disminuidos o ausentes en el área pulmonar afectada. El neumotórax es una presentación frecuente, sobre todo, en las formas tipo I. Pueden observarse signos de compromiso extrapulmonar en casos de enfermedad metastásica; los más frecuentes son aquellos que comprometen el sistema nervioso central -SNC-(síndrome de hipertensión endocraneana).6
Una característica del BPP, descrita por Dehner, es que puede progresar en el tiempo, desde un estado quístico a uno sólido.7 El BPP de tipo I tiene una edad promedio al momento del diagnóstico de 10 meses y tasas de supervivencia a 5 años que alcanzan el 80%-85%. Su recurrencia progresa frecuentemente al tipo II (edad promedio de diagnóstico: 34 meses) o tipo III (edad promedio de diagnóstico: 44 meses), ambas con una tasa de supervivencia a 5 años de 45%-50%.6 Una serie de casos de 50 pacientes con BPP entre los 0 y los 12 años, con edad promedio de presentación de 10 meses, describió su localización preferente del lado derecho en 70% y extrapulmonar en mediastino, pleura o diafragma en 20% del total. El BPP tipo I consta de un único quiste o, más frecuentemente, de quistes multiloculados con septos finos localizados en el parénquima pulmonar o pleura visceral. Representa el primer estadio de la tumorogénesis.8
Anatomía patológica
El BPP representa el 0,25%-0,5% de todas las neoplasias pulmonares. Está compuesto por tejido exclusivamente sarcomatoso sólido y/o quístico (incluido en tumores de tejidos blandos). Se clasifica de acuerdo con las características macroscópicas en tres tipos: tipo I (quístico), tipo II (sólido-quístico) y tipo III (sólido). El BPP tipo I se caracteriza por ser un quiste único o, más frecuentemente, quistes multiloculados con septos finos, localizados en el parénquima pulmonar o la pleura visceral; histológicamente presenta septos fibrosos tapizados por epitelio cúbico; subyacente al epitelio, se observa una capa continua o discontinua de células redondas primitivas. El BPP tipo III suele ser blando y friable, y puede llegar a ser de gran tamano (hasta 28 cm) y peso (hasta 1,1 kg).9 Microscópicamente, presenta células redondas blastematosas y aéreas sarcomatosas fusocelulares. Las técnicas de inmunohistoquímica muestran positividad con vimentina, actina, desmina y proteína s-100. Se han identificado anormalidades citogenéticas, particularmente vistas en el cromosoma 8 (trisomías). En formas familiares, se han detectado mutaciones de la línea germinal del gen DICER1.10
TRATAMIENTO
El Registro Internacional de Blastoma Pleuropulmonar (International Pleuropulmonary Blastoma Registry; IPPBR, por sus siglas en inglés), organismo encargado a nivel mundial del estudio y manejo de esta neoplasia, ha recomendado el tratamiento precoz con cirugía y quimioterapia como esquema básico. La cirugía, cualquiera que se realice (quistectomía, segmentectomía, lobectomía o neumonectomía), tiene como objetivo la resección quirúrgica completa del tumor. El IPPBR recomienda como esquema quimioterápico la asociación de vincristina, actinomicina D y ciclofosfamida (esquema VaC) para los casos de BPP tipo II. Es poco clara su utilidad para el BPP tipo I.11
CONCLUSIONES
Dada la actual controversia en el manejo de los quistes pulmonares en pediatría, es recomendable una conducta quirúrgica para aquellos casos atípicos o de presentación no habitual, con quistes grandes, bilaterales, asociados a otras neoplasias o cuando se encuentren antecedentes familiares de neoplasias quísticas. Cabe notar que el BPP, a pesar de ser una neoplasia muy poco frecuente, tiene que ser considerado dentro del diagnóstico diferencial de la enfermedad pulmonar quística en pediatría, ya que su diagnóstico precoz y el tratamiento oportuno podrían mejorar el pronóstico y la sobrevida de estos pacientes.
1. Priest JR, McDermott MB, Bhatia S, Watterson J, et al. Pleuropulmonary blastoma: a clinicopathologic study of 50 cases. Cancer 1997;80(1):147-61. [ Links ]
2. Barnard WG. Embryoma of lungs. Thorax 1952;7(4):299-301. [ Links ]
3. Manivel JC, Priest JR, Watterson J, Steiner M, et al. Pleuropulmonary blastoma. The so-called pulmonary blastoma of childhood. Cancer 1988;62(8):1516-26. [ Links ]
4. Romeo C, Impellizzeri P, Grosso M, Vitarelli E, et al. Pleuropulmonary blastoma: long-term survival and literature review. Med Pediatr Oncol 1999;33(4):372-6. [ Links ]
5. Dehner LP, Watterson J, Priest JR. Pleuropulmonary blastoma: a unique intrathoracic- pulmonary neoplasm of childhood. Perspect Pediatr Pathol 1995;18:214-26. [ Links ]
6. Priest JR, Watterson J, Strong L, Huff V, et al. Pleuropulmonary blastoma: a marker for familial disease. J Pediatr 1996;128(2):220-4. [ Links ]
7. Hill DA, Jarzembowski JA, Priest JR, Williams G, et al. Type I pleuropulmonary blastoma: pathology and biology study of 51 cases from the international pleuropulmonary blastoma registry. Am J Surg Pathol 2008;32(2):282-95. [ Links ]
8. Boman F, Hill DA, Williams GM, Chauvenet A, et al. Familial association of pleuropulmonary blastoma with cystic nephroma and other renal tumors: a report from the International Pleuropulmonary Blastoma Registry. J Pediatr 2006;149(6):850-4. [ Links ]
9. Priest JR, Hill DA, Williams GM, Moertel CL, et al. Type I pleuropulmonary blastoma: a report from the International Pleuropulmonary Blastoma Registry. J Clin Oncol 2007;24(27):4492-8. [ Links ]
10. Schultz KA, Yang J, Doros L, Williams GM, et al. DICER1-pleuropulmonary blastoma familial tumor predisposition syndrome: a unique constellation of neoplastic conditions. Pathol Case Rev 2014;19(2):90-100. [ Links ]
11. Messinger YH, Stewart DR, Priest JR, Williams GM, et al. Pleuropulmonary blastoma: a report on 350 central pathology-confirmed pleuropulmonary blastoma cases by the International Pleuropulmonary Blastoma Registry. Cancer 2015;121(2):276-85. [ Links ]













