Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.3 Buenos Aires jun. 2016
http://dx.doi.org/10.5546/aap.2016.277
SOCIEDAD ARGENTINA DE PEDIATRÍA. SUBCOMISIONES, COMITÉS Y GRUPOS DE TRABAJO
http://dx.doi.org/10.5546/aap.2016.277
Prevención de las enfermedades alérgicas en la infancia: entre la teoría y la realidad
Prevention of allergic diseases in childhood: from theory to reality
Comité Nacional de Alergia
Documento de toma de posición
Documento desarrollado en el marco del 50° aniversario del Comité Nacional de Alergia de la Sociedad Argentina de Pediatría
Correspondencia: Dr. Ricardo J. Saranz, rsaranz@arnet.com.ar
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 2-11-2015
Aceptado: 9-11-2015
Ricardo J. Saranz, Alejandro Lozano, Gloria Bandín, Andrea I. Marino, Raúl V. Boudet, María P. Sarraquigne, María E. Cáceres, Víctor C. Skrie, César M. Bozzola, Karina López, María E. Gervasoni, Betina Menéndez Porfilio, Claudio Agüero, Fabio Orellano, Laura V. Sasia, Patricia Pendino.
Colaboradores: Elsa Mindel, Roque G. Arnolt, Jorge García, Antonio Sánchez Segovia, Julio Orellana, Aldo Cavallo, Irene Aráoz, Norberto Procopio, Horacio González, Nilda Daguerre, Marcela García, Adolfo Blanco, Renée Claeys, Dante Maldonado, Juan M. Suárez García, Mariana Díaz Gálvez.
RESUMEN
Las enfermedades alérgicas tienen una prevalencia creciente de modo universal y ocasionan alto impacto sanitario. La investigación está dirigida al estudio de los factores etiológicos y de riesgo de estas enfermedades, que pueden ser potencialmente modificados con estrategias de prevención primaria, secundaria y terciaria. Muchas de esas medidas no tienen un efecto comprobado de manera definitiva, dado que se realizan en un contexto controlado diferente a lo que ocurre en la vida real.
Este documento tiene por objetivo revisar las evidencias más actuales sobre prevención de las enfermedades alérgicas considerando las certezas y cuestiones por resolver, y está especialmente centrado en las medidas ambientales, dietéticas, farmacológicas e inmunológicas para los distintos niveles preventivos.
Es imperativo un mejor conocimiento de genes y factores ambientales responsables de las enfermedades alérgicas para optimizar las medidas preventivas que permitan revertir la creciente prevalencia de estas enfermedades en la infancia.
Palabras clave: Alergia; Prevención; Asma; Control ambiental; Inmunoterapia.
ABSTRACT
Allergic diseases have an increasing worldwide prevalence and a great impact on the health related costs.
The research is focused on the study of etiological and risk factors of allergic diseases that can potentially be modified with primary, secondary and tertiary prevention strategies. Many of these measures do not have a definitively proven effect taking place in a controlled context different to what happens in real life.
This paper aims to review the latest evidence on prevention of allergic diseases considering certainties and unresolved issues and focuses mainly on environmental, dietary, pharmacological and immunological preventive strategies for different levels of prevention.
It is imperative to have a better understanding of genetic and environmental factors that cause allergic diseases to optimize preventive measures that are effective in reversing the increasing trend in the prevalence of allergic illnesses in childhood.
Key words: Allergy; Prevention; Asthma; Environmental control; Immunotherapy.
INTRODUCCIÓN
Las enfermedades alérgicas constituyen las patologías crónicas más frecuentes en la edad pediátrica, con elevados costos sanitarios para el diagnóstico y tratamiento y afectación de la calidad de vida.1. En Latinoamérica, aproximadamente el 20% de los niños y adolescentes padece alguna patología de origen alérgico y se observa una tendencia creciente en su prevalencia.2
Las patologías alérgicas, principalmente el asma, por su condición poligénica y multiplicidad de factores de riesgo (Tabla 1), plantean un desafío particular para su prevención.3 Por lo general, las evidencias nos aportan conclusiones sobre intervenciones únicas en condiciones controladas, que no siempre tienen el mismo resultado en la vida real, en un contexto etiopatogénico multifacético.4,5
Tabla 1: Factores de riesgo para el desarrollo de asma

Estas son las primeras guías nacionales de recomendaciones para la prevención del asma y otras enfermedades alérgicas que se basan, principalmente, en guías clínicas desarrolladas por sociedades científicas internacionales, artículos originales y de revisión, y tienen los siguientes objetivos:
a. Definir los propósitos de la prevención y sus distintos niveles.
b. Determinar la importancia de las medidas de prevención en el desarrollo de las enfermedades alérgicas y el fundamento que justifica su implementación.
c. Describir la utilidad de cada medida preventiva.
LA "MARCHA ATÓPICA": MITOS Y REALIDADES
La frecuente asociación entre las diversas patologías alérgicas y la observación de una manifestación clínica escalonada entre ellas permiten establecer lo que se denomina "marcha atópica".6 Es la expresión de la historia natural de las enfermedades alérgicas, caracterizada por una típica secuencia de progresión de síntomas clínicos, en que unos se tornan más prevalentes y otros involucionan. En general, signos clínicos de dermatitis atópica y alergia alimentaria preceden el desarrollo de asma y rinitis, lo que sugiere que son el "punto de partida" de la enfermedad alérgica6 (Figura 1). Estas entidades clínicas tienen en común algunas expresiones fenotípicas como IgE elevada, eosinofilia tisular y periférica, citoquinas Th2 y similares alérgenos desencadenantes, aunque solo comparten expresiones genotípicas en forma parcial.
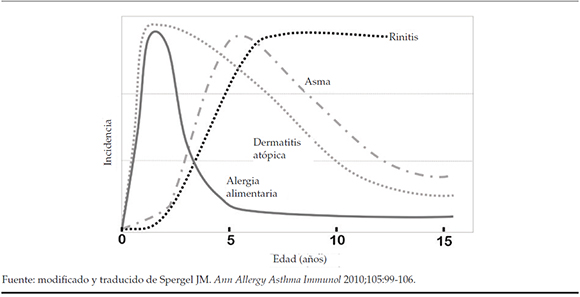
Figura 1: Evolución de la "marcha atópica"
Esta secuencia evolutiva se observa en la práctica médica pediátrica, aunque no siempre tiene una correlación tan lineal como la planteada en la especulación teórica.7 Reconocer la causalidad de la "marcha atópica" permitirá intervenciones con medidas preventivas tendientes a evitar el desarrollo de otros fenotipos evolutivos de enfermedad alérgica.8
GENÉTICA, MEDIOAMBIENTE Y EPIGENÉTICA EN EL DESARROLLO DE LAS ENFERMEDADES ALÉRGICAS
El conocimiento del genoma no siempre explica la expresión fenotípica de las enfermedades. Un ejemplo es el claro vínculo epidemiológico entre asma y rinitis: el 80% de los niños con asma padecen rinitis y el 40% de los niños con rinitis presentan síntomas de asma,9 pero los estudios genéticos muestran una coincidencia del 1,75% en los genes conocidos para ambas enfermedades.10
La epigenética se refiere al mecanismo bioquímico de metilación del ácido desoxirribonucleico (ADN) y modificación postraduccional de las histonas inducidos por factores ambientales exógenos (estímulos antigénicos y aspectos socioculturales) que modulan y modifican la expresión genética y contribuyen al desarrollo de la enfermedad alérgica.11 Por lo tanto, la epigenética es el resultado de una compleja interacción genmedioambiente que permite explicar los diferentes fenotipos que variarán de acuerdo con el estímulo antigénico, dosis y edad en que suceda.12 El reconocimiento preciso del vínculo entre gen y ambiente como modulador del fenotipo alérgico permitirá optimizar el uso de las medidas de prevención.
Lo que se sabe:
- La "marcha atópica" representa el modelo de la evolución natural de las enfermedades alérgicas y surge de la observación clínico-epidemiológica.
- La interacción genética-ambiente es necesaria para el desarrollo de la enfermedad alérgica.
Lo que se necesita saber:
- Los mecanismos precisos por los cuales la epigenética contribuye a la génesis de las alergias.
NIVELES DE PREVENCIÓN: DEFINICIÓN Y OBJETIVOS
Las medidas de prevención están destinadas a limitar la aparición de nuevos casos de sensibilización alergénica y evitar la aparición de enfermedades alérgicas, que incluyen su progresión y gravedad sintomática.13 Deben dirigirse a los pacientes de alto riesgo, definidos como individuos que presentan un antecedente alérgico familiar en primer grado.14
Se definen tres niveles de prevención14 (Figura 2): Prevención primaria: Conjunto de medidas preventivas destinadas a la población aun sana pero con riesgo de enfermedad. Incluye intervenciones perinatales para implementar antes de cualquier evidencia de sensibilización atópica y deben ser aplicables a toda la población, libres de riesgo y de bajo costo.

Figura 2: Niveles de prevención de las enfermedades alérgicas
Prevención secundaria: Son las estrategias tendientes a evitar el desarrollo de una enfermedad alérgica en un paciente previamente sensibilizado pero que aún no tiene un fenotipo alérgico definitivo. Deben llevarse a cabo en los primeros años de la vida.
Prevención terciaria: Se relaciona con el tratamiento de la enfermedad para controlar los síntomas y evitar su progresión y deterioro.
Los objetivos generales son los siguientes:13
- Disminuir la incidencia de sensibilización y de enfermedades alérgicas.
- Reducir el desarrollo de nuevas manifestaciones de atopia en individuos previamente enfermos.
- Disminuir la gravedad y proporción de pacientes graves y aumentar las posibilidades de remisión.
- Mejorar la calidad de vida.
ROL DEL MICROBIOMA
El microbioma es el conjunto de microorganismos y sus genomas que componen la microbiota de los diferentes compartimientos corporales, que generan una interacción beneficiosa con el huésped y modulan el sistema inmune y las respuestas inflamatorias.15 Está constituido, principalmente, por bacterias intestinales y del aparato respiratorio con predominancia de lactobacilos y bifidobacterias, simbióticas con el organismo humano, que producen una inmunodesviación Th1 y estímulo de células T reguladoras, lo que podría prevenir el desarrollo de la enfermedad alérgica.15-17
La regulación del sistema inmune depende, entre otros factores, de un microbioma adecuado tempranamente instalado. Un desequilibrio en la estructura y la función de la microbiota podría contribuir a una mayor predisposición de enfermedades inflamatorias, como asma y otras alergias. En ese contexto, el uso de pro- y prebióticos y otras medidas higiénico-dietéticas podrían modular favorablemente el microbioma y contribuir a su homeostasis y a la prevención de las enfermedades de origen alérgico.17
Lo que se sabe:
- Las medidas de prevención deben focalizarse en los primeros años de la vida.
- Un microbioma simbiótico estimula un perfil inmunológico que contribuye a la prevención de enfermedades alérgicas.
Lo que se necesita saber:
- Determinar marcadores predictores tempranos de atopia.
- Los mecanismos de tolerancia inmunológica implicados en la prevención de las enfermedades alérgicas.
MEDIDAS DE PREVENCIÓN MEDIOAMBIENTALES
Uno de los factores responsables de la mayor prevalencia de enfermedades alérgicas es el aumento de la contaminación ambiental.11 La polución ambiental proveniente del polvo, humo o aerosoles líquidos producidos por vehículos y fábricas, la ceniza residual liberada durante la combustión de aceites de bajo grado y la exposición al bisfenol A inducen una polarización de la respuesta inmune hacia Th218 y, en células epiteliales, estos compuestos activan genes proinflamatorios que pueden contribuir al desarrollo de diferentes fenotipos alérgicos.11
Humo del tabaco
La exposición al humo del tabaco durante el embarazo y en los primeros años de vida tiene impacto sobre la morbilidad respiratoria y constituye un factor de riesgo para el desarrollo de asma y otras enfermedades alérgicas.19 Induce cambios en el crecimiento pulmonar, hiperreactividad de las vías respiratorias, deterioro de la adaptación inmune a los patógenos virales, disminución del desarrollo del sistema inmune pulmonar y cambios inmunológicos que favorecen el desarrollo de la enfermedad alérgica.20 Además, la inducción de estrés oxidativo y las modificaciones en la colonización bacteriana de las mucosas provocan mayor penetración de alérgenos.21
La exposición posnatal inmediata se asocia con sibilancias en lactantes y aumento de la prevalencia de asma, independientemente del efecto de la exposición durante la gestación.19 La evitación del humo del tabaco es imperativa en los tres niveles de prevención. Se sugiere no fumar y evitar su exposición durante el embarazo y en la infancia con la mayor fuerza de recomendación.4,5,14
Control ambiental de ácaros del polvo doméstico
La reducción de la exposición a alérgenos del medioambiente hogareno incluye estrategias, como uso de aspiradoras con filtros HEPA (High Efficiency Particle Arrestance) y doble bolsa de recolección, fundas impermeables a alérgenos para colchones y almohadas, remoción y/o lavado de peluches, medidas para controlar los hongos ambientales del interior, evitación de los animales domésticos y erradicación de cucarachas.22
Existen controversias acerca de la eficacia de las medidas de evitación de ácaros en la prevención primaria y secundaria. La evidencia de la asociación lineal entre la exposición a los alérgenos de los ácaros del polvo doméstico, la sensibilización y el desarrollo de asma no es unánime.22,23-25 Los resultados surgen de protocolos de estudios con diferente metodología y difícil comparación, y con insuficiente período de seguimiento, lo que imposibilita la evaluación de la perdurabilidad del efecto y conlleva la falta de control de factores de confusión y, en la práctica, la dificultad de aplicación a toda la población de riesgo.26
Los estudios intervencionistas también arrojaron resultados diferentes e, incluso, paradojales, con aumento de la sensibilización a pesar de las medidas de reducción de la exposición.27,28 En la prevención terciaria, el control de ácaros y alergenos de cucarachas redujo significativamente la morbilidad del asma.29 No obstante, si bien, en ambientes controlados, el éxito de la evitación de alérgenos para el control de la enfermedad es posible, en la práctica, la mayoría de las estrategias de evitación no son sustentables en el tiempo, lo que contribuye a reducir su eficacia.26
Lo que se sabe:
- La exposición ambiental prenatal y perinatal al humo del tabaco es un factor de riesgo para el desarrollo y la exacerbación de las enfermedades alérgicas.
- No fumar durante el embarazo y evitar la exposición del niño al humo del tabaco tiene la más alta recomendación para la prevención del asma.
- La eficacia de la evitación de ácaros como estrategia para la prevención terciaria es indiscutible, aunque difícil de sostener en el tiempo.
Lo que se necesita saber:
- La relación entre la sensibilización alérgica y la incidencia de asma.
- La utilidad de la evitación de alérgenos en la prevención primaria y secundaria.
MEDIDAS DE PREVENCIÓN HIGIÉNICO-DIETÉTICAS
Lactancia materna
Los estudios que evalúan el rol de la lactancia en la prevención de enfermedades alérgicas son de difícil interpretación porque sus resultados son contradictorios. Se recomienda la lactancia exclusiva hasta los 4-6 meses, por su efecto prebiótico favorable sobre el microbioma intestinal y el desarrollo inmunológico del lactante.5,13,14 La mayoría de los estudios le asignan un efecto protector del desarrollo de alergia a las proteínas de la leche de vaca, dermatitis atópica y contribuye para una menor incidencia de sibilancias en los primeros años de la vida, efecto que puede declinar con el tiempo.30 La lactancia materna es la dieta de elección más allá de su influencia sobre el desarrollo de alergias.
Probióticos
Los probióticos son cepas de gérmenes vivos específicos que, administrados a un huésped, proveen un efecto beneficioso para la salud. Modificar la microbiota intestinal con probióticos, administrados pre- y posnatalmente, modula la respuesta inmune con inmunodesviación hacia Th1, con incremento del interferón gamma y, por lo tanto, reduce la inflamación alérgica. Las combinaciones de cepas parecen ser más eficaces.31 Los probióticos usados en la madre, en la gestación y durante la lactancia y en los primeros años de la vida del niño reducen el riesgo de dermatitis atópica.32 No tienen el mismo efecto en la prevención de la rinitis y el asma,33 por lo que se necesitan más evidencias para su recomendación en alergia respiratoria.
Vitaminas y suplementos dietarios
Su interés como factores protectores para el desarrollo de alergias está en aumento, debido a que su administración se considera no invasiva y de bajo riesgo.
Metaanálisis recientes sugieren que el déficit de vitaminas A, C y D durante el embarazo y el primer año de vida se relaciona con un aumento de alergias, y un adecuado aporte de estas vitaminas, zinc, magnesio y ácidos grasos poliinsaturados durante estas etapas reduciría el riesgo por sus efectos antiinflamatorios y antioxidantes.34,35 El adecuado aporte de vitamina D3 favorece el desarrollo pulmonar, promueve mecanismos antimicrobianos y reduce el perfil de citoquinas proinflamatorias, lo que contribuye a una disminución del riesgo de asma.35 Los resultados de la suplementación con ácido fólico para la prevención de enfermedades alérgicas no han sido concluyentes.34
Edad de introducción de alimentos sólidos
Una restricción dietaria especial luego de los 4 meses en niños con alto riesgo alérgico no es útil en la prevención de la alergia alimentaria y puede contribuir a un mayor riesgo de sensibilización y al desarrollo de enfermedades alérgicas.5
Uso de hidrolizados parciales y extensos
La alimentación con hidrolizados parciales y/o extensos de proteínas de la leche de vaca no es adecuada para la prevención de alergias en reemplazo de la leche materna.5,14 Existen recomendaciones para el uso de hidrolizados en niños con alto riesgo alérgico, como reemplazo de fórmulas lácteas con proteínas enteras, durante los primeros 4-6 meses de la vida y cuando la alimentación con leche materna no fuera posible.36 Las fórmulas de hidrolizados de proteínas de la leche de vaca o a base de soja no son útiles para prevenir la alergia alimentaria.37 Además, algunos niños con alergia a las proteínas de la leche de vaca pueden ser también alérgicos a las proteínas de la soja, por lo que no se recomienda su uso como fórmula de reemplazo.38
Dieta materna durante el embarazo y la lactancia
No es necesaria una dieta de restricción de alérgenos alimentarios para embarazadas y madres en etapa de amamantamiento. Solo debieran evitarse aquellos alimentos que hubieren ocasionado reacciones alérgicas comprobadas en la madre.5,13,14
Lo que se sabe:
- En lactantes de alto riesgo alérgico, la lactancia materna exclusiva, durante no menos de 4 meses, se asocia con una reducción del riesgo de alergia alimentaria y dermatitis atópica.
- El uso prenatal y posnatal inmediato de probióticos puede reducir el riesgo de eccema atópico.
- Una dieta materna libre de alimentos alergénicos durante el embarazo y la lactancia no es necesaria.
Lo que se necesita saber:
- Cuáles cepas probióticas son las más útiles para recomendar su administración en forma preventiva.
- Estar al tanto de las evidencias para la recomendación preventiva de vitaminas y suplementos dietarios.
MEDIDAS DE PREVENCIÓN FARMACOLÓGICAS
La mayor parte de las medidas farmacológicas han sido asignadas a la prevención secundaria y terciaria.
Los corticoides intranasales (CIN) son el tratamiento de primera elección en la rinitis alérgica. Es altamente frecuente la coexistencia de rinitis y asma.9 La mejoría de los síntomas nasales con CIN favorece el control del asma en niños con ambas enfermedades.39 Sin embargo, en pacientes que solo manifiestan rinitis, su uso no evita la progresión al asma, por lo que no son sugeridos para esa finalidad.39
Los antihistamínicos tienen evidencias débiles para la prevención del desarrollo de asma. El ketotifeno administrado por 12 meses redujo la incidencia de asma en lactantes con dermatitis atópica y antecedentes familiares de alergia e IgE sérica elevada.40 La cetirizina suministrada por 18 meses en lactantes con dermatitis atópica y/o historia familiar de alergia o asma redujo la posibilidad de desarrollo de asma en niños sensibles a ácaros y gramíneas, efecto que se mantuvo hasta los 36 meses.41 No obstante, no está comprobado que la indicación en los primeros años de la vida de estos antihistamínicos tenga una influencia sostenida y definitiva para una menor prevalencia de asma, por lo que no se recomienda su administración prolongada con ese objetivo.39
El concepto de intervención temprana en asma describe la importancia que tiene el diagnóstico y el tratamiento precoz para evitar la inflamación crónica con remodelación de la vía aérea.42 En el estudio Prevention of Early Asthma in Kids (PEAK),43 la administración inhalatoria de fluticasona por 24 meses en niños de entre 2 y 3 años con sibilancias y alto riesgo asmático logró reducir la sintomatología y mejorar la función pulmonar. No obstante, luego de la suspensión del tratamiento, el efecto no se mantuvo, por lo que los esteroides inhalatorios no modificaron la evolución natural de las sibilancias en niños preescolares.43
En la prevención terciaria, en niños con diagnóstico de asma persistente, los esteroides inhalatorios son de primera elección, puesto que mejoran los síntomas y los parámetros funcionales respiratorios, previenen exacerbaciones y disminuyen el uso de medicación de rescate, pero no existen certezas de un efecto preventivo sobre la progresión de la enfermedad y de la remodelación de la vía aérea.44
El uso de corticoides inhalatorios iniciados durante la fase aguda de bronquiolitis en menores de 2 años no demostró un efecto beneficioso para la prevención de sibilancias posbronquiolitis.45
Lo que se sabe:
- No se recomienda la administración prolongada de antihistamínicos para la prevención del asma.
- La terapia antiinflamatoria con esteroides inhalados puede contribuir al control del asma, pero no modifican su curso natural.
Lo que se necesita saber:
- Se deben desarrollar nuevas estrategias terapéuticas farmacológicas que, aplicadas en niños de alto riesgo atópico, puedan modificar la evolución natural de la enfermedad alérgica.
INTERVENCIÓN INMUNOLÓGICA
Inmunoterapia alérgeno específica
La inmunoterapia alérgeno específica subcutánea (ITSC) y sublingual (ITSL), utilizadas en el tratamiento de la alergia respiratoria, producen una mejoría significativa de los síntomas y del consumo de medicación,46 efecto que permanece luego de la suspensión y tiene un rol preventivo secundario de nuevas sensibilizaciones y de la progresión clínica de la rinitis al asma.9,47
El efecto preventivo del desarrollo de nuevas sensibilizaciones fue demostrado tanto para la modalidad subcutánea48,51 como sublingual.52 Los cambios inmunológicos provocados por la inmunoterapia se han observado desde los primeros años de la vida. En una reciente investigación, la ITSL utilizada en niños preescolares demostró ser una alternativa segura, que produjo un aumento del anticuerpo bloqueador IgG y una estimulación de la IL-10, que indujo la tolerancia alérgeno específica.53
La ITSC con alérgenos puede prevenir el desarrollo de asma en niños con rinoconjuntivitis, con efecto clínico sostenido a largo plazo.54 Luego de dos años de tratamiento con inmunoterapia con ácaros, se observó una mejoría de la hiperreactividad bronquial inespecífica a la metacolina en niños y adultos jóvenes con rinitis alérgica.55
La ITSL podría tener efectos similares. En un estudio en niños con rinoconjuntivitis sensibles a pólenes de gramíneas, la ITSL redujo la incidencia de asma56 y un ensayo abierto con pólenes y ácaros de 3 años de duración demostró su capacidad para reducir la hiperreactividad bronquial inespecífica y el comienzo de nuevas sensibilizaciones y de asma persistente51 (Tabla 2).
Tabla 2: Estudios que demuestran el efecto de la inmunoterapia con alérgenos para la prevención del desarrollo de asma en pacientes con rinitis alérgica

ITSL: inmunoterapia sublingual; ITSC: inmunoterapia subcutánea; RCA: aleatorizado con grupo control abierto; DCPC: doble ciego con grupo control con placebo; GC: grupo control; GCP: grupo control con placebo.
Por su capacidad preventiva, la inmunoterapia es la única modalidad terapéutica capaz de modificar la evolución natural de las enfermedades alérgicas en la infancia.47 Dado que los cambios funcionales respiratorios y la sensibilización a alérgenos en niños con asma ocurren en los primeros años de la vida y que la rinitis es un factor de riesgo para el desarrollo de asma,9 se refuerza la recomendación de la inmunoterapia con alérgenos en la infancia tan pronto como la indicación clínica lo justifique.
Inmunomoduladores biológicos
Está bien documentada la eficacia del omalizumab para el tratamiento del asma alérgica grave no controlada en niños mayores de seis años.44 Por su potencial capacidad de unirse a la IgE circulante y evitar su unión a los receptores específicos de mastocitos, se podría inferir un rol preventivo de nuevas sensibilizaciones y de prevención del desarrollo de asma en la rinitis. No obstante, ese efecto no ha sido aún demostrado. Otros agentes biológicos inmunomoduladores no han sido evaluados con fines preventivos.
Lo que se sabe:
- La ITSC e ITSL con alérgenos han demostrado eficacia para el tratamiento de la rinitis y el asma.
- Ambas modalidades de inmunoterapia pueden prevenir el desarrollo de asma y mejorar la hiperreactividad bronquial en niños con rinitis.
Lo que se necesita saber:
- Establecer el rol definitivo de la inmunoterapia para la prevención de nuevas sensibilizaciones.
- Estudiar la utilidad de la inmunoterapia alérgeno específica en la prevención primaria.
- Evaluar el efecto de nuevos agentes biológicos sobre la evolución natural de la enfermedad alérgica.
CONCLUSIONES
La prevención de las enfermedades es un objetivo permanente del accionar médico. Se ha evaluado la utilidad de las diferentes medidas en distintos niveles de prevención de las enfermedades alérgicas con efectos promisorios.
No obstante, algunos resultados contradictorios obtenidos por investigaciones realizadas en grupos poblacionales disímiles obligan a desarrollar protocolos que permitan establecer la utilidad definitiva de las diversas estrategias preventivas planteadas en este documento (Tablas 3 y 4).
Tabla 3: Estado del arte de las medidas higiénico-dietéticas en la prevención de las enfermedades alérgicas

Tabla 4: Estado del arte de las medidas ambientales, farmacológicas e inmunológicas en la prevención de las enfermedades alérgicas

ITA: Inmunoterapia con alérgenos.
Un mayor entendimiento de los factores genéticos y ambientales que condicionan las enfermedades alérgicas y una mejor identificación de niños con riesgo alérgico antes de que ocurra la sensibilización o los primeros síntomas permitirá optimizar el uso de las medidas preventivas para revertir la tendencia epidemiológica creciente experimentada en las últimas décadas en este grupo de enfermedades.
1. Comité Nacional de Alergia, Comité Nacional de Neumonología, Comité de Otorrinolaringología Filial Córdoba. Consenso Nacional de Rinitis Alérgica en Pediatría. Arch Argent Pediatr 2009;107(1):67-81. [ Links ]
2. Asher MI, Montefort S, Bjorkstén B, Lai CK, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry crosssectional surveys. Lancet 2006;368(9537):733-43. [ Links ]
3. Saranz RJ, Bustos GJ. Intervención temprana en las enfermedades alérgicas. En: Paris Mancilla E, Sánchez I, Beltramino D, Copto García A, eds. Meneghello Pediatría. 6.ta ed. Buenos Aires: Panamericana; 2013.Págs.998-9. [ Links ]
4. Beasley R, Semprini A, Mitchell EA. Risk factors for asthma: is prevention possible? Lancet 2015;386(9998):1075-85. [ Links ]
5. Nieto A, Wahn U, Bufe A, Eigenmann P, et al. Allergy and asthma prevention 2014. Pediatr Allergy Immunol 2014;25(6):516-33. [ Links ]
6. Spergel JM. From atopic dermatitis to asthma: the atopic march. Ann Allergy Asthma Immunol 2010;105(2):99-106. [ Links ]
7. Dharmage SC, Lowe AJ, Matheson MC, Burgess JA, et al. Atopic dermatitis and the atopic march revisited. Allergy 2014;69(1):17-27. [ Links ]
8. Fouzas S, Brand PL. Predicting persistence of asthma in preschool wheezers: crystal balls or muddy waters? Paediatr Respir Rev 2013;14(1):46-52. [ Links ]
9. Agresta MF, Saranz RJ, Lozano NA, Lozano A. Relación entre rinitis y asma: ¿está todo dicho? Rev Fac Cienc Méd Córdoba 2014;71(2):111-21. [ Links ]
10. Boulay ME, Morin A, Laprise C, Boulet LP. Asthma and rhinitis: what is the relationship? Curr Opin Allergy Clin Immunol 2012;12(5):449-54. [ Links ]
11. Harb H, Renz H. Update on epigenetics in allergic disease. J Allergy Clin Immunol 2015;135(1):15-24. [ Links ]
12. LiuAH. Endotoxin exposure in allergy and asthma: reconciling a paradox. J Allergy Clin Immunol 2002;109(3):379-92. [ Links ]
13. Halken S. Prevention of allergic disease in childhood: clinical and epidemiological aspects of primary and secondary allergy prevention. Pediatr Allergy Immunol 2004;15(Suppl 16):4-5,9-32. [ Links ]
14. Asher I, Baena-Cagnani C, Boner A, Canonica GW, et al. World Allergy Organization guidelines for prevention of allergy and allergic asthma. Int Arch Allergy Immunol 2004;135(1):83-92. [ Links ]
15. Garn H, Neves JF, Blumberg RS, Renz H. Effect of barrier microbes on organ-based inflammation. J Allergy Clin Immunol 2013;131(6):1465-78. [ Links ]
16. West CE, Jenmalm MC, Prescott SL. The gut microbiota and its role in the development of allergic disease: a wider perspective. Clin Exp Allergy 2015;45(1):43-53. [ Links ]
17. Rogers GB, Shaw D, Marsh RL, Carroll MP, et al. Respiratory microbiota: addressing clinical questions, informing clinical practice. Thorax 2015;70(1):74-81. [ Links ]
18. Donohue KM, Miller RL, Perzanowski MS, Just AC, et al. Prenatal and postnatal bisphenol A exposure and asthma development among inner-city children. J Allergy Clin Immunol 2013;131(3):736-42. [ Links ]
19. Burke H, Leonardi-Bee J, Hashim A, Pine-Abata H, et al. Prenatal and passive smoke exposure and incidence of asthma and wheeze: systematic review and meta-analysis. Pediatrics 2012;129(4):735-44. [ Links ]
20. Noakes PS, Holt PG, Prescott SL. Maternal smoking in pregnancy alters neonatal cytokine responses. Allergy 2003;58(10):1053-8. [ Links ]
21. Lannero E, Wickman M, van Hage M, Bergstrom A, et al. Exposure to environmental tobacco smoke and sensitisation in children. Thorax 2008;63(2):172-6. [ Links ]
22. Huiyan W, Yuhe G, Juan W, Junyan Z, et al. The importance of allergen avoidance in high risk Infants and sensitized patients: a meta-analysis study. Allergy Asthma Immunol Res 2014;6(6):525-34. [ Links ]
23. Brussee JE, Smit HA, van Strien RT, Corver K, et al. Allergen exposure in infancy and the development of sensitization, wheeze, and asthma at 4 years. J Allergy Clin Immunol 2005;115(5):946-52. [ Links ]
24. Custovic A. To what extent is allergen exposure a risk factor for the development of allergic disease? Clin Exp Allergy 2015;45(1):54-62. [ Links ]
25. Van Schayck OC, Maas T, Kaper J, Knottnerus AJ, et al. Is there any role for allergen avoidance in the primary prevention of childhood asthma? J Allergy Clin Immunol 2007;119(6):1323-8. [ Links ]
26. Tovey ER, Marks GB. It's time to rethink mite allergen avoidance. J Allergy Clin Immunol 2011;128(4):723-7.e6. [ Links ]
27. Corver K, Kerkhof M, Brussee JE, Brunekreef B, et al. House dust mite allergen reduction and allergy at 4 yr: follow up of the PIAMA-study. Pediatr Allergy Immunol 2006;17(5):329-36. [ Links ]
28. Arshad SH, Bojarskas J, Tsitoura S, Matthews S, et al. Prevention of sensitization to house dust mite by allergen avoidance in school age children: a randomized controlled study. Clin Exp Allergy 2002;32(6):843-9. [ Links ]
29. Morgan WJ, Crain EF, Gruchalla RS, O'Connor GT, et al. Results of a home-based environmental intervention among urban children with asthma. N Engl J Med 2004;351(11): 1068-80. [ Links ]
30. Munblit D, Boyle RJ, Warner JO. Factors affecting breast milk composition and potential consequences for development of the allergic phenotype. Clin Exp Allergy 2015;45(3):583-601. [ Links ]
31. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organ J 2015;8(1):4. [ Links ]
32. Cuello-Garcia CA, Brozek JL, Fiocchi A, Pawankar R, et al. Probiotics for the prevention of allergy: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol 2015;136(4):952-61. [ Links ]
33. Yao TC, Chang CJ, Hsu YH, Huang JL. Probiotics for allergic diseases: realities and myths. Pediatr Allergy Immunol 2010;21(6):900-19. [ Links ]
34. Moreno-Macias H, Romieu I. Effects of antioxidant supplements and nutrients on patients with asthma and allergies. J Allergy Clin Immunol 2014;133(5):1237-44. [ Links ]
35. Mirzakhani H, Al-Garawi A, Weiss ST, Litonjua AA, et al. Vitamin D and the development of allergic disease: how important is it? Clin Exp Allergy 2015;45(1):114-25. [ Links ]
36. Von Berg, A. The role of hydrolysates for allergy prevention-pro. Pediatr Allergy Immunol 2013;24(8):720-3. [ Links ]
37. Osborn DA, Sinn J. Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants. Cochrane Database Syst Rev 2006;(4):CD003664. [ Links ]
38. Tzifi F, Grammeniatis V, Papadopoulos M. Soy- and rice-based formula and infant allergic to cow's milk. Endocr Metab Immune Disord Drug Targets 2014;14(1):38-46. [ Links ]
39. Brozek JL, Bousquet J, Baena-Cagnani CE, Bonini S, et al. Allergic rhinitis and its impact on asthma (ARIA) guidelines: 2010 revision. J Allergy Clin Inmunol 2010;126(3):466-76. [ Links ]
40. Likura Y, Naspitz CK, Mikawa H, Talaricoficho S, et al. Prevention of asthma by ketotifen in infants with atopic dermatitis. Ann Allergy 1992;68(3):233-6. [ Links ]
41. Warner JO. A double-blinded, randomized, placebocontrolled trial of cetirizine in preventing the onset of asthma in children with atopic dermatitis: 18 months' treatment and 18 months' posttreatment follow-up. J Allergy Clin Immunol 2001;108(6):929-37. [ Links ]
42. Szefler SJ. Advances in pediatric asthma in 2012: moving toward asthma prevention. J Allergy Clin Immunol 2013;131(1):36-46. [ Links ]
43. Guilbert TW, Morgan WJ, Zeiger RS, Mauger DT, et al. Long-term inhaled corticosteroids in preschool children at high risk for asthma. N Engl J Med 2006;354(19):1985-97. [ Links ]
44. Papadopoulos NG, Arakawa H, Carlsen KH, Custovic A, et al. International consensus on (ICON) pediatric asthma. Allergy 2012;67(8):976-97. [ Links ]
45. Blom DJ, Ermers M, Bont L, van Woensel JB, et al. WITHDRAWN: Inhaled corticosteroids during acute bronchiolitis in the prevention of post-bronchiolitic wheezing. Cochrane Database Syst Rev 2011;(1):CD004881. [ Links ]
46. Compalati E, Penagos M, Tarantini F, Passalacqua G, et al. Specific immunotherapy for respiratory allergy: state of the art according to current meta-analyses. Ann Allergy Asthma Immunol 2009;102(1):22-8. [ Links ]
47. Comité Nacional de Alergia. Inmunoterapia con alergenos para la prevención y el tratamiento de las enfermedades alérgicas respiratorias de la infancia. Arch Argent Pediatr 2010;108(3):258-65. [ Links ]
48. Des-Roches A, Paradis L, Menardo JL, Bouges S, et al. Immunotherapy with a standardized Dermatophagoides pteronyssinus extract. VI. Specific immunotherapy prevents the onset of new sensitizations in children. J Allergy Clin Immunol 1997;99(4):450-3. [ Links ]
49. Pajno GB, Barberio G, De Luca F, Morabito L, et al. Prevention of new sensitizations in asthmatic children monosensitized to house dust mite by specific immunotherapy. A six-year follow-up study. Clin Exp Allergy 2001;31(9):1392-7. [ Links ]
50. Inal A, Altunas DU, Yılmaz M, Karacok GB, et al. Prevention of new sensitizations by specific immunotherapy in children with rhinitis and/or asthma monosensitized to house dust mite. J Investig Allergol Clin Immunol 2007;17(2):85-91.
51. Purello-D'Ambrosio F, Gangemi S, Merendino RA, Isola S, et al. Prevention of new sensitizations in monosensitized subjects submitted to specific immunotherapy or not. A retrospective study. Clin Exp Allergy 2001;31(8):1295-302. [ Links ]
52. Marogna M, Tomassetti D, Bernasconi A, Colombo F, et al. Preventive effects of sublingual immunotherapy in childhood: an open randomized controlled study. Ann Allergy Asthma Immunol 2008;101(2):206-11. [ Links ]
53. Szépfalusi Z, Bannert C, Ronceray L, Mayer E, et al. Preventive sublingual immunotherapy in preschool children: first evidence for safety and pro-tolerogenic effects. Pediatr Allergy Immunol 2014;25(8):788-95. [ Links ]
54. Jacobsen L, Niggemann B, Dreborg S, Ferdousi HA, et al. Specific immunotherapy has long-term preventive effect of seasonal and perennial asthma: 10-year follow-up on the PAT study. Allergy 2007;62(8):943-8. [ Links ]
55. Grembiale RD, Camporota L, Naty S, Tranfa CM, et al. Effects of specific immunotherapy in allergic rhinitic individuals with bronchial hyperresponsiveness. Am J Respir Crit Care Med 2000;162(6):2048-52. [ Links ]
56. Novembre E, Galli E, Landi F, Caffarelli C, et al. Coseasonal sublingual immunotherapy reduces the development of asthma in children with allergic rhinoconjunctivitis. J Allergy Clin Immunol 2004;114(4):851-7. [ Links ]














