Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.5 Buenos Aires oct. 2016
http://dx.doi.org/10.5546/aap.2016.453
COMUNICACIONES BREVES
http://dx.doi.org/10.5546/aap.2016.453
Niveles de moléculas de detección temprana de daño renal en la orina en niños con deficiencia de vitamina B12
Dr. Ali Güneşa, Dr. Fesih Aktara, Dr. İlhan Tana, Dr. Murat Sökerb, Dr. Ünal Ulucaa, Dr. Hasan Balıka y Dra. Nuriye Metec Colaborador: Dr. Velat Şena
a. Universidad de Dicle, Departamento de Pediatría de la Facultad de Medicina, Diyarbakir, Turquía.
b. Universidad de Dicle, Departamento de Hematología Pediátrica de la Facultad de Medicina, Diyarbakir, Turquía.
c. Universidad de Dicle, Departamento de Bioquímica de la Facultad de Medicina, Diyarbakir, Turquía.
Correspondencia: Dr. Ali Güne: draligunes@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 2-2-2016
Aceptado: 6-5-2016
RESUMEN
El objetivo de este estudio fue investigar los niveles de moléculas de detección temprana de daño renal en la orina, que incluyen la molécula 1 de lesión renal en humanos (KIM-1), la proteína hepática transportadora de ácidos grasos (L-FABP), el N-acetil-b-D-glucosaminidasa A (NAG) y la lipocalina asociada con la gelatinasa de neutrófilos (NGAL), en niños con deficiencia de vitamina B12 (cobalamina).Seincluyeron 12 niños condeficiencia de vitamina B12 y 20 niños sanos en el grupo de referencia emparejado. Se registraron los parámetros hematológicos, la urea en suero, la creatinina (Cr), los electrolitos, y los niveles de vitamina B12 y folato. Se calculó la tasa de filtración glomerular estimada (TFGe). Se midieronlosnivelesdeproteínas, electrolitos y marcadoresde deteccióntemprana en laorina. Lospacientescon deficiencia de cobalamina tenían un cociente significativamente superior de electrolitos/Cr en la orina (p < 0,05). Se hallaron niveles significativamente superiores de KIM-1/Cr, L-FABP/ Cr, NAG/Cr y N GAL / Cr en la orina en el grupo con deficiencia de cobalamina (p < 0,05). En estos pacientes, también se hallaron correlaciones negativas significativas entre los niveles de vitamina B12 en suero y los marcadores en la orina (p < 0,05). El aumento de los electrolitos y de las moléculas marcadoras de lesión renal en la orina en los niños con deficiencia de vitamina B12 sugiere una posible disfunción renal subclínica, que no puede determinarse mediante las pruebas funcionales renales convencionales.
Palabras clave: Deficiencia de vitamina B12; Lesión renal; KIM-1; L-FABP; NAG; NGAL.
INTRODUCCIÓN
La vitamina B12 (cobalamina) es un componente esencial de la proliferación y la diferenciación celular, la hematopoyesis y las funciones neurológicas.1 La deficiencia de cobalamina es un problema mundial en todos los grupos etarios. La deficiencia de cobalamina puede causar diversos síntomas, dado que la vitamina B12 es esencial para la síntesis de los ácidos nucleicos, para los eritrocitos y para el mantenimiento de la mielina.2 En los lactantes, se observan síntomas como hipotonía, convulsiones y retraso en el desarrollo, mientras que en los niños de mayor edad se observan cambios hematológicos megaloblásticos, signos extrapiramidales y delirio o psicosis.3 Se han informado casos de absorción deficiente selectiva de vitamina B12 o síndrome de Grasbeck-Imerslund, junto a proteinuria4 . Además, si la deficiencia de cobalamina avanza, produce anemia2 , que puede derivar en hipoxia crónica como una de las causas de lesión renal.5 Si bien los aspectos hematológicos y neurológicos de la deficiencia de cobalamina se han investigado ampliamente, no se encontró un estudio sobre los efectos renales de dicha deficiencia en la búsqueda bibliográfica.
Los niveles en suero de la creatinina o el nitrógeno ureico en sangre no aumentan hasta que se pierde más de la mitad de las funciones renales.6 Por lo tanto, se necesitan biomarcadores de detección temprana no invasivos que predigan el daño renal subclínico. Los biomarcadores con más probabilidad de lograrlo son la molécula 1 de lesión renal en humanos (KIM-1), la proteína hepática transportadora de ácidos grasos (L-FABP), el N-acetil-b-D-glucosaminidasa A (NAG) y la lipocalina asociada con la gelatinasa de neutrófilos (NGAL). En este estudio, se utilizaron nuevos marcadores de lesión, que incluyen KIM-1, L-FABP, NAG y NGAL, para investigar los posibles efectos subclínicos de la deficiencia de cobalamina en las funciones renales.
De acuerdo con la búsqueda de bibliografía en inglés, no se hallaron estudios que investigaran marcadores de detección temprana de daño renal en niños con deficiencia de vitamina B12. Por lo tanto, en este estudio, el objetivo fue investigar la posibilidad de lesión renal subclínica, que no puede determinarse a través de métodos convencionales en los niños con deficiencia de cobalamina.
MATERIALES Y MÉTODOS
Se incluyeron 12 niños (7 varones, 5 mujeres) con deficiencia de cobalamina, que ingresaron al hospital de la Universidad de Dicle entre abril y diciembre de 2015. El grupo de referencia incluyó 20 niños sanos emparejados por edad y sexo (11 varones, 9 mujeres), que ingresaron al hospital debido a un control de rutina o una cirugía menor, sin anemia ni uso de fármacos o enfermedades que afectaran las funciones renales. Se registraron los antecedentes médicos, los motivos de consulta y los resultados del examen físico. Se excluyó a los niños con diabetes mellitus, enfermedad reumática, infección urinaria, septicemia, nefropatía, antecedentes de uso de fármacos nefrotóxicos, enfermedad hepática o respiratoria, o cardiopatía.
Se registraron los siguientes valores: hemoglobina sanguínea (Hb), leucocitos, eritrocitos, volumen globular medio (MCV), concentración globular media de hemoglobina (MCHC) y plaquetas. La anemia infantil se definió como la concentración de hemoglobina (Hb) inferior al valor de corte establecido por la Organización Mundial de la Salud: 11 g/dl en niños de 6 a 59 meses, 11,5 g/dl en niños de 5 a 11 años y 12 g/dl en niños de 12 a 14 años7 . Los análisis bioquímicos incluyeron lo siguiente: urea en suero, creatinina (Cr), electrolitos [sodio (Na), potasio (K), calcio (Ca)], aspartato transaminasa (AST), alanina aminotransferasa (ALT), lactato deshidrogenasa (LDH), proteína C-reactiva (PCR), y niveles de vitamina B12 y folato. El diagnóstico de deficiencia de cobalamina se estableció cuando los niveles de vitamina B12 eran < 148 pmol/l, con niveles normales de folato y con la exclusión de otras causas de anemia.2
Se centrifugaron muestras de orina de 10 ml durante 3 minutos a 3000 rpm, y la orina de la parte superior del tubo se transfirió a cuatro tubos Eppendorf diferentes, que se almacenaron a -80 °C hasta las mediciones. En las muestras de orina, se estudiaron las siguientes variables: Ca, Na, K, magnesio (Mg), ácido úrico (AU), proteína y Cr. También se midieron los marcadores de detección temprana de lesión renal en la orina, que incluyen KIM-1, L-FABP, NAG y NGAL. Los parámetros bioquímicos se investigaron con un dispositivo Abbott ARCHITECT C16000 (Abbott Park, IL), a través de un método enzimático colorimétrico. Los marcadores de detección temprana de daño renal se examinaron mediante el método de análisis inmunoenzimático sobre adsorbente (ELISA). Para las comparaciones, las concentraciones de electrolitos y marcadores de detección temprana de lesión renal en la orina se dividieron por la creatinina en la orina. La TFGe se calculó a partir de la creatinina en suero utilizando la fórmula de Schwartz para los niños.8
El estudio cumplió con las pautas de la Declaración de Helsinki, todos los sujetos firmaron un consentimiento informado y el protocolo del estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Dicle.
Los datos numéricos se presentaron como media más/menos desviación estándar, mediana y máximo-mínimo, mientras que los datos categóricos se presentaron como número y porcentaje. Para la comparación entre grupos independientes, se utilizó la prueba U de MannWhitney. Para comparar los datos categóricos, se utilizó la prueba de la %2 . Las relaciones entre los datos se investigaron mediante los análisis de correlación de Spearman. El valor p inferior a 0,05 se consideró estadísticamente significativo.
RESULTADOS
Se incluyeron 12 niños (7 varones, 5 mujeres) con deficiencia de cobalamina. El grupo de referencia incluyó 20 niños sanos (11 varones, 9 mujeres). No hubo una diferencia significativa entre la edad media de los niños con deficiencia de cobalamina y la de los niños sanos del grupo de referencia (6,9 ± 4,6 frente a 5,3 ± 2,4 años) (p > 0,05) (Tabla 1).
Tabla 1. Características demográficas y bioquímicas del grupo de deficiencia de cobalamina (B12) y el grupo de referencia (mediana [mínimo-máximo])
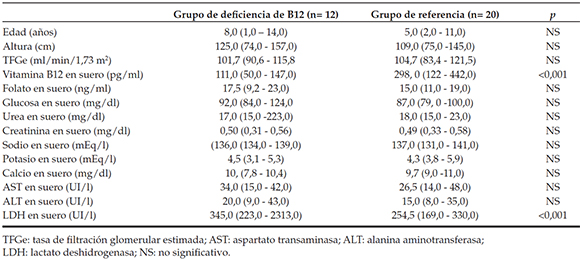
No se hallaron diferencias significativas en la TFGe y los niveles de urea en suero, Cr, Na, K, Ca, ALT, AST, glucosa y folato entre los pacientes con deficiencia de cobalamina y los del grupo de referencia. El nivel medio de vitamina B12 en suero fue significativamente inferior en el grupo de deficiencia de cobalamina comparado con el grupo de referencia (p < 0,001); sin embargo, el nivel de LDH en suero fue significativamente superior en el grupo de deficiencia de cobalamina (p < 0,001) (Tabla 1).
Se hallaron niveles significativamente más bajos de eritrocitos, hemoglobina y hematocrito (p < 0,001), y niveles más altos del volumen globular medio y la concentración globular media de hemoglobina en el grupo de deficiencia de cobalamina (p < 0,001; p= 0,035, para cada uno). No se observaron diferencias significativas entre los dos grupos en cuanto a los recuentos de leucocitos y plaquetas (p > 0,05) (Tabla 2).
Tabla 2. Características hematológicas del grupo de deficiencia de cobalamina y el grupo de referencia (mediana [mínimo-máximo])

Los niños con deficiencia de cobalamina tenían cocientes significativamente superiores de KIM-1/Cr, NGAL/Cr, NAG/Cr y L-FABP/Cr en la orina en comparación con los niños sanos del grupo de referencia (p= 0,008; p= 0,019; p= 0,003; p= 0,011, respectivamente) (Tabla 3).
Tabla 3. Niveles de moléculas de detección temprana de lesión renal en la orina en el grupo de deficiencia de cobalamina y el grupo de referencia (mediana [mínimo-máximo])

Si bien los pacientes con deficiencia de cobalamina tenían valores significativamente más altos de Na/Cr y AU/Cr en la orina en comparación con el grupo de referencia (p= 0,029; p = 0,025, respectivamente), no se hallaron diferencias significativas en los valores de P/Cr, Mg/Cr, K/Cr, Ca/Cr y proteína/Cr entre los dos grupos (Tabla 4).
Tabla 4. Cocientes de electrolitos/creatinina en la orina en el grupo de deficiencia de cobalamina y el grupo de referencia (mediana [mínimo-máximo])

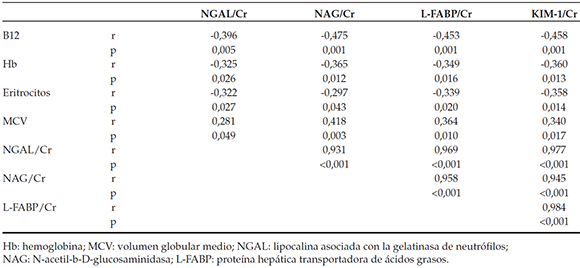
Se hallaron correlaciones positivas significativas entre los cocientes de KIM-1/Cr, L-FABP/Cr, NAG/Cr y NGAL/Cr en la orina en el grupo con deficiencia de cobalamina (p < 0,05). Se hallaron correlaciones negativas significativas entre el nivel de vitamina B12 en suero y los cocientes de biomarcadores/Cr en la orina (p < 0,05). Además, se hallaron correlaciones negativas significativas entre los valores de hemoglobina y hematocrito, y los cocientes de los biomarcadores en la orina (p < 0,05). Finalmente, se observaron correlaciones negativas significativas entre los eritrocitos y los cocientes de L-FABP/Cr y KIM-1/Cr en la orina en los pacientes con deficiencia de cobalamina (Tabla 5).
Tabla 5. Coeficientes de correlación de Spearman entre los novedosos biomarcadores en la orina y otras variables en el grupo de deficiencia de cobalamina
DISCUSIÓN
El aumento de los valores de Na/Cr y AU/ Cr en la orina en los niños con deficiencia de cobalamina puede indicar disfunción tubular renal. En la insuficiencia renal crónica, se halló que los biomarcadores de lesión en la orina disminuyen si los niveles bajos de hemoglobina se corrigen mediante la administración de eritropoyetina9 . La anemia que se produce en la deficiencia de cobalamina puede dar lugar a la hipoxia crónica. Las células tubulares renales tienen un alto nivel de actividad metabólica y consumo de oxígeno, y mucha tendencia a la hipoxia.10
La KIM-1, como proteína transmembrana, aumenta en las células tubulares proximales después de una lesión isquémica o nefrotóxica, y se expresa en las áreas fibróticas de los riñones dañados.11 Se hallaron niveles elevados de KIM-1 en la orina en los niños con deficiencia de cobalamina como marcador de cambios túbulointersticiales.
Se cree que la L-FABP es un antioxidante endógeno que elimina las lesiones túbulointersticiales, y es un biomarcador del daño renal crónico y de su avance.12 Por lo tanto, la L-FABP en la orina podría ser un novedoso biomarcador para la isquemia intrarrenal crónica. La eliminación más elevada de L-FABP en la orina que se detectó en los pacientes con deficiencia de cobalamina puede ser un signo de hipoxemia crónica debido a la anemia por deficiencia de cobalamina.
El NAG es una abundante enzima lisosómica de las células tubulares renales que se libera en la orina durante una lesión tubular proximal13 . La NGAL forma parte de la familia de las lipocalinas y se ha identificado como un sensible biomarcador de daño tubular renal en la nefropatía aguda y crónica.14 La eliminación significativamente elevada de NAG y NGAL en la orina en los pacientes con deficiencia de cobalamina puede indicar lesión subclínica de los túbulos renales.
El daño en las células tubulares renales puede dar lugar a la disfunción tubular, con una alteración en la reabsorción de electrolitos. En nuestro estudio, se halló una mayor eliminación de Na y ácido úrico en la orina. Además, el mayor nivel de moléculas marcadoras de lesión renal en la orina de los pacientes sugería daño renal. La correlación de estos cuatro novedosos biomarcadores indicó que estos pacientes pueden tener daño renal y destacó el valor de dichos marcadores.
Si bien no hubo diferencias en los cocientes de proteína/Cr en la orina entre los pacientes con deficiencia de cobalamina y los pacientes sanos, Wahlstedt-Fróberg y cols. informaron una mayor eliminación de proteínas en los seis pacientes con síndrome de Grasbeck-Imerslund de su estudio. El nivel no elevado de proteína en la orina de los pacientes de nuestro estudio puede estar relacionado con la etiopatogenia diferente (deficiencia de cobalamina alimentaria), en comparación con la absorción deficiente selectiva de vitamina B12 del síndrome de Grasbeck-Imerslund.4
Las correlaciones negativas entre las moléculas marcadoras de lesión renal en la orina y los niveles de hemoglobina y vitamina B12 en el grupo con deficiencia de cobalamina apoyan la existencia de un proceso crónico en el que la lesión renal aumenta de forma paralela al incremento de deficiencia de cobalamina.
La limitación principal es la poca cantidad de participantes en el grupo con deficiencia de cobalamina, y la otra limitación es el diseño transversal del estudio. No fue posible medir los biomarcadores en la orina una vez terminada la suplementación con cobalamina debido a la pérdida de la mayoría de los pacientes durante el seguimiento.
En conclusión, a pesar de los niveles normales detectados en las pruebas funcionales renales convencionales que se realizan con frecuencia, el aumento de las moléculas marcadoras de lesión renal en la orina puede indicar la existencia de daño renal subclínico en los pacientes con deficiencia de vitamina B12.
Agradecimientos
Los autores agradecen a DUBAP (Fondo de la Universidad de Dicle para los Proyectos de Investigación Científica) por el apoyo científico y financiero.
1. Briani C, Dalla Torre C, Citton V, Manara R, et al. Cobalamin deficiency: clinical picture and radiological findings. Nutrients 2013;5(11):4521-39. [ Links ]
2. Pawlak R, Lester SE, Babatunde T. The prevalence of cobalamin deficiency among vegetarians assessed by serum vitamin B12: a review of literature. Eur J Clin Nutr 2014;68(5):541-8. [ Links ]
3. Whitehead VM. Acquired and inherited disorders of cobalamin and folate in children. Br J Haematol 2006;134(2):125-36. [ Links ]
4. Wahlstedt-Froberg V, Pettersson T, Aminoff M, Dugué B, et al. Proteinuria in cubilin-deficient patients with selective vitamin B12 malabsorption. Pediatr Nephrol 2003;18(5): 417-21. [ Links ]
5. Ozcay F, Derbent M, Aldemir D, Turkoglu S, et al. Effect of iron deficiency anemia on renal tubular function in childhood. Pediatr Nephrol 2003;18(3):254-6. [ Links ]
6. Anderson RJ, Barry DW. Clinical and laboratory diagnosis of acute renal failure. Best Pract Res Clin Anaesthesiol 2004;18(1):1-20. [ Links ]
7. Scott SP, Chen-Edinboro LP, Caulfield LE, Murray-Kolb LE. The impact of anemia on child mortality: an updated review. Nutrients 2014;6(12):5915-32. [ Links ]
8. Schwartz GJ, Work DF. Measurement and estimation of GFR in children and adolescents. Clin J Am Soc Nephrol 2009;4(11):1832-43. [ Links ]
9. Nakamura T, Sugaya T, Kawagoe Y, Suzuki T, et al. Effect of erythropoietin on urinary liver-type fatty-acid-binding protein in patients with chronic renal failure and anemia. Am J Nephrol 2006;26(3):276-80. [ Links ]
10. Nangaku M. Chronic hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure. J Am Soc Nephrol 2006;17(1):17-25. [ Links ]
11. Lim AI, Tang SC, Lai KN, Leung JC. Kidney injury molecule-1: more than just an injury marker of tubular epithelial cells? J Cell Physiol 2013;228(5):917-24. [ Links ]
12. von Eynatten M, Baumann M, Heemann U, Zdunek D, et al. Urinary L-FABP and anaemia: distinct roles of urinary markers in type 2 diabetes. Eur J Clin Invest 2010;40(2): 95-102. [ Links ]
13. MartenssonJ, Martling CR, Bell M. Novelbiomarkers of acute kidney injury and failure: clinical applicability. Br J Anaesth 2012;109(6):843-50. [ Links ]
14. Devarajan P. Review: neutrophil gelatinase-associated lipocalin: a troponin-like biomarker for human acute kidney injury. Nephrology (Carlton) 2010;15(4):419-28. [ Links ]











 texto en
texto en 


