Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.5 Buenos Aires Oct. 2016
http://dx.doi.org/10.5546/aap.2016.e357
PRESENTACIÓN DE CASOS CLÍNICOS
http://dx.doi.org/10.5546/aap.2016.e357
Síndrome hemofagocítico asociado a tuberculosis en una paciente con inmunodeficiencia adquirida
Hemophagocytic syndrome associated with tuberculosis in a patient with acquired immunodeficiency
Dra. Norma E. Gonzáleza, Dra. Silvia Álvarez Pontea, Dra. Mariela Lópeza, Dr. Pablo Frontia, Dra. Silvina Smitha y Dr. Victor Pawluka
a. División Neumotisiología. Hospital General de Niños Pedro de Elizalde. Ciudad Autónoma de Buenos Aires. Argentina.
Correspondencia: Dra. Norma González, negonza@intramed.net
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 10-2-2016
Aceptado: 31-3-2016
RESUMEN
El síndrome hemofagocítico secundario es infrecuente en pediatría y, más aun, asociado a tuberculosis.
Presentamos el caso de una paciente con síndrome de inmunodeficiencia adquirida, tuberculosis diseminada y síndrome hemofagocítico.
Niña de 8 años, condiagnóstico de síndrome deinmunodeficiencia adquirida, que se internó por fiebre, vómitos y dolor abdominal. Presentaba distensión abdominal, deshidratación, taquipnea, rales subcrepitantes y sibilancias en ambos pulmones, anemia, plaquetopenia y alteración de la coagulación. Recibió antibióticos de amplio espectro y se realizó una laparotomía exploradora con apendicectomia y biopsia ganglionar. A las 72 horas, presentó convulsión tónico clónica, deterioro del sensorio, fiebre, hipoxemia, hepatoesplenomegalia, ascitis y edema periférico. Presentaba bicitopenia, hiperferritinemia y examen microscópico de médula ósea con hemofagocitosis. Recibió gammaglobulina intravenosa, corticoides y transfusiones sanguíneas. Se aisló Mycobacterium tuberculosis del aspirado gástrico, médula ósea y biopsia ganglionar abdominal. Se trató con isoniacida, rifampicina, estreptomicina y etambutol, y presentó franca mejoría.
Palabras clave: Síndrome hemofagocítico; Tuberculosis; VIH.
ABSTRACT
The secondary hemophagocytic syndrome is rare in children and even rarer associated with tuberculosis.
e report the case of a patient with acquired immunodeficiency syndrome, disseminated tuberculosis and hemophagocytic syndrome.
An 8-year-old girl, diagnosed with acquired immunodeficiency syndrome, was admitted due to fever, vomiting and abdominal pain. She presented abdominal distension, dehydration, tachypnea, crackles and wheezing in both lungs, anemia, thrombocytopenia and coagulopathy. She received broad-spectrum antibiotics and exploratory laparotomy was performed with appendectomy and lymph node biopsy. After 72 hours the patient presented tonic clonic seizure, impaired sensory, fever, hypoxemia, hepatosplenomegaly, ascites and peripheral edema. She developed bicytopenia, hyperferritinemia and bone marrow microscopic examination with hemophagocytosis. She received intravenous gammaglobulin, steroids and blood transfusions. Mycobacterium tuberculosis was cultured in gastric aspirate, bone marrow and abdominal lymph node biopsy. She was treated with isoniazid, rifampicin, streptomycin and ethambutol, showing marked improvement.
Key words: Hemophagocytic syndrome; Tuberculosis; HIV.
INTRODUCCIÓN
La tuberculosis en niños con síndrome de inmunodeficiencia adquirida (sida) suele presentarse con sintomatología inespecífica y formas extrapulmonares y diseminadas.
El síndrome hemofagocítico (SH) o linfohistiocitosis hemofagocítica es una enfermedad caracterizada por una proliferación benigna de histiocitos maduros con hemofagocitosis intensa en la médula ósea (MO), el bazo y los ganglios linfáticos. La forma secundaria se asocia a infecciones, inmunodeficiencias o neoplasias y puede presentarse como un cuadro grave y de alta letalidad. Su asociación con tuberculosis es infrecuente, especialmente en pediatría.
Se presenta un caso de SH secundario a tuberculosis diseminada en una paciente con sida.
CASO CLÍNICO
Niña de 8 años, con diagnóstico de infección por virus de inmunodeficiencia humana (VIH) a los 3 años de edad, sin haber realizado controles ni tratamiento. Se internó por fiebre, vómitos y dolor abdominal de 4 días de evolución. Refería que el padre había fallecido 2 años antes por tuberculosis y no se había administrado quimioprofilaxis a los contactos.
Al momento del ingreso, la paciente estaba en regular estado general, con dolor y distensión abdominal, deshidratada, taquipneica; se auscultaban rales subcrepitantes y sibilancias en ambos pulmones. Laboratorio: anemia, plaquetopenia y coagulograma alterado (Tabla 1). Radiografía de tórax con opacidades reticulonodulares bilaterales (Figura 1). Ecografía abdominal: múltiples adenomegalias en retroperitoneo y ambas fosas iliacas, líquido libre en cavidad.
Tabla 1. Datos bioquímicos en sangre evolutivos

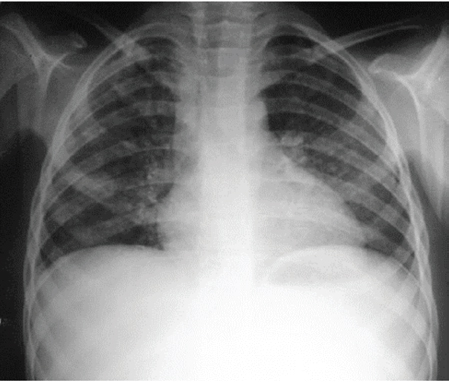
Figura 1. Radiografía de tórax al momento del ingreso. Se observan opacidades reticulonodulares difusas en ambos pulmones.
Se medicó con antibióticos de amplio espectro y se realizó una laparotomía exploradora con apendicectomía y toma de biopsia ganglionar.
La reacción en cadena de polimerasa (polymerase chain reaction; PCR, por sus siglas en inglés; Xpert MTB/RIF) de lavados gástricos y biopsia ganglionar fue positiva para Mycobacterium tuberculosis (MTB). Comenzó un tratamiento con rifampicina (10 mg/kg/ día) y estreptomicina (15 mg/kg/día) por vía parenteral porque presentaba íleo. A los 10 días, al mejorar su compromiso abdominal, se incorporó isoniacida (10 mg/kg/día) y etambutol (20 mg/ kg/día), medicamentos disponibles en Argentina solo para administración por vía oral.
A las 72 horas desde su ingreso, presentó convulsión tónico clónica y deterioro del sensorio, fiebre, hipoxemia, hepatoesplenomegalia, ascitis y edema en los miembros inferiores. Presentaba bicitopenia, coagulograma alterado, ferritina elevada (Tabla 1) y examen microscópico de aspirado de MO con hemofagocitosis.
Con diagnóstico de SH, además del tratamiento para tuberculosis, se le administró gammaglobulina endovenosa (1 g/kg/día) 2 días, dexametasona (0,4 mg/kg/día) y transfusiones sanguíneas. A los 15 días, presentó mejoría clínica y de laboratorio (Tabla 1). Los cultivos de contenido gástrico, MO y biopsia de ganglio mesentérico fueron positivos para MTB. Se descartaron otros patógenos (virus, bacterias, hongos y parásitos) mediante serología, cultivos y biología molecular en sangre, orina, materia fecal, MO y líquido cefalorraquídeo (LCR).
Comenzó a recibir los fármacos antirretrovirales (efavirenz-lamivudina-estavudina) al vigésimo día de tratamiento antituberculoso. Recibió dexametasona (39 días) y luego metilprednisona (1 mg/kg/día) durante 4 semanas, con reducción gradual de la dosis durante 3 semanas más. Completó el tratamiento durante 12 meses con isoniacida y rifampicina, y recibió etambutol y estreptomicina durante los dos meses iniciales.
La paciente continúa con buena evolución a los 6 meses de haber finalizado el tratamiento antituberculoso.
DISCUSIÓN
La tuberculosis es una enfermedad prevenible y curable, aun en pacientes con inmunodeficiencia. Sin embargo, como en este caso clínico, la falta de control y tratamiento del sida y la exposición a enfermos de tuberculosis sin administración de quimioprofilaxis a los contactos aumentan enormemente el riesgo de desarrollar una forma grave diseminada, con complicaciones y mayor morbimortalidad.1
El SH se produce por un trastorno en la regulación de la activación macrofágica. Puede ser primario o secundario. La forma primaria es más frecuente en menores de 2 años y se asocia a una variedad de mutaciones genéticas.2 El SH secundario, como el que presentó nuestra paciente, puede ocurrir a cualquier edad y ser causado por enfermedades malignas, autoinmunes, reacciones de hipersensibilidad a medicamentos e infecciones. Cuando el SH se asocia a procesos infecciosos, complica su evolución y manejo terapéutico, con una mortalidad del 30% al 40%.2
El diagnóstico de SH se basa en la presencia de, al menos, 5 de 8 criterios3 (Tabla 2): fiebre, esplenomegalia, citopenia, hipertrigliceridemia y/o hipofibrinogenemia, hiperferritininemia, hemofagocitosis en MO, bazo, ganglios linfáticos o hígado, disminución o ausencia de actividad celular natural killer (NK), CD25 elevado (cluster diferenciado 25 en la cadena a del receptor de IL-2). En nuestro caso, se solicitaron los exámenes complementarios al sospecharlo por la evolución clínica y se confirmó que la paciente reunía 6 criterios (NK y CD25 no estaban disponibles en ese momento en nuestra institución).
Tabla 2. Criterios diagnósticos para síndrome hemofagocítico secundario

El SH asociado a tuberculosis puede causar un cuadro grave, con elevada mortalidad, especialmente si se retrasa el diagnóstico y tratamiento antifímico.2
En una revisión reciente, Osowicki et al.4 , han recopilado 14 casos pediátricos, en su mayoría lactantes y formas de tuberculosis diseminada. En la Tabla 3, se expresan los resultados de dicho estudio y algunos casos más que han reportado otros autores. Todos ellos ponen énfasis en el reconocimiento del SH mediante los criterios diagnósticos y el tratamiento precoz de la tuberculosis.
Tabla 3. Casos reportados de síndrome hemofagocítico asociado a tuberculosis en pediatría

En nuestra paciente, obtener el resultado de la PCR positiva para MTB nos permitió administrar los fármacos antituberculosos rápidamente, y, debido a la gravedad del cuadro que presentó al desarrollar el SH, se emplearon corticoides y gammaglobulina, con buena respuesta. Varios de los casos que hemos encontrado en la bibliografía también han tenido una evolución favorable con este manejo terapéutico.2,5-7
El diagnóstico de SH suele ser dificultoso, ya que no todos los criterios están presentes al inicio. También debe tenerse en cuenta que algunos pacientes con tuberculosis grave y diseminada pueden presentar anemia, leucopenia, trombocitopenia o pancitopenia, que se resuelven con el tratamiento antituberculoso.8 La ferritina puede elevarse en procesos inflamatorios agudos o crónicos. Visser et al.9 , observaron hiperferritininemia en pacientes con tuberculosis diseminada, especialmente en VIH positivos.
El SH asociado a VIH ha sido reportado en adultos, solo o asociado a infecciones oportunistas, con elevada mortalidad.10,11 En el manejo de estos casos, se señala que es de suma importancia el tratamiento antirretroviral y de las infecciones concomitantes. Tenemos entendido que el único caso en niños de SH asociado a tuberculosis y sida fue reportado en 1995 por Dalle et al.12 , en la época previa al uso de los tratamientos antirretrovirales de gran actividad. A diferencia de nuestra paciente, esa niña tenía neumonía intersticial linfoide, infección diseminada por virus de Epstein-Barr y
Se ha descrito SH secundario al VIH11 o al tratamiento antituberculoso.13 La paciente que reportamos mejoró antes de iniciar los fármacos antirretrovirales, por lo que consideramos que fue la tuberculosis la que desencadenó el SH.
En los pacientes coinfectados con tuberculosis y VIH, la inmunosupresión aumenta la mortalidad. Las guías recomiendan comenzar con el tratamiento antirretroviral entre las 2-8 semanas posteriores al inicio de los antimicobacterianos.1,10 Una vez instaurados ambos tratamientos, puede haber interacciones medicamentosas, toxicidad o síndrome de reconstitución inmune.1
El caso que presentamos, a pesar de haber desarrollado SH y tuberculosis diseminada, tuvo buena tolerancia a todos los medicamentos.
CONCLUSIÓN
El SH secundario es infrecuente en pediatría, más aún, asociado a tuberculosis y sida. El tratamiento oportuno, etiológico y de soporte es de fundamental importancia, dada su elevada morbimortalidad.
1. Argentina. Ministerio de Salud, Organización Panamericana de la Salud, Sociedad Argentina de Pediatría, UNICEF. Atención integral de niños, niñas y adolescentes con VIH. Buenos Aires: UNICEF; 2012. [Acceso: 27 de enero de 2016]. Disponible en: http://www.sap.org.ar/docs/NNA_VIH_Web.pdf. [ Links ]
2. Brastianos PK, Swanson JW, Torbenson M, Sperati J, et al. Tuberculosis-associated haemophagocytic syndrome. Lancet Infect Dis 2006;6(7):447-54. [ Links ]
3. Henter JI, Horne A, Arico M, Egeler RM, et al. HLH-2004: diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer 2007;48(2):124-31. [ Links ]
4. Osowicki J, Wang S, McKenzie C, Marshall C, et al. Congenital tuberculosis complicated by hemophagocytic lymphohistiocytosis. Pediatr Infect Dis J 2016;35(1):108-10. [ Links ]
5. Seo JH, Lee JA, Kim DH, Cho J, et al. Tuberculosis-associated hemophagocytic lymphohistiocytosis in adolescent diagnosed by polymerase chain reaction. Korean J Pediatr 2016;59(1):43-6. [ Links ]
6. Padhi S, Ravichandran K, Sahoo J, Varghese R, et al. Hemophagocytic lymphohistiocytosis: an unusual complication in disseminated Mycobacterium tuberculosis. Lung India 2015;32(6):593-601. [ Links ]
7. Giri PP, Pal P, Ganguly N, Ghosh A. Pulmonary tuberculosis with ARDS and Hemophagocytic Syndrome. A case report. J Pediatr Criti Care 2014;1(4):251-3. [ Links ]
8. Dilber E, Erduran E, Kalyoncu M, Aynaci F, et al. Hemophagocytic syndrome as an initial presentation of miliary tuberculosis without pulmonary findings. Scand J Infect Dis 2002;34(9):689-92. [ Links ]
9. Visser A, van de Vyver A. Severe hyperferritinemia in mycobacteria tuberculosis infection. Clin Infect Dis 2011;52(2):273-4. [ Links ]
10. Baraldès MA, Domingo P, Gonzalez MJ, Aventin A, et al. Tuberculosis-associated hemophagocytic syndrome in patients with acquired immunodeficiency syndrome. Arch Intern Med 1998;158(2):194-5. [ Links ]
11. Fardet L, Lambotte O, Meynard JL, Kamouh W, et al. Reactive haemophagocytic syndrome in 58 HIV-1-infected patients: clinical features, underlying diseases and prognosis. AIDS 2010;24(9):1299-306. [ Links ]
12. Dalle JH, Dollfus C, Leverger G, Landman-Parker J, et al. Syndrome d'activation macrophagique chez l'enfant infecté par le VIH: a propos de trois cas. Arch Pediatr 1995;2(5):442-6. [ Links ]
13. Ramesh Bhat Y, Kurien A, Shruthi K, Padma MS, et al. Spontaneous recovery of haemophagocytic syndrome in an adolescent girl receiving anti-tuberculosis treatment. J Microbiol Infect Dis 2013;3(4):211-3. [ Links ]
14. Nandi M, Ganguli SK, Mondal RK, Dutta S, et al. Infection associated hemophagocytic syndrome in childhood tuberculosis: A case report. J Pediatr Infect Dis 2010;5(1):91-4. [ Links ]
15. Tavil B, Caliskan U, Unal S, Gumruk F. Pulmonary tuberculosis presenting with pancytopaenia, haemophagocytosis and foamy histiocytes in an infant. Int J Tuberc Lung Dis 2007;11(8):931-2. [ Links ]














