Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.6 Buenos Aires Dec. 2016
http://dx.doi.org/10.5546/aap.2016.508
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2016.508
Bacteriemia por Staphylococcus aureus adquirido en la comunidad en niños: estudio de cohorte 2010-2014
Dra. Guadalupe Péreza, Dra. Soledad Martirena, Bqca. Vanesa Reijtmanb, Dra. Romina Romerob, Lic. Alejandra Mastroiannib, Dra. Lidia Casimirb y Dra. Rosa Bolognaa
a. Servicio de Control Epidemiológico e Infectología. Hospital de Pediatría "Prof. Dr. Juan P. Garrahan". Ciudad Autónoma de Buenos Aires. Argentina.
b. Servicio de Microbiología. Hospital de Pediatría "Prof. Dr. Juan P. Garrahan". Ciudad Autónoma de Buenos Aires. Argentina.
Correspondencia: Dra. Guadalupe Pérez, guaperez@hotmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 31-1-2016
Aceptado: 14-6-2016
RESUMEN
Introducción. Las infecciones por Staphylococcus aureus meticilino resistente adquirido en la comunidad son un problema grave y frecuente en pediatría.
Objetivo. Describir la resistencia a los antibióticos enlas infecciones bacteriémicas por Staphylococcus aureus (SA) de la comunidad. Comparar las características de las infecciones bacteriémicas por SA según la resistencia a la meticilina.
Material y métodos. Cohorte prospectiva entre enero de 2010 y diciembre de 2014. Criterios de inclusión: niños de entre 30 días y 16 años de edad hospitalizados en el Hospital de Pediatría J. P. Garrahan por infecciones adquiridas en la comunidad, con desarrollo de SA en hemocultivos. Criterios de exclusión: antecedente de internación reciente, asistencia a un centro relacionado con los cuidados de la salud, vivir en una comunidad cerrada o catéter venoso. Se compararon características microbiológicas, demográficas y clínicas según la sensibilidad a la meticilina. Análisis estadístico: Stata10.
Resultados. Se incluyeron 208 niños; varones: 141 (68%). La mediana de edad fue 60 meses (rango intercuartilo 29-130). Tenían enfermedad de base 34 pacientes (16%). En 136 niños (65%), se identificó Staphylococcus aureus meticilino resistente. La resistencia a la clindamicina fue 9%. Se encontraron diferencias estadísticas significativas en la frecuencia de enfermedad subyacente, bacteriemia persistente, sepsis al momento del ingreso, foco secundario de infección, ingreso a unidades de cuidados intensivos y necesidad de cirugía. Fallecieron 12 pacientes (6%); todos tuvieron identificación de Staphylococcus aureus meticilino resistente adquirido en la comunidad.
Conclusiones. En la cohorte estudiada, predominó el Staphylococcus aureus meticilino resistente. La resistencia a la clindamicina fue del 9%. Las infecciones por Staphylococcus aureus meticilino resistente adquirido en la comunidad predominaron en niños sanos. En los pacientes con Staphylococcus aureus meticilino resistente, fue más frecuente la bacteriemia persistente, el ingreso a unidades de cuidados intensivos y la cirugía.
Palabras clave: Infecciones comunitarias adquiridas; Staphylococcus aureus; Resistencia a la meticilina.
INTRODUCCIÓN
El Staphylococcus aureus (SA) es un coco Gram-positivo de distribución universal con factores de virulencia que determinan su persistencia, recurrencia y la tendencia a producir focos secundarios. En las últimas décadas, se ha registrado, a nivel mundial, el aumento de la resistencia a los antibióticos de SA. Desde los primeros reportes de infecciones por SA resistente a la meticilina adquirido en la comunidad (SAMR-ac), en Sudamérica,1 en 2003, la frecuencia de identificación de resistencia antibiótica ha ido en aumento.
Las infecciones por SAMR-ac representan un motivo de consulta frecuente a nivel mundial en niños.2 El SAMR-ac predomina en niños sin enfermedad subyacente ni antecedentes de internación. Se presenta, en general, con infecciones superficiales de la piel y las partes blandas, que son motivo de consultas médicas frecuentes y de tratamiento antibiótico ambulatorio, pero puede provocar infecciones graves que requieren internación, drenaje quirúrgico y antimicrobianos en forma prolongada.3
El SAMR-ac suele identificarse en el cultivo de las lesiones supuradas; sin embargo, no es infrecuente la bacteriemia en niños con infecciones graves. La frecuencia reportada de hemocultivos positivos en los pacientes sin enfermedad subyacente con infecciones producidas por SA es del 5%.4
Conocer la sensibilidad a los antimicrobianos de SA de la
comunidad, las características evolutivas según el tipo de tratamiento indicado y los factores pronósticos de los niños con bacteriemia son fundamentales en el tratamiento de este tipo de infecciones.
El objetivo del estudio fue describir la frecuencia de resistencia a los antibióticos y comparar las características clínicas de los pacientes según la resistencia a la meticilina.
MATERIAL Y MÉTODOS
Desde el 1 de enero de 2010 al 31 de diciembre de 2014, se enrolaron prospectivamente todos los pacientes con infecciones por SA con bacteriemia. Fueron criterios de inclusión ser mayor de 30 días y menor de 16 años, haber sido hospitalizado en el Hospital de Pediatría Prof. Dr. Juan P. Garrahan por infecciones adquiridas en la comunidad, con, al menos, un hemocultivo tomado dentro de las primeras 48 h de internación con desarrollo de SA. Se excluyeron los pacientes que hubiesen permanecido internados, al menos, por 24 h durante los últimos 6 meses, que concurrieran, al menos, semanalmente a un centro relacionado con los cuidados de la salud, que tuvieran catéter de larga permanencia o que vivieran en comunidades cerradas.
El hospital donde se desarrolló el estudio es un centro de atención de tercer nivel; cuenta con más de 600 camas de internación, 4 unidades de cuidados intensivos (UCI) y 1 unidad de cuidados intensivos neonatales. Se internan niños desde el Área de Emergencias y Consultorios Externos, donde los pacientes consultan en forma espontánea o derivados de otras instituciones de todo el país.
El SA fue aislado de sangre a partir de muestras de hemocultivos utilizando el sistema automatizado Bact/Alert 3D y, posteriormente, tipificado mediante pruebas microbiológicas convencionales y automatizadas, siguiendo los protocolos de trabajo vigentes en el Laboratorio de Microbiología.
La resistencia a la meticilina se determinó por difusión con discos de cefoxitina de 30 pg. También se determinó la resistencia a la rifampicina (5 pg), a la gentamicina (10 pg), a la trimetoprima sulfametoxasol (25 pg), a la eritromicina (15 pg) y a la clindamicina (2 pg) realizando, para todos los casos, antibiogramas por difusión en agar de Müeller Hinton, incubando a 37 °C durante 24 h. Los antibiogramas se interpretaron según las normas del Clinical & Laboratory Standards Institute (CLSI) vigentes.5 La resistencia inducible a la clindamicina se identificó colocando el disco de esta droga a una distancia de 25 mm del disco de eritromicina en el antibiograma. La concentración inhibitoria mínima (CIM) a la vancomicina se realizó por el método de dilución en agar utilizando tiras Etest.
Se registraron los antecedentes, las características clínicas y evolutivas de los pacientes en una base de datos. Los pacientes ingresaron a la cohorte el día de su admisión hospitalaria y permanecieron en seguimiento hasta el alta médica. Se compararon las características de los pacientes con infecciones por SA meticilino resistente (SAMR) y SA meticilino sensible (SAMS).
Definiciones
Foco secundario de infección: cualquier foco clínico de infección que no estuviera presente en el momento de la hospitalización del paciente y que se manifestara luego de 72 h de la fecha de los hemocultivos positivos.
Duración de la bacteriemia: tiempo en días transcurrido desde el inicio del tratamiento antibiótico adecuado y la fecha de los primeros hemocultivos negativos.
Tratamiento empírico: tratamiento antibiótico indicado sin información sobre los resultados de hemocultivos.
Tratamiento definitivo: tratamiento antibiótico indicado luego del informe de susceptibilidad antibiótica de Microbiología.
Bacteriemia persistente: presencia de hemocultivos positivos luego del quinto día de tratamiento antibiótico adecuado.
Las variables categóricas se expresaron en porcentaje y las variables continuas, en medianas y rango intercuartilo (RIC). El análisis de las variables continuas se realizó con test de T o Wilcoxon Rank-sum Test según su distribución. Para comparar variables categóricas, se utilizó test de chi2. Se consideró significativo un valor p menor de 0,05.
Se calculó el riesgo relativo (RR) y su intervalo de confianza del 95% para cada grupo, para medir la fuerza de la asociación con el resultado. Se utilizó el programa Stata versión 10.0.
Consideraciones éticas: Al inicio del seguimiento, se informó a los pacientes la existencia del estudio, se los invitó a participar y se garantizó la confidencialidad de los datos y la absoluta reserva respecto a la identificación de los pacientes. Los padres o responsables del paciente presentes durante la entrevista inicial firmaron el consentimiento informado. Cuando el niño era mayor de 8 años, se le solicitó su asentimiento. Se les explicó a los pacientes y a sus familias que el estudio era descriptivo analítico, pero no de intervención. Las medidas terapéuticas habituales indicadas en cada caso no fueron modificadas por el desarrollo de este protocolo. El protocolo de investigación fue aprobado para su realización en el Hospital por el Comité de Investigación de la Institución.
RESULTADOS
En el período de estudio, se identificaron 208 pacientes con infecciones invasivas y bacteriemia por SA provenientes de la comunidad. Eran varones el 68% (n: 141). La mediana de edad fue 60 meses (RIC 29-130). Tenían enfermedad de base 34 pacientes (16%) (Tabla 1).
Tabla 1. Características demográficas, clínicas y evolutivas de los pacientes según la resistencia a la meticilina (n: 208)

Al momento de la hospitalización, tuvieron foco clínico de infección 197 pacientes (96%). Los focos clínicos más frecuentes fueron la osteoartritis (55%, n: 117), las infecciones de la piel y las partes blandas (34%, n: 71) y la neumonía (15%, n: 32).
Predominó el SAMR. Se identificó resistencia a la meticilina en 136 niños (65%).
La mediana de duración de la bacteriemia fue de 4 días (RIC 3-5) en los pacientes con SAMR vs. 3 (RIC 2-5) días en aquellos con SAMS.
El tratamiento empírico fue clindamicina en 116 pacientes (55%). Todos los pacientes recibieron, al menos, un antibiótico con actividad para el germen documentado en los hemocultivos.
El tratamiento definitivo fue, en 42 niños (20%), con clindamicina; en 98 (46%), con vancomicina; y, en 72 (34%), con cefalosporinas de primera generación.
La mediana de duración del tratamiento parenteral fue de 14 días (RIC 10-24) para los pacientes con bacteriemia por SAMR vs. 14 días (RIC 10-14) por SAMS; el tratamiento oral fue 28 días (RIC 20-60) vs. 28 días (RIC 14-40), respectivamente.
La mediana de duración de la internación fue, para los niños con SAMR, 17 días (RIC 12-30) y 15 días (12-19) en los pacientes con SAMS.
El foco secundario de infección más frecuente fue la neumonía en ambos grupos.
Fallecieron en relación con la infección 12 pacientes (6%). Todos los niños fallecidos tuvieron identificación de SAMR.
En el análisis bivariado que comparó las características de los pacientes con bacteriemia por SAMR vs. SAMS, se encontraron diferencias estadísticamente significativas en la frecuencia de enfermedad subyacente (11% vs. 26%, p < 0,01), bacteriemia persistente (33% vs. 6%, p 0,01), sepsis al momento del ingreso (33% vs. 14%, p < 0,01), ingreso a la UCI (28% vs. 12%, p 0,01) y requerimientos de cirugía (77% vs. 50%, p < 0,01).
Se identificaron 18 (9%) aislamientos resistentes a la clindamicina. A lo largo de los años de estudio, se mantuvo estable la resistencia a los antibióticos.
La sensibilidad a los antimicrobianos se presenta en la Tabla 2.
Tabla 2. Sensibilidad a los antimicrobianos (n: 208)
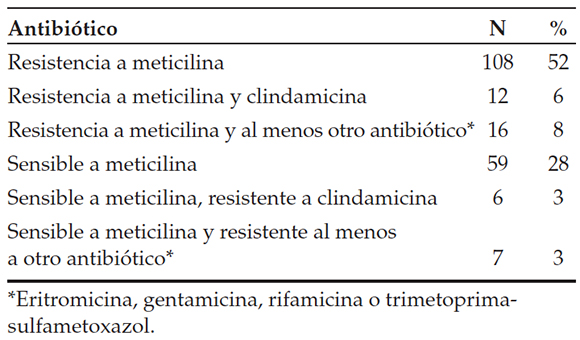
Entre los 18 pacientes con documentación de SAMR con resistencia a la clindamicina, 4 de ellos (22%) tenían antecedente de dermatitis atópica.
DISCUSIÓN
La prevalencia de las infecciones por SAMR-ac en niños ha aumentado en las últimas décadas hasta alcanzar características epidémicas. Un extenso trabajo multicéntrico en el que participaron pacientes de la Ciudad de Buenos Aires, conurbano de la provincia de Buenos Aires, Santa Fe, Rosario, Jujuy, Corrientes, Resistencia y Mar del Plata sobre la epidemiología de SAMR en la población pediátrica realizado en nuestro país6 informaba una prevalencia global de 61% de resistencia a la meticilina. A partir de esta descripción, otros autores reportaron la evolución de la frecuencia de resistencia a la meticilina en SA, en Argentina. Corso et al.,7 registraron, en un estudio publicado en 2014, un 55% de resistencia global en SA, en infecciones en niños y adultos de Argentina.
A diferencia de los estudios antes mencionados, la presente cohorte incluyó solo niños con infecciones adquiridas en la comunidad. Se excluyeron del estudio los pacientes con infecciones intrahospitalarias y asociadas al cuidado de la salud, quienes presentaban un epidemiología diferente de SAMR-ac.7
Al igual que en otros estudios publicados de Argentina,6,8 en esta cohorte, se observó una frecuencia de resistencia a la meticilina del 65%.
Las infecciones invasivas por SA adquiridas en la comunidad descritas en otras series7,8 predominan en pacientes de sexo masculino y en edad escolar. En la cohorte presentada, los niños con enfermedad subyacente representaron el 16%. La presencia de enfermedad de base en este estudio fue más frecuente en los niños con infecciones por SAMS. Otras investigaciones también fallaron en identificar factores de riesgo de adquisición y de infección por SAMR-ac.9,10
El SA produce celulitis, abscesos, piomiositis y osteoartritis y, en ocasiones, neumonía y empiema pleural.11,12 En la cohorte analizada, también predominaron las infecciones de la piel, las partes blandas y osteoarticulares.
El compromiso pulmonar se describe, frecuentemente, en las formas graves de infección y adopta formas clínicas variadas, que incluyen la supuración pleuropulmonar, la neumonía necrotizante y la bronconeumonía.13 En este trabajo, la neumonía fue significativamente más frecuente en los casos de SAMR. Se describe, a nivel mundial, el aumento de los casos de neumonía por SAMR, sobre todo, en los países que incorporaron la vacuna conjugada para neumococo.14
La bacteriemia por SA secundaria a un foco clínico de infección adecuadamente tratada y con el foco inicial drenado suele tener buen pronóstico. Sin embargo, la mediana de días transcurridos hasta la resolución de la bacteriemia es, en la literatura, de 5 días. En el estudio presentado, se observó mayor frecuencia de bacteriemia persistente en los niños con SAMR vs. SAMS.
La aparición de focos secundarios de infección en los niños con SAMR, probablemente, esté relacionada con la mayor exposición a hemocultivos positivos, producción de toxinas y el retraso en el inicio del tratamiento adecuado en los niños con infecciones por este germen.13,15
Diferentes estudios han intentado relacionar el peor pronóstico de las infecciones con la resistencia antibiótica de SA.16,17 Wang et al.,18 en un estudio realizado en adultos, no observaron diferencias en la duración de la internación ni en la mortalidad a los 30 días en los pacientes con infecciones por SAMS vs. SAMR.
Cuando se evalúan los pacientes con infecciones graves por SAMR, algunos autores plantean que aquellos con CIM para vancomicina más altas tendrían peor pronóstico.19 Un metaanálisis publicado en 2014, que comparó la evolución de los pacientes con bacteriemia por SAMR, no pudo demostrar asociación entre la CIM para vancomicina menor o mayor de 1,5 ug/L y la mortalidad.20
En el presente estudio, no se ajustó el análisis por gravedad ni por retraso en el tratamiento definitivo; sin embargo, es llamativo que todos los fallecidos estuvieron en el grupo SAMR.
Las recomendaciones para el tratamiento de las infecciones graves por SA son cefalosporinas de primera generación, como cefalotina, cuando se constata la sensibilidad a la meticilina y la vancomicina si se trata de SAMR.21 En las regiones donde la resistencia a la clindamicina es menor del 15%, esta sería una alternativa de tratamiento. Durante los cinco años en los que se enrolaron pacientes en esta cohorte, la resistencia a la clindamicina fue menor del 9%. En otros estudios en los que se incluyeron infecciones por SA intrahospitalarias y asociadas al cuidado de la salud, la frecuencia de resistencia a la clindamicina fue mayor.6,8
El uso de clindamicina para el tratamiento de bacteriemia secundaria a focos osteoarticulares ha sido documentado en estudios. Martínez Aguilar et al.22 reportaron 53 infecciones invasivas por SAMR-ac (que incluyeron bacteriemia, neumonía, osteomielitis, artritis séptica) que fueron adecuadamente tratadas con clindamicina y concluyeron que era efectiva para el tratamiento de las infecciones invasivas por SA. La clindamicina se postula como tratamiento útil ante la presencia de cuadros clínicos mediados por la acción de toxinas, como neumonía y fascitis necrotizante. Sin embargo, esta recomendación es opinión de expertos y se basa en estudios in vitro y en modelos en animales.23
Las recomendaciones de la Sociedad Americana de Infectología para el tratamiento de las infecciones invasivas, según el tipo de infección, los antecedentes del paciente y el cuadro clínico, sugieren vancomicina o clindamicina por SAMR-ac.22 Se reserva el uso de clindamicina para los niños sin compromiso hemodinámico y con bacteriemias secundarias. En la presente cohorte, el 21% de los niños fueron tratados con clindamicina, con buena evolución clínica.
Se describe, en la literatura, una mortalidad relacionada con la infección por SAMR de entre el 0,7%24 y el 1,4%.11 La letalidad de esta infección es mucho menor que la descrita en adultos, en quienes la mortalidad alcanza el 40% de las infecciones graves. El tratamiento inicial adecuado incluye tanto el tratamiento antibiótico correcto como el drenaje de los focos supurados.25
En esta cohorte, fueron excluidos los niños con antecedentes de internación y de contacto frecuente con el hospital para mejorar la validez externa de los hallazgos; sin embargo, por haber sido una investigación desarrollada en un centro de tercer nivel de atención, no pueden generalizarse las conclusiones.
Otra limitante para tener en cuenta es que, por las características del diseño de cohorte, no puede establecerse con certeza que las diferencias encontradas en la evolución de los pacientes con SAMS vs. SAMR sean exclusivamente secundarias a la resistencia antibiótica. Se requieren estudios estratificados por grupos de riesgo para obtener más información.
Una de las principales fortalezas del presente estudio es su característica prospectiva y su tiempo de duración. Si hubiese existido algún cambio estacional, habría sido registrado, dado que los pacientes fueron enrolados durante 5 años en forma consecutiva.
Otra fortaleza en cuanto al diagnóstico de la resistencia antibiótica consiste en que el Laboratorio de Microbiología determina la sensibilidad de todos los aislamientos de SA por difusión colocando los discos de eritromicina y clindamicina de manera estratégica para detectar la resistencia inducible a clindamicina. Además, en todos los casos, se determinó la CIM a la vancomicina para detectar cepas con heterorresistencia a dicha droga.
La elección del tratamiento antibiótico empírico para los pacientes con infecciones de la piel y las partes blandas que requieren internación, y en los que se sospecha bacteriemia, depende de los patrones de sensibilidad a la meticilina y a la clindamicina en cada región.
De acuerdo con los resultados reportados en estudios anteriores6,7 y en el actual, la clindamicina constituye una alternativa para los pacientes en los que se sospechan infecciones por SAMR-ac y sin sepsis grave. La vancomicina se reserva para los niños con infecciones por SAMR-ac graves, bacteriemia persistente y sospecha de foco endovascular. Debe considerarse el tratamiento efectivo para el SAMR-ac en esquema empírico de las infecciones graves en niños procedentes de la comunidad (neumonía grave que requiere UCI y el shock séptico).
CONCLUSIONES
En la cohorte estudiada, predominaron las infecciones por SA con resistencia a la meticilina. La resistencia a la clindamicina se mantuvo estable en los 5 años observados y fue menor del 9%. Las infecciones por SAMR-ac predominaron en niños sanos.
Los pacientes con infecciones por SAMR presentaron con más frecuencia bacteriemia persistente, requerimientos de UCI y cirugía que los niños con SAMS.
Se requiere mantener la vigilancia epidemiológica para conocer cambios en el patrón de sensibilidad a los antibióticos de SA y elaborar recomendaciones adaptadas a la epidemiología local.
1. Galiana Villar A. Infección por Staphylococcus aureus meticilino resistente adquirido en la comunidad. Arch Pediatr Urug 2003;74(1):26-9. [ Links ]
2. Paganini HR. Staphylococcus aureus. En: Paganini HR, ed. Infectología pediátrica. Buenos Aires: Científica Interamericana; 2007.Págs.955-61.
3. Comité Nacional de Infectología. Infecciones de piel y partes blandas en pediatría: consenso sobre diagnóstico y tratamiento. Parte 2: Celulitis, ectima y ectima gangrenoso, celulitis necrotizantes. Consideraciones finales. Arch Argent Pediatr 2014;112(2):183-91.
4. Morin CA, Hadler JL. Population-based incidence and characteristics of community-onset Staphylococcus aureus infections with bacteremia in 4 metropolitan Connecticut areas, 1998. J Infect Dis 2001;184(8):1029-34.
5. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Five Informational Supplement (M100-S25). Wayne: CLSI; 2015.
6. Paganini H, Della Latta MP, Muller Opet B, Ezcurra G, et al. Estudio multicéntrico sobre las infecciones pediátricas por Staphylococcus aureus meticilino-resistente provenientes de la comunidad en la Argentina. Arch Argent Pediatr 2008;106(5):397-403.
7. Egea AL, Gagetti P, Lamberghini R, Faccone D, et al. New patterns ofmethicillin-resistant Staphylococcus aureus (MRSA) clones, community-associated MRSA genotypes behave like healthcare-associated MRSA genotypes within hospitals, Argentina. Int J Med Microbiol 2014;304(8):1086-99.
8. Ves Losada JE, Graziano AP, De Abreu M, Blanco M, et al. Infecciones graves por Staphylococcus aureus: características clínicas, sensibilidad antibiótica y uso de antimicrobianos. Serie de casos. Arch Argent Pediatr 2014;112(4):e152-5.
9. Sattler CA, Mason EO Jr, Kaplan SL. Prospective comparison of risk factors and demographic and clinical characteristics of community-acquired, methicillin-resistant versus methicillin-susceptible Staphylococcus aureus infection in children. Pediatr Infect Dis J 2002;21(10):910-7.
10. Miller LG, Perdreau-Remington F, Bayer AS, Diep B, et al. Clinical and epidemiologic characteristics cannot distinguish community-associated methicillin-resistant Staphylococcus aureus infection from methicillin-susceptible S. aureus infection: a prospective investigation. Clin Infect Dis 2007;44(4):471-82.
11. Suryati BA, Watson M. Staphylococcus aureus bacteraemia in children: a 5-year retrospective review. J Paediatr Child Health 2002;38(3):290-4.
12. Denniston S, Riordan FA. Staphylococcus aureus bacteraemia in children and neonates: a 10 year retrospective review. J Infect 2006;53(6):387-93.
13. Vidal PM, Trindade PA, Garcia TO, Pacheco RL, et al. Differences between "classical" risk factors for infections caused by methicillin-resistant Staphylococcus aureus (MRSA) and risk factors for nosocomial bloodstream infections caused by multiple clones of the staphylococcal cassette chromosome mec type IV MRSA strain. Infect Control Hosp Epidemiol 2009;30(2):139-45.
14. Machado K, López A, Pacheco H, Algorta G, et al. Características del empiema paraneumónico luego del inicio de la vacunación antineumocócica: Centro Hospitalario Pereira Rossell, año 2010. Arch Pediatr Urug 2014;85(4):212-9.
15. Boucher H, Miller LG, Razonable RR. Serious infections caused by methicillin-resistant Staphylococcus aureus. Clin Infect Dis 2010;51(Suppl 2):S183-97.
16. Al-Nammari SS, Bobak P, Venkatesh R. Methicillin resistant Staphylococcus aureus versus methicillin sensitive Staphylococcus aureus adult haematogenous septic arthritis. Arch Orthop Trauma Surg 2007;127(7):537-42.
17. Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, et al. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis. Clin Infect Dis 2003;36(1):53-9.
18. Wang JL, Chen SY, Wang JT, Wu GH, et al. Comparison of both clinical features and mortality risk associated with bacteremia due to community-acquired methicillin-resistant Staphylococcus aureus and methicillin-susceptible S. aureus. Clin Infect Dis 2008;46(6):799-806.
19. Jacob JT, Diaz Granados CA. High vancomycin minimum inhibitory concentration and clinical outcomes in adults with methicillin-resistant Staphylococcus aureus infections: a meta-analysis. Int J Infect Dis 2013;17(2):e93-e100.
20. Kalil AC, Van Schooneveld TC, Fey PD, Rupp ME. Association between vancomycin minimum inhibitory concentration and mortality among patients with Staphylococcus aureus bloodstream infections: a systematic review and meta-analysis. JAMA 2014;312(15):1552-64.
21. Liu C, Bayer A, Cosgrove SE, Daum RS, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary. Clin Infect Dis 2011;52(3):285-92.
22. Martinez-Aguilar G, Hammerman WA, Mason EO Jr, Kaplan SL. Clindamycin treatment of invasive infections caused by community-acquired, methicillin-resistant and methicillin-susceptible Staphylococcus aureus in children. Pediatr Infect Dis J 2003;22(7):593-8.
23. Stevens DL, Ma Y, Salmi DB, McIndoo E, et al. Impact of antibiotics on expression of virulence-associated exotoxin genes in methicillin-sensitive and methicillin-resistant Staphylococcus aureus. J Infect Dis 2007;195(2):202-11.
24. Asgeirsson H, Gudlaugsson O, Kristinsson KG, Vilbergsson GR, et al. Low mortality of Staphylococcus aureus bacteremia in Icelandic children: nationwide study on incidence and outcome. Pediatr Infect Dis J 2015;34(2):140-4.
25. López-Cortés LE, Del Toro MD, Gálvez-Acebal J, Bereciartua-Bastarrica E, et al. Impact of an evidence-based bundle intervention in the quality-of-care management and outcome of Staphylococcus aureus bacteremia. Clin Infect Dis 2013;57(9):1225-33.











 text in
text in 


