Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.114 no.6 Buenos Aires dic. 2016
http://dx.doi.org/10.5546/aap.2016.549
COMUNICACIONES BREVES
http://dx.doi.org/10.5546/aap.2016.549
Inmunidad humoral a tétanos, sarampión y rubéola en niños con leucemia linfoblástica aguda luego del tratamiento quimioterápico
Dra. Myriam Onoratelia, Dra. Claudia Botanaa, Dra. Laura Peraltaa, Dra. Magali Rebolloa, Dra. Silvina Ruvinskya, Dra. Myriam Guittera, Dra. Maria S. Felicea, Dra. Mercedes Posadasa, Dra. Silvina Evangelistaa, Dra. Maria V. Villara, Dra. Mariana Golluscioa, Dra. Agustina Molinaa y Dra. Lidia Fraquellia
a. Hospital de Pediatría SAMIC "Prof. Dr. Juan P. Garrahan", Ciudad de Buenos Aires.
Correspondencia: Dra. Myriam Onoratelli, onoratelli@yahoo.com.ar
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 13-12-2015
Aceptado: 28-7-2016
RESUMEN
Los regímenes de quimioterapia y los avances en el soporte clínico han mejorado la supervivencia de los niños con leucemia linfoblástica aguda. Son temas de preocupación las secuelas del tratamiento, entre ellas, el daño inmunológico inducido por la terapia inmunosupresora, que se refleja en la pérdida de niveles protectores de anticuerpos provistos por inmunizaciones previas.
Nuestro objetivo fue evaluar la presencia de títulos protectores de anticuerpos para sarampión, rubéola y tétanos en pacientes con leucemia linfoblástica aguda luego de haber finalizado el tratamiento quimioterápico.
Se incluyeron 61 niños con leucemia linfoblástica aguda asistidos en el Hospital Garrahan, que habían finalizado el tratamiento, como mínimo, 6 meses antes y con vacunación completa previa al diagnóstico. Las tasas de anticuerpos protectores fueron sarampión: 46% (IC 32-59); tétanos: 53% (IC 40-67); rubéola: 60% (IC 47-63).
Estos resultados refuerzan la necesidad de reconsiderar la revacunación en este grupo de pacientes.
Palabras clave: Leucemia linfoblástica aguda; Inmunizaciones; Inmunidad humoral; Anticuerpos; Quimioterapia.
INTRODUCCIÓN
En las últimas dos décadas, los regímenes intensificados de la quimioterapia y los avances en la implementación del soporte clínico lograron mejorar la supervivencia de los niños con leucemia linfoblástica aguda (LLA).1
El número creciente de sobrevivientes plantea un desafío para los pediatras, especialmente en relación con el desarrollo de secuelas secundarias al tratamiento. Entre ellas, se encuentra el daño inmunológico inducido por la terapia inmunosupresora. Los niños con LLA tratados con quimioterapia sufren una inmunosupresión humoral y celular que puede durar meses o años después de haber finalizado el tratamiento.2-4
Las inmunizaciones constituyen una medida sumamente importante en la prevención de enfermedades infecciosas transmisibles. En este contexto, resulta relevante conocer el nivel de protección para enfermedades prevenibles por vacunas en estos pacientes, que recibieron las inmunizaciones en forma oportuna y luego realizaron quimioterapia.
Existe poca evidencia en la literatura acerca de la recuperación de los niveles protectores de anticuerpos provistos por inmunizaciones previas en los niños tratados por LLA que finalizaron tratamiento quimioterápico. Los estudios publicados difieren en los resultados reportados, de modo que no es posible realizar una recomendación definitiva sobre una política de revacunación.5 En nuestro medio, no existen datos publicados sobre este tema.
El objetivo de este estudio fue evaluar la presencia de títulos protectores de anticuerpos para sarampión, rubéola y tétanos en pacientes con LLA luego de haber finalizado el tratamiento quimioterápico.
POBLACIÓN Y MÉTODOS
Realizamos un estudio descriptivo y observacional, de corte transversal.
Se incluyeron 61 pacientes con diagnóstico de LLA asistidos en el Hospital de Pediatría "Prof. Dr. Juan P. Garrahan" durante el período comprendido entre junio de 2008 y enero de 2013. Los criterios de inclusión fueron haber recibido tratamiento de primera línea según el protocolo en curso, niños de entre 1 y 17 años en el momento del diagnóstico, haber transcurrido entre 6 y 18 meses luego de haber finalizado el tratamiento al momento del estudio y que tuvieran vacunación completa, según el Calendario Nacional de Vacunación.
Los pacientes incluidos aceptaron participar en forma voluntaria e informada, mediante consentimiento y asentimiento si correspondía.
El tratamiento recibido fue el Protocolo 11-ALLIC/BFM-2002.6 Los pacientes se clasificaron en tres grupos de riesgo (estándar, intermedio y alto) de acuerdo con parámetros clínicos, biológicos y respuesta al tratamiento. El tratamiento administrado difirió en intensidad según los grupos de riesgos.
El cumplimiento de la vacunación se corroboró con el carnet de vacunas.
Se excluyeron aquellos niños que habían recibido los refuerzos correspondientes por la edad para tétanos, sarampión o rubéola luego de la finalización de la quimioterapia, pacientes con alteraciones de la inmunidad previas al diagnóstico de LLA y aquellos que no habían recibido algún refuerzo correspondiente a la edad por estar bajo quimioterapia.
Las principales variables de resultado fueron los títulos de anticuerpos para rubéola, sarampión y tétanos obtenidos luego del ingreso al estudio.
El dosaje de anticuerpos se realizó después de 6 a 18 meses de haber finalizado la quimioterapia, por lo que la situación se definió como "ausencia" de niveles protectores y no de "pérdida", ya que no se realizó el dosaje previo a la quimioterapia. Si bien estos resultados no se compararon con los niveles de anticuerpos previos al tratamiento quimioterápico, se tuvo en cuenta que, en la población general con esquema de vacunación completa, la prevalencia de niveles protectores de anticuerpos contra las enfermedades estudiadas fue entre el 90% y el 95%.7-10
Los dosajes de inmunoglubulina G (IgG) para rubéola se determinaron mediante un método cuantitativo basado en enzimoinmunoensayo de micropartículas (microparticle enzyme immunoassay; MEIA, por sus siglas en inglés) de Laboratorios Abbott®.
Para el dosaje de IgG para sarampión, se utilizó un método cualitativo que asociaba el método inmunoenzimático sandwich en dos etapas a una detección final por fluorescencia (enzyme linked fluorescent assay; ELFA, por sus siglas en inglés) de Laboratorios Biomerieux®.
El dosaje de títulos de anticuerpos para toxoide tetánico se realizó en el laboratorio de inmunología utilizando el test de ensayo por inmunoabsorción ligado a enzimas (enzyme-linked immunosorbent assay; ELISA, por sus siglas en inglés).
Adicionalmente, se consignó, en cada caso, edad del niño al momento del diagnóstico, tiempo (en meses) trascurrido desde la finalización de la quimioterapia y grupo de riesgo de LLA.
En todos los casos, se realizó una única determinación a través de una extracción de sangre por venopunción solicitada junto con el control oncológico que habitualmente se realiza en estos pacientes. No se realizaron extracciones adicionales para este estudio.
El estudio fue aprobado para su desarrollo por el Comité Revisor de Investigación y el Comité de Ética Hospitalario.
Análisis estadístico
Para el análisis descriptivo de las variables continuas, se usaron, como medidas de resumen, media, mediana y desvío estándar, según correspondiera a la distribución de los datos. Las variables categóricas se midieron en valor absoluto y porcentual.
Las tasas de protección se expresaron como porcentajes e IC 95% para reportar la precisión del valor obtenido.
Además, se analizó la relación entre la presencia o no de títulos protectores y grupos de riesgos de LLA, edad en el momento del diagnóstico y tiempo de finalizado el tratamiento. Para el análisis, se utilizó el programa estadístico STATA 9.0 (StataCorp USA).
RESULTADOS
Ingresaron al estudio 61 niños, 31 mujeres y 30 varones. En la Tabla 1, se describen las principales características de la población.
Tabla 1. Características generales de la población evaluada (n= 61)

La tasa de anticuerpos protectores fue, para sarampión, 46% (IC 95%: 32-59); para tétanos, 53% (IC 95%: 40-67); y, para rubéola, 60% (IC 95%: 47-63).
La presencia de anticuerpos protectores según los grupos de riesgo fue la siguiente:
- para sarampión, en el 53% de los pacientes de riesgo estándar, 50% de los de riesgo intermedio y ninguno de los 6 pacientes de riesgo alto.
- para rubéola, en el 53% de los niños de riesgo estándar, 65% de los de riesgo intermedio y 50% de los de riesgo alto.
- para tétanos, en el 53% de los niños de riesgo estándar, 57% de los correspondientes a riesgo intermedio y 33% de los de riesgo alto.
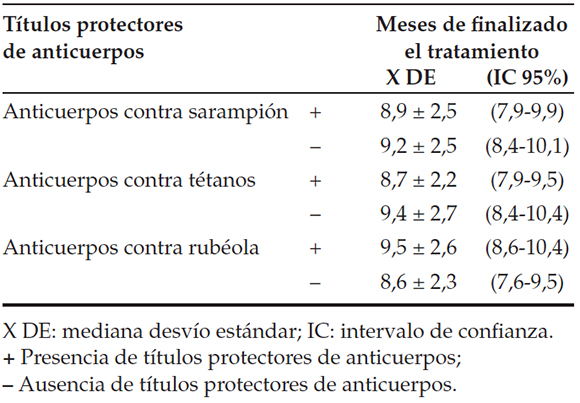
En el análisis descriptivo de nuestros resultados, no se observó diferencia entre la presencia de anticuerpos protectores y la mediana de edad en el momento del diagnóstico o la mediana en meses de tiempo transcurrido luego de haber finalizado el tratamiento (Tablas 2 y 3).
Tabla 2. Presencia de títulos protectores para sarampión, rubéola y tétanos según edad al momento del diagnóstico (n= 61)
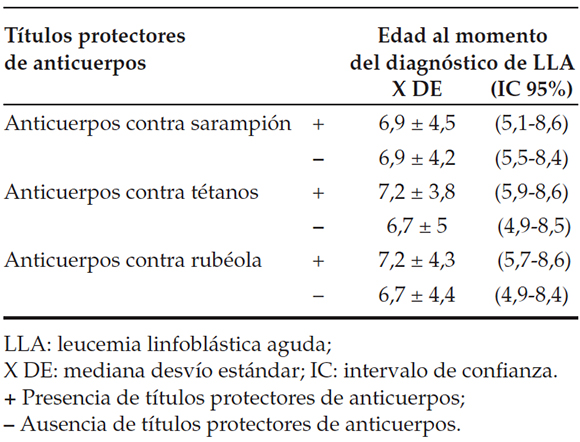
Tabla 3. Presencia de títulos protectores para sarampión, rubéola y tétanos según meses de finalizado el tratamiento quimioterápico (n= 61)
DISCUSIÓN
En nuestro estudio, se observó que, dependiendo del anticuerpo evaluado, entre el 40% y el 54% de los niños con diagnóstico de LLA, que cumplieron tratamiento quimioterápico convencional, carecían de anticuerpos protectores para sarampión, rubéola y tétanos, inmunizaciones recibidas según el Calendario Nacional de Vacunación, antes de comenzar el tratamiento.
Los niños con LLA tratados con quimioterapia sufren una inmunosupresión humoral y celular que puede durar meses o años después de haber finalizado el tratamiento.2-4 La inmunidad humoral expresada por la función de células B puede ser evaluada midiendo los niveles séricos de inmunoglobulinas. Se ha observado que, al finalizar la quimioterapia, estos niveles están cercanos al percentilo 10 y alcanzan valores normales dentro de los 6 meses de haber finalizado el tratamiento inmunosupresor.2,4
Sin embargo, existe poca evidencia en la literatura acerca de la recuperación de los niveles protectores de anticuerpos provistos por inmunizaciones recibidas previamente al tratamiento quimioterápico.
Nilsson et al.,11 analizaron los niveles de anticuerpos en 43 niños después de la quimioterapia y demostraron la persistencia de los niveles de protección contra el sarampión y la rubéola en el 60% y el 72% de los pacientes, respectivamente. Brodtman et al.,12 estudiaron los títulos de anticuerpos para varias vacunas en 100 niños con LLA y observaron que el porcentaje de niños con LLA que tenían títulos protectores fue notablemente inferior al previsto para los sujetos de control inmunizados. En el estudio de Von der Hardt et al.,13 más de 50% de los pacientes carecían de inmunidad protectora contra la difteria y tétanos después del tratamiento quimioterápico.
Los estudios publicados difieren en los resultados y, si bien muchos de ellos demuestran reducción en los niveles protectores de anticuerpos, en algunos, se cuestiona su diseño.
En la única revisión sistemática realizada por Van Tilburg et al.,5 los resultados fueron presentados en rangos de valores de tasas de protección, lo que parecía apropiado dada la diversidad de los estudios. El amplio rango en niveles de anticuerpos protectores entre los estudios, que puede ser explicado por su heterogeneidad y el tamaño limitado en la muestra, no permitió realizar un metaanálisis. Por lo tanto, no se pudo adoptar una recomendación definitiva sobre una política de revacunación.5
En el Reino Unido y en España, se recomienda la administración de una dosis de refuerzo de las vacunas recibidas luego de 6 meses de haber finalizado el tratamiento quimioterápico. Estas recomendaciones se basan, principalmente, en la opinión de expertos y un número limitado de estudios publicados.14,15
Algunos estudios han demostrado que, en los pacientes de menor edad, se observa una mayor incidencia de disminución en los niveles de anticuerpos protectores.11
En el análisis descriptivo de nuestros resultados, no se observó diferencia entre la presencia de anticuerpos protectores y la mediana de edad al momento del diagnóstico o la mediana en meses de tiempo transcurrido luego de haber finalizado el tratamiento.
Con respecto a los grupos de riesgo de LLA, si bien se describe el porcentaje de anticuerpos protectores en los diferentes grupos de riesgo, una de las limitaciones de estos resultados es que, en el grupo de alto riesgo, solo tuvimos 6 pacientes.
Por lo tanto, si bien se observó que ninguno de los pacientes de alto riesgo tenía anticuerpos protectores para sarampión, el tamaño pequeño de la muestra no permite detectar una diferencia significativa.
Es interesante resaltar que, aún los pacientes de riesgo estándar, no presentaron anticuerpos protectores en un alto porcentaje.
Por lo tanto, los resultados hallados refuerzan la necesidad de reconsiderar las políticas de revacunación en los pacientes que reciben tratamientos de quimioterapia para LLA, aún de aquellos que pertenecen a los grupos de riesgo estándar o intermedio y reciben tratamientos de menor intensidad, y, sin dudas, especialmente en el grupo de pacientes de alto riesgo, que reciben esquemas de mayor intensidad.
Agradecimientos
Se agradece la colaboración en la confección y realización de este trabajo a la Dra. Susana Patricia Rodríguez* y a la Dra. Stella Carchio.**
* Directora asociada de Docencia e Investigación, Hospital de Pediatría SAMIC Prof. Dr. Juan P. Garrahan.
** Jefa de Área de Laboratorio.
1. Smith MA, Ries LA. Childhood cancer: incidence, survival, and mortality. In: Pizzo PA, Poplack DG, eds. Principles and practice of pediatric oncology. 4th ed. Philadelphia: Lippincott-Williams and Wilkins; 2002.Págs.1-12. [ Links ]
2. Alanko S, Pelliniemi TT, Salmi TT. Recovery of blood B-lymphocytes and serum immunoglobulins after chemotherapy for childhood acute lymphoblastic leukemia. Cáncer 1992;69(6):1481-6. [ Links ]
3. Alanko S, Salmi TT, Pelliniemi TT. Recovery of blood T-cell subsets after chemotherapy for childhood acute lymphoblastic leukemia. Pediatr Hematol Oncol 1994;11(3):281-92. [ Links ]
4. Mustafa MM, Buchanan GR, Winick NJ, McCracken GH, et al. Immune recovery in children with malignancy after cessation of chemotherapy. J Pediatr Hematol Oncol 1998;20(5):451-7. [ Links ]
5. Van Tilburg CM, Sanders EA, Rovers MM, Wolfs TF, et al. Loss of antibodies and response to (re-)vaccination in children after treatment for acute lymphocytic leukemia: a systematic review. Leukemia 2006;20(10):1717-22. [ Links ]
6. Stary J, Zimmermann M, Campbell M, Castillo L, et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia:results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol 2014;32(3):174-84. [ Links ]
7. Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Estudio seroepidemiológico: situación de las enfermedades vacunables en España. Madrid. Ministerio de Sanidad y Consumo; 2000. [ Links ]
8. Pachón I, Amela C, De Ory F. Age specific seroprevalence of poliomyelitis, diphtheria and tetanus antibodies in Spain. Epidemiol Infect 2002;129(3):535-41. [ Links ]
9. Pedranti MS, Adamo MP, Macedo R, Zapata MT. Prevalencia de anticuerpos antirrubéola y antiparvovirus B19 en embarazadas de la ciudad de Córdoba y en mujeres en edad fértil de la ciudad de Villa Mercedes, San Luis. Rev Argent Microbiol 2007;39(1):47-50. [ Links ]
10. Pichichero ME, Anderson El, Rennels MB, Edwards KM, et al. Fifth vaccination with diphtheria, tetanus and acellular pertussis is beneficial in four- to six-year-olds. Pediatr Infect Dis J 2001;20(4):427-33. [ Links ]
11. Nilsson A, De Milito A, Engstrom P, Nordin M, et al. Current chemotherapy protocols for childhood acute lymphoblastic leukemia induce loss of humoral immunity to viral vaccination antigens. Pediatrics 2002;109(6):e91. [ Links ]
12. Brodtman DH, Rosenthal DW, Redner A, Lanzkowsky P, et al. Immunodeficiency in children with acute lymphoblastic leukemia after completion of modern aggressive chemotherapeutic regimens. J Pediatr 2005;146(5):654-61. [ Links ]
13. Von der Hardt K, Jüngert J, Beck JD, Heininger U. Humoral immunity against diphtheria, tetanus and poliomyelitis after antineoplastic therapy in children and adolescents--a retrospective analysis. Vaccine 2000;18(26):2999-3004. [ Links ]
14. Royal College of Paediatrics and Child Health (RCPCH). Immunization of the immunocompromised child: Best Practice Statement. United Kingdom: RCPCH; 2002. [ Links ]
15. Mellado Peña MJ, Moreno-Pérez D, Ruíz Contreras J, Hernández- Sampelayo Matos, et al. Documento de consenso de la Sociedad Española de Insectología Pediátrica y el Comité Asesor de Vacunas de la Asociación Española de Pediatría para la vacunación en inmunodeprimidos. An Pediatr (Barc) 2011;75(6):413.e1-22. [ Links ]











 texto en
texto en 


