Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.115 no.3 Buenos Aires June 2017
http://dx.doi.org/10.5546/aap.2017.262
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2017.262
Niveles de cortisol en la saliva y séricos en recién nacidos
Dra. María V. Forclaza, Dr. Eduardo Morattob, Dra. Alicia Pennisic, Dra. Silvina Falcoc, Dra. Graciela Olsenc, Dra. Patricia Rodríguezb, Dra. Regina Papaziana y Dr. Ignacio Bergadád
a. Endocrinología Pediátrica, Servicio de Pediatría, Hospital Nacional Prof. Dr. A. Posadas, Buenos Aires, Argentina.
b. Laboratorio de Endocrinología, Servicio de Laboratorio, Hospital Nacional Prof. Dr. A. Posadas, Buenos Aires, Argentina.
c. Servicio de Neonatología, Hospital Nacional Prof. Dr. A. Posadas, Buenos Aires, Argentina.
d. Departamento de Endocrinología, Hospital de Niños Dr. Ricardo Gutiérrez, Buenos Aires, Argentina.
Correspondencia: Dra. María V. Forclaz, mforclaz@intramed.net
Financiamiento: Dosaje de CBG financiada por Biodiagnóstico S. A.
Conflicto de intereses: Ninguno que declarar.
Recibido: 7-4-2016
Aceptado: 22-12-2016
RESUMEN
Introducción. Dada la dificultad en la interpretación de los valores de cortisol sérico en recién nacidos (RN), el objetivo de este estudio fue correlacionar los niveles basales de cortisol en el suero y la saliva, y describir las concentraciones de cortisol salival durante el primer mes de vida.
Población y métodos. Estudio descriptivo, prospectivo, longitudinal y de correlación. Se seleccionaron RN de término del Servicio de Neonatología del Hospital Nacional Profesor Alejandro Posadas en 2014. En la saliva, se determinó cortisol; en la sangre, cortisol, globulina tansportadora de cortisol y albúmina. Se utilizó la correlación lineal para relacionar cortisol sérico y salival; el test de Friedman para comparar el cortisol durante el primer mes de vida y la diferencia para analizar el comportamiento de valores iguales o inferiores al primer cuartil.
Resultados. Se evaluaron 55 RN. Cortisol sérico: 7,65 (1,0-18,1 gg/dl); cortisol salival: 35,88 (5,52107,64 nmol/L); globulina transportadora de cortisol: 22,07 (16,5-33,0 gg/μL), expresados como mediana y rango. El coeficiente de correlación entre el cortisol sérico y salival fue de 0,54; P= 0,001. El comportamiento del cortisol durante el primer mes de vida no mostró diferencias estadísticamente significativas y la diferencia entre la segunda y la primera muestra de valores iguales o inferiores al primer cuartil aumentó en 10 de 12 pacientes.
Conclusión. La determinación de cortisol en la saliva refleja la concentración de cortisol sérico en RN normales. Algunos pacientes presentaron niveles bajos de cortisol a las 36 h de vida y mostraron una tendencia a incrementarse espontáneamente durante el primer mes de vida.
Palabras clave: Recién nacido; Cortisol en saliva; Cortisol sérico.
INTRODUCCIÓN
La activación del eje hipotálamo-hipofisoadrenal con la liberación de cortisol es crítica para mantener la homeostasis en respuesta al estrés.1 Más del 80% de la corteza de la glándula adrenal en el feto está constituida por la zona fetal que sintetiza, predominantemente, sulfato de dehidroepiandrosterona1 y bajas concentraciones de cortisol, que se explican por la reducida actividad de la enzima 3-p ol-deshidrogenasa.1-3 Luego del nacimiento, la corteza fetal involuciona de modo paulatino y, concomitantemente, se observa un aumento en la actividad de la enzima 3-p ol-deshidrogenasa.
Los niveles de cortisol sérico en RN sanos suelen ser bajos, en un rango similar a los observados en aquellos con deficiencia hormonal. Esto dificulta el diagnóstico en niños con baja sospecha clínica de insuficiencia adrenal, lo que limita su valor diagnóstico y obliga a realizar la terapia de reemplazo con diagnóstico incierto. Sin embargo, se ha descrito que la fracción de hormona libre tiende a ser similar a la observada en adultos, aparentemente, secundaria a una baja concentración sérica de la globulina transportadora de cortisol (cortisol-binding globulin; CBG, por sus siglas en inglés).4,5 El cortisol en la saliva es un marcador confiable de la actividad del eje hipotálamo-hipofisoadrenal; se correlaciona con el cortisol plasmático y refleja el cortisol libre plasmático.6 La muestra de saliva es relativamente fácil para recolectar con una técnica no invasiva.6,7 Para obtener cantidad suficiente de saliva en recién nacidos (RN), se han utilizado diferentes estimulantes: ácido cítrico4,7,8 o jugo de limón.
En neonatos, ha sido demostrada la correlación entre los valores de sangre y saliva en muestras procesadas por métodos radioinmunométricos.9 La determinación del cortisol en la saliva facilitó la exploración del ritmo circadiano suprarrenal en RN y lactantes,4,10 y la investigación de la influencia del estrés en neonatos en Cuidados Intensivos y del contacto cercano con la madre.6,11
OBJETIVO
1. Correlacionar los niveles basales de cortisol en el suero y la saliva.
2. Analizar los niveles de cortisol en la saliva en muestras seriadas durante el primer mes de vida de recién nacidos de término (RNT) sanos.
MATERIAL Y MÉTODOS
Diseño: descriptivo, prospectivo, longitudinal y de correlación.
Este estudio fue aprobado por el Comité de Ética del Hospital Nacional Profesor Alejandro Posadas y el consentimiento informado fue obtenido por la firma de uno de los padres o el tutor del RN.
Población
El tamaño muestral se calculó sobre la base de trabajos previos. Para estimar con un nivel de confianza del 95% la media de cortisol salival matinal en RN, tomando como aceptable un error de 3 mmol/L y estimando una varianza de 72 nmol/L9 más una pérdida del 15% por diferentes motivos, deberían reincorporarse, al menos, 36 RN en el estudio.
Se seleccionaron los RNT sanos nacidos los días hábiles desde el 1 al 15 de marzo de 2014 en el Hospital Nacional Profesor Alejandro Posadas. Se incluyeron los hijos de madres sanas con embarazo normal, que nacieron por parto vaginal o cesárea, con puntaje de Apgar > 7 al primer minuto de vida, alimentados por vía oral y con examen físico normal. Se excluyeron aquellos que presentaron malformaciones congénitas, los hijos de madres que habían recibido tratamiento con corticoides y aquellos que no tenían, al menos, una hora de ayuno antes de la toma de la muestra. La edad gestacional (EG) se determinó por la fecha de última menstruación (FUM); en los casos en que fue incierta, por ecografía precoz y/o examen físico (Capurro) evaluado por 2 personas experimentadas. Se definió RNT a aquel que, por lo mencionado anteriormente, tenía ≥ 37 y < de 42 semanas de EG; RN de peso adecuado, si el peso de nacimiento (PN) estaba comprendido entre el pc 10 y 90 para la EG; RN de bajo peso, si el PN estaba debajo del pc 10 para la EG; y RN de alto peso, si el PN estaba sobre el pc 90 para la EG.12
Se consideraron como relevantes variables demográficas de la población: sexo del RN, peso de nacimiento (g), longitud corporal (cm), EG (semanas).
Muestras
Se les tomaron muestras de saliva (100 ^l) y de sangre periférica (1 μL) por punción venosa en días hábiles entre las 7:00 y las 8:00 de la mañana, después de las 36 horas de vida, que coincidió con la muestra solicitada para la pesquisa neonatal. En las muestras de saliva, se determinó cortisol y, en las de sangre periférica, cortisol total, CBG y albúmina. Las muestras de saliva se tomaron inmediatamente antes de la extracción de sangre, con 1 o más horas de ayuno. Para estimular la secreción de saliva, se colocaron sobre la lengua 2 gotas de ácido cítrico al 5%, 2 minutos antes de la toma de la muestra.4,7,8 Para evitar interferencias, se empleó el estimulante en todos y no solo en los cuales la recolección fue dificultosa.8 Se realizó una inspección suave de la boca con el objeto de minimizar el riesgo de contaminación con leche que pudiera interferir en el ensayo.13 La saliva se obtuvo por aspiración suave del piso de la boca con pipetas Pasteur de plástico blando y se colocó en tubos de plástico, que se conservaron congelados a -20 °C hasta su procesamiento.4 Las muestras de sangre periférica se colocaron en tubos secos, se centrifugaron y se conservaron congeladas a -20 °C hasta su procesamiento.
A aquellos que concurrieron a control dentro de los primeros 30 días de vida se les tomaron muestras adicionales de saliva en días diferentes, de 9:00 a 11:00 de la mañana.
Las determinaciones de cortisol sérico y en la saliva se realizaron utilizando inmunoensayos competitivos automatizados quimioluminiscentes en un analizador ACCESS (Beckman-Coulter),14 sin extracción previa,4,15 con un límite de detección de 0,4 μg/dl y 11,0 nmol/L, respectivamente, y coeficiente de variación interensayo e intraensayo de 6,0% y 2,14%. La concentración de la CBG se determinó por medio de un ensayo inmunorradiométrico (Diasource) con un límite de detección de 6,5 mg/L y un coeficiente de variación intraensayo e interensayo de 8,6% y 10,8%, respectivamente.
Los valores de cortisol sérico se expresaron en μg/dl; los de cortisol en la saliva, en nmol/L y μg/dl; y los de CBG, en mg/L.
Factores de conversion: nmol/L x 0,036= μg/d; μg/dl x 27,6= nmol/L.
Análisis estadístico
Los datos continuos se expresaron como media y mediana con sus respectivas dispersiones (desvío estándar -DE-/rango) y los categóricos, como números absolutos y medidas de frecuencia (porcentaje). La correlación entre el cortisol sérico y en la saliva fue evaluada usando el test de correlación lineal. Se consideraron diferencias significativas con valor p <0,05. Para comparar el comportamiento del cortisol sérico y en la saliva según la forma de finalización del embarazo, se utilizó el test de Mann-Whitney-Wilcoxon. Para comparar los 3 valores de cortisol en la saliva matinales no consecutivos durante el primer mes de vida, se utilizó el análisis de Friedman. El comportamiento de cortisol en la saliva de los pacientes con valores iguales o menores al primer cuartil en la primera muestra se analizó como la diferencia de los valores de cortisol en la saliva entre la segunda y la primera muestra.
RESULTADOS
Se evaluaron 55 RNT y citados para control y toma de muestras de saliva durante el primer mes de vida, como se observa en la Figura 1. Las características clínicas y los resultados se detallan en la Tabla 1.
Tabla 1. Características de la población estudiada
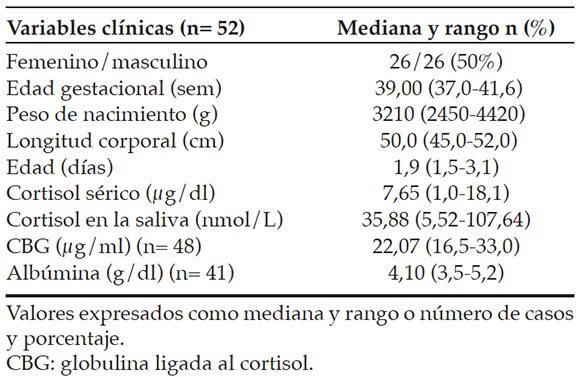
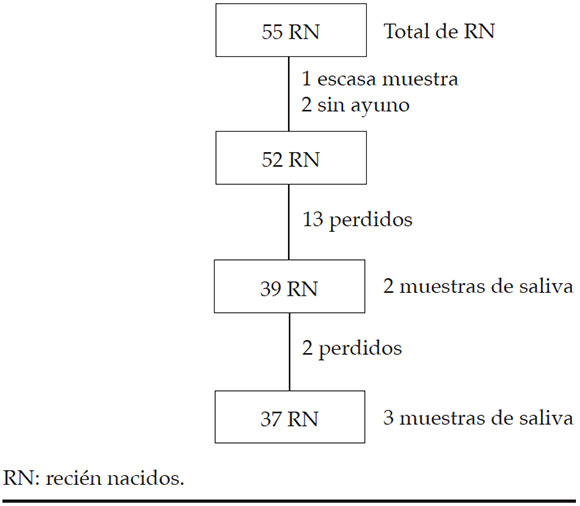
Figura 1. Flujograma de recién nacidos
Los resultados de la regresión lineal entre los niveles de cortisol sérico y en la saliva (r= 0,54; P= 0,001) se presentan en la Figura 2.
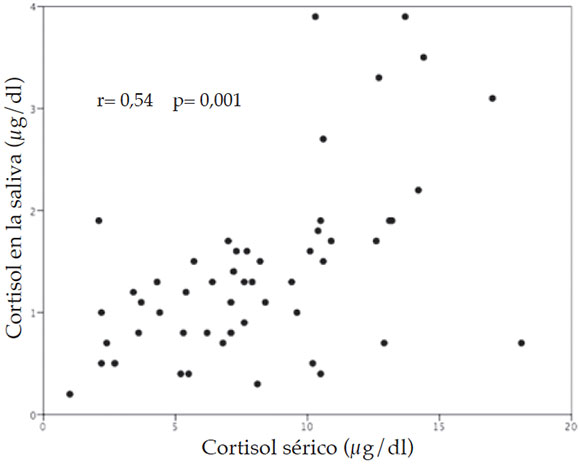
Figura 2. Correlación entre los niveles de cortisol sérico y en la saliva en 52 muestras basales de recién nacidos de término
De los 52 pacientes con muestras suficientes, 39 (75%) pudieron ser evaluados en más de una ocasión durante el primer mes de vida. La comparación de las mediciones de cortisol en la saliva matinal, no consecutivas durante el primer mes de vida se muestra en la Figura 3.
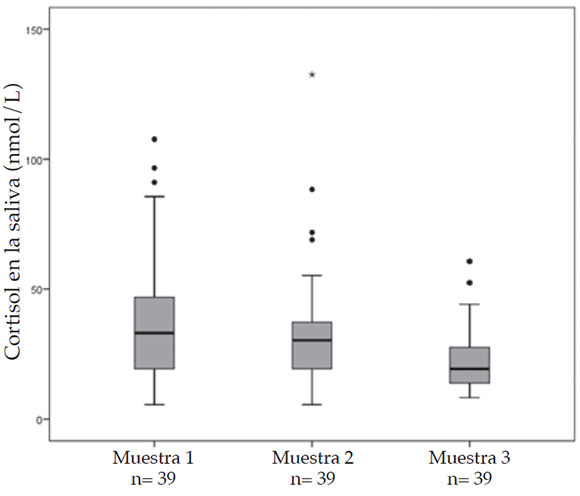
Figura 3. Niveles de cortisol en la saliva durante el primer mes de vida
En la muestra 1 (n= 39), obtenida a una mediana de edad de 1,9 días de vida (rango: 1,53,1), la mediana de cortisol en la saliva fue de 33,12 nmol/L (rango: 5,52-107,6); en la muestra 2 (n= 39), obtenida a una mediana de edad de 5 días de vida (rango: 3-20 nmol/L), la mediana de cortisol en la saliva fue de 30,3 nmol/L (rango: 5,52-132,48); y, en la muestra 3 (n= 37), obtenida a una mediana de edad de 16 días de vida (rango: 7-30), la mediana de cortisol en la saliva fue de 19,3 nmol/L (rango: 8,28-60,7). Los valores de cortisol en la saliva a lo largo del primer mes de vida no mostraron diferencias estadísticamente significativas (P= 0,99).
En 12 de 16 pacientes con valores de cortisol en la saliva iguales o menores al primer cuartil (22,0 nmol/L), se obtuvo una segunda muestra (Figura 4). La diferencia mostró una tendencia a aumentar en 10 pacientes, en 1 disminuyó y, en otro, se mantuvo igual.
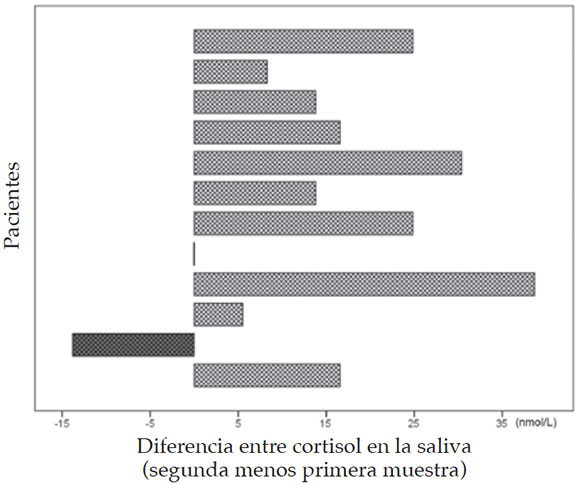
Figura 4. Comportamiento del cortisol en la saliva en 12 recién nacidos con valores iguales o menores al primer cuartil en la primera muestra (cada barra corresponde a un paciente)
La mediana de la CBG sérica fue de 22,07 μg/μL (rango: 16,5-33,0).
DISCUSIÓN
En este estudio prospectivo de RNT, se encontró una correlación entre el cortisol sérico y en la saliva. Esta fue de 0,54, lo cual está en concordancia con lo publicado por Maas y
col., quienes, en una revisión sistemática de la literatura, informaron que variaba entre 0,44 y 0,83.16 De los resultados obtenidos, se desprende que las concentraciones bajas de cortisol en el suero se corresponderían con bajas concentraciones en la saliva. Ello implica que, en condiciones fisiológicas, existiría una proporción de RN sanos que presentarían una "hipocortisolemia fisiológica", la cual podría correlacionarse con los niveles bajos de cortisol en la saliva. Estos hallazgos se encontraron asociados a concentraciones de CBG comparables a las de los adultos, a diferencia de lo publicado,8,16,17 lo cual confirmaría que algunos RN presentan una secreción baja de cortisol en esta etapa de la vida.6-8 Hadjian y col., demostraron, mediante equilibrio de diálisis y una técnica adsorbente, una menor capacidad en las proteínas del suero de ligar cortisol en RNT.7 Sin embargo, Scott y col., en una muestra de 120 RN prematuros, obtuvieron valores bajos de cortisol que no pudieron explicarlos por el déficit de CBG, ya que los valores de CBG medidos en 61 RN (16 ± 5 mg/L) estaban solo levemente debajo del rango adulto normal (19-45 mg/L).17
Los bajos niveles de cortisol sérico en algunos de estos niños, probablemente, correspondan a algún fenómeno de inmadurez o tiempos diferentes de involución de la zona fetal adrenal asociados a los bajos niveles de hormona adrenocorticotropina (adrenocorticotropic hormone; ACTH, por sus siglas en inglés) y de la 3-p ol-deshidrogenada, como ha sido descrito.1-3 Se ha postulado que la placenta humana sintetiza grandes cantidades de hormona liberadora de corticotropina (corticotropin-releasing hormone; CRH, por sus siglas en inglés), que es liberada a la circulación materna y fetal, lo que resulta en las concentraciones de CRH más altas de la vida. Después del parto, ocurre una disminución abrupta de CRH circulante. Frente a esas circunstancias, las hipótesis serían que el hipotálamo del RN no habría alcanzado la madurez suficiente para secretar CRH o que la hipófisis, habiendo estado expuesta a grandes cantidades de CRH, fuera transitoriamente refractaria a las bajas concentraciones producidas por el hipotálamo del RN.3
La mediana de cortisol sérico fue de 7,65 μg/dl (rango: 1-18,1) de muestras obtenidas de 7:00 a 8:00 con, al menos, 1 hora de ayuno, similares a las reportadas.4
En una muestra piloto de RNT entre los 2 y los 7 días de vida alimentados a libre demanda, se ha observado que las concentraciones de cortisol sérico obtenidas entre las 10:00 y las 11:00 fueron de 3,5 ± 2,3 μg/dl (media ± DE) y la mediana, de 2,7 μg/dl (rango: 0,7-11,5 μg/dl).18
La mediana de los valores de cortisol en la saliva fue similar a la reportada con mayor dispersión.4, 11 Esta variabilidad puede ser una limitante para el diagnóstico clínico definitivo de insuficiencia adrenal.
Cabe destacar que la utilización de ácido cítrico resultó útil para obtener muestras de saliva con cantidades adecuadas para procesar en la mayoría de los niños, sin generar efectos adversos y, al utilizarla en todos los RN, se evitó la interferencia que se podría haber producido.
En el muestreo longitudinal de cortisol en la saliva durante las primeras tres semanas de vida, se pudo evaluar más del 70% de la población estudiada; no se evidenciaron cambios significativos respecto de la muestra del día 2 de vida. Sin embargo, la diferencia de los valores de cortisol en la saliva entre la segunda y la primera muestra de pacientes que se encontraban en el primer cuartil o por debajo de este mostró una tendencia a aumentar en 10 de 12 pacientes.
Una limitación de este trabajo fue que el tiempo de ayuno fue referido por la madre sin haber sido corroborado por un testigo. Las muestras se obtuvieron solo los días de semana por disponibilidad del personal. Otra limitación fue que no se pudo medir la ACTH ni la CRH, lo cual puede explicar la presencia de sesgos no advertidos. Los amplios rangos en los resultados de las determinaciones de cortisol en la saliva reflejan la alta variabilidad interindividual, tal como se ha reportado.9
El dosaje de cortisol en la saliva podría ser una herramienta que ayudara al diagnóstico de insuficiencia adrenal en estos niños, aunque se precisan más estudios para confirmar estos hallazgos. Existe una proporción de RN normales cuyo cortisol sérico y salival se encuentra en concentraciones bajas, lo que dificulta el diagnóstico de insuficiencia adrenal solamente sobre la base de esta determinación.
CONCLUSIÓN
La determinación de cortisol en la saliva refleja la concentración de cortisol sérica en RN normales. Los bajos niveles de cortisol observados a las 36 horas de vida en los RN normales mostraron una tendencia a incrementarse espontáneamente a lo largo del primer mes de vida.
Agradecimientos
Al Dr. Fernando Ríos por su invaluable contribución en el análisis estadístico, a la Lic. Silvana Varela por el aporte brindado, al Dr. Horacio Repetto por su colaboración y dedicación en la corrección del manuscrito.
1. Fernandez E, Watterberg K. Relative adrenal insufficiency in the preterm and term infant. J Perinatol 2009;29(Suppl 2);S44-9. [ Links ]
2. Voutilainen R. Endocrine pathology of the premature infant-adrenal function [abstract]. Horm Res 2009;72(Suppl 3):11.
3. Fernandez E, Montman R, Watterberg K. ACTH and Cortisol response to critical illness in term and late preterm newborns. J Perinatol 2008;28(12):797-802. [ Links ]
4. Calixto C, Martinez F, Jorge S, Moreira A, et al. Correlation between plasma and salivary cortisol levels in preterm infants. J Pediatr 2002;140(1):116-8. [ Links ]
5. Francis S, Walker R, Riad-Fahmy D, Hughes D, et al. Assesment of adrenocortical activity in term newborn infants using salivary cortisol determinations. J Pediatr 1987;111(1):129-33. [ Links ]
6. Hadjian A, Chedin M, Cochet C, Chambaz E. Cortisol Binding to proteins in plasma in the human neonate and infant. Pediatr Res 1975;9:40-5. [ Links ]
7. Neu M, Laudenslager M, Robinson J. Coregulation in Salivary Cortisol during maternal holding of premature infants. Biol Res Nurs 2009;10(3):226-40. [ Links ]
8. Talge N, Donzella B, Kryzer E, Gierens A, et al. It's Not That Bad: Error Introduced by Oral Stimulants in Salivary Cortisol Research. Dev Psychobiol 2005;47(4):369-76. [ Links ]
9. Groschl M, Rauh M, Dorr H. Circadian Rhythm of salivary cortisol, 17a-Hydroxyprogesterone, and Progesterone in healthy Children. Clin Chem 2003;49(10):1688-91. [ Links ]
10. de Weerth C, Zijl C, Buitelaar J. Development of cortisol circadian rhythm in infancy. Early Hum Dev 2003;73(1-2):39-52. [ Links ]
11. Cabral D, Antonini S, Custódio R, Martinelli C Jr, et al. Measurement of Salivary Cortisol as a marker of stress in newborns in a Neonatal Intensive Care Unit. Horm Res Paediatr 2013;79(6):373-8. [ Links ]
12. Lejarraga H, Diaz Ballvé, Guerra A. Estudio antropométrico de 1.401 recién nacidos sanos del área urbana de Buenos Aires. Rev Hosp Niños B Aires 1976;18:9-21. [ Links ]
13. Magnano CL, Diamond EJ, Gardner JM. Use of salivary cortisol measurements in young infant: a note of caution. Child Dev 1989;60(5):1099-101. [ Links ]
14. Van Aken M, Romijn J, Miltemburg J, Lentjes E. Automated measurement of Salivary Cortisol. Clin Chem 2003; 49(8)1408-9. [ Links ]
15. Flück CE. Assessing the function of the human adrenal cartex. In Ranke M, Mullis P-E, eds. Diagnostics of endocrine function in children and adolescents. 4th ed. Basel: Karger; 2011. Págs.350-78. [ Links ]
16. Maas C, Ringwald C, Weber K, Engel C, et al. Relationship of Salivary and Plasma Cortisol levels in Preterm Infants: Results of a prospective observational study and systematic review of the literature. Neonatology 2014;105(4):312-8. [ Links ]
17. Scott S, Watterberg K. Effect of gestational age, postnatal age and illness on plasma cortisol concentrations in premature infants. Pediatr Res 1995;37(1):112-6. [ Links ]
18. Forclaz V, Moratto E, Falco S, Romero E, et al. Growth Hormone (GH), Insulin (I) and Cortisol (F) values in relation to glycaemia (G) in term neonates [abstract]. J Pediatric Endocrinol Metab 2006;19(Suppl 3):1071.











 text in
text in 


