Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.115 no.4 Buenos Aires ago. 2017
http://dx.doi.org/10.5546/aap.2017.391
ACTUALIZACIÓN
http://dx.doi.org/10.5546/aap.2017.391
Estudio de la subunidad ácido-lábil y su utilidad en pediatría
Bioq. Verónica E. Zaidmana
a. Servicio de Endocrinología. Hospital de Pediatría "Prof. Dr. Juan P. Garrahan".
Correspondencia: Bioq. Verónica E. Zaidman: vez2202@hotmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 2-9-2016
Aceptado: 16-1-2017
RESUMEN
La subunidad ácido-lábil (acid-labile subunit; ALS, por sus siglas en inglés) es una glicoproteína de 85 kiloDalton (kD) que pertenece a la superfamilia de repeticiones ricas en leucina. Principalmente, circula en suero dentro de un complejo ternario de alto peso molecular.
La principal y más estudiada función de la ALS es prolongar la vida media del complejo binario que forman los factores de crecimiento insulino-símil tipo 1 y 2 con sus proteínas de transporte 3 y 5. El nivel sérico de la ALS es menor en neonatos, aumenta para llegar a un pico en la pubertad tardía y luego disminuye lentamente durante la vida adulta. Su déficit tiene consecuencias sobre el crecimiento, el metabolismo hidrocarbonado, el óseo y, en algunos casos, en el desarrollo puberal. Hasta el momento, se han encontrado 25 pacientes con déficit completo de la ALS debido a mutaciones del gen IGFALS.
Palabras clave: Subunidad ácido-lábil; Factor I del crecimiento similar a la insulina; Baja talla.
| GLOSARIO | |
| ALS: | subunidad ácido-lábil |
| ALS-D: | déficit completo de subunidad ácido-lábil |
| DMO: | densidad mineral ósea |
| HC: | hormona de crecimiento |
| IGF: | factores de crecimiento insulino-símil |
| IGFBP: | proteínas de unión a los factores de crecimiento insulino-símil |
| kD: | kiloDalton |
| LRR: | repeticiones ricas en leucina |
| SDE; | score de desvío estándar |
INTRODUCCIÓN
La subunidad ácido-lábil (acidlabile subunit; ALS, por sus siglas en inglés) es una glicoproteína de 85 kiloDalton (kD) que pertenece a la superfamilia de repeticiones ricas en leucina (leucine-rich repeats; LRR, por sus siglas en inglés), una familia caracterizada por participar en la unión proteína-proteína. El gen que la codifica está ubicado en el cromosoma 16 y contiene dos exones y un intrón.1
Esta glicoproteína es secretada por el hígado en respuesta a la hormona de crecimiento (HC) y, principalmente, circula en suero dentro de un complejo ternario de alto peso molecular (150 kD).En este complejo, se encuentra asociado a alguna de las proteínas de la familia de los factores de crecimiento insulino-símil (insulin-like growth factor; IGF, por sus siglas en inglés) y a una de las proteínas de unión a los factores de crecimiento insulino-símil (insulin-like growth factor-binding protein; IGFBP, por sus siglas en inglés): IGFBP3 o IGFBP5.23
La familia de los IGF está compuesta por 2 hormonas peptídicas sintetizadas por el hígado: IGF1 e IGF2.Estas tienen en común, aproximadamente, el 50% de su secuencia aminoacídica y comparten gran parte de su secuencia con la proinsulina, pero, a diferencia de esta, retienen el péptido C y, por lo tanto, son más extensas. Las acciones y la biodisponibilidad de los IGF están reguladas por una familia de 6 proteínas de unión a los IGF, conocidas como IGFBP1, 2, 3, 4, 5 y 6,4 en conjunto con la ALS. De estas, solo las IGFBP3 y 5 pueden formar parte del complejo ternario.5
Descripción molecular
El gen IGFALS, que codifica para la ALS humana,comprende, aproximadamente, 3300 pares de bases, localizadas en la región cromosómica 16p13.3, y consta de 2 exones separados por un intrón. El exón 1 codifica para los primeros 5 aminoácidos del péptido senal y la primera base del codón correspondiente al sexto aminoácido; el exón 2 codifica las 2 últimas bases del codón seis y los 599 aminoácidos restantes.1 El péptido senal comprende los primeros 27 aminoácidos. La proteína madura consiste en 578 aminoácidos organizados en 3 dominios, uno amino-terminal, un dominio central que contiene 21 LRR de 24 aminoácidos cada uno (que constituyen el 75% de la ALS) y un dominio carboxiterminal; ambos dominios terminales contienen residuos ricos en cisteína. La proteína se pliega de manera que LRR-1 queda ubicada muy cercanamente a LRR-20 y forman una estructura tipo rosquilla.3
El primer modelo estructural fue descrito en 1999. Más recientemente, David y col.,2 presentaron un nuevo modelo que analizaba su glicosilación, distribución de cargas y los mecanismos por los cuales las mutaciones con cambio de sentido afectaban la estructura proteica.2 Este modelo estructural contiene seis puentes disulfuro, los cuales están agrupados, principalmente, hacia el extremo aminoterminal (LRR-1) y hacia el extremo carboxiterminal (LRR-20). También propone siete sitios de N-glicosilación potenciales; seis de ellos se encuentran hacia los extremos aminoterminal y carboxiterminal, mientras que uno se encuentra en la región central de la proteína (LRR-14).
En cuanto a los sitios de O-glicosilación, se predicen 14 posibles: ocho están localizados hacia los extremos aminoterminal y carboxiterminal; 12 de esos 14 están localizados en la superficie exterior convexa y 2, en la superficie interior cóncava. Las regiones aminoterminal y carboxiterminal son ricas en prolina. Respecto al potencial electrostático, este modelo muestra regiones cargadas positivamente en la superficie externa y una predominancia de regiones cargadas negativamente en la superficie cóncava interior.2
Esta estructura facilitaría la interacción con la región carboxiterminal de IGFBP3, que es rica en residuos básicos y, por lo tanto, tiene carga positiva.3
También se determinó que la remoción de toda la carga negativa del ácido siálico de las cadenas glicosiladas reducía la afinidad de la ALS por el complejo binario, pero no anulaba la formación del complejo ternario.6
Síntesis y regulación
La síntesis de la ALS está, principalmente, confinada a los hepatocitos.7 Es probable que el suero sea la mayor fuente de la ALS extravascular, pero también existe síntesis local en ciertos tejidos. Usando técnicas sensibles, se ha encontrado expresión génica de IGFALS extrahepática en riñones, hueso en desarrollo, glándulas mamarias en lactancia, timo y pulmón.3,7
Independientemente de su origen, la ALS extravascular puede regular la acción local de los IGF a través de su unión al complejo ternario.8
El comienzo de la síntesis de la ALS es uno de los últimos eventos en el desarrollo del sistema de IGF; la proteína es indetectable en humanos a las 27 semanas de gestación, pero sí está presente en los niños nacidos a término.9 La ALS libre representa el 30% del total de esta glicoproteína durante la vida fetal. Este porcentaje aumenta en la ninez hasta alcanzar un máximo de, aproximadamente, 70% en la pubertad.10
La HC es el más potente inductor del ácido ribonucleico mensajero de la ALS en hígado y, en consecuencia, de los niveles circulantes de la proteína en plasma.4 Esto se evidencia por la marcada disminución o ausencia de los niveles de la ALS en los pacientes con déficit de HC.11 Pruebas hechas en ratas evidencian que estos efectos de la HC sobre el hígado son directos y ocurren a nivel transcripcional en el gen de IGFALS.12,13
También existe una variedad de condiciones que reducen los niveles séricos de la ALS, como desnutrición, ayuno, enfermedades catabólicas, diabetes, lesión cerebral y cirrosis.14-20
Funciones
La principal y más conocida función de la ALS es prolongar la vida media del complejo binario IGF1-IGFBP3/IGFBP5.La vida media de IGF1 libre es de 12 minutos; en cambio, en complejo con la IGFBP3 y la ALS, la vida media de los IGF se extiende a más de 12 horas. Así, el complejo ternario se convierte en el principal reservorio de los IGF y regula su biodisponibilidad y bioactividad.21 La ALS también actúa regulando la acción de los IGF en ciertos tejidos extravasculares con la formación del complejo localmente. El rol inhibitorio de la ALS en las acciones de los IGF se demuestra en la observación de que una sobreexpresión generalizada de la ALS produce retardo del crecimiento en ratones de 4-8 semanas.22
Es importante decir que la ALS no tiene afinidad por ninguna de estas proteínas en estado libre, de manera que es necesario que se forme el complejo binario IGF1-IGFBP3/IGFBP5 antes de conformar el complejo ternario.8
La ALS también cumple un rol importante en la prevención de efectos metabólicos inespecíficos de los IGF, como la hipoglucemia. Esto ocurre gracias a que los IGF en el complejo ternario no pueden atravesar el endotelio capilar y activar el receptor de insulina, lo que restringe los efectos intrínsecos símil insulina de los IGF.23
Déficit completo de la subunidad ácido-lábil Efecto sobre el sistema de factores de crecimiento insulino-símil
La ausencia de la ALS en circulación resulta en una deficiencia generalizada del llamado "sistema de IGF", con disminución de los niveles de los IGF1 e IGF2; los niveles de la IGFBP3 se encuentran profundamente reducidos y tanto la IGFBP1 como la IGFBP2 también se hallan bajas.24 Lo característico de este déficit es una falta de proporción en la reducción de los niveles del IGF1 y la IGFBP3 comparado con el efecto sobre el crecimiento posnatal, ya que, en la mayoría de los casos, la talla antes y durante la pubertad se encuentra entre -2 score de desvío estándar (SDE) y -3 SDE.25
La HC en estos pacientes está normal o, a veces, elevada cuando la muestra es tomada de manera espontánea o bajo estímulo, efecto que podría explicarse como resultado de la deficiencia de una retroalimentación negativa de los IGF1 sobre la secreción de la HC.26 En niños con déficit completo de subunidad ácido-lábil (acid-labile subunit deficit ALS-D, por sus siglas en inglés), se ha observado un peso al nacer por debajo de la media de entre -2,23 SDE y -0,08 SDE, lo que sugiere un posible efecto en el crecimiento prenatal, aunque todavía su mecanismo es incierto.25
Efectos metabólicos
En pacientes con ALS-D, la glucosa en ayunas fue normal en todos los casos de los que se obtuvieron datos. En 10 de 11 pacientes, se sugirió insensibilidad a la insulina por cumplir 1 o más criterios de análisis, a saber: insulinemia en ayunas >15 mU/L, pico de insulina >150 mU/L pos glucosa en la prueba de tolerancia, insulinemia a 120 minutos >75 mU/ml o índice de evaluación de la homeostasis de la glucosa >3.25
Estos datos sugieren que la deficiencia de la
ALS tiene consecuencias sobre el metabolismo hidrocarbonado. Los mecanismos fisiopatológicos involucrados son todavía desconocidos. Los niveles de la HC ligeramente elevados reportados en estos pacientes podrían contribuir a esta deficiencia en la acción de la insulina por múltiples mecanismos, como el aumento de ácidos grasos libres por el efecto lipolítico, un efecto de entrecruzamiento de senales entre las vías de senalización del receptor de la HC y del receptor de insulina, entre otras cosas. De todos modos, no parecería ser esa leve elevación de la HC la única causante de la insensibilidad a la insulina en estos pacientes. Se ha demostrado que los IGF1 mejoran la absorción de glucosa, especialmente, en músculo esquelético,27 y se ha sugerido que la marcada disminución de los IGF1 podría contribuir a la insensibilidad a la insulina observada en estos pacientes. El leve aumento de la secreción de la HC, la reducción de los niveles de los IGF1 o la interacción de estos 2 factores podrían ser la posible causante de este desorden del metabolismo hidrocarbonado.21
Efectos óseos
Los IGF1 juegan un rol importante en la adquisición y el mantenimiento del tejido óseo y la ALS es el responsable del aumento en la vida media de IGF1; por lo tanto, un descenso de la vida media de los IGF1 en circulación podría ser el responsable de que se vea afectada la densidad mineral ósea (DMO). Se ha descrito una disminución de la DMO en tres pacientes con ALS-D.28,29 Esto se correspondería con los hallazgos reportados en ratones con deleciones inactivantes del gen de la ALS, en los cuales se encontraron diferencias significativas respecto a los controles tanto en la DMO como en la longitud femoral y en el espesor cortical.30
Otros efectos
También se ha encontrado, en la mitad de los pacientes con ALS-D, pubertad retrasada, con predominio en pacientes de sexo masculino, aunque todavía no se ha estudiado el mecanismo por el cual ocurre.25
Efecto de la mutación en heterocigosis simple
Para evaluar el efecto de las mutaciones del gen de la ALS en heterocigosis simple, la Sociedad Internacional de la ALS realizó un estudio que incluyó a los familiares de los casos con ALS-D. Se utilizó la información de 21 pacientes, los cuales eran homocigotas o heterocigotas compuestos, y de 44 familiares, de los cuales 36 eran portadores heterocigotas y 8 no tenían mutación alguna en el gen de la ALS. Este estudio mostró un posible efecto de dosis, dado que los homocigotas y heterocigotas compuestos eran, aproximadamente, 1,5 SDE más bajos que los portadores heterocigotas, y que estos presentaban una altura en promedio 1 SDE menor que los que no presentaban mutación alguna.21
Sin embargo, en una familia descrita en 2014,en la que 3 miembros presentaban heterocigosis simple para una mutación del gen IGFALS que generaba un codón de stop prematuro, los 3 casos tenían talla entre -2 SDE y -3,2 SDE.31 Estos datos remarcan la necesidad de realizar un trabajo más extenso en el que se estudie el efecto de dosis en detalle, teniendo en cuenta el grado de dano molecular.
¿Cuándo sospechar de un déficit completo de la subunidad ácido-lábil?
El ALS-D debe ser considerado en los pacientes que presentan lo siguiente:
1) una respuesta normal o exagerada al test de estimulación de la HC.
2) niveles séricos de los IGF1 bajos con niveles séricos de IGFBP3 profundamente reducidos.
3) retardo leve del crecimiento en comparación con el grado de déficit del IGF1 y la IGFBP3.
4) test de generación del IGF1 carente de respuesta.
En el caso de tener que evaluar a un niño/a con baja estatura (<-2,5 SDE) y sospecha de ALS-D, se propone un diagrama de flujo (Figura 1).
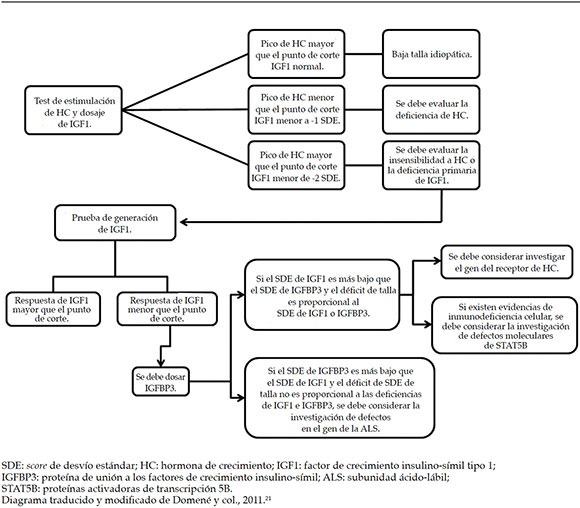
Figura 1. Diagrama de diagnóstico diferencial en pacientes con sospecha de déficit de subunidad ácido-lábil
Evaluación del laboratorio clínico
Cuando se tiene la sospecha de un ALS-D, el primer paso es evaluar la concentración de la proteína en sangre; la herramienta más utilizada es el enzimoinmunoensayo. Existen ensayos comerciales que miden los niveles de la ALS con gran especificidad. Este ensayo es tipo sándwich y utiliza dos anticuerpos monoclonales de alta afinidad contra la ALS.32
En cuanto a los valores esperados para niños y adolescentes sin patología del eje somatotrófico, distintos estudios han publicado que el nivel sérico de la ALS es menor en neonatos, aumenta de modo constante para llegar a un pico en la pubertad tardía y luego disminuye lentamente durante la vida adulta.4,10,33-35 En cuanto a los niños pretérmino, nacen con valores menores, comparándolos con los nacidos a término.10 Hay reportes que publican diferencias según género, en los que las niñas presentan concentraciones de la ALS sérica mayores que los niños,33-35 mientras que, al menos, un reporte no encuentra diferencias significativas entre géneros.10
Evaluación del laboratorio molecular
Luego de verificar el nivel disminuido o indetectable de la proteína en suero, el paso siguiente es hallar el origen molecular de esta patología. La evaluación en busca de posibles mutaciones se realiza a partir de ácido desoxirribonucleico genómico, el cual puede ser obtenido de leucocitos de sangre periférica. Se utilizan primers (cebadores) específicos para amplificar el gen IGFALS con una reacción en cadena de la polimerasa. Los fragmentos obtenidos son visualizados primero en un gel de agarosa, para luego ser secuenciados. Esa secuenciación es comparada con la del gen IGFALS normal para encontrar dónde existe alguna discordancia.21,36 Las variantes genómicas halladas deben ser testeadas con las bases disponibles del Proyecto 1000 Genomas Humanos y evaluar la frecuencia en la población de referencia para catalogarla como posible variante deletérea. Estudios de predicción "in sílico" representan una estrategia para orientar la posible patogenicidad de la variante hallada.
Estudios recientes muestran resultados sobre este tipo de ensayos.37
Mutaciones encontradas
El primer caso de una mutación inactivante en el gen IGFALS humano, asociado con baja estatura, insensibilidad a la HC y niveles anormalmente bajos de los IGF1 y la IGFBP3, que produce un corrimiento en el marco de lectura con un codón de finalización prematuro, fue detectado en Argentina por el grupo de Domené y col. en 2004.38 Desde ese momento, se identificaron 20 mutaciones (Figura 2).
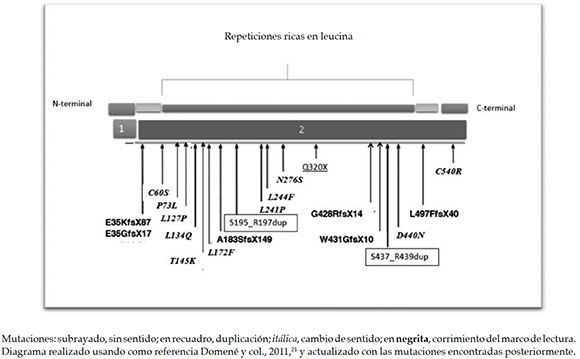
Figura 2. Representación esquemática de las 20 mutaciones encontradas hasta el momento en el gen de la subunidad ácido-lábil que indica su localización
Se han descrito 24 pacientes de 19 familias con alguna de las 20 mutaciones distintas reportadas hasta el momento en el gen IGFALS, con ALS-D congenito. Estas 19 familias representan una gran diversidad de etnias y países de residencia. Dieciséis pacientes presentan una mutación en homocigosis y nueve, heterocigosis compuesta21,24,29,36,38-40 (Tabla 1). Solo cinco son niñas, probablemente, debido a que la baja talla no muy pronunciada en las niñas despierta menor preocupación en los padres, lo cual puede llevar a subestimar la proporción de niñas con esta patología.
Tabla 1. Mutaciones homocigotas o heterocigotas compuestos encontradas en 24 pacientes con déficit completo de subunidad ácido-lábil
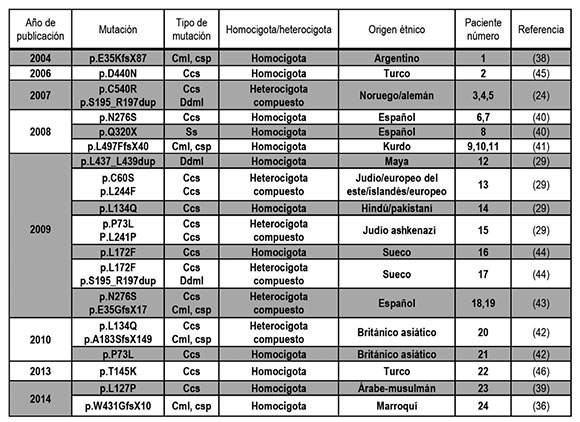
Cml: corrimiento del marco de lectura; csp: codón de stop prematuro; ccs: con cambio de sentido; ss: sin sentido;
ddml: duplicación de 3 aminoácidos dentro del marco de lectura.
Se ha demostrado un patrón de herencia autonómico recesivo.21 Además, se han encontrado mutaciones en heterocigosis simple.31,37,47
El espectro de mutaciones del gen IGFALS, tanto homocigotas como heterocigotas simples o compuestos, cubre la mayoría de la extensión del gen, todas en el área codificada por el exón 2 (Figura 2).
Utilidad clínica
Los pacientes con diagnóstico de deficiencia de la ALS no presentan buena respuesta al tratamiento con la HC. Por lo tanto, la principal utilidad de evaluar a los niños con sospecha clínica de esta patología es tratar de evitar las consecuencias metabólicas, óseas y sobre el desarrollo puberal que pudieran afectar su calidad de vida y evitar tratamientos inefectivos.
DISCUSIÓN
En los últimos 12 años, desde la descripción del primer paciente con ALS-D, se realizó un exhaustivo estudio tanto de la molécula como de nuevas posibles mutaciones, aunque todavía falta mucho por conocer.
Es importante entender los mecanismos por los cuales el ALS-D afecta el metabolismo hidrocarbonado, el metabolismo óseo y el desarrollo puberal, y también el efecto de dosis génica en relación con el grado de dano molecular.
Por el contrario, ya se ha avanzado en el conocimiento de la molécula, de su estructura y de la manera en que la afectan las mutaciones con cambio de sentido, así como en el diagnóstico diferencial y el estado de alerta para poder llegar al diagnóstico de estos casos.
La importancia del correcto diagnóstico de estos niños con baja talla es elaborar estrategias de tratamiento útiles para prevenir los efectos y evitar sustituciones hormonales inefectivas, como el tratamiento con la HC y la sustitución hormonal para inducir la pubertad.
Agradecimientos:
A la Dra. Alicia Belgorosky, el Dr. Eduardo Chaler, la Dra. Patricia Pennici, la Dra. Mercedes Maceiras, la Dra. Dolores Urso, la Dra. Melina Pelanda y el Dr. Juan Manuel Lazzati por la corrección y los valiosos aportes al trabajo.
1. Suwanichkul A, Boisclair YR, Olney RC, et al. Conservation of a growth hormone-responsive promoter element in the human and mouse acid-labile subunit genes. Endocrinology2000;141(2):833-8. [ Links ]
2. David A, Kelley LA, Sternberg MJ. A new structural model of the acid-labile subunit: Pathogenetic mechanisms of short stature-causing mutations. J Mol Endocrinol 2012;49(3): 213-20. [ Links ]
3. Janosi JB, Ramsland PA, Mott MR, et al. The Acidlabile Subunit of the Serum Insulin-like Growth Factorbinding Protein Complexes. Structural determination by molecular modeling and electron microscopy. J Biol Chem 1999;274(33):23328-32. [ Links ]
4. Baxter RC. Insulin-like growth factor binding proteins in the human circulation: a review. Horm Res 1994;42(4-5): 140-4. [ Links ]
5. Twigg SM, Baxter RC. Insulin-like growth factor (IGF)-binding protein 5 forms an alternative ternary complex with IGFs and the acid-labile subunit. J Biol Chem 1998;273(11):6074-9. [ Links ]
6. Janosi JB, Firth SM, Bond JJ, et al. N-Linked Glycosylation and Sialylation of the Acid-labile Subunit. J Biol Chem 1999;274(9):5292-8. [ Links ]
7. Chin E, Zhou J, Dai J, et al. Cellular Localization and Regulation of Gene Expression for Components of the Insulin-Like Growth Factor Ternary Binding Protein Complex. Endocrinology 1994;134(6):2498-504. [ Links ]
8. Boisclair YR, Rhoads RP, Ueki I, et al. The acid-labile subunit (ALS) of the 150 kDa IGF-binding protein complex: An important but forgotten component of the circulating IGF system. J Endocrinol 2001;170(1):63-70. [ Links ]
9. Lewitt MS, Scott FP, Clarke NM, et al. Developmental regulation of circulating insulin-like growth factor-binding proteins in normal pregnancies and in pre-eclampsia. Prog Growth Factor Res 1995;6(2-4):475-80. [ Links ]
10. Barrios V, Pozo J, Muñoz MT, et al. Normative data for total and free acid-labile subunit of the human insulin-like growth factor-binding protein complex in pre- and full-term newborns and healthy boys and girls throughout postnatal development. Horm Res 2000;53(3):148-53. [ Links ]
11. Aguiar-Oliveira MH, Gill MS, de A Barretto ES, et al. Effect of severe growth hormone (GH) deficiency due to a mutation in the GH-releasing hormone receptor on insulin-like growth factors (IGFs), IGF-binding proteins, and ternary complex formation throughout life. J Clin Endocrinol Metab 1999;84(11):4118-26. [ Links ]
12. Ooi GT, Cohen FJ, Tseng LY, et al. Growth hormone stimulates transcription of the gene encoding the acidlabile subunit (ALS) of the circulating insulin-like growth factor-binding protein complex and ALS promoter activity in rat liver. Mol Endocrinol 1997;11(7):997-1007. [ Links ]
13. Ooi GT, Hurst KR, Poy MN, et al. Binding of STAT5a and STAT5b to a Single Element Resembling a gama-Interferon-Activated Sequence Mediates the Growth Hormone Induction of the Mouse Acid-Labile Subunit Promoter in Liver Cells. Mol Endocrinol 1998;12(5):675-87. [ Links ]
14. Dai J, Scott CD, Baxter RC. Regulation of the acid-labile subunit of the insulin-like growth factor complex in cultured rat hepatocytes. Endocrinology 1994;135(3):1066-72. [ Links ]
15. Bereket A, Wilson TA, Blethen SL, et al. Regulation of the acid-labile subunit of the insulin-like growth factor ternary complex in patients with insulin-dependent diabetes mellitus and severe burns. Clin Endocrinol(Oxf) 1996;44(5):525-32. [ Links ]
16. Lang CH, Fan J, Frost RA, et al. Regulation of the insulinlike growth factor system by insulin in burn patients. J Clin Endocrinol Metab 1996;81(7):2474-80. [ Links ]
17. Lang CH, Liu X, Nystrom GJ, et al. Acute response of IGF-I and IGF binding proteins induced by thermal injury. Am J Physiol Endocrinol Metab 2000;278(6):E1087-96. [ Links ]
18. Oster MH, Levin N, Fielder PJ, et al. Developmental differences in the IGF-I system response to severe and chronic calorie malnutrition. Am J Physiol 1996;270(4 Pt 1):E646-53. [ Links ]
19. Fukuda I, Hotta M, Hizuka N, et al. Decreased serum levels of acid-labile subunit in patients with anorexia nervosa. J Clin Endocrinol Metab 1999;84(6):2034-6. [ Links ]
20. Moller S, Juul A, Becker U, et al. The acid-labile subunit of the ternary insulin-like growth factor complex in cirrhosis: relation to liver dysfunction. J Hepatol 2000;32(3):441-6. [ Links ]
21. Domené HM, Hwa V, Jasper HG, et al. Acid-labile subunit (ALS) deficiency. Best Pract Res Clin Endocrinol Metab 2011;25(1):101-13. [ Links ]
22. ModricT, Shi Z, Rajkumar K, et al. Growth retardation of transgenic mice overexpressing insulin-like growth factor binding protein-3 and acid labile subunit. In: Proceedings of the 5th International Symposium on Insulin-like Growth Factors. Brighton, United Kingdom, oct 31-nov 4, 1999:393. [ Links ]
23. Zapf J, Hauri C, Futo E, et al. Intravenously injected insulinlike growth factor (IGF) I/IGF binding protein-3 complex exerts insulin-like effects in hypophysectomized, but not in normal rats. J Clin Invest 1995;95(1):179-86. [ Links ]
24. Domene HM, Scaglia PA, Lteif A, et al. Phenotypic effects of null and haploinsufficiency of acid-labile subunit in a family with two novel IGFALS gene mutations. J Clin Endocrinol Metab 2007;92(11):4444-50. [ Links ]
25. Domene HM, Hwa V, Argente J, et al. Human Acid-Labile Subunit Deficiency: Clinical, Endocrine and Metabolic Consequences. Horm Res 2009;72(3):129-41. [ Links ]
26. Domene HM, Scaglia PA, Jasper HG. Deficiency of the insulin-like growth factor-binding protein acidlabile subunit (ALS) of the circulating ternary complex in children with short stature. Pediatr Endocrinol Rev 2010;7(4):339-46. [ Links ]
27. Dohm GL, Elton CW, Raju MS, et al. IGF-I--stimulated glucose transport in human skeletal muscle and IGF-I resistance in obesity and NIDDM. Diabetes 1990;39(9):1028-32. [ Links ]
28. Domene HM, Bengolea S V, Jasper HG, et al. Acid-labile subunit deficiency : Phenotypic similarities and differences between human and mouse. J Endocrinol Invest 2005; 28(5 Suppl):43-6. [ Links ]
29. Fofanova-Gambetti V,Hwa V, Kirsch S, et al. Three novel IGFALS gene mutations resulting in total ALS and severe circulating IGF-I/IGFBP-3 deficiency in children of different ethnic origins. Horm Res 2009;71(2):100-10. [ Links ]
30. Yakar S, Rosen CJ, Beamer WG, et al. Circulating levels of IGF-1 directly regulate bone growth and density. J Clin Invest 2002;110(6):771-81. [ Links ]
31. Grandone A, Miraglia del Giudice E, Cirillo G, et al. Clinical features of a new acid-labile subunit (IGFALS) heterozygous mutation: anthropometric and biochemical characterization and response to growth hormone administration. Horm Res Pediatrics 2014;81(1):67-72. [ Links ]
32. Stadler S, Wu Z, Dressendorfer RA, et al. Monoclonal antiacid-labile subunit oligopeptide antibodies and their use in a two-site immunoassay for ALS measurement in humans. J Immunol Methods 2001;252(1-2):73-82. [ Links ]
33. Ertl DA, Gleiss A, Sagmeister S, et al. Determining the normal range for IGF-I, IGFBP-3 and ALS: New reference data based on current internal standards. submitted. Wien Med Wochenschr 2014;164(17-18):343-52. [ Links ]
34. Nimura A, Katsumata N, Horikawa R, et al. Acidlabile subunit (ALS) measurements in children. Endocr J 2000;47(Suppl:S111-4). [ Links ]
35. Juul A, Moller S, Mosfeldt-Laursen E, et al. The acidlabile subunit of human ternary insulin-like growth factor binding protein complex in serum: hepatosplanchnic release, diurnal variation, circulating concentrations in healthy subjects, and diagnostic use in patients with growth hormone deficienc. J Clin Endocrinol Metab 1998;83(12): 4408-15. [ Links ]
36. Poukoulidou T, Kowalczyk J, Metherell L, et al. A novel homozygous mutation of the IGFALS gene in a female adolescent: indirect evidence for a contributing role of the circulating IGF-I pool in the pubertal growth spurt. Horm Res Pediatrics 2014;81(6):422-7. [ Links ]
37. Martucci LC, Gutiérrez ML, Karabatas LM, et al. Assessment of pathogenicity of natural IGFALS gene variants by in silico bioinformatics tools and invitro functional studies. Mol Cell Endocrinol 2016;429:19-28. [ Links ]
38. Domené HM, Bengolea S V, Martínez AS, et al. Deficiency of the circulating insulin-like growth factor system associated with inactivation of the acid-labile subunit gene. N Engl J Med 2004;350(6):570-7. [ Links ]
39. Hess O, Khayat M, Hwa V, et al. A novel mutation in IGFALS, c.380T>C (p.L127P), associated with short stature, delayed puberty, osteopenia and hyperinsulinaemia in two siblings: insights into the roles of insulin growth factor-1 (IGF1). Clin Endocrinol (Oxf) 2013;79(6):838-44. [ Links ]
40. Heath KE, Argente J, Barrios V, et al. Primary Acid-Labile Subunit Deficiency due to Recessive IGFALS Mutations Results in Postnatal Growth Deficit Associated with Low Circulating Insulin Growth Factor (IGF)-I, IGF Binding Protein-3 Levels, and Hyperinsulinemia. J Clin Endocrinol Metab 2008;93(5):1616-24. [ Links ]
41. van Duyvenvoorde HA, Kempers MJE, Twickler TB, et al. Homozygous and heterozygous expression of a novel mutation of the acid-labile subunit. Eur J Endocrinol 2008;159(2):113-20. [ Links ]
42. David A, Rose SJ, Miraki-Moud F, et al. Acid-labile subunit deficiency and growth failure: Description of two novel cases. Horm Res Paediatr 2010;73(5):328-34. [ Links ]
43. Gallego-Gómez E, Sánchez del Pozo J, Rojo J, et al. Novel compound heterozygous IGFALS mutation associated with impaired postnatal growth and low circulating IGF-I and IGFBP-3 levels. Horm Res 2009;72(Suppl 3):90-1. [ Links ]
44. Bang P, Fureman A, Nilsson A, et al. A novel missense mutation of the ALSIGF gene causing a L172F substitution in LRR6 is associated with short stature in two Swedish children homozygous or compound heterozygous for the mutation. Horm Res 2009;72(Suppl 3):86. [ Links ]
45. Hwa V, Haeusler G, Pratt KL, et al. Total absence of functional acid labile subunit, resulting in severe insulinlike growth factor deficiency and moderate growth failure. J Clin Endocrinol Metab 2006;91(5):1826-31. [ Links ]
46. Schreiner F, Schoenberger S, Koester B,et al. Novel acid-labile subunit (IGFALS) mutation p.T145K (c.434C>A) in a patient with ALS deficiency, normal stature and immunological dysfunction. Horm Res Paediatr 2013;80(6):424-30. [ Links ]
47. Domené HM, Scaglia PA, Martínez AS, et al. Heterozygous IGFALS gene variants in idiopathic short stature and normal children: Impact on height and the IGF system. Horm Res Paediatr 2014;80(6):413-23. [ Links ]














