Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.115 no.5 Buenos Aires Oct. 2017
http://dx.doi.org/10.5546/aap.2017.476
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2017.476
Displasia broncopulmonar: incidencia y factores de riesgo
Dr. Pablo H. Brener Dika, Dra. Yeimy M. Niño Gualdrona, Dra. María F. Gallettia, Dra. Carolina M. Cribiolia y Dr. Gonzalo L. Mariania
a. Departamento de Pediatría, Servicio de Neonatologia, Hospital Italiano de Buenos Aires, Ciudad Autónoma de Buenos Aires.
Correspondencia: Dr. Pablo H. Brener Dik: pablo.brener@hiba.org.ar
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 11-10-2016
Aceptado: 6-3-2017
RESUMEN
Introducción. La displasia broncopulmonar es la secuela pulmonar crónica más frecuente en recién nacidos de muy bajo peso. El objetivo fue estimar su incidencia en nuestra Unidad Neonatal durante los últimos 5 años y analizar los factores de riesgo asociados.
Población y métodos. Se realizó un estudio observacional y analítico sobre una cohorte retrospectiva, utilizando datos extraídos de una base de recolección prospectiva de recién nacidos en el Hospital Italiano de Buenos Aires, con peso al nacer menor de 1500 gramos, entre enero de 2010 y diciembre de 2014. Se estudió la incidencia y la asociación de la displasia broncopulmonar con diversas variables de estudio secundarias.
Resultados. Se incluyeron 245 pacientes. La incidencia de displasia broncopulmonar moderada/grave fue de 22% y se asoció a menor edad gestacional y peso al nacer. Se encontró una asociación significativa con requerimiento de surfactante, asistencia ventilatoria y su duración. Los pacientes con displasia broncopulmonar moderada/grave presentaron mayor incidencia de ductus y sepsis tardía. El menor peso al nacer (ORa 0,99; IC 95%: 0,991-0,997; p < 0,001) y la duración de la asistencia ventilatoria (ORa 1,08; IC 95%: 1,01-1,15; p < 0,01) mantuvieron la asociación luego de ajustar por otras variables. Además, se encontró una asociación en pacientes con restricción de crecimiento intrauterino menores de 32 semanas de edad gestacional (OR 4,71; IC 95%: 1,68-13,2).
Conclusiones. Se estableció la incidencia de displasia broncopulmonar en nuestra Unidad y se encontró asociada al menor peso de nacimiento y duración de la ventilación. En menores de 32 semanas, la restricción de crecimiento intrauterino constituye un riesgo adicional.
Palabras clave: Displasia broncopulmonar; Recién nacido prematuro; Ventilación mecánica.
INTRODUCCIÓN
Los avances en la atención perinatal producidos en las últimas dos décadas han contribuido a un aumento en la supervivencia de los recién nacidos (RN) de muy bajo peso al nacer.1,2 Uno de los grandes desafíos de la neonatología actual es continuar disminuyendo la mortalidad sin que esto tenga como consecuencia un incremento de las complicaciones.1,2 La morbilidad respiratoria asociada a la prematurez no está disminuyendo concomitantemente con la mejoría de otros resultados adversos neonatales.1 La displasia broncopulmonar (DBP) es la secuela pulmonar crónica más frecuente en esta población y está asociada a diversos factores de riesgo que, sumados a la inmadurez de la vía aérea, provocan una alteración del crecimiento de esta y de los capilares pulmonares, lo que da lugar a una limitación en la función respiratoria de grado variable.3,4
Se realizan grandes esfuerzos tanto en investigación como en la asistencia perinatal para intentar disminuir la incidencia de DBP, con la implementación de distintas estrategias: tratamientos maternos (uteroinhibidores y corticoides prenatales), mejor atención en el parto (vía y estabilización inicial), drogas en la etapa neonatal (surfactante, vitamina A, corticoides, cafeína, etc.), nuevas modalidades ventilatorias, control de la infección nosocomial, mejora de los aspectos nutricionales, etc.5-7 Al ser la causa más frecuente de morbilidad respiratoria en RN prematuros que sobreviven al período neonatal, resulta de interés conocer su incidencia en las unidades neonatales, además de identificar los factores
que pueden desencadenar su desarrollo en estos niños. No obstante, tanto su incidencia como los factores de riesgo asociados podrían ir modificándose a través del tiempo, luego de implementar las estrategias mencionadas.7,8 Si bien la bibliografía disponible en este campo es amplia y muy extensa,3,8-11 realizar una revisión periódica de la incidencia y los factores de riesgo asociados a DBP en cada unidad neonatal resulta importante a la hora de reevaluar las estrategias de prevención.
Nuestro objetivo fue estimar la incidencia de DBP en pacientes menores de 1500 gramos nacidos en nuestra Unidad Neonatal durante los últimos 5 años y analizar los factores de riesgo asociados.
MATERIAL Y MÉTODOS
Diseño: Estudio observacional y analítico sobre una cohorte retrospectiva.
Población: Se incluyó en el estudio a todos los RN vivos en el Hospital Italiano de Buenos aires, con peso al nacer menor de 1500 gramos, durante el período comprendido entre el 1o de enero de 2010 y el 31 de diciembre de 2014. Se excluyeron los pacientes en los cuales no figuraba la variable de resultado primaria en la base secundaria utilizada.
Recolección de datos: Para la realización del presente estudio, se utilizaron datos extraídos de una base secundaria de RN prematuros. Este grupo de pacientes nacidos en el Hospital Italiano de Buenos Aires son incluidos en la base de datos de la Red Neonatal Neocosur,12 que incluye prematuros con peso menor de 1500 gramos independientemente de su edad gestacional (EG). El registro de variables demográficas y resultados clínicos se realiza en forma prospectiva y sistemática. Se recabaron, para nuestro estudio, las siguientes variables para analizar: embarazo múltiple, restricción de crecimiento intrauterino (RCIU), definido como crecimiento por debajo del percentil 3 en las curvas de Fenton, curso completo de corticoides prenatales, corioamnionitis, EG, peso al nacer (PN), Apgar al 5to minuto, sexo, uso de oxígeno, uso de presión positiva continua en la vía aérea (continuous positive airway pressure; CPAP, por sus siglas en inglés), uso de asistencia respiratoria mecánica (ARM), uso de ventilación de alta frecuencia oscilatoria (VAFO), días con ARM, uso de surfactante pulmonar (al menos, una dosis), sepsis, enterocolitis necrotizante (ECN) mayor que el estadio II de Bell o igual, ductus arterioso persistente (DAP) que haya recibido tratamiento.
Variable primaria de resultado: DBP recabada como variable dicotòmica. Se definió como requerimiento de fracción inspirada de oxígeno (FiO2) mayor de 0,21 durante 28 días. Además, se recabó la presencia de DBP moderada o grave como requerimiento de oxígeno a las 36 semanas de edad posconcepcional en sobrevivientes. Para analizar su asociación con las otras variables, se excluyeron los pacientes fallecidos. La mayoría de los estudios clínicos prospectivos utilizan el resultado combinado de DBP y/o muerte, ya que ambas variables compiten entre sí. Los prematuros que fallecen tempranamente no podrán desarrollar DBP. Un centro con tasas bajas de esta afección podría tener una mortalidad muy alta; por el contrario, los centros con baja mortalidad podrían tener alta tasa de DBP. De incluir a los fallecidos, podría ocurrir una falsa subestimación (incluso protección) en la asociación con ciertos factores de riesgo.
Análisis estadístico: Se calcularon las medidas de tendencia central y dispersión para variables continuas y, sobre la base de su distribución, se reportaron como media y desvío estándar o como mediana y rango intercuartilo. Para variables dicotómicas, se calcularon medidas de frecuencia y se reportaron como porcentajes. Se realizó el cálculo de incidencia de DBP y de mortalidad. Se realizó un análisis univariado para estudiar la asociación entre la variable primaria de resultado con las otras recabadas en el estudio. Se utilizó T-Test o Mann-Whitney (según su distribución) para analizar variables continuas y el test de chi2 para variables dicotómicas. Por último, se realizó un análisis multivariado de regresión logística para establecer variables independientes asociadas a DBP, ajustando por otras estudiadas en el trabajo que arrojaran significancia estadística en el análisis univariado. Se consideró significativo todo valor de p < 0,05 y el análisis se realizó con el programa STATA 13.
Consideraciones éticas: El protocolo de estudio fue aprobado en mayo de 2016 por el Comité de Ética en Protocolos de Investigación de la Institución.
RESULTADOS
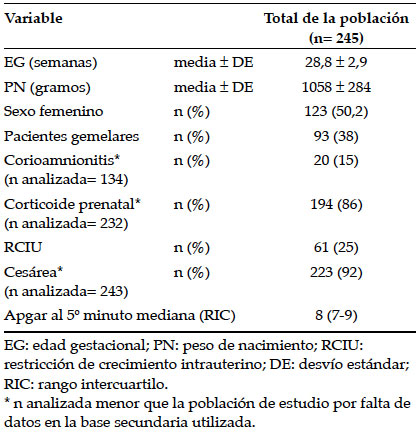
Durante el período estudiado, nacieron 252 pacientes en nuestro Hospital con criterio de elegibilidad. Fueron excluidos 7 pacientes por falta del dato de la variable primaria, con lo cual 245 pacientes fueron incluidos en el estudio (véase la Figura 1). Las características demográficas de la población se presentan en la Tabla 1. Un total de 73 pacientes cumplieron con la definición de nuestra variable primaria de resultado, con lo cual la incidencia de DBP fue de 29,7%. La incidencia de DBP moderada/grave en sobrevivientes fue de 22%. Fallecieron 42 pacientes durante el período estudiado, por lo que la mortalidad global fue de 17,1%. Excluidos los pacientes que fallecieron, se utilizaron 203 pacientes para el análisis, para buscar una asociación entre DBP y factores de riesgo.

Figura 1. Flujograma de pacientes
Tabla 1. Variables demográficas de la población
Se realizaron análisis univariados para evaluar la asociación entre factores de riesgo y requerimiento de oxígeno a los 28 días y a las 36 semanas de edad posconcepcional. Este último se presenta en la Tabla 2. La DBP moderada/grave se asoció significativamente a presentar menor EG, menor PN y al sexo masculino. Los pacientes con DBP moderada/grave tuvieron, en forma significativa, mayor uso de CPAP, ARM, surfactante pulmonar, VAFO y persistieron más tiempo con ARM. Además, presentaron significativamente mayor frecuencia de sepsis y DAP. Por el contrario, no se encontró asociación con embarazo múltiple, RCIU, corticoides prenatales, presencia de corioamnionitis o haber presentado ECN. Sin embargo, al estratificar a la población según EG (< 32 semanas), el grupo de bebés que presentó RCIU mostró una asociación con DBP moderada/grave 4 veces mayor que el grupo que no padeció RCIU (OR 4,71; IC 95%: 1,68-13,2). El grupo de pacientes con DBP moderada/grave recibió cafeína más frecuentemente (OR 2,8; IC 95%: 1,4-5,7) (últimos dos análisis realizados post hoc).
Tabla 2. Análisis univariado. Displasia broncopulmonar moderada-grave. N= 203

Se realizó, además, un análisis multivariado por regresión logística, que se presenta en la Tabla 3. El menor PN y el tiempo de duración de la ARM se asociaron significativamente a presentar DBP moderada/grave, luego de ajustar por sexo, requerimiento de ARM y surfactante, haber presentado DAP y sepsis tardía. Cada día de ventilación mecánica aumentó un 8% la asociación con DBP moderada/grave, independientemente del resto de las variables incluidas en el modelo.
Tabla 3. Análisis multivariado. Displasia pulmonar moderada-grave. N= 203

Se analizó, por último, el grupo de fallecidos (n= 42). Su EG fue 26 ± 3 semanas y su PN, 729 ± 239 gramos, ambos significativamente menores comparados con los sobrevivientes (p < 0,001). Utilizaron ARM el 98%, surfactante el 91%, presentaron DAP un 60% y sepsis tardía un 54%. Solo 7 pacientes fallecieron luego de haber presentado DBP.
DISCUSIÓN
La DBP es una enfermedad de origen multifactorial, que afecta, sobre todo, a bebés prematuros y se presenta de manera inversamente proporcional a la EG y al PN.3,4 El progresivo aumento en la supervivencia de neonatos de muy bajo peso ha dado lugar a un aumento en el número de niños con riesgo de desarrollarla.1,2
En el presente trabajo, su tasa de incidencia en nuestra Unidad Neonatal se encuentra dentro del rango descrito en otras redes neonatales, más allá de que puede variar de un centro a otro. La red neonatal de los National Institutes of Health (NIH) de los Estados Unidos (EE. UU.) reporta un aumento de la incidencia de DBP (definida como requerimiento de oxígeno a las 36 semanas) en los últimos 20 años y la sitúa por sobre un 40% para prematuros nacidos entre 22 y 28 semanas.1 Además, en un reciente reporte, la red sudamericana Neocosur presenta una incidencia de DBP (definida de igual manera) del 25% en RN menores de 1500 gramos.2
Los pacientes fallecidos eran más pequeños e inmaduros comparados con los sobrevivientes. Tuvieron altas tasas de utilización de ARM, surfactante, DAP y sepsis, a pesar de presentar menor incidencia de DBP, por haber fallecido antes de poder padecerla. Estos datos sustentan el haber excluido a este grupo para el análisis de factores de riesgo. De lo contrario, se hubieran encontrado como protectores varios factores que resultaron asociados a la variable primaria.
Es importante identificar al subgrupo de pacientes con DBP moderada/grave, ya que su pronóstico es peor comparado con los que tienen DBP leve.13 Por esto es que, si bien se realizó el análisis para buscar factores de riesgo asociados a ambos subgrupos, se reportaron los resultados encontrados en los pacientes con DBP moderada/grave.
La EG y el PN resultaron significativamente más bajos en pacientes con DBP, como era esperable. Los varones incluidos en nuestro estudio tuvieron mayor incidencia que las niñas, aunque esta asociación se perdió al ajustar por otras variables. Es conocido que el sexo masculino se asocia a mayor morbimortalidad en neonatología.14 En varios estudios previos, el uso de corticoides prenatales ha disminuido significativamente la morbimortalidad neonatal, pero no ha disminuido la enfermedad pulmonar crónica.515 En nuestro medio, se encontró una alta tasa de uso de estos, sin asociación con la variable de resultado primaria.
Un resultado interesante de este trabajo es que, al analizar la población total, no se encontró asociación con RCIU. No obstante, en el estrato de EG menor de 32 semanas, la asociación del grupo de pacientes con RCIU a DBP moderada/grave fue mayor de 4 veces comparado con los pacientes sin RCIU. La asociación entre RCIU y DBP ha sido reportada por varios grupos.16-18 Es probable que, como factor de riesgo, la RCIU pierda su preponderancia entre los niños con mayor EG y, por lo tanto, más maduros, al comportarse esta última variable como un modificador de efecto para esta asociación.
Existe evidencia del rol que juega la inflamación en la patogenia de la DBP. Esto se debería a una falla en la regulación y el control de la respuesta inflamatoria y, si bien es un aspecto controversial, la corioamnionitis podría predisponerla.1119
En nuestro trabajo, las madres de pacientes con DBP tuvieron el doble de corioamnionitis; sin embargo, esta diferencia no alcanzó significancia estadística. La infección sistémica incrementa los niveles de agentes vasodilatadores, prostaglandinas y otros mediadores que se han asociado a un aumento de la apertura del DAP y a una mayor incidencia de DBP.3,5,7,9-11 Ambas variables (inflamación, representada por sepsis y DAP) se asociaron a DBP en nuestro estudio, aunque estos resultados no se mantienen al realizar el análisis multivariado.
La utilización de oxígeno y ARM se han considerado, desde hace mucho tiempo, dentro de los factores más importantes en la patogenia de esta entidad.20-22 El efecto de la hiperoxia a través de radicales libres en los prematuros se ve favorecido por una disminución de mecanismos antioxidantes en este grupo de niños.3,20,21
El estudio aleatorizado SUPPORT comparó dos rangos de objetivos de saturación de oxígeno en prematuros menores de 28 semanas durante toda su internación.23 Estos autores reportaron que, si bien el rango bajo (85-89%) disminuyó el riesgo de retinopatía del prematuro y DBP, se asoció a mayor mortalidad. Además, si bien la DBP es infrecuente en RN que no han recibido soporte ventilatorio mecánico, actualmente, se reconoce su desarrollo en pacientes sin enfermedad pulmonar grave inicial.3-10,24 El exceso de volumen corriente en cada ciclo conduce al denominado "volutrauma", caracterizado por una sobredistensión de la membrana alveolocapilar, desarrollo de una reacción inflamatoria, edema intersticial e inactivación de surfactante.22 En nuestro estudio, tanto la utilización de oxígeno como el requerimiento de ventilación asistida y surfactante pulmonar (como expresión de gravedad del síndrome de dificultad respiratoria inicial) se asociaron a DBP en el análisis univariado.
En la última década, la DBP clásica, descrita hace más de 40 años,25 ha ido reemplazándose por formas más leves de lesión pulmonar crónica, denominada "nueva DBP".3,10,24 Sus características principales consisten en presentarse en niños más inmaduros y de menor PN, con menor cantidad de alvéolos y capilares, ventilación mecánica gentil con menor requerimiento de oxígeno.3,10,24 Esta presentación tiene mejor pronóstico y menos secuelas a largo plazo, aunque la incidencia no ha disminuido.1,3,10 La población de pacientes con DBP moderada/grave estudiada en nuestro trabajo presenta dichas características de inmadurez reflejadas en las medias de EG y PN. Más allá de que el 80% de este grupo de pacientes requirió ARM y administración de surfactante pulmonar, resulta interesante destacar el hecho de que estos dos factores no se asociaron de manera independiente a DBP, mientras que sí lo hizo la duración de la ventilación mecánica. De nuestros datos puede desprenderse que el tiempo de permanencia con ARM, probablemente, juega un rol preponderante e interviene en la patogénesis de la DBP. Nuestros hallazgos concuerdan con los de Gagliardi et ál., quienes, en un análisis de 1260 RN menores de 1500 gramos, encontraron que la tasa de intubación inicial no se asociaba a DBP y que la ventilación asistida prolongada era el factor de riesgo asociado a ella.26 Estos resultados nos estimulan a tener una estrategia proactiva para la extubación temprana y se comienza a pensar en ella desde el mismo momento en que cada paciente prematuro recibe ventilación mecánica.
Existe bibliografía acerca de drogas que se han estudiado para la prevención de la enfermedad pulmonar crónica del RN prematuro.6 Un reconocido estudio que aleatorizó a más de 2000 prematuros a recibir cafeína o placebo encontró que no administrarla cuando estaba indicada aumentaba el riesgo de desarrollar DBP.27 Se suele concluir que la cafeína debe darse a todo RN prematuro para prevenir DBP, lo cual es una interpretación errónea del estudio citado. En nuestra cohorte, se encontró una asociación significativa entre haber recibido cafeína y presentar DBP moderada/grave; sin embargo, este resultado debe ser interpretado con suma cautela debido al diseño retrospectivo de nuestro estudio. Es razonable plantear que la asociación se debe a que se indicó cafeína a los prematuros más extremos, quienes tienen más riesgo de desarrollar DBP.
Nuestro estudio tiene ciertas limitaciones y fortalezas. La disponibilidad de abundante bibliografía sobre el tema podría cuestionar la utilidad del trabajo. De todos modos, tanto la incidencia como los factores de riesgo y el manejo de estos pacientes van modificándose a través del tiempo. Un reciente trabajo, incluso, objeta las definiciones actuales de DBP y propone un cambio hacia otra que correlacione con la morbilidad respiratoria en la infancia.28 Entonces, parece necesaria la realización de estudios como el presente en busca de factores de riesgo, ya conocidos o nuevos, para poder elaborar nuevas estrategias de prevención, como podría ser la extubación precoz para evitar, así, la permanencia innecesaria de pacientes con ARM y disminuir la posibilidad de progresión hacia la enfermedad pulmonar crónica. Debido a su diseño retrospectivo y observacional, no es posible establecer causalidad entre los factores de riesgo estudiados y DBP. No obstante, el hecho de haber utilizado una base secundaria de recolección prospectiva nos asegura alta confiabilidad en los datos y la incorporación al estudio de un porcentaje cercano al 100% de todos los pacientes con criterio de inclusión. Por lo tanto, existe alta presunción de veracidad al momento de ponderar estos resultados. Teniendo en cuenta que, para el manejo de la enfermedad pulmonar crónica, en ocasiones, son necesarios tiempos prolongados de asistencia respiratoria, podría dificultarse la interpretación de nuestros resultados. Aunque teniendo en cuenta la EG media (27 semanas) y el rango intercuartilo de permanencia con ARM (7-39 días) en nuestros pacientes con DBP, es más probable que este tiempo haya ocurrido anteriormente y no en forma posterior a este diagnóstico.
Para concluir, se ha establecido la incidencia de DBP en nuestra Unidad y se ha encontrado una asociación con diversos factores de riesgo. El menor PN y la duración de la ventilación mecánica resultan factores de riesgo independientes para el desarrollo de DBP moderada/grave. En menores de 32 semanas de EG, la presencia de RCIU constituye una variable de riesgo adicional.
1. Stoll BJ, Hansen NI, Bell EF, et al. Trends in care practices, morbidity and mortality of extremely preterm neonates, 1993-2012. JAMA 2015;314(10):1039-51. [ Links ]
2. Fernández R, D'Apremont I, Domínguez M, et al. Supervivencia y morbilidad en recién nacidos de muy bajo peso al nacer en una Red Neonatal sudamericana. Arch Argent Pediatr 2014;112(5):405-12. [ Links ]
3. Bancalari A. Actualización en Presentación y Patogénesis de la Displasia Broncopulmonar. Rev Chil Pediatr 2009;80(3):213-24. [ Links ]
4. Sánchez Luna M, Moreno Hernando J, Botet Mussons F, et al. Displasia broncopulmonar: definiciones y clasificación.
An Pediatr 2013;79(4):262.e1-6.
5. Greenough A, Ahmed N. Perinatal prevention of bronchopulmonary dysplasia. J Perinat Med 2013;41(1): 119-26. [ Links ]
6. Beam KS, Aliaga S, Ahlfeld SK, et al. A systematic review of randomized controlled trials for the prevention of bronchopulmonary dysplasia in infants. J Perinatol 2014;34(9):705-10. [ Links ]
7. Payne N, Finkelstein M, Liu M, et al. NICU Practices and Outcomes Associated With 9 Years of Quality Improvement Collaboratives. Pediatrics 2010;125(3):437-46. [ Links ]
8. Latini G, De Felice C, Giannuzzi R, et al. Survival rate and prevalence of bronchopulmonary dysplasia in extremely low birth weight infants. Early Hum Dev 2013;89(Suppl 1): S69-73. [ Links ]
9. Gursoy T, Hayran M, Derin H, et al. A Clinical Scoring System to Predict the Development of Bronchopulmonary Dysplasia. Am J Perinatol 2015;32(7):659-66. [ Links ]
10. Bancalari E, Claure N, Sosenko IR. Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition. Semin Neonatol 2003;8(1):63-71. [ Links ]
11. Speer C. Chorioamnionitis, Postnatal Factors and Proinflammatory Response in the Pathogenetic Sequence of Bronchopulmonary Dysplasia. Neonatology 2009;95(4): 353-61. [ Links ]
12. Grupo Colaborativo Neocosur. Very-low-birth-weight infant outcomes in 11 South American NICUs. J Perinatol 2002;22(1):2-7. [ Links ]
13. Hirata K, Nishihara M, Shiraishi J, et al. Perinatal factors associated with long term respiratory sequelae in extremely low birthweight infants. Arch Dis Child Fetal Neonatal Ed 2015;100(4):F314-9. [ Links ]
14. Marshall G, Tapia J, D' Apremont I, et al. A New Score for Predicting Neonatal Very Low Birth Weight Mortality Risk in the NEOCOSUR South American Network. J Perinatol 2005;25(9):577-82. [ Links ]
15. Roberts D, Dalziel S. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev 2006;(3):CD004454. [ Links ]
16. Reiss I, Landmann E, Heckmann M, et al. Increased risk of bronchopulmonary dysplasia and increased mortality in very preterm infants being small for gestational age. Arch Gynecol Obstet 2003;269(1):40-4. [ Links ]
17. Eriksson L, Haglund B, Odlind V, et al. Perinatal conditions related to growth restriction and inflammation are associated with an increased risk of bronchopulmonary dysplasia. Acta Paediatr 2015;104(3):259-63. [ Links ]
18. Lal M, Manketlow B, Draper E, et al. Chronic Lung Disease of Prematurity and Intrauterine Growth Retardation: A Population-Based Study. Pediatrics 2003;111(3):483-7. [ Links ]
19. Ericson JE, Laughon MM. Chorioamnionitis: implications for the neonate. Clin Perinatol 2015;42(1):155-65. [ Links ]
20. Saugstad OD. Bronchopulmonary dysplasia and oxidative stress: are we closer to an understanding of the pathogenesis of BPD? Acta Paediatr 1997;86(12):1277-82. [ Links ]
21. Davis JM. Role of oxidant injury in the pathogenesis of neonatal lung disease. Acta Paediatr Suppl 2002;91(437):23-5. [ Links ]
22. Attar MA, Donn SM. Mechanisms of ventilator- induced lung injury in premature infants. Semin Neonatol 2002;7(5):353-60. [ Links ]
23. SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network. Target Ranges of Oxygen Saturation in Extremely Preterm Infants. N Engl J Med 2010;362(21):1959-69. [ Links ]
24. Jobe A. The new bronchopulmonary dysplasia. Curr Opin Pediatr 2011;23(2):167-72. [ Links ]
25. Northway WH, Rosan RC, Porter DY. Pulmonary disease following respiratory therapy of hyaline membrane disease. Bronchopulmonary dysplasia. N Engl JMed 1967;276(7):357-68. [ Links ]
26. Gagliardi L, Bellu R, Lista G, et al. Do differences in delivery room intubation explain different rates of bronchopulmonary dysplasia between hospitals? Arch Dis Child Fetal Neonatal Ed 2011;96(1):F30-5. [ Links ]
27. Schmidt B, Roberts R, Davis P, et al. Caffeine therapy for apnea of prematurity. N Engl J Med 2006;354(20):2112-21. [ Links ]
28. Poindexter B, Feng R, Schdmidt B, et al. Comparisons and limitations of current definitions of Bronchopulmonary dysplasia for the prematurity and respiratory outcomes program. Ann Am Thorac Soc 2015;12(12):1822-30. [ Links ]














