Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.115 no.6 Buenos Aires dic. 2017
http://dx.doi.org/10.5546/aap.2017.e397
ARTÍCULO ESPECIAL
http://dx.doi.org/10.5546/aap.2017.e397
El hígado y la toxicidad por drogas, hierbas y suplementos dietéticos
Dra. María L. Cavalieria y Dr. Daniel D'Agostinoa
a. Servido de Gastroenterología, Hepatología y Trasplante Hepático e Intestinal Pediátrico del Hospital Italiano de Buenos Aires.
Correspondencia: Dra. María L.Cavalieri: maria.cavalieri@hospitalitaliano.org.ar.
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 21-2-2017
Aceptado: 8-6-2017
RESUMEN
El daño hepático por drogas y sustancias representa, aproximadamente, el 20% de los casos de falla hepática aguda en niños. Está causada por dos mecanismos: hepatotoxicidad directa y por idiosincrasia.
La primera surge de la administración de una droga con toxicidad intrínseca y es dependiente de la dosis (ejemplo: acetaminofén). La idiosincrasia es impredecible, ocurre con baja frecuencia, es variable en su presentación y no depende de la dosis.
Las manifestaciones clínicas, histológicas y de laboratorio son hepatitis, en general, asintomática, con gran aumento de enzimas hepáticas; colestasis, con ictericia, prurito, aumento predominante de fosfatasa alcalina y leve aumento de aminotransferasas; o mixto, hepatitis más colestasis.
El tiempo de recuperación es variable, ya que depende del tipo de daño hepático. La detección temprana y la suspensión precoz de la droga son las intervenciones más eficaces e importantes para acelerar la resolución histológica y clínica, y reducir el daño hepático grave.
Palabra clave: Daño hepático inducido por drogas.
INTRODUCCIÓN
La hepatotoxicidad por drogas y sustancias, denominada mundialmente como Drug Induced Liver Injury (DILI), es una entidad importante en la práctica clínica diaria. Su incidencia es desconocida debido a la escasez de estudios prospectivos poblacionales. Se ha estimado una incidencia anual de DILI en la población general de 1 a 2 casos por 100 000 personas.
En los países occidentales, la mayoría de los casos están asociados con antibióticos, anticonvulsivantes y agentes psicotrópicos. En los países asiáticos, los suplementos herbales y dietéticos son las causas más comunes de DILI.1
En Estados Unidos y Europa, la hepatotoxicidad intrínseca representa del 7% al 15% de los casos de falla hepática aguda y es la causa más frecuente de discontinuidad de una droga aprobada del mercado.2
En pediatría, la hepatotoxicidad por drogas representa el 20% de los casos de falla hepática aguda, de los cuales el 14% han sido reportados por acetaminofén.
Actualmente, hay reportados más de 1000 fármacos y sustancias que causan hepatotoxicidad en niños y adultos.3,4 La amplia gama de presentación clínica, la multiplicidad de agentes causantes y la falta de pruebas diagnósticas específicas hacen que su diagnóstico sea dificultoso. A pesar de su baja incidencia en la población general, se debe considerar siempre la posibilidad de DILI en pacientes con enfermedad hepática aguda idiopática. Muchos suplementos dietéticos y de hierbas pueden causar DILI y, por lo tanto, deben tenerse en cuenta al momento de la sospecha de lesión hepática. Los factores genéticos y ambientales, asociados a la exposición a una droga, determinan el desarrollo de la hepatotoxicidad en cada niño y adolescente.
SUSCEPTIBILIDAD A LAS DROGAS
La biotransformación hepática de las drogas comienza en el retículo endoplasmático con la oxidación por el citocromo P450 seguida de la conjugación por las enzimas n-acetiltransferasa y
glutationtransferasa, que produce metabolitos, denominados haptenos, que son ligados, posteriormente, a las proteínas del hepatocito. Estos haptenos son presentados al complejo mayor de histocompatibilidad (human leukocyte antigen; HLA, por sus siglas en inglés), lo que genera una respuesta inmune innata, que, en la mayoría de los casos, se resuelve con inmunotolerancia.
Dado que las moléculas de HLA exhiben un alto grado de polimorfismo, y participan en la activación del sistema inmune específico, algunas variantes de alelos y haplotipos pueden estar relacionadas con reacciones hepatotóxicas inmunes.5 El polimorfismo genético, de esta forma, condiciona que ciertas drogas o sustancias presenten diferente riesgo de susceptibilidad a la toxicidad.6
Por lo tanto, no todos los individuos responden de la misma forma al ingerir una misma droga o sustancia. Existen individuos tolerantes: la lesión hepática no es detectable; individuos adaptadores: la lesión es transitoria y selectiva y la función hepática se normaliza, incluso si la administración de la droga continúa; e individuos susceptibles: la lesión es clínicamente significativa y puede ser reversible cuando la droga se retira.7
Una forma útil y común de caracterizar la hepatotoxicidad es dividirla en intrínseca o idiosincrática. La intrínseca afecta a todos los individuos en grado variable y es dependiente de la dosis. Un ejemplo es el acetaminofén. La seguridad y eficacia del acetaminofén en niños está bien establecida, pero la toxicidad se incrementó en los últimos años. La dosis tóxica es de 120 a 150 mg/kg y las dosis continuadas tienen memoria.
La idiosincrática está definida como una reacción adversa inesperada, afecta solo a individuos susceptibles, tiene menor relación con la dosis y varía en latencia, presentación y curso.8,9
Los factores de riesgo para DILI son edad, sexo, estado nutricional, consumo de drogas concomitantes, tabaco y la genética. Las enfermedades hepáticas crónicas, como la hepatitis C, el hígado graso y el consumo de alcohol, predisponen a una mayor susceptibilidad de algunas drogas o sustancias.1,10
CLÍNICA Y DIAGNÓSTICO
Los signos, síntomas y hallazgos de laboratorio de DILI pueden imitar cualquier forma clínica de enfermedad hepática aguda o crónica. No hay hallazgos de laboratorio específicos de hepatotoxicidad, excepto el dosaje de acetaminofén cuando este es el causante. El diagnóstico es de exclusión, basado en el juicio clínico y el conocimiento sobre el potencial del agente para causar daño hepático.
Sin embargo, existen criterios bioquímicos que definen el tipo de daño hepático por drogas:
• alaninoaminotransferasa (ALT) con valor sérico 5 veces mayor de su valor normal,
• fosfatasa alcalina (FAL) con valor sérico 2 veces mayor de su valor normal,
• ALT con valor sérico 3 veces mayor de su valor normal acompañada de bilirrubina con valor sérico 2 veces mayor de su valor normal.2 Para evaluar la probabilidad de enfermedad hepática causada por drogas, es importante tener en cuenta estos aspectos:
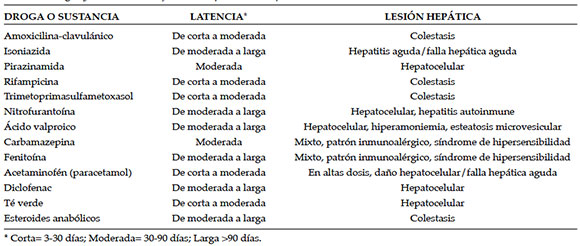
• Latencia: representa el tiempo desde el inicio de la terapia con una droga o sustancia hasta la aparición del daño hepático, ya sea clínicamente o con alteración del hepatograma. Este rango debe ser de entre 5 y 90 días para que se considere fuerte asociación a hepatotoxicidad. Se divide en corta (de 3 a 30 días), moderada (entre 30 y 90 días), larga (más de 90 días). Hay excepciones en las quela latencia puede ser de 24 a 72 h, en general, por la reexposición a la droga (sulfonamidas y macrólidos), de 3 a 12 meses (isoniazida) o mayor a un año (nitrofurantoína, ciproterona).9,11
• Tiempo de recuperación: representa el tiempo desde que se suspende la droga hasta la completa recuperación de la lesión hepática, con valores del hepatograma iguales al inicio de la hepatotoxicidad. Se estima que comienza una mejoría una a dos semanas luego de suspender la droga y se resuelve, finalmente, en 2-3 meses.
Para evaluar la atribución de causalidad a la sospecha de DILI, se utiliza el sistema RUCAM (Roussel Uclaf Causality Assessment Method), el cual separa la lesión hepatocelular de la colestásica o mixta. Se otorga puntaje entre -9 y +10, en el que las puntuaciones más altas indican mayor probabilidad de DILI. Se evalúa el tiempo de exposición a la droga, valores del hepatograma, factores de riesgo, medicación concomitante, diagnósticos diferenciales y la información luego de la reincorporación de la droga.1,9,12,13
MANIFESTACIONES CLÍNICAS, HISTOLÓGICAS Y DE LABORATORIO
Las anormalidades bioquímicas y las características histológicas, asociadas al cuadro clínico, permiten definir el patrón de la lesión hepática de una droga o sustancia. Se utiliza el valor riesgo (R), que se define como el valor sérico de ALT sobre su valor normal (VN) dividido el valor sérico de FAL sobre su VN. Si el R>5, el patrón es hepatocelular; R 2-5, mixto; R<2, colestásico.2
Clasificación de la lesión de acuerdo con las anormalidades del hepatograma y su histología:
1. Hepatitis: R>5. ALT elevada 3 o más veces del valor normal, aspartatoaminotransferasa (AST) elevada, FAL y gamma glutamiltranspeptidasa (GGT) levemente elevadas. Síntomas: debilidad, fatiga, vómitos. Histología: necrosis celular, inflamación y moderada estasis biliar. Ejemplos: acetaminofén, isoniazida, té verde.
2. Colestasis: R<2. FAL elevada 2 o más veces del valor normal, GGT muy elevada, ALT, AST levemente elevadas. Síntomas: ictericia, prurito y dolor en el hipocondrio derecho. Histología: estasis biliar, inflamación portal, con proliferación ductal y ductular. Ejemplos: amoxicilina-clavulánico, difenilhidantoína, esteroides.
3. Mixto: R 2-5. ALT y FAL elevadas en forma similar. Síntomas: fatiga, ictericia y prurito. Histología: necrosis hepatocitaria, inflamación y marcada estasis biliar. Ejemplos: sulfonamidas, diclofenac.14,15
De acuerdo con esta clasificación, el daño hepático inducido por drogas puede tener las siguientes presentaciones clínicas (Tabla 1):
Tabla 1. Drogas y sustancias más frecuentes que causan hepatotoxicidad
1. Necrosis hepática aguda: rápido comienzo de la lesión hepatocelular luego de la exposición a la droga, con clínica y análisis de laboratorio de falla hepática y marcado aumento de la ALT. Puede ser mortal, pero la recuperación en los casos no fatales es rápida al suspender la droga. Ejemplo: acetaminofén, aspirina.
2. Hepatitis aguda: similar a las hepatitis agudas virales, con marcado aumento de ALT y daño hepatocelular. Los síntomas son náuseas, fatiga, ictericia, coluria, dolor abdominal. Ejemplos: isoniazida, ketoconazol.
3. Silente elevación de enzimas hepáticas: es la manifestación clínica más frecuente, con aumento de ALT y FAL, sin síntomas clínicos.
4. Hepatitis crónica: la lesión hepática persiste por más de 6 meses desde la suspensión de la droga. En algunos casos, solo representa una lenta mejoría del daño hepático; en otros, la droga puede disparar un proceso crónico en el hígado, como puede ser una hepatitis autoinmune.
5. Síndrome de obstrucción sinusoidal: es una forma rara pero grave que puede llevar a la falla hepática aguda. Se observa, principalmente, en pacientes trasplantados de médula ósea. Los síntomas más frecuentes son dolor abdominal, edemas, ascitis. Hay aumento de ALT con un patrón hepatocelular. Ejemplo: quimio y radioterapia.
6. Tumores hepáticos: están asociados a terapias prolongadas con lesión hepática crónica. Ejemplos: adenomas con estrógenos en altas dosis, adenocarcinoma con uso crónico de andrógenos y angiosarcoma con el uso de contrastes radiológicos.
7. Hepatitis autoinmune: se puede presentar con un aumento de inmunoglobulinas y marcadores para autoinmunidad positivos. Cuando se suspende la droga, los síntomas mejoran y el análisis de laboratorio se normaliza. Ejemplo: nitrofurantoína, metildopa.
8. Hígado graso no alcohólico: elevación moderada y persistente de enzimas hepáticas, con un patrón hepatocelular. En general, es asintomática, se diagnostica por ecografía o biopsia hepática y presenta una latencia de entre 3 y 12 meses. El cuadro se resuelve al suspender la droga. Ejemplos: corticoides, antidepresivos, antipsicóticos, metrotexato.16
Clasificación de gravedad en hepatotoxicidad por drogas y sustancias
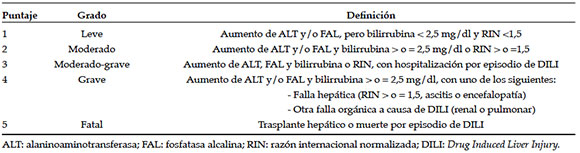
El grado de gravedad del daño hepático se clasifica en leve, moderado o grave según el nivel de bilirrubina y enzimas hepáticas, signos de falla hepática, recuperación, cronicidad o muerte (Tabla 2).1,2
Tabla 2. Clasificación de gravedad del daño hepático inducido por drogas
EXCLUSIÓN DE OTROS DIAGNÓSTICOS
El elemento final en el diagnóstico del daño inducido por drogas es descartar otras patologías que afectan al hígado. Esto incluye una historia clínica completa, con antecedentes personales y consumo de otras drogas concomitantes, análisis de laboratorio con hepatograma, coagulograma, serologías, marcadores de autoinmunidad, proteinograma e inmunoglobulinas, cobre sérico, ceruloplasmina, cupruria de 24 h y ecodoppler hepático.
¿Cuándo realizar una biopsia hepática?
1. Antes de la indicación de inmunosupresores con sospecha de hepatitis autoinmune versus DILI.
2. Aumento de enzimas hepáticas o empeoramiento de la función hepática luego de retirar la droga sospechosa de DILI.
3. Niveles de ALT que no descienden >50% a los 30-60 días del comienzo (DILI hepatocelular) o niveles de FAL que no descienden >50% a los 180 días del comienzo (DILI colestásicas), a pesar de haber suspendido la droga sospechosa de DILI.
4. Luego de 180 días de lesión hepática para evaluar enfermedad hepática crónica.16
HEPATOTOXICIDAD Y EL USO DE HIERBAS, SUPLEMENTOS DIETÉTICOS Y SUSTANCIAS RECREACIONALES
El uso terapéutico de hierbas medicinales es cada vez más frecuente, basado, fundamentalmente, en el hecho de pensar que los productos naturales o hierbas son siempre seguros. Se han reportado casos de insuficiencia hepática aguda grave tras la utilización de estos productos para el tratamiento de diferentes patologías. En Estados Unidos, la incidencia alcanza un 9% y, en los países de Asia, un 19-63% de los casos totales de DILI.
Los productos herbales y suplementos dietarios asociados más frecuentemente a DILI son Aloe vera, Centella asiática, Herbalife®, Valeriana, té verde y OxyElite Pro®, entre otros.17
La Amanita phalloides es un hongo que se encuentra en lugares húmedos, cubierto de hojas secas, debajo de robles y pinos. Su ingesta y posterior intoxicación produce una fase inicial de síntomas gastrointestinales que puede evolucionar a la insuficiencia hepática, con alta mortalidad. El tratamiento específico es el soporte hemodinámico y la administración dentro de las primeras 72 h de penicilina endovenosa y silibinina con su isómero silimarina, ambas bloquean la captación de la amatoxina por los hepatocitos. En los casos de niños con falla hepática aguda, debe considerarse tempranamente la posibilidad de realizar un trasplante hepático. En la anatomía patológica, puede hallarse necrosis centrolobulillar y degeneración grasa del hígado (Figura 1).18,19
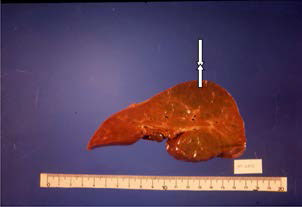
Macroscopía del hígado explantado: áreas de necrosis hemorrágica
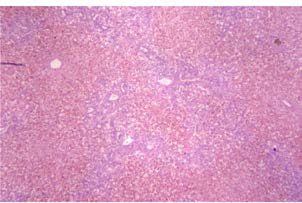
Histología: Se observa necrosis submasiva y hemorragia centrolobulillar.
Figura 1. Hígado explantado, macroscopía e histología de paciente con falla hepática aguda por intoxicación por Amanita phalloides
En los últimos años, se observó un aumento en el consumo de alcohol, drogas recreativas y uso de anabólicos, principalmente, en adolescentes.
El consumo excesivo de alcohol produce enfermedad hepática, que incluye hígado graso, hepatitis y cirrosis. El alcohol es metabolizado en el hígado, y sus consumidores tendrán aumento predominantemente de GGT y AST. El consumo diario no debe superar los 14 gramos en la mujer y 28 gramos en el hombre.20,21
El cannabis o marihuana es la droga recreacional más consumida en el mundo. Las formas de administración son por vía inhalatoria y oral, como comidas o bebidas. Los dos ingredientes más estudiados de la marihuana son el tetrahidrocannabinol y el cannabidiol. En el hígado, interfiere en el metabolismo de drogas a través del citocromo P450 y aumenta sus niveles séricos. Además, el receptor cannabinoide tipo 1 presenta efectos esteatogénicos. Los pacientes con hepatitis C crónica presentan, frecuentemente, esteatosis hepática, por lo tanto, el consumo diario de cannabis puede empeorarles la esteatosis y acelerar la progresión a fibrosis.22
La cocaína es una droga de abuso que se consume por vía intranasal, inhalada o endovenosa. Se considera la droga ilícita más peligrosa. Produce hepatitis citolítica, con aumento significativo de ALT pocas horas después del consumo, asociado a rabdomiolisis, y falla renal aguda. Se puede acompañar de shock, hipertermia e hipotensión.23
REEXPOSICIÓN A
UNA DROGA HEPATOTÓXICA
No está recomendada la reexposición a una droga sospechosa de haber causado hepatotoxicidad, en especial, en los casos en los que la lesión hepática inicial presentó un aumento significativo de ALT, falla hepática o ictericia prolongada. Existen excepciones cuando la vida del paciente depende de esa droga o no existe tratamiento alternativo. En estos casos, se deberá reintroducir la droga gradualmente y con estricto monitoreo del hepatograma.
TRATAMIENTO
La detección temprana y la suspensión de la droga hepatotóxica previene la progresión del daño hepático. El tratamiento de la falla hepática por hepatotoxicidad es similar al de la causa viral, incluso, puede requerir trasplante hepático. Existen dos drogas que se destacan y son ejemplo de un tratamiento específico: n-acetilcisteína para la toxicidad por acetaminofén y la carnitina para la toxicidad por ácido valproico.
El uso de ácido ursodesoxicólicoy antioxidantes está descrito para casos graves y prolongados de hepatotoxicidad. Hay estudios que avalan el uso de corticoides en los casos en los que el daño hepático es grave, acompañado de una reacción de hipersensibilidad multisistémica, que reduce la mortalidad.24,25
COMENTARIO
El daño hepático causado por drogas, hierbas, productos para adelgazar o para aumentar el rendimiento físico constituyen hoy un importante problema que afecta a la población general, a pacientes con patología precedente, pero también compete a los médicos, quienes indican diferentes tratamientos, a la industria farmacéutica y a los organismos de control.
El daño hepático inducido por drogas representa el 10-20% de los casos de falla hepática aguda y trasplante hepático. Sin embargo, la mayor parte de la información de hepatotoxicidad se obtiene con los datos referidos por el sistema de notificación y por la información publicada en las revistas médicas. Por consiguiente, la cuantificación real es, probablemente, solo la "punta de un iceberg".
A pesar de que la información epidemiológica sobre el efecto tóxico de los fármacos en el hígado es escasa, se sabe que la incidencia está aumentando de forma paralela a la introducción de nuevos agentes en el mercado, al incremento de la esperanza de vida, la polimedicación y al uso cada vez más extendido de productos herbales.
El diagnóstico de hepatotoxicidad es difícil y puede demandar un largo tiempo de estudios y de exclusión de otras enfermedades.
Ante la sospecha de hepatotoxicidad, es importante que el clínico pediatra pueda consultar con hepatólogos pediátricos o centros especializados en toxicología. En la Argentina, hay centros de referencia en toxicología, como son el Hospital Posadas y el Hospital de Niños Ricardo Gutiérrez, los cuales brindan información amplia telefónica y personalizada.
Dada la importancia del tema, numerosos hepatólogos de nuestro país participan del protocolo de estudio de hepatopatías asociadas a medicamentos, para el registro latinoamericano de hepatotoxicidad, dirigido por el Servicio de Gastroenterología y Hepatología del Hospital Provincial del Centenario, Rosario, y por la Unidad de Hepatología, Farmacología Clínica, del Servicio de Aparato Digestivo, Hospital Universitario, Málaga.
El Servicio de Gastroenterología, Hepatología y Trasplante Hepático e Intestinal Pediátrico del Hospital Italiano incorporó una sección de hepatotoxicidad que brinda asesoramiento a médicos y pacientes sobre la vigilancia de drogas y sustancias potencialmente hepatotóxicas para la prevención de efectos adversos. Además, ofrece seguimiento y eventual tratamiento de los pacientes que presentan daño hepático por drogas.
Agradecimientos
Al Dr. Fernando Bessone, coordinador del Registro Latinoamericano de Hepatotoxicidad (LATINDILI), por su asesoramiento, revisión del manuscrito y apoyo.
1. Fontana R, Seeff L, Andrade R, et al. Standardization of Nomenclature and Causality Assessment in Drug-Induced Liver Injury: Summary of a Clinical Research Workshop. Hepatology 2010;52(2): 730-42. [ Links ]
2. Aithal G, Watkins P, Andrade R, et al. Case Definition and Phenotype Standardization in Drug-Induced Liver Injury. Clin Pharmacol Ther 2011;89(6): 806-15. [ Links ]
3. Molleston J, Fontana R, Lopez M, et al. Characteristics of Idiosyncratic Drug-induced Liver Injury in Children: Results From the DILIN Prospective Study. J Pediatr Gastroenterol Nutr 2011;53(2): 182-9. [ Links ]
4. Amin M, Harpavat S, Leung D. Drug- induced liver injury in children. Curr Opin Pediatr 2015;27(5): 625-33. [ Links ]
5. Ocete-Hita E, Salmerón-Fernández MJ, Urrutia-Maldonado E, et al. Analysis of immunogenetic factors in idiosyncratic drug-induced liver injury in the paediatric population. J Pediatr Gastroenterol Nutr 2017;64(5): 742-7. [ Links ]
6. Chang C and Schiano T. Review article: drug hepatotoxicity. Aliment Pharmacol Ther 2007;25(10): 1135-51. [ Links ]
7. Pauls L, Senior J. Drug-Induced liver injury. Clinical investigator training course. 15 November 2012. [Online]. [Acceso: 26 de mayo de 2016]. Disponible en: https://www.fda.gov/downloads/training/clinicalinvestigatortrainingcourse/ucm340019.pdf.
8. American Academy of Pediatrics. Committee on Drugs. Acetaminophen toxicity in children. Pediatrics 2001;108(4): 1020-4. [ Links ]
9. Chalasani N, Hayashi P, Bonkovsky H, et al.ACG Clinical Guideline: The Diagnosis and Management of Idiosyncratic Drug-Induced Liver Injury. Am J Gatroenterol 2014;109(7): 950-66. [ Links ]
10. Chalasani N, Fontana R, Bonkovsky H, et al. Causes, clinical features, and outcomes from a prospective study of drug-induced liver injury in the United States. Gastroenterology 2008;135(6): 1924-34.e1-4. [ Links ]
11. Bessone F, Lucena M, Roma M, et al. Cyproterone acetate induces a wide spectrum of acute liver damage including corticosteroid-responsive hepatitis: report of 22 cases. Liver Int 2016;36(2): 302-10. [ Links ]
12. Benichou C, Danan G, Flahault A. Causality assessment of adverse reactions to drugs-II. An original model for validation of drug causality assessment methods: Case reports with positive rechallenge. J Clin Epidemiol 1993;46(11): 1331-6. [ Links ]
13. Danan G, Benichou C. Causality assessment of adverse reactions to drugs-I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol 1993;46(11): 1323-30. [ Links ]
14. Teschke R, Wolff A, Frenzel C, et al. Drug and herb induced liver injury: Council for International Organizations of Medical Sciences scale for causality assessment. World J Hepatol 2014;6(1): 17-32. [ Links ]
15. Saxena R. Liver Injury Due to Drugs and Herbal Agents. En: Saxena R. Practical Hepatic Pathology: A diagnostic approach. Philadelphia: Elsevier-Saunders; 2011: 311-51. [ Links ]
16. National Institute of Diabetes and Digestive and Kidney Diseases, National Library of Medicine.LiverTox Database: Clinical and Research Information on Drug-Induced Liver Injury [Online]. [Acceso: mayo de 2016]. Disponible en: https://livertox.nlm.nih.gov.
17. Leise M, Poterucha J, Talwalkar J. Drug-induced liver injury. Mayo Clin Proc 2014;89(1): 95-106. [ Links ]
18. Grabhorn E, Nielsen D, Hillebrand G, et al. Successful outcome of severe Amanita phalloides poisoning in children. Pediatr Transplant 2013;17(6): 550-5. [ Links ]
19. Talamoni M, Cabrerizo S, Cari C, et al. Intoxicación por Amanita phalloides, diagnóstico y tratamiento. Arch Argent Pediatr 2006;104(4): 372-4. [ Links ]
20. Agarwal S, Fulgoni V, Lieberman H. Assessing alcohol intake & its dose dependent effects on liver enzymes by 24-h recall and questionnaire using NHANES 2001-2010 data. Nutr J 2016;15(1): 62. [ Links ]
21. Office of Disease Prevention and Health Promotion. Dietary Guidelines for Americans 2015-2020 [Online]. [Acceso: diciembre de 2016]. Disponible en: https://health.gov/dietaryguidelines/2015/.
22. Mayo Clinic. Drugs and supplements. 2013 [Online]. [Acceso: diciembre den2016]. Disponible en: http://www.mayoclinic.org/drugs-supplements.
23. Tarantino G, Citro V, Finelli C. Recreational Drugs: a New Health Hazard for Patients with Concomitant Chronic Liver Diseases. J Gastrointestin Liver Dis 2014;23(1): 79-84. [ Links ]
24. Murray K. Drug-Induced Liver Disease. In: Kelly D. Diseases of the Liver and Biliary System in Children. 3rd ed. United Kingdom: Blackwell Publishing; 2008: 207-30. [ Links ]
25. Roberts E. Drug-Induced Liver Disease. InSuchy F, Sokol R, Balistreri W (edit). Liver Disease in Children. 3rd ed. Cambridge: Cambridge University Press; 2007: 478-512. [ Links ]














