Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.115 no.6 Buenos Aires Dec. 2017
http://dx.doi.org/10.5546/aap.2017.e404
ACTUALIZACIÓN
http://dx.doi.org/10.5546/aap.2017.e404
Alopecia areata. Actualidad y perspectivas
Dra. Karina J. Juárez-Rendóna,b, Dr. Gildardo Rivera Sánchezb, Dr. Miguel A. Reyes-Lópezb, Dr. José E. García-Ortizc, Dr. Virgilio Bocanegra-Garcíab, Dra. Iliana Guardiola-Avilaa y Dra. María L. Altamirano-Garcíad
a. Consejo Nacional de Ciencia y Tecnología (CONACYT).
b. Centro de Biotecnología Genómica, Instituto Politécnico Nacional, Reynosa, Tamaulipas, México.
c. División de Genética, Centro de Investigación Biomédica de Occidente, Centro Médico Nacional de Occidente, Instituto Mexicano del Seguro Social, Guadalajara, Jalisco, México.
d. Centro Dermatológico Brunnenhalt de Reynosa, Reynosa, Tamaulipas, México.
Correspondencia: Dra. Karina J. Juárez-Rendón: kjgenetic2012@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 6-1-2017
Aceptado: 21-5-2017
RESUMEN
La alopecia areata es un padecimiento dermatológico caracterizado por la pérdida de pelo no cicatricial del cuero cabelludo y/o del cuerpo, con una evolución impredecible y variable en los pacientes. A pesar de esfuerzos multidisciplinarios, su etiología sigue sin conocerse con exactitud, aunque algunas evidencias sugieren que factores ambientales, inmunológicos y genéticos podrían estar originando la enfermedad. El objetivo de esta revisión consiste en dar un panorama actual de las características clínicas, diagnóstico y tratamiento de la alopecia areata, analizar los mecanismos que podrían participar en su etiología, así como revisar algunas de las variantes génicas más importantes, que podrían conferir susceptibilidad al desarrollo de la enfermedad.
Palabras clave: Alopecia areata; Genes; Susceptibilidad.
INTRODUCCIÓN
La alopecia es un padecimiento común en los individuos, aunque, en algunos casos, puede estar asociada con otras enfermedades.1,2 Ejemplo de ello es la alopecia areata (AA) (OMIM 104000), caracterizada por la pérdida de pelo, no cicatricial,3 con una evolución variable e impredecible en cada paciente,4 la cual está clasificada en tres grupos de acuerdo con la gravedad y con las regiones en donde se observa la ausencia de pelo: 1) alopecia areata en parche (AA), considerada la forma más común e identificada por la presencia de parches redondos u ovalados en la cabeza (90% de los casos) o en diferentes regiones del cuerpo; 2) alopecia total (AT), en la cual existe una ausencia total o casi total de pelo en el cuero cabelludo; y 3) alopecia universal (AU), establecida como la más grave y diferenciada de las dos anteriores porque la pérdida total de pelo es observada en todo el cuerpo, que incluye la cara y el cuero cabelludo.5,6
Epidemiología
Se ha establecido que la AA afecta al 1-2% de la población general, con un riesgo estimado de presentar la enfermedad a lo largo de la vida de 1, 7%.7,8 Sin embargo, la prevalencia puede variar entre 0, 1% y 6, 9% dependiendo de la población estudiada.9 En Estados Unidos (EE. UU.), la AA afecta al 0, 7-3% de su población. En el Reino Unido, aproximadamente, 2% de su población presenta la enfermedad.10 En México, la prevalencia reportada se encuentra en 0, 2-3, 8%11 y, en Corea, se ha estimado que la AA afecta entre 0, 9% y 6, 9% de los individuos.12
La AA no distingue géneros, aunque algunos trabajos sugieren que tiene una ligera predominancia por las mujeres.3,13 Sin embargo, esto puede depender de la población estudiada, dado que, en países como la India y Turquía, el mayor número de casos corresponde al sexo masculino,14 que presenta las formas más graves en comparación con las mujeres (63% vs. 36%, respetivamente).15 Además, se ha reportado que la AA podría afectar a todos los grupos de edad,16 aunque alrededor del 25% de los individuos son niños.17 En neonatos, la AA ocurre con menor frecuencia y, según la literatura, el padecimiento podría aparecer en los primeros meses de vida.18,19
Los rangos de edad en que la AA se presenta oscilan entre los 4-5 años y los 15-40 años, con mayor predominio entre los 10 y los 25 años (60%). Sin embargo, estudios recientes reportan que 1-2% de individuos menores de 2 años y 2124% menores de 16 años también la manifiestan. En adultos con más de 60 años, la AA ocurre raramente.9,13,20
Etiología
La estructura básica del folículo piloso es considerada la más complicada e importante de los anexos de la piel, cuyas funciones primordiales son las siguientes: 1) defensa de los efectos de la radiación ultravioleta, 2) supresión de pérdida de calor y 3) sensación táctil.3 Además, se caracteriza porque atraviesa tres fases durante el ciclo de crecimiento normal: anágena, catágena y telógena. La fase anágena es considerada la etapa de crecimiento (1 cm por mes aproximadamente) y, por ende, la de duración más prolongada (26 años).7 En la fase catágena (2-4 semanas), el crecimiento de pelo es interrumpido, es decir, ocurre un proceso de apoptosis de queratinocitos, además de darse la preparación para la última fase del ciclo,3 la fase telógena (2-3 meses), caracterizada por ser una etapa de inactividad, en la que el pelo se va perdiendo y da lugar a un nuevo ciclo de crecimiento.21 No obstante, en los pacientes con AA, la pérdida de pelo podría deberse a la alteración de una de estas fases de crecimiento del folículo piloso, es decir, la transición prematura de la fase anágena a catágena2 o de anágena a telógena (Figura 1).7 Dicho evento no puede darse por sí solo, sino que diversos reportes han sugerido que, a pesar de que la etiología de la AA no se conoce con exactitud, es posible que factores ambientales, inmunológicos y genéticos sean los responsables de su desarrollo.22,23
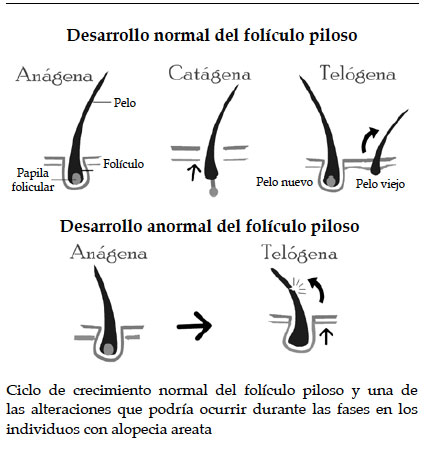
Figura 1. Fases de desarrollo del folículo piloso
Factores ambientales
En relación con el ambiente, se ha propuesto que uno de los factores que podría contribuir de manera importante al desarrollo de la AA es el estrés, pues algunos reportes señalan que, al menos, 23% de los pacientes experimentan algún evento emocional o una crisis de ansiedad previos al inicio de la AA.11,24,25 Otros factores, tales como infecciones, toxinas y la propia alimentación, podrían estar asociados a procesos de desregulación inmune y, por consiguiente, han sido propuestos como posibles desencadenantes de la enfermedad, aunque no todos han sido
validados.13,15
Factores inmunológicos
Diversos grupos de investigación han documentado que la AA tiene una fuerte asociación con enfermedades autoinmunes, como el vitiligo. Se estima que la probabilidad de que un paciente con AA lo presente es de 2 veces mayor que la población general, aunque los pacientes con AT y AU tienen un riesgo más alto, mientras que las personas que ya tienen vitiligo tienen 4 veces más posibilidad de desarrollar AA.26 Además, se ha observado que 2, 3% de los pacientes con enfermedad tiroidea, 3, 2% de los pacientes con diabetes mellitus tipo 1, 0, 9% con artritis reumatoide, 10-60% con anemia perniciosa y 4, 1% de pacientes con vitiligo podrían desarrollar AA,14,27 aunque la enfermedad de Addison, lupus eritematoso sistémico, miastenia gravis, esclerodermia, rinitis alérgica, dermatitis atópica, asma24 y psoriasis28 también han sido asociadas, por lo tanto, una historia positiva de enfermedades autoinmunes podría representar un grupo importante de pacientes con AA.10
Aunado a esto, se ha hipotetizado que la AA es causada porque los pacientes desarrollan anticuerpos que actúan contra la estructura de sus propios folículos pilosos en la fase anágena y, en relación con ello, se ha observado que los linfocitos T CD4+ y CD8+ se infiltran alrededor del bulbo del folículo piloso.13,29 Los linfocitos CD8+ son los responsables primarios del daño folicular y los más predominantes durante la activación de la enfermedad, mientras que los linfocitos CD4+ se presentan en menor cantidad y solo contribuyen con las células CD8+ para que la AA se desarrolle. Se ha propuesto que no solo los linfocitos CD4+ y CD8+ están involucrados en dichos procesos, sino que también participarían células natural killer, macrófagos, células de Langerhans y diversas citocinas30,31 que podrían generar tres sucesos: 1) formación de un proceso inflamatorio en la periferia de los parches, 2) alteración de los ciclos del folículo piloso y 3) inhibición de su crecimiento.29
Factores genéticos
La mayoría de los casos de AA son esporádicos.32 Sin embargo, existen reportes que señalan una fuerte asociación entre los factores genéticos y el desarrollo de la enfermedad,9 la cual está respaldada por 3 tipos de estudios: 1) de ligamiento basados en familias, 2) estudios en gemelos monocigóticos en los que se ha observado hasta un 50% de concordancia para el desarrollo de esta14 y 3) estudios basados en la heredabilidad en parientes de primer grado,10 en los que se ha reportado que la incidencia familiar positiva para AA es de 10-42%.16 3% de los pacientes tienen, al menos, un hermano con la enfermedad y 2% tienen, al menos, 1 hijo afectado,10 con un riesgo estimado de 6% en niños de pacientes con AA.13
Así mismo, se ha observado que la AA tiene un origen poligénico, es decir, no sigue un patrón mendeliano común atribuido a un solo locus génico, sino que intervienen múltiples genes que van a conferir mayor susceptibilidad al desarrollo de la enfermedad,9 por lo que, en los últimos años, se han desarrollado estudios de asociación de genes candidatos para AA,27 considerando las siguientes características para su elección: 1) que participen en procesos inflamatorios, 2) que sean genes reguladores de la inmunidad y 3) que participan en la diferenciación y mantenimiento de células T.24,28 De ahí que genes con funciones específicas en el folículo piloso, como STX17, PRDX5, ULBP6 y ULBP3, genes asociados a procesos inflamatorios o respuesta inmune, tales como HLA, NOCH4, MICA, IL13, IL4, PTPN2, IRG, IFN, NKG2D, IKZF4, CTLA4, así como los genes que se muestran en el Anexo han sido analizados en diversas investigaciones, con resultados variables dependiendo de la población estudiada.33
Manifestaciones clínicas
La AA en parche es la forma más común en niños. Se caracteriza por la presencia de áreas circulares u ovaladas de pérdida de pelo no cicatricial, en el cuero cabelludo, las cejas, las pestañas o en cualquier lugar donde haya pelo20 y, en adultos, además de las áreas mencionadas, pueden observase parches en la barba o, incluso, en el área púbica, con tamaño y número variable en cada paciente.21 En los casos más graves, como la AT o la AU, es evidente la pérdida casi completa de pelo en el cuero cabelludo o la cara y en todo el cuerpo, respectivamente.5
Diagnóstico
La realización de un diagnóstico preciso en pacientes con AA puede ser, en ocasiones, complejo, particularmente, en recién nacidos, dado el poco pelo que tienen en esta etapa.1,20 Por ello, el diagnóstico debe de estar basado en la historia clínica y en la exploración física.34 La historia clínica es uno de los elementos claves para identificar posibles disparadores de la enfermedad o determinar la presencia de algún otro desorden clínico en ellos2. La exploración física permitirá establecer un diagnóstico preciso mediante el apoyo de técnicas, como el signo de pilotracción y el signo de Jacquet, o con el uso de herramientas, como el dermatoscopio, con el cual se podrán observar puntos amarillos y pelo en forma de signos de exclamación en la periferia del parche, es decir, corto (con una longitud de 3-4 mm aproximadamente), roto y con un extremo distal amplio, aunque esta característica es visible solo en casos de AA simple.2,21,35
Las uñas y la apariencia del pelo también deben ser consideradas durante la exploración física. En el caso de las uñas, se ha reportado que 10-66% de los pacientes con AA podrían presentar alteraciones ungueales, pitts (pequeños hoyuelos), entre las más comunes,2,10,25 mientras que el pelo puede observarse con un color blanquecino, delgado y carente de brillo en algunos pacientes.35
Los exámenes histológicos, aunque no son necesarios para el diagnóstico, podrían ser de utilidad en casos particulares, dado que permiten observar agregados de células alrededor del bulbo de folículo piloso, que son las responsables de ocasionar los procesos inflamatorios.54 Además, las pruebas de laboratorio también podrían ser necesarias, sobre todo, en aquellos casos en los
que existan condiciones autoinmunes asociadas.35
El diagnóstico diferencial también debe ser considerado para establecer un diagnóstico preciso de AA. En niños, se realiza, principalmente, con la tricotilomanía y tinea capitis, alopecia triangular congénita y pérdida de pelo neonatal transitoria,20 aunque, tanto en niños como en adultos, debería ser considerado el efluvio telógeno y la alopecia por tracción. El lupus eritematoso y la alopecia androgénica son de mayor interés en adultos.55,56
Tratamiento
No existe tratamiento universal y totalmente aceptado para todos los casos de AA. Sin embargo, las guías de tratamientos para AA británica y japonesa han sugerido la inmunoterapia tópica (dinitroclorobenceno, difenilciclopropenona o el ácido escuárico dibutilester) como una de las opciones más efectivas,7,8 aunque también los corticoesteroides intralesionales, tópicos o sistémicos (acetónido de fluocinolona, triamcinolona acetonida, dexametasona, propionato de clobetasol, metilprednisolona y otros) son empleados en los pacientes con AA.10,14
Otras opciones de tratamiento incluyen la antralina, azatioprina,10 ciclosporina, metotrexato, sulfasalazina, minoxidil,21 adalimumab,29 tofacitinib y ruxolitinib.57,58 Todos los fármacos usados están encaminados a eliminar la inflamación, prevenir la pérdida de pelo y controlar los síntomas.2 No obstante, es importante señalar que los pacientes que se encuentran bajo tratamiento deben ser monitoreados clínicamente por los efectos adversos que pueden generarse, como ganancia de peso, necrosis avascular, hipertensión, diabetes, alteración del sueño, cambios en el estado de ánimo, acné, sensibilización ante alergias,21 coloraciones atípicas en el pelo,59 o hasta enfermedades, como el vitiligo ocasionado por la difenilciclopropenona.26
A pesar de las diversas opciones de tratamientos para AA, cada individuo puede responder de manera diferente tanto a los fármacos como a las enfermedades.29 Ejemplo de ello son los casos de AA graves, en los que la respuesta a cualquier fármaco puede depender de un conjunto de factores, tales como la edad de inicio, edad del paciente, antecedentes familiares, además de las condiciones clínicas que podrían estar asociadas.24
En los niños, las opciones son más limitadas dados los efectos adversos que generan,
por lo que deben prescribirse fármacos con efectos adversos menores, considerando que la mayoría de los casos en este grupo de edad son de remisión espontánea.60 Para casos de AA en parche, se utilizan, con mayor frecuencia, corticoesteroides tópicos, como el dipropionato de betametasona 0, 05%, propionato de clobetasol 0, 05% o la triamcinolona acetónido 0, 1% por 3-4 meses. Los corticoesteroides intralesionales en niños no son tolerados y deberían evitarse.25,61 Sin embargo, tanto el minoxidil 5% como la antralina tópica 1-2% podrían ser prescritos en estos pacientes.62 En casos graves de AA, se ha usado la inmunoterapia tópica (difenilciclopropenona), aunque la pulsoterapia de corticoesteroides ha mostrado menores efectos adversos en bajas dosis.63,64 El metotrexato está siendo evaluado en niños con AT o AU y la prednisolona se ha recomendado en algunos casos.63,65
Pronóstico
El curso de la AA tanto en niños como en adultos es impredecible. Sin embargo, se ha establecido que un mal pronóstico podría estar dado por la edad temprana de aparición, la extensión de pérdida de pelo, alteraciones en la uñas, historia familiar positiva para AA y la comorbilidad con enfermedades autoinmunes.21
Los casos graves se presentan, con mayor frecuencia, antes de la pubertad y tienen menos de 10% de probabilidad de que recuperen el pelo a pesar de los tratamientos.63
Manejo psicológico
La pérdida de pelo en niños y adultos tiene efectos psicológicos importantes no solo en los pacientes afectados, sino también en las familias, dado el efecto cosmético que causa. Baja autoestima, ansiedad, depresión y efectos negativos en su calidad de vida son algunos ejemplos.57,66 En los niños, particularmente, tales efectos podrían repercutir en su crecimiento y desarrollo,20,64 por lo que el paciente con AA debe recibir tanto asesoría médica como psicológica. El médico debería explicar al paciente o a los padres del paciente (cuando son niños) la naturaleza impredecible del padecimiento, el curso que podría tomar, los tratamientos disponibles en la actualidad y el éxito o fracaso que podrían tener. Los especialistas en salud mental deben trabajar con el paciente en el manejo de emociones y deben brindar soporte emocional en casos de recaídas.66
CONCLUSIÓN
La AA es un padecimiento cada vez más común en los individuos, que tiene efectos emocionales importantes en niños y adultos. En la actualidad, no existen tratamientos universales que garanticen bajas tasas de recaídas y efectos adversos menores, por lo que es necesario que nuevos fármacos sean desarrollados, a partir de genes (dianas terapéuticas) que participen en procesos autoinmunes o inflamatorios y en el desarrollo o función del folículo piloso.
Anexo
Variantes génicas asociadas con alopecia areata

1. Wohltmann WE, Sperling L. Histopathologic diagnosis of multifactorial alopecia. J Cutan Pathol 2016;43(6): 483-91. [ Links ]
2. Nalluri R, Harries M. Alopecia in general medicine. Clin Med (Lond) 2016;16(1): 74-8. [ Links ]
3. Qi J, Garza LA. An overview of alopecias. Cold Spring Harb Perspect Med 2014;4(3): a013615. [ Links ]
4. Betz RC, Petukhova L, Ripke S, et al. Genome-wide metaanalysis in alopecia areata resolves HLA associations and reveals two new susceptibility loci. Nat Commun 2015;6: 5966. [ Links ]
5. Rencz F, Gulácsi L, Péntek M, et al. Alopecia areata and health-related quality of life: a systematic review and metaanalysis. Br J Dermatol 2016;175(3): 561-71. [ Links ]
6. Haida Y, Ikeda S, Takagi A, et al. Association analysis of the HLA-C gene in Japanese alopecia areata. Immunogenetics 2013;65(7): 553-7. [ Links ]
7. Wolff H, Fischer TW, Blume-Peytavi U. The Diagnosis and Treatment of Hair and Scalp Diseases. Dtsch Arztebl Int 2016;113(21): 377-86. [ Links ]
8. Yoshimasu T, Furukawa F2. Modified immunotherapy for alopecia areata. Autoimmun Rev 2016;15(7): 664-7. [ Links ]
9. Salinas-Santander M, Sánchez-Domínguez C, Cantú-Salinas C, et al. Association between PTPN22 C1858T polymorphism and alopecia areata risk. Exp Ther Med 2015;10(5): 1953-8. [ Links ]
10. Islam N, Leung PS, Huntley AC, et al. The autoimmune basis of alopecia areata: A comprehensive review. Autoimmun Rev 2015;14(2): 81-9. [ Links ]
11. Olguín García MG, Martín del Campo A, Rodríguez Acar M, et al. Factores psicológicos asociados con la alopecia areata. Dermatol Rev Mex 2013;57(3): 171-7. [ Links ]
12. Kim SK, Chung JH, Park HJ, et al. Polymorphisms in the promoter regions of the CXCL1 and CXCL2 genes contribute to increased risk of alopecia areata in the Korean population. Genet Mol Res 2015;14(3): 9667-74. [ Links ]
13. Kim SK, Park HJ, Chung JH, et al. Association between interleukin 18 polymorphisms and alopecia areata in Koreans. J Interferon Cytokine Res 2014;34(5): 349-53. [ Links ]
14. Ranawaka RR. An observational study of alopecia areata in Sri Lankan adult patients. Ceylon Med J 2014;59(4): 128-31. [ Links ]
15. Alzolibani AA. Epidemiologic and genetic characteristics of alopecia areata (part 1). Acta Dermatovenerol Alp Pannonica Adriat 2011;20(4): 191-8. [ Links ]
16. Aytekin N, Akcali C, Pehlivan S, et al. Investigation of interleukin-12, interleukin-17 and interleukin-23 receptor gene polymorphisms in alopecia areata. J Int Med Res 2015;43(4): 526-34. [ Links ]
17. Nageswaramma S, Lakshmi Sarojini V, Vani T, et al. A clinico-epidemiological study of pediatric hair disorders. Indian J Paedr Dermatol 2017;18(2): 100-3. [ Links ]
18. Bonifazi E. Neonatal Alopecia Areata. Eur J Pediatr Dermatol 2011;21: 56. [ Links ]
19. Lopera A, Gómez L, Trujillo M. Alopecia areata neonatal tratada con tacrolimus tópico: reporte de un caso. Rev Asoc Colomb Dermatol Cir Dermatol 2010;18(3): 169-71. [ Links ]
20. Alves R, Grimalt R. Hair loss in children. Curr Probl Dermatol 2015;47: 55-66. [ Links ]
21. Spano F, Donovan JC. Alopecia areata: Part 1: pathogenesis, diagnosis, and prognosis. Can Fam Physician 2015;61(9): 751-5. [ Links ]
22. Kalkan G, Seqkin HY, Benli Í, et al. Relationship between manganese superoxide dismutase (MnSODAla-9Val) and glutathione peroxidase (GPx1 Pro 197 Leu) gene polymorphisms and alopecia areata. Int J Clin Exp Med 2015;8(11): 21533-40. [ Links ]
23. Bhanusali DG, Sachdev A, Olson MA, et al. PTPN22 profile indicates a novel risk group in Alopecia areata. Hum Immunol 2014;75(1): 81-7. [ Links ]
24. Hordinsky MK. Overview of alopecia areata. J Investig Dermatol Symp Proc 2013;16(1): S13-5. [ Links ]
25. Messenger A. Patient education: Alopecia areata (Beyond the Basics). UpToDate [Acceso: marzo de 2017]. Disponible en: https://www.uptodate.com/contents/alopecia-areata-beyond-the-basics.
26. Riad H, Mannai HA, Mansour K, et al. Diphenylcyclopropenone-induced vitiligo in a patient with alopecia universalis. Case Rep Dermatol 2013;5(2): 225-31. [ Links ]
27. Lu D, Chen L, Shi X, et al. A functional polymorphism in interleukin-1a (IL1A) gene is associated with risk of alopecia areata in Chinese populations. Gene 2013;521(2): 282-6. [ Links ]
28. Megiorni F, Mora B, Maxia C, et al. Cytotoxic T-lymphocyte antigen 4 (CTLA4) +49AG and CT60 gene polymorphisms in Alopecia Areata: a case-control association study in the Italian population. Arch Dermatol Res 2013;305(7): 665-70. [ Links ]
29. Gorcey L, Gordon Spratt EA, Leger MC. Alopecia universalis successfully treated with adalimumab. JAMA Dermatol 2014;150(12): 1341-4. [ Links ]
30. Kalkan G, Karakus N, Baş Y, et al. The association between Interleukin (IL)-4 gene intron 3 VNTR polymorphism and alopecia areata (AA) in Turkish population. Gene 2013;527(2): 565-9.
31. Seok H, Suh DW, Jo B, et al. Association between TLR1 polymorphisms and alopecia areata. Autoimmunity 2014;47(6): 372-7. [ Links ]
32. Alzolibani AA, Zari S, Ahmed AA. Epidemiologic and genetic characteristics of alopecia areata (part 2). Acta Dermatovenerol Alp Pannonica Adriat 2012;21(1): 15-9. [ Links ]
33. Norris DA. Genes and immune response in alopecia areata: review of the alopecia areata research summit first day proceedings. J Investig Dermatol Symp Proc 2013;16(1): S10-2. [ Links ]
34. Pratt CH, King LE Jr, Messenger AG, et al. Alopecia areata. Nat Rev Dis Primers 2017;3: 17011. [ Links ]
35. Restrepo R, Niño L. Alopecia areata, nuevos hallazgos en histopatología y fisiopatología. Rev Asoc Colomb Dermatol Cir Dermatol 2012;20(1): 41-53. [ Links ]
36. Wengraf DA, McDonagh AJ, Lovewell TR, et al. Genetic analysis of autoimmune regulator haplotypes in alopecia areata. Tissue Antigens 2008;71(3): 206-12. [ Links ]
37. Tazi-Ahnini R, Cork MJ, Gawkrodger DJ, et al. Role of the autoimmune regulator (AIRE) gene in alopecia areata: strong association of a potentially functional AIRE polymorphism with alopecia universalis. Tissue Antigens 2002;60(6): 489-95. [ Links ]
38. Jan A, Basit S, Wakil SM, et al. A novel homozygous variant in the dsp gene underlies the first case of non-syndromic form of alopecia. Arch Dermatol Res 2015;307(9): 793-801. [ Links ]
39. Alfadhli S, Kharrat NJ, Al-Tememy B, et al. Susceptible and protective endothelial nitric oxide synthase gene polymorphism in alopecia areata in the Kuwaiti population. Autoimmunity 2008;41(7): 522-5. [ Links ]
40. Kalkan G, Ateş O, Karakuş N, et al. Functional polymorphisms in cell death pathway genes FAS and FAS ligand and risk of alopecia areata. Arch Dermatol Res 2013;305(10): 909-15.
41. Fan X, Shangguan L, Li M, et al. Functional polymorphisms of the FAS/FASLG genes are associated with risk of alopecia areata in a Chinese population: a case-control analysis. Br J Dermatol 2010;163(2): 340-4. [ Links ]
42. Conteduca G, Rossi A, Megiorni F, et al. Single nucleotide polymorphisms in the promoter regions of Foxp3 and ICOSLG genes are associated with Alopecia areata. Clin Exp Med 2014;14(1): 91-7. [ Links ]
43. Ahmed MS, Rauf S, Naeem M, et al. Identification of novel mutation in the HR gene responsible for atrichia with papular lesions in a Pakistani family. J Dermatol 2013;40(11): 927-8. [ Links ]
44. Nucara S, Colao E, Mangone G, et al. Identification of a new mutation in the gene coding for hairless protein responsible for alopecia universalis: The importance of direct gene sequencing. Dermatol Online J 2011;17(1): 3. [ Links ]
45. Alfadhli S, Nanda A. Genetic analysis of interleukin-1 receptor antagonist and interleukin-1ß single-nucleotide polymorphisms C-511T and C+3953T in alopecia areata: susceptibility and severity association. Clin Exp Med 2014;14(2): 197-202. [ Links ]
46. Kalkan G, Yigit S, Karakuş N, et al. Methylenetetrahydrofolate reductase C677T mutation in patients with alopecia areata in Turkish population. Gene 2013;530(1): 109-12. [ Links ]
47. Alfadhli S, Nanda A. Genetic evidence for the involvement of NOTCH4 in rheumatoid arthritis and alopecia areata. Immunol Lett 2013;150(1-2): 130-3. [ Links ]
48. Betz RC, König K, Flaquer A, et al. The R620W polymorphism in PTPN22 confers general susceptibility for the development of alopecia areata. Br J Dermatol 2008;158(2): 389-91. [ Links ]
49. Cantu S, Salinas M, Lagos A, et al. Tumor necrosis factor alpha promoter-308G/A polymorphism in Mexican patients with patchy alopecia areata. Int J Dermatol 2012;51(5): 571-5. [ Links ]
50. Miao Y, Kang Z, Xu F, et al. Association analysis of the IL2RA gene with alopecia areata in a Chinese population. Dermatology 2013;227(4): 299-304. [ Links ]
51. Redler S, Albert F, Brockschmidt FF, et al. Investigation of selected cytokine genes suggests that IL2RA and the TNF/LTA locus are risk factors for severe alopecia areata. Br J Dermatol 2012;167(6): 1360-5. [ Links ]
52. Lew BL, Chung JH, Sim WY. Association between IL16 gene polymorphisms and susceptibility to alopecia areata in the Korean population. Int J Dermatol 2014;53(3): 319-22. [ Links ]
53. Kim HK, Lee H, Lew BL, et al. Association between TAP1 gene polymorphisms and alopecia areata in a Korean population. Genet Mol Res 2015;14(4): 18820-7. [ Links ]
54. Hordinsky MK. Treatment of alopecia areata: "What is new on the horizon?" Dermatol Ther 2011;24(3): 364-8. [ Links ]
55. Messenger AG, McKillop J, Farrant P, et al. British Association of Dermatologists' guidelines for the management of alopecia areata 2012. Br J Dermatol 2012;166(5): 916-26. [ Links ]
56. Alkhalifah A, Alsantali A, Wang E, et al. Alopecia areata update: part I. Clinical picture, histopathology, and pathogenesis. J Am Acad Dermatol 2010;62(2): 177-88. [ Links ]
57. Craiglow BG, Tavares D, King BA. Topical Ruxolitinib for the Treatment of Alopecia Universalis. JAMA Dermatol 2016;152(4): 490-1. [ Links ]
58. Castelo-Soccio L, Mcmahon P. Pediatric Dermatology. J Clin Aesthet Dermatol 2017;10(3): S8-15. [ Links ]
59. Delorenze LM, Gavazzoni-Dias MF, Teixeira MS, et al. Concentric Polycyclic Regrowth Pattern in Alopecia Areata. Int J Trichology 2016;8(1): 35-7. [ Links ]
60. Lorizzo M, Oranje AP. Current and future treatments of alopecia areata and trichotillomania in children. Expert Opin Pharmacother 2016;17(13): 1767-73. [ Links ]
61. Spano F, Donovan JC. Alopecia areata: Part 2: treatment. Can Fam Physician 2015;61(9): 757-61. [ Links ]
62. Özdemir M, Balevi A. Bilateral Half-Head Comparison of 1% Anthralin Ointment in Children with Alopecia Areata. Pediatr Dermatol 2017;34(2): 128-32. [ Links ]
63. Jahn-Bassler K, Bauer WM, Karlhofer F, et al. Sequential high- and low-dose systemic corticosteroid therapy for severe childhood alopecia areata. J Dtsch Dermatol Ges 2017;15(1): 42-7. [ Links ]
64. Lalosevic J, Gajic-Veljic M, Bonaci-Nikolic B, et al. Combined oral pulse and topical corticosteroid therapy for severe alopecia areata in children: a long-term follow-up study. Dermatol Ther 2015;28(5): 309-17. [ Links ]
65. Anuset D, Perceau G, Bernard P, et al. Efficacy and Safety of Methotrexate Combined with Low- to Moderate-Dose Corticosteroids for Severe Alopecia Areata. Dermatology 2016;232(2): 242-8. [ Links ]
66. Cortés G A, Mardones V F, Zemelman D V. Caracterización de las causas de alopecia infantil. Rev Chil Pediatr 2015;86(4): 264-9. [ Links ]














