Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.116 no.1 Buenos Aires feb. 2018
http://dx.doi.org/10.5546/aap.2018.e8
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2018.e8
Composición corporal y gasto energético en población de niños y adolescentes con mielomeningocele
Dra. Carolina Caminitia, Dra. Carola Saurea, Dra. Julieta Weglinskia, Dra. Fernanda de Castrob y Dra. Liliana Campmanyc
a. Servicio de Nutrición y Diabetes.
b. Hospital de Día Polivalente.
c. Consultorios Externos de Bajo Riesgo. Hospital "Prof. Dr. Juan P. Garrahan", Ciudad Autónoma de Buenos Aires.
Correspondencia: Dra. Carolina Caminiti: carocaminiti@gmail.com
Financiamiento: El trabajo fue realizado con una Beca de Docencia e Investigación del Hospital "Prof. Dr. Juan P. Garrahan".
Conflicto de intereses: Ninguno que declarar.
Recibido: 1-3-2017
Aceptado: 9-8-2017
RESUMEN
Introducción: El mielomeningocele es un defecto congénito con cierre incompleto del tubo neural. Presenta alteraciones en la composición corporal y alta prevalencia de obesidad. Es difícil detectar el indicador más apropiado para diagnóstico nutricional por impresición de las medidas antropométricas.
Objetivo: Describir en una población de pacientes con mielomeningocele seguidos en el "Hospital Garrahan", la composición corporal, gasto energético en reposo y trastornos metabólicos, comparando los pacientes con mielomeningocele obesos con una población control con obesidad multifactorial.
Población y Métodos: Se realizó antropometría, impedanciometría, pliegues cutáneos, perímetro braquial, calorimetría indirecta y determinaciones bioquímicas a todos los pacientes con mielomeningocele entre junio/2013-abril/2014, previa firma del Consentimiento Informado.
Resultados: Se evaluaron 131 pacientes de 0,718,6 años, clasificados según Score-Z de Índice de Masa Corporal en 15% bajo peso, 42% normopeso, 12% sobrepeso y 31% obesidad. Se encontró alta correlación (r20,74) entre %masa grasa por impedanciometría vs calculado con pliegues cutaneos. Los pacientes con % masa grasa elevada vs %masa grasa normal tuvieron mayor score-Z de Indice de Masa Corporal (1,07 vs -0,27 p0,0001) aunque ambos valores se encontraban dentro de parámetros normales. Hubo menor gasto energético en reposo en los pacientes con mielomeningocele obesos comparado con el esperado y con obesos multifactoriales. Conclusiones: Se encontró alto porcentaje de sobrepeso/obesidad en la población con mielomeningocele. Los pliegues cutáneos serían más apropiados para detectar obesidad. Los pacientes con mielomeningocele obesos presentaron gasto energetico en reposo menor al esperado y a los controles. La indicación de energía debe ser personalizada.
Palabras clave: Mielomeningocele; Obesidad; Gasto energético; Composición corporal.
INTRODUCCIÓN
El mielomeningocele es un defecto congénito que se produce como consecuencia del cierre incompleto del tubo neural durante la cuarta semana de gestación. Está asociado a defectos sensitivos y motores que dependen de su magnitud y localización.1 La incidencia aproximada es de 1-2 casos cada 1000 nacidos vivos, pero varía ampliamente en diferentes países.2-4
La posición anormal intrauterina produce significativas deformidades ortopédicas al nacer que se acentúan durante la infancia temprana por desbalance muscular, efectos posturales, crecimiento, etc. El 80% de los niños con lesiones lumbares altas tienen baja talla; entre otras causas, se encuentran la hipoplasia de miembros inferiores, escoliosis,1 infecciones urinarias repetidas, insuficiencia renal crónica, etc.
Los niños con mielomeningocele presentan riesgo de padecer diversos desórdenes nutricionales. En promedio, la prevalencia de obesidad en los pacientes con mielomeningocele es de 42%,5 debido al incremento de masa grasa (MG) combinado con importante déficit de masa magra (MM). La obesidad puede conducir a exacerbación de comorbilidades, como limitación en el traslado, escaras por decúbito, menor autonomía, que comprometen aún más la calidad de vida,6 y consecuencias metabólicas, como resistencia a la insulina (RI), intolerancia a los hidratos de carbono, diabetes mellitus, hígado graso, dislipidemia, hipertensión arterial (HTA), síndrome de apnea obstructiva del sueño y aumento del riesgo cardiovascular, etc.7,8
La dificultad para realizar mediciones precisas por la patología ortopédica descrita y utilizar indicadores tradicionales, como el índice de masa corporal (IMC), sumada a la alteración en la composición corporal, obstaculiza el diagnóstico antropométrico.9 Varios estudios han analizado la utilización de distintas medidas5 y puntos de corte más apropiados con resultados diversos. Uno de los desafíos nutricionales en pacientes con mielomeningocele es detectar el indicador más adecuado para el diagnóstico de obesidad.4 Algunas de las consecuencias del diagnóstico antropométrico incorrecto son la sobreestimación del requerimiento energético y la subestimación de la presencia de complicaciones metabólicas.
OBJETIVO
Describir, en una población de pacientes con mielomeningocele en seguimiento en el Hospital Nacional de Pediatría "Prof. Dr. Juan P. Garrahan", la composición corporal, gasto energético en reposo (GER) y trastornos metabólicos, y comparar a los pacientes con mielomeningocele y obesidad con una población control con obesidad multifactorial.
POBLACIÓN Y MÉTODOS
El diseño del estudio fue analítico, prospectivo y observacional. Se incluyeron por muestreo consecutivo todos los niños y adolescentes de ambos sexos con mielomeningocele en seguimiento en el Hospital de Pediatría "Prof. Dr. Juan P. Garrahan" entre junio de 2013 y abril de 2014 que aceptaran participar en el estudio y firmaran el consentimiento informado. Fue aprobado por el Comité de Ética del Hospital. Se midió el peso con balanza camilla electrónica y la talla, en pacientes deambuladores, con altímetro de pared y, en no deambuladores, en decúbito dorsal con pediómetro. Se percentiló en tablas de peso/edad y talla/edad hasta los 60 meses con los estándares de la Organización Mundial de la Salud (OMS) y, a partir de los 61 meses, con las tablas argentinas.10 Se calculó el IMC como peso/talla2; se percentiló según estándares de la OMS y se clasificó como bajo peso a los pacientes con IMC Pc < 5; normopeso, IMC Pc 5-84; sobrepeso, IMC Pc ≥ 85 y < 95; y obesos, IMC Pc ≥ 95.
Se midió la tensión arterial (TA) con manguito que cubriera 2/3 del perímetro del brazo (esfigmomanómetro), en posición sentada y luego de 10 minutos de descanso. Se percentiló según las referencias Task Force.11 Se asumió HTA con TA sistòlica y/o diastólica Pc ≥ 95. Los pacientes con HTA fueron derivados a un especialista para su confirmación y estudio correspondiente. Se midieron los espesores de los pliegues cutáneos tricipital, subescapular y suprailíaco con plicómetro graduado en mm y el perímetro braquial con cinta métrica no extensible en el punto medio entre acromion y olécranon. En ambos casos, se percentilaron hasta los 60 meses utilizando estándares de la OMS y, a partir de los 61 meses, las referencias argentinas.10
Se clasificó en prepúberes y púberes por estadio de Tanner.
Se realizó dosaje de glucemia por glucosa-oxidasa, insulina por radioinmunoensayo con kit comercial, colesterol total y triglicéridos por método colorimétrico Color-CHOD-PAP y colesterol-HDL y LDL por método CHOD-PAP con precipitación con heparina. Se consideró dislipidemia HDL < 40 mg/dl y/o triglicéridos > 110 mg/dl.12 Todas las determinaciones se realizaron con ayuno de 12 horas.
La RI se calculó de acuerdo con el modelo de evaluación homeostática (homeostatic model assessment; HOMA, por sus siglas en inglés)13 insulina basal (μU/ml) x glucosa basal (mg/dl/18)/22,5. Se consideró RI un valor ≥ 2,5 (> 2 desvíos estándar -DE- del valor medio en una población control).14
Los pacientes fueron clasificados en tres grupos de acuerdo con el estudio de glucemia basal: normales (< 110 mg/dl), glucemia en ayunas alterada (110-126 mg/dl) y diabéticos (> 126 mg/dl).
Para la determinación de la composición corporal, se utilizó impedanciometría bioeléctrica de monofrecuencia. Además, se calculó, a partir de los pliegues cutáneos, el porcentaje de masa grasa (%MG) utilizando las siguientes fórmulas:
1. (15)Mujeres: 1,21 x (pliegue tricipital + subescapular) - 0,008 x (pliegue tricipital + subescapular)2 - 1,7.
2. (15)Varones: 1,33 x (pliegue tricipital + subescapular) - 0,013 x (pliegue tricipital + subescapular)2 - 2,5.
Se calculó MM como perímetro braquial (cm)/[3,14 x pliegue tricipital (mm)].
Para categorizar en %MG elevada, se utilizó ≥ Pc 90 de las referencias de McCarthy et al.16
Se midió el GER mediante calorimetría indirecta usando un analizador de intercambio de gas con medición del consumo de oxígeno (O2) y producción de dióxido de carbono (CO2) (CCM Express de Medgraphics) durante 20 minutos luego de 20 minutos de reposo.
A los pacientes con mielomeningocele y obesidad se los comparó con una población de obesos de origen multifactorial en seguimiento por el Servicio de Nutrición sin otra patología y que no estuvieran recibiendo ninguna medicación. Ambas poblaciones fueron apareadas por edad y sexo antes de su comparación.
Se realizó un análisis descriptivo y analítico. En primer lugar, se describió el comportamiento de cada variable y, según su distribución, se informó la media y sus respectivos DE para las variables normales y mediana y rango para las de distribución sesgada. Las variables normales se analizaron con el test de Student y las sesgadas, con Wilcoxon Rank Test. Las variables categóricas se analizaron con chi2/Fisher. Se realizó regresión lineal para determinar la magnitud de la correlación entre variables determinadas. Se asumieron test a dos colas y con significación estadística p < 0,05.
RESULTADOS
Se evaluaron 131 pacientes con diagnóstico de mielomeningocele. Todos aceptaron participar. La edad media fue de 8,1 años (0,7-18,6). El 50% (65/131) fueron varones. El 58%, prepúberes (44/131). El 33% (25/131) de los pacientes eran deambuladores. En la Tabla 1, se observan los resultados de las variables demográficas y clínicas.
Tabla 1. Variables demográficas y clínicas de los pacientes con mielomeningocele
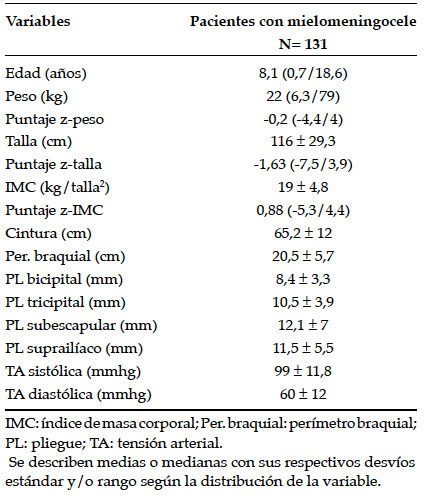
Se categorizó a la población según IMC en bajo peso: 15% (19/131); normopeso: 42% (55/131); sobrepeso: 12% (16/131); y obesidad: 31% (41/131).
El 25% tuvo cintura patológica (6/25 pacientes eran deambuladores). Se detectó HTA en el 25% de los pacientes (19/131) en una única medición. Ningún paciente presentó diabetes mellitus. Los casos de glucemia basal alterada fueron descartados con una segunda determinación, que concluyó que todos los pacientes analizados tuvieron glucemia en ayunas normal. En el 14% (18) de los pacientes, se constató RI. Con respecto a la dislipidemia, 13% (17) presentó hiper-TG y el 30% (39), colesterol HDL bajo. En la Tabla 2, se observan los resultados de las variables bioquímicas.
Tabla 2. Variables bioquímicas de los pacientes con mielomeningocele
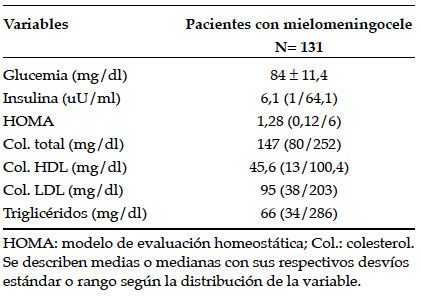
Se encontró asociación entre acantosis nigricans y RI (p 0,04) y no con HTA ni dislipidemia.
El 66% de los pacientes presentó %MG elevada por impedanciometría. No hubo diferencias entre el %MG ni porcentaje de masa magra (%MM) entre deambuladores y no deambuladores (%MG 23,8 ± 12,3 vs. 25,7 ± 9,8, p 0,46, y %MM 76 ± 1,5 vs. 74 ± 1,7, p 0,37, respectivamente). Tampoco se encontró asociación entre %MG y perímetro de cintura. En la Tabla 3, se describen las variables de gasto energético y composición corporal.
Tabla 3. Variables de composición corporal y gasto energético de los pacientes con mielomeningocele
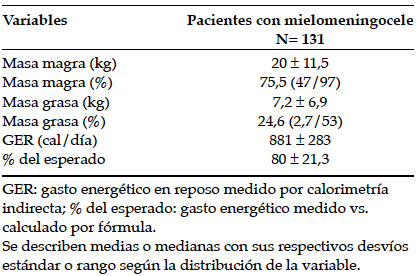
Se encontró alta correlación (r2 0,74) entre %MG observado por impedanciometría y el obtenido por pliegues cutáneos (23 ± 12,2 vs. 20,5 ± 8,9, respectivamente). También se encontró alta correlación (r2 0,81) entre MM absoluta por impedanciometría y la calculada con perímetro braquial y pliegues cutáneos (20,1 ± 11,5 vs. 17,2 ± 4,9, respectivamente).
Los pacientes con %MG elevada tuvieron mayor puntaje z-IMC que los que tenían %MG normal en forma significativa (puntaje z-IMC 1,07 vs. -1,27, p 0,00001), aunque ambos valores se encontraron dentro de los parámetros normales.
De los pacientes que cumplían el criterio para RI, solo 54,5% fueron diagnosticados como obesos por puntaje z-IMC, mientras que el 80% se diagnosticó por %MG elevada.
El GER medido en toda la población de mielomeningocele analizada fue de 881 ± 283 cal, que fue menor que el esperado calculado por fórmula (GER 77 ± 21% del esperado).
Por último, se compararon los pacientes con mielomeningocele obesos (N= 31) con controles obesos (N= 27) multifactoriales apareados por edad y sexo. La mediana de edad de ambas poblaciones fue 9,2 ± 2,8 vs. 10 ± 1,69 años, p 0,23, respectivamente (rango de edad de 4,4 a 14,7 años). Los datos comparativos se observan en la Tabla 4.
Tabla 4. Variables de composición corporal y gasto energético de pacientes con mielomeningocele obesos vs. pacientes obesos multifactoriales
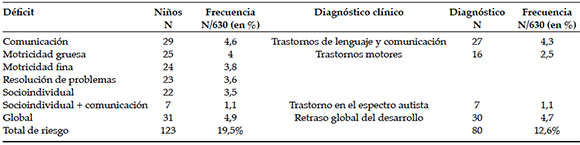
La población de pacientes con mielomeningocele obesos presentó significativamente menor magnitud de obesidad que los controles (puntaje z-IMC 2,2 ± 1,6 vs. 3,4 ± 1,2, p 0,0001), aunque sin diferencias significativas en %MG (30 ± 7,7 vs. 33 ± 5,6%, p 0,14).
Además, a pesar de presentar la misma magnitud de MG, se encontró que los pacientes con mielomeningocele tenían menor GER que los controles (82 ± 23 vs. 108 ± 23,9%, p 0,0048).
DISCUSIÓN
El 43% de los pacientes con mielomeningocele presentaron sobrepeso/obesidad, en coincidencia con otros autores, como Fiore et al.17 y Littlewood et al.6 Este porcentaje es superior al 31% en promedio de prevalencia en los diferentes grupos etarios en nuestro país sobre la base de la Encuesta Nacional de Nutrición y Salud (ENNyS),18 pero similar a otros estudios nacionales en adolescentes de ambos sexos.19
El 25% de los pacientes deambuladores tuvo cintura patológica y no se encontró asociación entre esta y %MG elevada. En coincidencia con la falta de asociación, estudios recientes demuestran mayor localización de MG en los miembros inferiores en esta población de pacientes.20 Existe también la posibilidad de que el reducido número de pacientes en esta categoría pudo haber subestimado la relación entre ambos indicadores.
Se detectó HTA en una cuarta parte de los pacientes en una única medición. Sin embargo, aunque están descritas causas de sobreestimación de la TA,21 llama la atención el alto porcentaje comparado con la publicación sobre síndrome metabólico a nivel nacional de Mazza et al.,19 que encontró una prevalencia del 13,5% de HTA en adolescentes obesos. Una de las causas orgánicas para descartar es la alteración en la función renal, que podría justificar este hallazgo clínico.
Además, a pesar de que el porcentaje de obesidad fue mayor que en la población general, se encontró menor prevalencia de RI y dislipidemia, en coincidencia con estudios sobre mielomeningocele recientes,22 aunque en controversia con trabajos previamente citados en adolescentes obesos.19 Lorenzana et al.20 constataron el incremento de adiposidad intramuscular en los miembros inferiores, que, a pesar de ser un factor de riesgo para complicaciones metabólicas comparado con el depósito subcutáneo, podría justificar el aumento en el %MG periférico en lugar de central. Otros estudios23 también confirman dicha localización periférica de MG, en particular en los miembros inferiores.
Al utilizar el %MG, el porcentaje de pacientes con mielomeningocele obesos asciende al 66% comparado con puntaje z-IMC. Sin embargo, como se observa, las medianas de puntaje z-IMC se encuentran dentro del rango normal, lo que confirma la subestimación de la magnitud de obesidad del puntaje z-IMC, que coincide con la publicación de Liusuwan et al.,9 en la que no se encontró correlación entre IMC y %MG. Otros estudios, como el de Nelson et al.,24 encuentran 74% de pacientes con obesidad basados en indicadores directos de MG vs. 53% basados en puntaje z-IMC.
En el presente trabajo, se encontró alta correlación entre %MG por impedanciometría y fórmula de pliegues cutáneos, que coincide con otros estudios que encuentran alta correlación entre pliegues cutáneos y potasio corporal total.8 A su vez, se encontró correlación entre MM absoluta con impedanciometría y fórmula por perímetro braquial y pliegues cutáneos, por lo que ambas serían medidas apropiadas para evaluar la alteración de la composición corporal en estos pacientes. Grogan et al.25 encontraron 50% menos de MM en niños con mielomeningocele vs. controles.
A pesar de que, en nuestro trabajo, no se encontró diferencia significativa de composición corporal entre deambuladores y no deambuladores, se considera de gran importancia detectar MM basados en estudios como el de Buffart et al.26 sobre riesgo cardiovascular en adolescentes y adultos jóvenes con mielomeningocele, en el que se halló que los pacientes deambuladores presentaron mayor nivel de actividad física, menor %MG y menor riesgo cardiovascular comparado con los no deambuladores. Esto resalta la importancia de realizar actividades que mejoren la composición corporal para aumentar la MM.
Al comparar la composición corporal en pacientes obesos con mielomeningocele y obesos multifactoriales apareados por edad y sexo, se encontró que, en los primeros, a pesar de tener puntaje z-IMC menor, el %MG fue mayor. Este resultado coincidide con estudios recientes, como el estudio citado de Mueske et al.23
Finalmente, en el presente trabajo, se observó menor GER comparado tanto con el gasto energético esperado como con el GER en controles. Esto último, incluso, a pesar de presentar similar %MG entre ambas poblaciones. Polfuss et al.,8 recientemente, publicaron una revisión en la que analizaron la bibliografía hasta la actualidad sobre gasto energético en pacientes con mielomeningocele. Los tres estudios que lo analizan coinciden en que el gasto energético es menor que el esperado. El primero, realizado por L. Bandini et al.27 en 1991 en 16 adolescentes con mielomeningocele, encontró menor GER que el esperado, así como menor gasto energético total (GET) en los no deambuladores. Más recientemente, Littlewood et al.6 y Liusuwan et al.9 analizaron GER y GET. En el primero, en 19 niños con mielomeningocele, encontraron que el GER era muy variable (96 ± 18% del esperado), mientras el GET estaba francamente descendido (73,3% del esperado). En el segundo, evaluaron a 66 pacientes con espina bífida de 11 a 21 años de edad y encontraron GER disminuido y asociado a menor MM. Basados en la evidencia descrita, la bibliografía coincide en hacer hincapié en reducir la ingesta energética por debajo de la recomendación para niños sanos para evitar el desarrollo de obesidad y sus complicaciones metabólicas y no metabólicas descritas anteriormente en la presente publicación.
Las limitaciones del estudio fueron las siguientes: 1) la falta de un método gold standard para composición corporal (potasio corporal total); 2) el reducido número de pacientes al categorizar en subgrupos, que pudo haber subestimado la asociación entre distintas variables. Mientras que las fortalezas fueron las siguientes: 1) especialmente, el número de pacientes estudiados con calorimetría indirecta; 2) su naturaleza prospectiva.
CONCLUSIONES
Se encontró una alta prevalencia de obesidad en la población con mielomeningocele seguida en nuestro Hospital. Los indicadores derivados de pliegues cutáneos y de perímetro braquial presentaron asociación estadísticamente significativa con %MG y MM absoluta. Los pacientes obesos con mielomeningocele presentaron menor GER comparado tanto con el esperado como con población de obesos multifactoriales.
1. Sandler AD. Children with Spina Bifida: Key Clinical Issues. Pediatr Clin N Am 5010:57(4):879-92. [ Links ]
2. Buffart LM, Roebroeck ME, Rol M, et al. Triad physical activity, aerobic fitness and obesity in adolescents and young adults with myelomeningocele. J Rehabil Med 2008;40(1):70-5. [ Links ]
3. Mayer S, Weisser M, Till H, et al. Congenitalmyelomeningocele - do we have to change our management? Cerebrospinal Fluid Res 2010;7:17. [ Links ]
4. Ponte SF, Rondon A, Bacelar H, et al. Anthropometric measurements as an indicator of nutritional status in spina bifida patients undergoing enterocystoplasty. Einstein (Sao Paulo) 2013;11(2):168-73. [ Links ]
5. Shurtleff D, Walker W, Duguay S, et al. Obesity and myelomeningocele: Anthropometric Measures. J Spinal Cord Med 2010;33(4):410-9. [ Links ]
6. Littlewood RA, Trocki O, Shepherd RW, et al. Resting energy expenditure and body composition in children with myelomeningocele. Pediatr Rehabil 2003;6(1):31-7. [ Links ]
7. Klein S, Burke LE, Bray GA, et al. Clinical implications of obesity with specific focus on cardiovascular disease, a statement for professionals from the American Heart Association Council of Nutrition, Physical Activity, and Metabolism endorsed by the American College of Cardiology Foundation. Circulation 2004;110(18):2952-67. [ Links ]
8. Polfuss M, Bandini LG, Sawin K. Obesity prevention for individuals with Spina Bifida. Curr Obes Res 2017;6(2): 116-26. [ Links ]
9. Liusuwan RA, Widman L, Abresch RT, et al. Body composition and resting energey expenditure in patients aged 11 to 21 years with spinal cord dysfunction compared to controls: comparisons and relationships among the groups. J Spinal Cord Med 2007;30(Suppl 1):S105-11. [ Links ]
10. Comité Nacional de Crecimiento y Desarrollo. Guías para la evaluación del crecimiento físico. Buenos Aires: Sociedad Argentina de Pediatría; 2013. [ Links ]
11. National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure in Children and Adolescents. Pediatrics 2004;114(2 Suppl 4th Report):555-76. [ Links ]
12. Cook S, Auinger P, Huang TT. Growth curves for cardio-metabolic risk factors in children and adolescents. J Pediatr 2009;155(3):S6.e15-26. [ Links ]
13. Haffner S, Miettinen H, Stern M. The Homeostasis Model in the San Antonio Heart Study. Diabetes Care 1997;20(7): 1087-92. [ Links ]
14. Guntsche Z, Guntsche EM, Saravi FD, et al. Umbilical wais-to-height ratio and trunk fat index (DXA) as markers of central adiposity and insulin resistance in Argentinean children with a family history of metabolic syndrome. J Pediatr Endocrinol Metab 2010;23(3):245-56. [ Links ]
15. Slaughter MH, Lohman TG, Boileau RA, et al Skinfold equations for estimation of body fatness in children and youth. Hum Biol 1988;60(5):709-23. [ Links ]
16. McCarthy HD, Cole TJ, Fry T, et al. Body fat reference curves for children. Int J Obes (Lond) 2006;30(4):598-602. [ Links ]
17. Fiore P, Picco P, Castagnola E, et al. Nutritional Survey of children and adolescents with myelomeningocele. Overweight associated with reduced energy intake. Eur J Pediatr Surg 1998;8(Suppl 1):34-6. [ Links ]
18. Argentina. Ministerio de Salud. Encuesta Nacional de Nutrición y Salud. Respuestas de la gente. Propuestas para el país. Documentos de resultados 2007. [Consulta: 9 de agosto de 2017]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000257cnt-a08-ennys-documento-de-resultados-2007.pdf.
19. Mazza C, Evangelista P, Figueroa A, et al. Estudio clinico del síndrome metabòlico en niños y adolescentes de Argentina. Rev Argent Salud Pública 2011;2(6):25-33. [ Links ]
20. Lorenzana D, Mueske N, Ryan D, et al. Quantitative analysis of lower leg adipose tissue distribution in youth with myelomeningocele. J Child Neurol 2016;31(8):979-81. [ Links ]
21. Grupo de Hipertensión. Consenso sobre factores de riesgo de enfermedad cardiovascular en pediatría. Hipertensión arterial en el niño y el adolescente. Arch Argent Pediatr 2005;103(4):348-66. [ Links ]
22. Liusuwan MS, Widman LM, Abresch RT, et al. Behavioral intervention, exercise and nutrition education to improve health and fitness (BENEfit) in adolescents with mobility imparement due to spinal cord dysfunction. Spinal Cord Med 2007;30(Suppl 1):S119-26. [ Links ]
23. Mueske NM, Ryan DD, Van Speybroeck AL, et al. Fat distribution in children and adolescents with myelomeningocele. Dev Med Chid Neurol 2015;57(3):273-8. [ Links ]
24. Nelson M, Widman LM, Abresch RT, et al. Metabolic Syndrome in Adolescents With Spinal Cord Dysfunction. J Spinal Cord Med 2007;30(Suppl 1):S127-39. [ Links ]
25. Grogan C, Ekwall SM. Body composition of children with myelomeningocele, determined by K40, urinary creatinine and anthropometric measures. J Am Col Nutr 1999;18(4):316-23. [ Links ]
26. Buffart LM, van der Berg-Emmons RJ, Burdorf A, et al. Cardiovascular disease risk factors and the relationship with physical activity, aerobic fitness, and body fat in adolescents and adults with myelomeningocele. Arch Phys Med Rehabil 2008;89(11):2167-73. [ Links ]
27. Bandini L, Schoeller D, Fukugawa N, et al. Body composition and energy expenditure in adolescents with cerebral palsy or myelodisplasia. Pediatr Res 1991;29(1):70-7. [ Links ]











 texto en
texto en 


