Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.116 no.3 Buenos Aires jun. 2018
http://dx.doi.org/10.5546/aap.2018.e371
ARTÍCULOS ORIGINALES
http://dx.doi.org/10.5546/aap.2018.e371
Hipercalcemia e hipofosfatemia en prematuros que reciben nutrición parenteral agresiva
Dr. Pablo H. Brener Dika, Dra. María F. Gallettia, Dra. Leticia T. Bacigalupoa, Dra. Silvia Fernández Jonusasa y Dr. Gonzalo L. Mariania
a. Departamento de Pediatría, Servicio de Neonatología, Hospital Italiano de Buenos Aires, Ciudad Autónoma de Buenos Aires.
Correspondencia: Dr. Pablo H. Brener Dik: pablo.brener@hospitalitaliano.org.ar
Financiamiento: Ninguno
Conflicto de intereses: Ninguno que declarar.
Recibido: 22-6-2017
Aceptado: 9-10-2017
RESUMEN
Introducción. La nutrición parenteral agresiva constituye un estándar de cuidado en prematuros de muy bajo peso. Sin embargo, investigaciones recientes evaluaron su impacto en los resultados a corto plazo, como la homeostasis mineral y electrolítica. El objetivo fue comparar la prevalencia de hipercalcemia e hipofosfatemia en prematuros que recibían nutrición parenteral agresiva o estándar.
Métodos. Estudio observacional retrospectivo que comparó a un grupo de prematuros menores de 1250 gramos que recibían nutrición parenteral agresiva con un grupo control histórico. Se calculó la prevalencia de hipercalcemia y se buscó la asociación con nutrición parenteral agresiva ajustando por confundidores. Se estimó la media de fosfatemia del grupo control mediante regresión lineal y se la comparó con el otro grupo.
Resultados. Se incluyeron 40 pacientes por grupo. La prevalencia de hipercalcemia fue mayor en el grupo de nutrición parenteral agresiva (87,5% vs. 35%, p= 0,001). La nutrición parenteral agresiva se asoció con hipercalcemia al ajustar por peso al nacer, restricción del crecimiento intrauterino, aporte de aminoácidos y calorías (ORa 21,8; IC 95%: 3,7-128). La media de calcemia fue diferente entre ambos grupos (p= 0,002). El grupo de nutrición parenteral agresiva presentó más sepsis sin alcanzar significancia estadística y su fosfatemia media resultó menor que la estimada para el grupo control (p= 0,04). La prevalencia de hipofosfatemia en este grupo fue de 90% (IC 95%: 76-97%).
Conclusiones. Nuestros datos muestran una asociación entre hipercalcemia/hipofosfatemia y nutrición parenteral agresiva. Se recomienda monitorizar la calcemia y la fosfatemia frecuentemente, ya que pueden estar asociadas con resultados clínicos adversos.
Palabras clave: Hipercalcemia; Hipofosfatemia; Nutrición parenteral; Prematuro.
INTRODUCCIÓN
Está ampliamente demostrado que el recién nacido pretérmino (RNPT) de muy bajo peso al nacer (PN, < 1500 gramos) tiene alto riesgo de desarrollar restricción de crecimiento posnatal,1,2 lo cual continúa siendo una complicación frecuente, a pesar de las recomendaciones sobre nutrición precoz y adecuada. La estrategia que combina la nutrición parenteral (NP) precoz y agresiva, que incluye un alto aporte de energía desde el primer día de vida, con el suministro temprano de leche humana se ha convertido en un estándar de cuidado.3,5 Esta estrategia ha mostrado optimizar la nutrición del paciente prematuro4,6,7 y reducir el potencial impacto negativo a largo plazo de la deficiencia nutricional, sobre todo, en el neurodesarrollo.8,9 Sin embargo, investigaciones recientes se han centrado en el impacto que esta estrategia nutricional provoca en los resultados a corto plazo, como la homeostasis electrolítica y mineral, especialmente, en el metabolismo fosfocálcico.10-13 Además, la NP agresiva se ha asociado con mayor incidencia de sepsis en este grupo de pacientes.9,14
La principal causa de este disturbio podría ser un aporte subóptimo de calcio y fósforo.15,16 Adicionalmente, el síndrome de realimentación, definido por la presencia de hipofosfatemia, hipercalcemia e hipokalemia, se ha relacionado con la nutrición temprana y rica en calorías.10,17 Según lo reportado por algunos autores, el alto aporte de aminoácidos en la primera semana de vida es el principal
factor relacionado con los niveles de calcio y fósforo en la sangre.1011 Además, este desorden se ha asociado, principalmente, a restricción del crecimiento intrauterino (RCIU).10,12,17 Los RNPT incluidos en programas de nutrición agresiva se encuentran en un estado de anabolismo, por lo cual consumen mayor energía, que podría conducir a una mayor utilización de fósforo.10
Se ha desarrollado el presente estudio para comprender mejor su causalidad, y se comparó a una cohorte de RNPT que recibieron NP agresiva con una alta prevalencia del trastorno con un grupo control histórico de pacientes que recibieron NP estándar. Nuestra hipótesis fue que este fenómeno se asociaba a NP agresiva. El objetivo principal fue comparar la prevalencia de hipercalcemia e hipofosfatemia durante la primera semana de vida entre ambos grupos.
MÉTODOS
Diseño: Estudio retrospectivo, observacional y analítico que comparó a dos grupos de pacientes similares, excepto por la NP recibida.
Población de estudio: Los pacientes RNPT menores de 1250 gramos al nacer eran elegibles para ser incluidos en el estudio:
Grupo 1: pacientes RNPT nacidos entre enero de 2012 y diciembre de 2014 que recibieron NP agresiva.
Grupo 2: pacientes RNPT nacidos entre enero de 2008 y diciembre de 2010 que recibieron NP estándar.
Criterios de exclusión: Pacientes sin medición de calcemia durante la primera semana de vida, aquellos con malformaciones congénitas mayores o quienes fallecieron en la sala de partos o dentro de las primeras horas de vida. Los pacientes nacidos en 2011 (año en el cual fue instaurada la NP agresiva) también fueron excluidos por posible superposición de ambas estrategias.
Exposición: Los pacientes del grupo 1 recibieron NP con aporte de aminoácidos (Aminoven Infant al 10%) de 3 a 4 g/kg/día, aporte de lípidos al 20% (Lipovenos MCT/LCT 20% o SMOF® lípidos 20%) de 2 a 3 g/kg/día desde el primer día de vida (NP preparada por Fresenius Kabi®, Buenos Aires, Argentina). Los pacientes del grupo 2 histórico recibieron NP con 2-3 g/kg/día de iguales aminoácidos y 0,5-2 g/kg/día de los mismos lípidos a partir del segundo o tercer día de vida. La fórmula consistió, para ambos grupos, en una mezcla de solución 3 en 1, que incluía dextrosa, aminoácidos y lípidos. No se realizaron otros cambios en la composición de NP más que los descritos anteriormente. Se utilizó gluconato de calcio (40 mg/kg/día) y glicerofosfato (20 mg/kg/día) en una proporción 2:1 (molar 1,5:1), que se mantuvo constante en ambos períodos.
Mediciones: Se recabaron valores de calcemia iónica y fosfatemia (correspondientes a la primera semana de vida) de la historia clínica electrónica de cada paciente. Se consideraron, para el análisis, el menor valor de fosfatemia y el mayor valor de calcemia registrados de cada paciente, así como los valores medios de ambos. Se reportaron valores de calcemia iónica en mmol/L (1 mmol/L= 4,01 mg/dl) y de fosfatemia en mg/dl (3,1 mg/dl= 1 mmol/L).
Variable primaria de resultado: Se comparó la prevalencia de hipercalcemia entre ambos grupos. Fue definida como todo valor de calcio iónico sérico por encima de 1,35 mmol/L.
Fosfatemia: No estaba disponible para el grupo histórico, ya que no se medía rutinariamente durante la primera semana de vida en esa época. Sin embargo, se estimó la media de fosfatemia histórica utilizando un modelo de regresión lineal derivado de nuestra cohorte reportada previamente.13 Se definió hipofosfatemia como todo valor por debajo de 4 mg/dl.
Variables demográficas: Se recabó la RCIU, definida como PN inferior al 10% para la edad gestacional (EG); EG, definida por la fecha de la última menstruación (FUM), y PN. Además, se comparó la media de calorías y aminoácidos recibida por cada paciente para asegurar que la variable de exposición fuera diferente entre ambos grupos.
Variables de resultado a corto plazo: Se compararon, entre ambos grupos, el requerimiento de asistencia respiratoria mecánica (ARM), el uso de inotrópicos y la sepsis.
Análisis estadístico: Se calcularon las medidas de tendencia central y la dispersión para variables continuas. Estos datos se reportaron como media (desvío estándar -DE-) o mediana (rango intercuartílico -RIC-) según la distribución y se compararon entre ambos grupos por medio de la prueba t de Student o Mann-Whitney según correspondiera. Tanto la hipercalcemia como otras variables dicotómicas se expresaron como porcentaje y se compararon utilizando la prueba de chi2. Se realizó un análisis univariado para evaluar la asociación entre NP agresiva e hipercalcemia. Luego, se realizó un análisis por regresión logística ajustando por variables de confusión, como PN, RCIU, aporte de aminoácidos y calorías. Se utilizó la regresión lineal sobre la base de los datos de fosfatemia y calcemia del grupo 1, con los que se podía estimar la fosfatemia en función de la calcemia (teniendo en cuenta que había correlación negativa significativa entre ambas). Luego, se estimó la media teórica de fosfatemia del grupo histórico en función de la media de calcemia de ese grupo. Se consideró significativo todo valor de p < 0,05.
Cálculo del tamaño muestral: Sobre la base del artículo previamente publicado,13 en el que se reportó una prevalencia de hipercalcemia del 80% en pacientes con NP agresiva, estimando una prevalencia en el grupo histórico del 50% (ya que era desconocida), con un poder del 80% y un alfa del 5%, se necesitaron incluir 40 pacientes por grupo. Estos fueron seleccionados por muestreo aleatorio simple. El análisis estadístico se realizó con el software Stata 13.
Consideraciones éticas: El estudio fue aprobado por el Comité de Ética en Protocolos de Investigación de nuestra Institución.
RESULTADOS
Durante el período estudiado, nacieron, en nuestro hospital, 164 RNPT con peso menor de 1250 gramos. Se excluyeron los 28 nacidos en 2011, 11 pacientes fallecidos en las primeras 48 h de vida y/o portadores de malformaciones congénitas y 5 sin medición de calcemia. Luego de aplicar dichos criterios de exclusión, quedaron 120 RNPT, de los cuales se seleccionaron 40 pacientes por grupo.
Las medias de EG y PN de la población total fueron 27,3 ± 2,4 semanas y 894 ± 192 gramos, respectivamente, y no se encontraron diferencias al compararlas entre los grupos. En la Tabla 1, se presentan las variables demográficas y de resultado a corto plazo que comparan a ambos grupos. Los RNPT que recibieron NP estándar requirieron con mayor frecuencia ARM y drogas vasoactivas. La incidencia de sepsis fue mayor en el grupo de NP agresiva, sin alcanzar significancia estadística. La prevalencia de hipercalcemia fue significativamente mayor en pacientes con NP agresiva. La NP agresiva se asoció a hipercalcemia (odds ratio -OR- 13; intervalo de confianza -IC- 95%: 4,1-41; p= 0,001). La media de calcemia iónica (mmol/L) fue diferente entre ambos grupos: 1,25 ± 0,10 vs. 1,13 ± 0,16, p= 0,002 (Figura 1). La media de fosfatemia en el grupo 1 fue de 3,35 ± 1,47 mg/dl y la prevalencia de hipofosfatemia fue de 90% (IC 95%: 76-97%) (los valores de fosfatemia solo estaban disponibles en este grupo). Luego, se compararon los pacientes hipercalcémicos con los normocalcémicos (Tabla 2). Los pacientes que presentaron hipercalcemia recibieron mayor aporte calórico y de aminoácidos. Además, presentaron mayor incidencia de RCIU, aunque esta diferencia no resultó significativa.
Tabla 1. Características de los pacientes según la estrategia nutricional
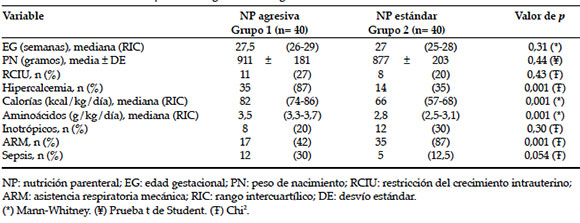
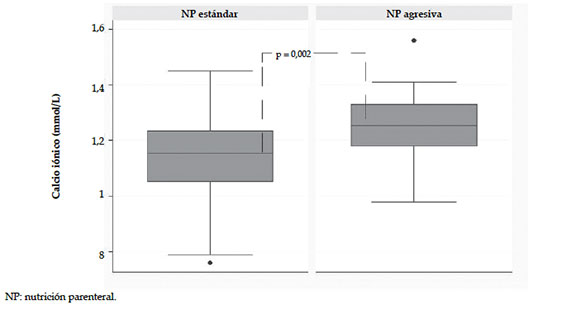
Figura 1. Media de calcemia iónica según la nutrición parenteral
Tabla 2. Características de los pacientes según el desarrollo de hipercalcemia

En un modelo de regresión logística (Tabla 3), la asociación entre NP agresiva e hipercalcemia mantuvo su significativa estadística luego de haber ajustado por PN, RCIU, aporte de aminoácidos y calorías (OR ajustado 21,8; IC 95%: 3,7-128). Finalmente, se realizó una regresión lineal para fosfatemia como función de calcemia, utilizando los datos del grupo 1 (Tabla 4). Luego, tomando el valor de la media de calcio iónico del grupo histórico 1,13 mmol/L (4,53 mg/dl), se estimó la media de fosfatemia de ese grupo: 4,2 mg/dl (IC 95%: 2,41-5,92). La fosfatemia media estimada del grupo histórico fue estadísticamente mayor que la fosfatemia del grupo que recibió NP agresiva: 4,2 mg/dl vs. 3,35 mg/dl (p= 0,04).
Tabla 3. Modelos univariado y multivariado: odds ratio y odds ratio ajustado de presentar hipercalcemia

Tabla 4. Ecuación de regresión lineal para fosfatemia como ' función de calcemia. Número de observaciones: 244

DISCUSIÓN
El presente estudio muestra que tanto la prevalencia de hipercalcemia como la media de calcio iónico son mayores en el grupo de pacientes que recibieron NP agresiva. En nuestra Unidad, se comenzó a utilizar esta estrategia nutricional en 2011, que reportó una alta prevalencia de hipofosfatemia temprana e hipercalcemia asociadas.13 Como, además, se mostró una correlación negativa entre calcemia y fosfatemia dentro de la primera semana de vida, se propone que la diferencia significativa en la calcemia media entre ambos grupos debería acompañarse de una diferencia similar en la media de fosfatemia. Al ser las variables demográficas estudiadas (EG, PN, RCIU) similares entre ambos grupos, mientras que la exposición (aporte de aminoácidos y calorías) es diferente, la asociación encontrada entre hipercalcemia y NP agresiva podría ser causal. Además, en el análisis multivariado, esta asociación permaneció significativa luego de ajustar por los posibles factores confundidores.
Existe bibliografía creciente que destaca este problema y describe sus posibles causas.10-18 Se ha descrito que puede asemejarse a lo que ocurre en la población pediátrica y adulta privada de nutrientes por largos períodos al reiniciar la alimentación19 y es probable que un aporte de calcio y fósforo subóptimo sea la principal causa de este desequilibrio. Moe y cois. estudiaron un grupo de RNPT < 28 semanas que recibieron diferentes aportes de fosfato en la NP. Encontraron que los niveles de fosfatemia se correspondieron con el aporte de fósforo, puesto que aquellos pacientes que recibieron menos cantidad de fósforo tuvieron menor fosfatemia.20 Al contrario de otros estudios, hallaron que el aumento del contenido de aminoácidos en las soluciones de NP no parecía tener ningún impacto en la ganancia de peso durante el primer mes de vida.20 Un reciente estudio prospectivo realizado por Christmann y cols. mostró que podía ocurrir tanto hipercalcemia como hipofosfatemia, aun luego de implementar una NP con mayor aporte de calcio y fósforo.16 En una investigación sobre una población de RNPT similar a la nuestra, Senterre y cols. concluyeron que los aportes más altos de calcio y fósforo con una relación molar < 1 evitaban este trastorno.15 Otros autores, recientemente, compararon a 2 grupos de RNPT que recibieron NP con alto aporte de aminoácidos y también recomendaron incrementar el aporte de estos minerales administrándolos en forma equimolar.21 En nuestro estudio, ambos grupos de pacientes recibieron NP (mezcla de solución de 3:1) con la misma cantidad de estos minerales en una proporción molar de 1,5:1 (40 mg/kg/día de gluconato de calcio y 20 mg/kg/día de glicerofosfato). Por lo tanto, es probable que se hayan administrado cantidades insuficientes y en proporción inadecuada, lo cual podría ser considerado como un factor importante para las alteraciones encontradas. Sin embargo, ambos grupos fueron expuestos a este probable inadecuado aporte, mientras que el resultado adverso ocurrió solo en el grupo que recibió NP agresiva.
Varios autores encontraron esta afección asociada a la RCIU.10,12,17 Ross y cols., publicaron, recientemente, un estudio de cohorte retrospectivo a 10 años, en el cual el síndrome de realimentación ocurrió en RNPT con RCIU nacidos de madres con preeclampsia, ajustado ese resultado a la práctica nutricional.17 Más aún, mostraron una relación entre displasia broncopulmonar e hipofosfatemia.17 En nuestro estudio previo, el 40% de los pacientes con hipofosfatemia presentaron RCIU.13 En el presente trabajo, los pacientes con hipercalcemia tuvieron más RCIU; sin embargo, esta asociación no resultó estadísticamente significativa.
El "síndrome de realimentación" a causa de la NP agresiva puede provocar hipofosfatemia, hipercalcemia e hipokalemia según algunos autores.1112 El alto aporte de aminoácidos durante la primera semana de vida fue el factor determinante de los niveles de calcio y fósforo en un análisis de ingesta de diferentes macronutrientes.11 En el presente estudio, se ha demostrado una fuerte asociación entre NP agresiva e hipercalcemia ajustando por otras variables relacionadas. El concepto de NP agresiva implica comenzar de manera temprana luego del nacimiento con un aporte alto de aminoácidos y lípidos. Como el aporte de aminoácidos no alcanzó significancia en nuestro modelo multivariado, es probable que otras características de la NP agresiva, como el aporte de lípidos o el tiempo desde el nacimiento hasta el comienzo de esta (que fue distinto en ambos grupos), estén implicadas en dicho concepto.
Existe un potencial impacto de este trastorno en los RNPT. El fósforo es esencial para la generación de trifosfato de adenosina (adenosine triphosphate; ATP, por sus siglas en inglés), por lo que su déficit influye directamente en el metabolismo celular.13,19,22 Se ha descrito debilidad neuromuscular y fracaso de extubación en pacientes adultos con hipofosfatemia,22,23 y un reporte reciente sobre un RNPT de bajo peso para la EG que manifestó bradicardia, insuficiencia ventilatoria e ictericia hemolítica atribuye esta presentación a un aporte inadecuado de fósforo y al síndrome de realimentación desencadenado por NP agresiva.24 Más aún, recientemente, se ha asociado la morbilidad respiratoria (displasia broncopulmonar grave) a la hipofosfatemia temprana en prematuros de muy bajo PN.25,26 Sin embargo, en el presente estudio, los RNPT con NP estándar (pacientes normocalcémicos) recibieron ARM con mayor frecuencia. Esto podría reflejar un cambio en la práctica clínica durante los últimos años en cuanto al manejo respiratorio en nuestra Unidad Neonatal, con mayor uso de ventilación no invasiva. El fósforo, además, interviene en la migración de células inmunes y fagocitos. Un estudio aleatorizado que compara dos estrategias nutricionales debió suspenderse al encontrar mayor sepsis en pacientes con NP agresiva.13 En nuestro estudio, los pacientes que recibieron NP agresiva presentaron mayor incidencia de sepsis, aunque esta diferencia no resultó estadísticamente significativa.
Nuestro estudio tiene limitaciones. Otros aspectos de la asistencia neonatal (como el manejo respiratorio antes mencionado), además de los estudiados, pueden haber cambiado entre ambos períodos. Estos también podrían explicar los resultados encontrados, además de la variable de exposición. Debido al diseño retrospectivo y observacional, no se puede establecer causalidad de manera absoluta. No obstante, nuestros datos apoyan firmemente la asociación estudiada. Además de comparar los valores de calcemia, hubiese sido apropiado realizar la misma comparación con la fosfatemia, pero no era medida históricamente. Como la comparación no fue realizada sobre la base de datos reales, es difícil asegurar la causalidad. De todos modos, se mostró una alta prevalencia de hipofosfatemia asociada a NP agresiva.
En conclusión, según nuestros datos, existe una asociación entre hipercalcemia/hipofosfatemia y NP agresiva en pacientes prematuros de muy bajo peso. Se recomienda un monitoreo frecuente de calcio y fósforo en RNPT que reciben NP agresiva, ya que puede estar asociada con resultados clínicos adversos.
Agradecimientos
Se honra la memoria del Dr. Carlos Fustiñana (fallecido), quien fue el mentor de esta investigación.
Se agradece al Dr. Gustavo Izbizky, especialista en Obstetricia, por ayudarnos con el manuscrito como asesor científico.
1. Clark R, Thomas P, Peabody J. Extrauterine growth restriction remains a serious problem in prematurely born neonates. Pediatrics 2003;111(5 Pt 1): 986-90. [ Links ]
2. Sakurai M, Itabashi K, Sato Y, et al. Extrauterine growth restriction in preterm infants of gestational age < 32 weeks. Pediatr Int 2008;50(1):70-5. [ Links ]
3. Ei Hassan NH, Kaiser JR. Parenteral Nutrition in the Neonatal Intensive Care Unit. Neo Reviews 2011;12(3):e130-40. [ Links ]
4. Dinerstein A, Nieto R, Solana C, et al. Early and aggressive nutritional strategy (parenteral and enteral) decreases postnatal growth failure in very low birth weight infants. J Perinatol 2006;26(7):436-42. [ Links ]
5. Ibrahim H, Jeroudi M, Baier RJ, et al. Aggressive early total parenteral nutrition in low birth weight infants. J Perinatol 2004;24(8):482-6. [ Links ]
6. Valentine C, Fernandez S, Rogers LK, et al. Early amino-acid administration improves preterm infant weight. J Perinatol 2009;29(6):428-32. [ Links ]
7. Fischer CJ, Maucort-Boulch D, Essomo Megnier-Mbo CM, et al. Early parenteral lipids and growth velocity in extremely-low-birth-weight infants. Clin Nutr 2014;33(3):502-8. [ Links ]
8. Lucas A, Morley R, Cole TJ, et al. Randomized trial of early diet in preterm babies and later intelligence quotient. BMJ 1998;317(7171):1481-7. [ Links ]
9. Stroomen K, Blakstad EW, Moltu SJ, et al. Enhanced Nutrient Supply to Very Low Birth Weight Infants is Associated with Improved White Matter Maturation and Head Growth. Neonatology 2015;107(1):68-75. [ Links ]
10. Ichikawa G, Watabe Y, Suzumura H, et al. Hypophosphatemia in small for gestational age extremely low birth weight infants receiving parenteral nutrition in the first week after birth. J Pediatr Endocrinol Metab 2012;25(3-4):317-21. [ Links ]
11. Bonsante F, Iacobelli S, Latorre G, et al. Initial amino acid intake influences phosphorus and calcium homeostasis in preterm infants. It is time to change the composition of the early parenteral nutrition. PLoS One 2013;8(8):e72880. [ Links ]
12. Boubred F, Herlenius E, Bartocci M, et al. Extremely preterm infants who are small for gestational age have a high risk of early hypophosphatemia and hypokalemia. Acta Paediatr 2015;104(11):1077-83. [ Links ]
13. Brener Dik P, Galletti M, Fernández Jonusas S, et al. Early hypophosphatemia in preterm infants receiving aggressive parenteral nutrition. J Perinatol 2015;35(9):712-5. [ Links ]
14. Moltu SJ, Strommen K, Blakstad E, et al. Enhanced feeding in very-low-birth-weight infants may cause electrolyte disturbances and septicemia-a randomized controlled trial. Clin Nutr 2013;32(2):207-12. [ Links ]
15. Senterre T, Abu Zahirah I, Pieltain C, et al. Electrolyte and mineral homeostasis after optimizing early macronutrient intakes in VLBW Infants on parenteral nutrition. J Pediatr Gastroenterol Nutr 2015;61(4):491-8. [ Links ]
16. Christmann V, de Grauw AM, Visser R, et al. Early Postnatal Calcium and Phosphorus Metabolism in Preterm Infants. J Pediatr Gastroenterol Nutr 2014;58(4):398-403. [ Links ]
17. Ross JR, Finch C, Ebeling M, et al. Refeeding syndrome in very-low-birth-weight intrauterine growth-restricted neonates. J Perinatol 2013;33(9):717-20. [ Links ]
18. Mena Nannig P, Cubillos Celis MP, Toro Jara C et al. Perfil bioquímico en sangre de cordón en prematuros extremos y crecimiento fetal. Rev Chil Pediatr 2016;87(4):250-4. [ Links ]
19. Manary MJ, Hart CA, Whyte MP. Severe hypophosphatemia in children with kwashiorkor is associated with increased mortality. J Pediatr 1998;133(6):789-91. [ Links ]
20. Moe K, Beck-Nielsen SS, Lando A, et al. Administering different levels of parenteral phosphate and amino acids did not influence growth in extremely preterm infants. Acta Pediatr 2015;104(9):894-9. [ Links ]
21. Mulla S, Stirling S, Cowey S, et al. Severe hypercalcaemia and hypophosphataemia with an optimised preterm parenteral nutrition formulation in two epochs of differing phosphate supplementation. Arch Dis Child Fetal Neonatal Ed 2017;102(5):F451-5. [ Links ]
22. Patel U, Sriram K. Acute respiratory failure due to refeeding syndrome and hypophosphatemia induced by hypocaloric enteral nutrition. Nutrition 2009;25(3):364-7. [ Links ]
23. Oud L. Transient hypoxic respiratory failure in a patient with severe hypophosphatemia. Med Sci Monit 2009;15(3):CS49-53. [ Links ]
24. Mizumoto H, Mikami M, Oda H, et al. Refeeding syndrome in a small-for-dates micro-preemie receiving early parenteral nutrition. Pediatr Int 2012;54(5):715-7. [ Links ]
25. Warburton A, Kumar N. Early hypophosphatemia in extremely low birth weight infant and respiratory outcome. Paper presented in PAS Meeting; 2016 April 30-May 3; Baltimore, MD.
26. Thekumparampil R, Chen Y, Xie X et al. Association between early hypophosphatemia and respiratory morbidities in very preterm infants. Poster session presented in Congress The Eastern Society for Pediatric Research; 2016 March 11-13; Philadelphia, PA. [Acceso: 26 de octubre de 2017]. Disponible en: https://www.aps-spr.org/regions/espr/meetings/Program/2016Program.pdf.














