Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.116 no.3 Buenos Aires jun. 2018
http://dx.doi.org/10.5546/aap.2018.e421
ACTUALIZACIONES
http://dx.doi.org/10.5546/aap.2018.e421
Miocardiopatía dilatada e insuficiencia cardíaca grave. Puesta al día para el médico pediatra
Dra. Paola Caviedes Bottnera, Dra. Tamara Córdova Fernándeza, Dr. Marcos Larraín Valenzuelab y Dr. Pablo Cruces Romeroc
a. Unidad de Paciente Crítico Pediátrica. Hospital El Carmen de Maipú.
b. Cardiología Infantil. Hospital El Carmen de Maipú.
c. Centro de Investigación de Medicina Veterinaria, Escuela de Medicina Veterinaria, Facultad de Ecología y Recursos Naturales, Universidad Andres Bello. Santiago, Chile.
Correspondencia: Dra. Tamara Córdova Fernández: tamara_cor@hotmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 27-3-2017
Aceptado: 18-10-2017
RESUMEN
La miocardiopatía dilatada es la principal causa de insuficiencia cardíaca que lleva a trasplante cardíaco. Su pronóstico es variable y depende de la etiología, la edad de presentación y el grado de insuficiencia cardíaca. El manejo está orientado a minimizar los síntomas y evitar la progresión de la enfermedad; se requiere de una evaluación integral en la pesquisa de comorbilidades y prevención de complicaciones que permitan mejorar la condición general de estos niños y atenuar su pronóstico. A continuación, se realiza una revisión orientada al manejo multidisciplinario que el pediatra debería considerar a la hora de enfrentarse a este tipo de pacientes.
Palabras clave: Miocardiopatía dilatada; Insuficiencia cardíaca; Tratamiento; Pronóstico; Pediatría.
GLOSARIO
ADH: hormona antidiurética.
ATP: adenosis trifosfato.
FAVI: fracción de acortamiento del ventrículo izquierdo.
FE: fracción de eyección.
GC: gasto cardíaco.
HLA: antígeno leucocitario humano.
IC: insuficiencia cardíaca.
IECA: inhibidor de la enzima convertidora de angiotensina.
IL: interleuquina.
KB: kappa beta.
MCD: miocardiopatía dilatada.
PA: presión arterial.
PNC: péptido natriurético cerebral.
RNA: ácido ribonucleico.
RRA: renina angiotensina aldosterona.
RVS: resistencia vascular sistémica.
SNC: sistema nervioso central.
TH: linfocitos T helper.
TNF: factor de necrosis tumoral.
VI: ventrículo izquierdo.
INTRODUCCIÓN
La MCD es una enfermedad progresiva y casi siempre irreversible del músculo cardíaco, caracterizada por la dilatación ventricular izquierda y la disminución de su función sistólica, lo cual conduce a IC y, más tardíamente, a falla orgánica múltiple, con una mortalidad de 20% al año y 56% a 4 años, por lo que es la principal indicación de trasplante cardíaco en adultos y niños.1,2 Su sintomatología es inespecífica (fatiga, disnea de esfuerzo y edema), lo que dificulta un diagnóstico temprano, y se desconoce su incidencia real, la cual se estima en 0,57 casos por 100 000 personas/año.3,4 Existen distintas etapas de esta entidad (latente, establecida y avanzada), cuyo abordaje terapéutico sería diferente. En esta revisión, se enfocará en el manejo multidisciplinario en la MCD avanzada.5
ETIOLOGÍA
La MCD tiene distintas etiologías; las principales causas en niños son la miocarditis y las enfermedades neuromusculares. Sin embargo, hasta en un 70% de los casos, no se identifica una causa, por lo que la MCD idiopática es la forma más frecuente, y su diagnóstico es de exclusión.6,7 Dentro de las causas identificables, la miocarditis y las arritmias podrían mostrar una mejoría funcional con un tratamiento oportuno9,13 (Tabla 1).
Tabla 1. Etiologías de miocardiopatía dilatada en la infancia

Es más frecuente en lactantes menores, varones (herencia ligada al X y mitocondrial) y en la raza negra.14
Patogenia y mecanismos de compensación
En la MCD, ocurre una respuesta adaptativa en el corazón con lesión difusa caracterizada por rigidez y fibrosis del cardiomiocito, interposición de células hipertrófica y atrófica, depósito de glicógeno, mitocondrias anormales y ausencia o disminución de miosina, actina, troponina y troponina T.15-17 En etiologías específicas, como posinfecciosa, se encuentra, además, un aumento del infiltrado inflamatorio, en el que las células TH1 y Th2 serían las responsables de la perpetuación de la inflamación.18-20 Algunos virus, al incorporar el RNA a la célula miocárdica, serían capaces de provocar una respuesta autoinmunitaria inducida por el reconocimiento de epítopes miocárdicos e inducir apoptosis de cardiomiocitos. Concordantemente, se ha encontrado un aumento de las citoquinas proinflamatorias en plasma (IL-6 y TNF-a), asociado de modo directo con la remodelación del cardiomiocito, la disminución de la contractibilidad miocárdica y la dilatación ventricular.21-23
En etapas tempranas de la MCD, la remodelación del VI es una respuesta adaptativa que compensa la reducción de la contractilidad. Sin embargo, con el tiempo, el VI se dilata y se hace disfuncional, lo que lleva a una falla anterógrada, con hipoperfusión periférica, y a una falla retrógrada, con edema pulmonar y congestión venosa, responsables de sus síntomas, y culmina en IC, principal causa de muerte.
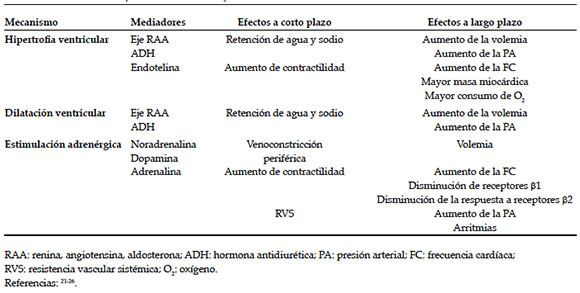
Los principales mecanismos de compensación, así como los mecanismos subyacentes y sus efectos tempranos y tardíos, son detallados en la Tabla 2. La activación del sistema nervioso simpático permite mantener un GC adecuado ante la disminución de leve a moderada del volumen eyectivo, por lo que se sugiere el empleo cauteloso de fármacos capaces de suprimir esta respuesta, como anestésicos sistémicos, que, a largo plazo, inducen una disminución en un 60-70% de la expresión de receptores pt y disminución de la respuesta a los receptores p224,25 (vide infra). Además, hay una elevación de prostaglandinas que permite preservar el flujo sanguíneo renal y antagoniza localmente los efectos de la hormona antidiurética, por lo que es aconsejable el uso juicioso de antiinflamatorios no esteroideos. Otros mecanismos descritos son el aumento del péptido natriurético atrial, que estimula la diuresis, el aumento del PNC, responsable de la hipertrofia miocárdica, y la activación del sistema de calicreína-quinina, que induce la vasodilatación renal.26
Tabla 2. Mecanismos compensatorios en la insuficiencia cardíaca
Sospecha diagnóstica
Los síntomas pueden ser inespecíficos, ya que podrían simular una patología respiratoria. La sospecha diagnóstica es mayor cuando se detecta taquicardia, síntomas y signos de IC. La radiografía de tórax pesquisa un aumento de la silueta cardíaca y, en las radiografías evolutivas, se puede apreciar la transición de oligohemia a congestión pulmonar. Se puede solicitar un electrocardiograma y enzimas cardíacas, y el ecocardiograma es el estudio confirmatorio. El cardiólogo puede complementar el estudio con una resonancia magnética nuclear, coronariografía u otros.27
Factores pronósticos clínicos y ecocardiográficos
Hay factores clínicos asociados a mayor mortalidad, como diagnóstico en menores de 14,3 años, IC establecida,27,28 estado nutricional y déficit de carnitina. Y otros asociados a mayor morbilidad, como el déficit de vitamina D, la anemia, los cuales serán detallados posteriormente.
La ecocardiografía se utiliza para la confirmación diagnóstica, la evaluación de la gravedad y la progresión de la enfermedad. Como factor pronóstico, se utiliza la medición de la FE, la FAVI y las dimensiones del VI de fin de sístole y fin de diástole, con su puntaje z, respectivamente. Un estudio mostro que los niños con una FE <35% presentaban una sobrevida de 50% a 4 años versus un 90% en niños con una FE mayor. Al comparar pacientes con MCD e IC grave, la media de la FAVI en los fallecidos fue 12% versus 21% en los sobrevivientes.28 Otro estudio determinó que una medición de dimensión fin de diástole del VI con puntaje z > 7,7 y velocidad de propagación de flujo VI con puntaje z > -0,28 eran predictores de progresión de la enfermedad.27-30
La elevación de biomarcadores, como el péptido natriurético atrial y el PNC, se considera un factor de mal pronóstico en pacientes incluso asintomáticos, y se encuentra una correlación directa con la dimensión ecográfica utilizada en el seguimiento cardiológico de estos pacientes: medición del VI en fin de diástole, tiempo de contracción isovolumétrica izquierda, índice de Tei y evaluación en modo M del diámetro del septum interventricular en sístole y diástole.27
También se ha encontrado, aunque menos específico que la MCD, que el aumento del ácido úrico y de procalcitonina puede correlacionarse con un mal pronóstico, especialmente, en los que presentan hipertensión pulmonar.27
Manejo integral del paciente con miocardiopatía dilatada
La mayoría de las veces, la MCD carece de tratamiento etiológico, por lo que su manejo está orientado a aliviar los síntomas, retrasar la insuficiencia cardíaca y prolongar la sobrevida. Sin embargo, este tiene una tasa de fracaso de 40% a los 2 años y puede llevar a IC refractaria que requiera de trasplante cardíaco.
El soporte farmacológico está basado en IECA, diuréticos, b bloqueo, digital y anticoagulación. Todo esto debe ir acompañado de una completa evaluación multidisciplinaria, que se detallará a continuación.
a) Cuidados nutricionales
La desnutrición es un marcador independiente de mortalidad y morbilidad en niños y adolescente con MCD e IC, y se asocia a hospitalizaciones frecuentes, retraso en el desarrollo y malos resultados postrasplante.31 Existe un riesgo de desequilibrio energético y malnutrición, por un alto gasto energético y una baja ingesta de alimentos.
Se pueden encontrar alteraciones gastrointestinales estructurales y funcionales como agentes causantes de desnutrición. En las estructurales, se encuentran cambios en la mucosa gástrica, edema de la pared intestinal y aumento del colágeno en el intestino delgado. Los cambios funcionales son ocasionados por la hipoperfusión intestinal, que genera una alteración en el transporte de proteínas, alto índice de colonización bacteriana y absorción de endotoxinas. A largo plazo, produce la disminución en la absorción intestinal y la pérdida de nutrientes.32
La desnutrición, además, contribuye a la disfunción miocárdica, disfunción endotelial, atrofia musculoesquelética, resistencia a la insulina y lipolisis. Por lo tanto, para el pediatra, es primordial entender el metabolismo y las formas que más beneficien el desarrollo integral del niño.
La restricción de volumen es una barrera importante que deja pocas alternativas nutricionales. La optimización del apoyo nutricional implica no solo satisfacer el gasto energético, sino también los requerimientos de macro- y micronutrientes. Para ello, se utilizan fórmulas concentradas o aditivos de alto contenido calórico, pero proporcionan un menor aporte proteico, que puede resultar en la degradación muscular. Para evitar esto, se recomienda un aporte proteico de 1,5-2,5 g/kg en lactantes y 0,8-1,5 g/kg en niños mayores. Una estrategia temprana destinada a reducir el gasto energético es la instalación de sondas de alimentación enteral. Con frecuencia, se utiliza la alimentación enteral continua nocturna para no intervenir con la rutina habitual del paciente.33
La evaluación nutricional no es sencilla. La estimación de peso es limitada por cambios de fluidos, incluso durante un mismo día, y el uso o no de diuréticos. La medición de pliegues, como el tríceps, y la medición de la circunferencia del brazo pueden no ser útiles en la estimación de la masa magra, ya que se ven alteradas con la presencia de edema. Por ello, se hace necesaria una evaluación complementaria con marcadores bioquímicos, como albúmina, prealbúmina, transferrina, transferritina, proteína de unión retinal y la proteína C reactiva. Se ha encontrado que pacientes con albúmina menor de 3 g/dl presentan estadías hospitalarias más prolongadas, independientemente de la causa de su hospitalización. Además, los pacientes con mayor albuminemia mostraron menores valores de PNC y menor uso de inotrópicos durante su hospitalización.34-36
Los niños con enfermedades crónicas y con aumento de citoquinas inflamatorias presentan resistencia a la hormona del crecimiento, por lo que el estado nutricional y los niveles de citoquinas son los principales determinantes de esta resistencia. Las citoquinas proinflamatorias, como TNF-a, actúan en el SNC alterando el apetito y el metabolismo energético, y proporcionan una señal que causa la pérdida de masa muscular (factor nuclear kB y vías proteolíticas ubiquitina dependientes de ATP). La pobre ingesta calórica y proteica puede interferir en el período crítico del crecimiento y es irreversible, en especial si ya se ha iniciado la pubertad. Las citoquinas parecen alterar la secreción de la hormona liberadora de la gonadotrofina y su capacidad de respuesta endógena a la testosterona, lo que agrava los efectos de la desnutrición y retrasa el desarrollo puberal.37
En la MCD causada por errores metabólicos, tales como los defectos de p-oxidación y los trastornos mitocondriales, se presenta una acumulación de ácidos orgánicos intermedios, que, al conjugarse con L-carnitina, pueden ser eliminados por la orina. Por tanto, el suplemento con L-carnitina es la piedra angular del tratamiento.38,39 Además, su uso en niños con IC mejora el estado nutricional, con aumento de la masa magra, de la FE y del área de superficie del VI, probablemente, como efecto secundario a un mejor rendimiento de los cardiomiocitos no hipertróficos, que compensan con una mayor fuerza contráctil.40-42
La vitamina D es responsable no solo de la absorción de calcio, sino también del buen funcionamiento inmune y de la proliferación celular. Existen receptores de vitamina D en el cardiomiocito que intervienen directamente en la contractilidad, sin interacción del calcio. Los niños con cardiopatía tienen más riesgo de presentar déficit de vitamina D. Aunque existen estudios contradictorios, el déficit de vitamina D se ha relacionado con mayores requerimientos de inotrópicos, mayores días de hospitalización, mayor riesgo de infecciones e inestabilidad en el manejo de fluidos.43-46 El suplemento por 12 meses con 1000 U/día de colecalciferol en niños con IC y MCD u otras patologías con disfunción sistólica del VI disminuye los marcadores de inflamación y mejora las dimensiones del VI y el índice de función sistólica.47
b) Actividad física
La combinación de un deficiente estado nutricional y la activación inmunológica pueden inducir anormalidades de la musculatura esquelética, con la reducción de la capacidad física y el empeoramiento de la calidad de vida. La inactividad induce la pérdida de masa muscular y el agravamiento de la desnutrición, por lo que se sugiere incentivar la actividad física y mantener rangos de movilidad de acuerdo con las condiciones cardiovasculares en que se encuentre.48
c) Hemoderivados
Es frecuente encontrar anemia ferropénica, ocasionada por la pobre ingesta, malabsorción, pérdidas a nivel intestinal, hematíes anormales, compromiso renal, inflamación crónica, hemodilución y uso crónico de medicamentos. Esta diversidad de causas hace primordial el suplemento de hierro por vía oral o endovenosa.
En potenciales receptores de trasplante, se sugiere limitar la exposición de transfusiones, ya que se consideran un factor de riesgo para el desarrollo de anticuerpos anti-HLA, relacionados con el rechazo al aloinjerto.49
d) Consideraciones anestésicas
Estos pacientes son más propensos a hacer hipotensión grave tras la administración de sedantes y anestésicos, ya sea por su enfermedad de base o por el uso de fármacos de efecto vasodilatador (IECA, p bloqueadores). El uso de anestésicos causa venodilatación y, por tanto, disminución de la precarga, así pueden acentuar la hipovolemia. Por ello, aunque haya registro de signos vitales en el rango de la normalidad, el uso de inotrópicos previo a un procedimiento que requiera sedación puede disminuir considerablemente la caída del GC. En general, los pacientes hospitalizados presentan mayor riesgo de hipotensión grave que los pacientes ambulatorios.50
Los fármacos más utilizados para la sedación/anestesia en pacientes con MCD son el propofol, ketamina, tiopental y etomidato. El propofol y el tiopental tienen un efecto hipotensor dependiente de la dosis y reducen súbitamente la precarga y la poscarga e, incluso, la contractilidad miocárdica. Además, la ketamina aumenta la FC y la PA en un corazón normal, pero también podría inducir la depresión miocárdica en estos pacientes, secundaria a la depleción de catecolaminas. En pacientes con miocardiopatía e IC terminal, se ha visto que disminuye la poscarga y genera hipotensión, junto con un mayor riesgo de isquemia, arritmias y paro cardíaco. El uso de etomidato no ha demostrado que genere disminución de la contractilidad, pero sí disminuye el cortisol y suprime la respuesta adrenal frente al estrés. Aun así, se recomienda en pacientes con IC terminal, ya que el riesgo relativo de generar hipotensión grave es menor al compararlo con el uso de otros anestésicos.51-53
Los opioides en dosis altas presentan alteración de la función cardíaca y menor respuesta al estrés, en especial, en procedimientos quirúrgicos; la morfina es la más reconocida para disminuir la precarga y/o la RVS. Si se combina el uso de opioides con benzodiacepinas, se aumenta al doble el riesgo de depresión circulatoria.53,54
El uso de gases anestésicos deprime la contractilidad y disminuye la RVS, lo que hace que el GC solo dependa de la precarga y el uso de drogas vasoactivas. El óxido nitroso parece tener poco efecto sobre la RVS. Sobre la base del riesgo de complicaciones, se sugiere que los pacientes con IC y FAVI < 25% se hospitalicen antes de un procedimiento anestésico, ya que existe hasta un 38% de riesgo de requerir soporte vasoactivo.54-57
e) Nuevas terapias
En pacientes con evidencia histológica de inflamación crónica activa, el uso de inmunoglobulinas e interferón beta mejoran la FE y la capacidad funcional.58,59
El estudio genético de familiares con MCD o distrofia muscular puede permitir su diagnóstico precoz y el eventual tratamiento para evitar la remodelación y la fibrosis miocárdica.5
El alto costo que conlleva un trasplante hace necesario buscar alternativas. En este sentido, se ha planteado el uso de células madres como enfoque potencial e innovador, que promueve la regeneración cardíaca mediante la sustitución de tejido enfermo. El ensayo más grande incluye a nueve niños con MCD, en el que cinco mejoraron su capacidad funcional, disminuyeron los niveles de PNC y mejoraron su contractilidad. De estos cinco, tres no lograron llegar posteriormente al trasplante.60,61 Es necesario profundizar los estudios para establecer su rol.
f) Vacunas
Los pacientes con IC tienen un mayor riesgo de hospitalización, pues presentan descompensaciones desencadenadas por la falta de adherencia al tratamiento, isquemia miocárdica e infecciones respiratorias. Si se considera que la congestión pulmonar predispone a infecciones respiratorias, las sociedades cardiológicas de América del Norte, Sur y Europa recomiendan vacunar a los menores de un año con palivizumab y a todos los niños con MCD contra la influenza y Streptococcus pneumoniae para optimizar al máximo la cobertura de inmunizaciones.62
g) Consideraciones psicosociales
Otro aspecto para considerar es el manejo y el reconocimiento de las alteraciones emocionales. Estos pacientes suelen presentar ansiedad y miedos propios de una enfermedad terminal. Se requiere de un acompañamiento psicológico personal y familiar que aborde la progresión de los síntomas, el diagnóstico, su tratamiento y pronóstico. El objetivo es lograr identificar los pensamientos irracionales sobre su enfermedad y normalizar las emociones que vaya expresando. Además, se deben sospechar e identificar los trastornos psicosociales para poder ser derivados en forma oportuna e iniciar su tratamiento. Se deben abordar las etapas posteriores y la aparición de nuevas complicaciones propias de la inmunosupresión postrasplante, para que el paciente y su entorno familiar tengan las herramientas necesarias para enfrentarlas.
1. Daubeney P, Nugent A, Chondros P, et al. National Australian Childhood Cardiomyopathy Study. Clinical featuresand outcomesofchildhood dilatedcardiomyopathy: results from a national population-based study. Circulation 2006;114()24:2671-8. [ Links ]
2. Naudi D, Rossano JW. Epidemiology and Cost of heart failure in children. Cardiol Young 2015;25(8):1460-8. [ Links ]
3. Towbin JA, Lowe AM, Colan SD, et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA 2006;296(15):1867-76. [ Links ]
4. Nugent AW, Daubeney PEF, Chondros P, et al. The epidemiology of childhood cardiomyopathy in Australia. N Eng J Med 2003;348(17):1639-46. [ Links ]
5. Japp AG, Gulati A, Cook SA, et al. The Diagnosis and Evaluation of Dilated Cardiomyopathy. J Am Coll Cardiol 2016;67(25):2996-3010. [ Links ]
6. Bostan OM, Cil E. Dilated cardiomyopathy in childhood: prognostic features and outcome. Acta Cardiol 2006;61(2):169-74. [ Links ]
7. Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society of Cardiology Working Group on Myocardial an pericardial diseases. Eur Heart J 2009;29(2):270-6. [ Links ]
8. Prasad AN, Chaudhary S. Intravenous immunoglobulin in children with acute myocarditis and/or early dilated cardiomyopathy. Indian Pediatr 2014;51(7):583-4. [ Links ]
9. Ono M, Shimizu J, Miyachi Y, et al. Control of autoimmune myocarditis and multiorgan inflammation by glucocorticoid-induced TNF receptor family-related protein(high), Foxp3-expressing CD25+ and CD25-regulatory T cells. J Immunol 2006;176(8):4748-56. [ Links ]
10. Sakaguchi S. Regulatory T cells: key controllers of immunologic self-tolerance. Cell 2000;101(5):455-8. [ Links ]
11. Carlquist J, Menlove R, Murray M, et al. HLA class II (DR and DQ) antigen associations in idiopathic dilated cardiomyopathy: validation study and meta-analysis of published HLA association studies. Circulation 1991;83(2):515-22. [ Links ]
12. Anderson JL, Carlquist JF, Hammond EH. Deficient natural killer cell activity in patients with idiopathic dilated cardiomyopathy. Lancet 1982;2(8308):1124-7. [ Links ]
13. Gerli R, Rambotti P, Spinozzi F, et al. Immunologic studies of peripheral blood from patients with idiopathic dilated cardiomyopathy. Am Heart J 1986;112(2):350-5. [ Links ]
14. Gagliardi MG. Dilated cardiomyopathy in children. Acta Paediatr Suppl 2006;95(452):14-6. [ Links ]
15. Sparks E, Boudoulas K, Raman S, et al. Heritable cardiac conduction and myocardial disease: from the clinic to the basic science laboratory and back to the clinic. Cardiology 2011;118(3):179-86. [ Links ]
16. Matitiau A, Perez-Atayde A, Sanders SP, et al. Infantile dilated cardiomyopathy: relation of outcome to left ventricular mechanics, hemodynamics and histology at the time of presentation. Circulation 1994;90(3):1310-8. [ Links ]
17. Balestrini L. Miocardiopatia Dilatada en niños. Cardiología Pediátrica. [Acceso:10 de noviembre de 2016]. Disponible en: www.fac.org.ar/tcvc/llave/c178/bales.htm.
18. Cooper LT. Myocarditis. N Engl J Med 2009;360(15):1526-38. [ Links ]
19. Fairweather D, Frisancho-Kiss S, Rose N. Viruses as adjuvants for autoimmunity: evidence from Coxsackievirus-induced miocarditis. Rev Med Virol 2005;15(1):17-27. [ Links ]
20. San Martin M, García A, Rodríguez F. Autoinmunidad y miocardiopatía dilatada: situación actual y perspectivas. Rev Esp Cardiol 2002;55(5):514-24. [ Links ]
21. Barranco Ruiz F, Blasco Morilla J, Mérida Morales A, et al eds. Insuficiencia Cardiaca. En: Principios de Urgencias, Emergencia y Cuidados críticos. Granada: Alhulia, 1999. [ Links ]
22. Moruno A, García-Angleu F, Coserria F. Miocardiopatías en la infancia. An Pediatr Contin 2007;5(2):77-84. [ Links ]
23. Towbin J, Lowe A, Colan S, et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children. JAMA 2006;296(15):1867-76. [ Links ]
24. Fisiopatología de la Insuficiencia Cardiaca. Apuntes de Fisiopatología Cardiovascular (re-edición 2011). [Acceso: 24 de octubre de 2017]. Disponible en: https://www.cardiouc.cl/CardiologiaUC/curso_iii/apuntes%203ro%202011/004FISIOPATOLOGIA%20DE%20LA%20INSUFICIENCIA%20CARDIACA.doc
25. Griffin ML, Hernandez A, Martin TC, et al. Dilated cardiomyopathy in infants and children. J Am Coll Cardiol 1988;11(1):139-44. [ Links ]
26. Guadalajara Boo J. Entendiendo la Insuficiencia cardiaca. Arch Cardiol Mex 2006;76(4):431-47. [ Links ]
27. Mathew T, Williams L, Navaratnam G, et al. Diagnosis and assessment of dilated cardiomyopathy: a guideline protocol from the British Society of Echocardiography. Echo Res Pract 2017;4(2):G1-13. [ Links ]
28. Kaddourah A, Goldstein S, Lipshultz S, et al. Prevalence, Predictors, and Outcome of Cardiorenal Syndrome in Children with Dilated Cardiomyopathy. A report from the pediatric cardiomyopathy registry. Pediatr Nephrol 2015;30(12):2177-88. [ Links ]
29. Richardson P, McKenna W, Bristow M, et al. Report of the 1995 World Health Organization/International society and Federation of Cardiology task force on the Definition an classification of the Cardiomyopathies. Circulation 1996;93(5):841-2. [ Links ]
30. Molina KM, Shrader P, Colan SD, et al. Pedictors of Disease Progression in Pediatric Dilated Cardiomyopathy. Circ Heart Fail 2013:6(6);1214-22. [ Links ]
31. Azevedo VM, Albanesi Filho FM, Castier MB, et al. O Impacto da desnutrido na cardiomiopatía dilatada idiopàtica na infancia. J Pediatr (Río J) 2004;80(3):211-6. [ Links ]
32. Romeiro F, Okoshi K, Zornoff L, et al. Alteraciones gastrointestinales asociadas a Insuficiencia Cardiaca. Arq Bras Cardiol 2012;98(3):273-7. [ Links ]
33. Wong S, Cheifetz, Ong C, et al. Nutrition Support for Children Undergoing Congenital Heart Surgeries: A Narrative Review. World J Pediatr Congenit Heart Surg 2015;6(3):443-54. [ Links ]
34. Ong C, Han WM, Wong JJ, et al. Nutrition biomarkers and clinical outcomes in critically ill children: a critical appraisal of the literature. Clin Nutr 2014;33(2):191-7. [ Links ]
35. Leite HP, Fisberg M, de Carvalho WB, et al. Serum albumin and clinical outcome in pediatric cardiac surgery. Nutrition 2005;21(5):553-8. [ Links ]
36. Radman M, Mack R, Barnoya J, et al. The effect of preoperative nutritional status on postoperative outcomes in children undergoing surgery for congenital heart defects in San Francisco (UCSF) and Guatemala City (UNICAR). J Thorac Cardiovasc Surg 2014;147(1):442-50. [ Links ]
37. Kyle UG, Shekerdemian LS, Coss-Bu JA. Growth Failure and Nutrition Considerations in Chronic Childhood Wasting Diseases. Nutr Clin Pract 2015;30(2):227-38. [ Links ]
38. Helton E, Darragh R, Francis P, et al. Metabolic aspects of myocardial disease and a role for L-carnitine in the treatment of childhood cardiomyopathy. Pediatrics 2000;105(6):1260-70. [ Links ]
39. Winter S, Jue K, Prochazka J, et al. The role of L-carnitine in pediatric cardiomyopathy. J Child Neurol 1995;10(Suppl 2):S45-51. [ Links ]
40. Azevedo VM, Albanesi Filho M, Castier M, et al. O Impacto da L-carnitina nos parámetros ecocardiográficos da cardiomiopatía dilatada na infancia. Rev Socerj 2005;18(Suppl A):S100-4. [ Links ]
41. Azevedo VM, Albanesi FM, Santos MA, et al. The role of L-carnitine in nutritional status and echocardiographic parameters in idiopathic dilated cardiomyopathy in children. J Pediatr 2005;81(5):368-72. [ Links ]
42. Pauly DF, Pepine CJ. The role of carnitine in myocardial dysfunction. Am J Kidney Dis 2003;41(4 Suppl 4):S35-43. [ Links ]
43. Venkatrans S, Chillinuri S, Adrish M, et al. Vitamin D deficiency is associated with mortality in the medical intensive care unit. Crit Care 2011;15(6):R292. [ Links ]
44. Braun AB, Gibbons KF, Litonjua AA, et al. Low serum 25-hydroxyvitamin D at critical care initiation is associated with increased mortality. Crit Care Med 2012;40(1):63-72. [ Links ]
45. Higgins DM, Wischmeyer PE, Queensland KM, et al. Relationship of vitamin D deficiency to clinical outcomes in critically ill patients. JPEN J Parenter Enteral Nutr 2012;36():713-20. [ Links ]
46. Rey C, Sanchez-Arango D, Lopez-Herce J, et al. Vitamin D deficiency at pediatric intensive care admission. J Pediatr (Rio J) 2014;90(2):135-42. [ Links ]
47. Abou-Zahr R, Kaudil SB. A pediatric critical care perspective on Vitamin D. Pediatr Res 2015;77(1-2):164-7. [ Links ]
48. Martinez P, Okoshi K, Zornoff, et al. Chronic heart failure induced skeletal muscle atrophy, necrosis, and changes in myogenic regulatory factors. Med Sci Monit 2010;16(12):BR374-83. [ Links ]
49. Thrush P, Hoffman T. Pediatric heart transplantation-indications and outcomes in the current era. J Thorac Dis 2014;6(8):1080-96. [ Links ]
50. Rosenthal DN, Hammer GB. Cardiomyopathy and heart failure in children: anesthetic implications. Pediatr Anaesth 2011;21(5):577-84. [ Links ]
51. Kudoh A, Matsuki A. Ketamine inhibits inositol 1,4,5-trisphosphate production depending on the extracellular Ca2+ concentration in neonatal rat cardiomyocytes. Anesth Analg 1999;89(6):1417-22. [ Links ]
52. Williams GD, Philip BM, Chu LF, et al. Ketamine does not increase pulmonary vascular resistance in children with pulmonary hypertension undergoing sevoflurane anesthesia and spontaneous ventilation. Anesth Analg 2007;105(6):1578-84. [ Links ]
53. Sprung J, Ogletree-Hughes ML, Moravec CS. The effects of etomidate on the contractility of failing and nonfailing human heart muscle. Anesth Analg 2000;91(1):68-75. [ Links ]
54. Rivenes SM, Lewin MB, Stayer SA, et al. Cardiovascular effects of sevoflurane, isoflurane, halothane, and fentanyl-midazolam in children with congenital heart disease: an echocardiographic study of myocardial contractility and hemodynamics. Anesthesiology 2001;94(2):223-9. [ Links ]
55. Ikemba CM, Su JT, Stayer SA, et al. Myocardial performance index wit sevoflurane-pancuronium versus fentanyl-midazolam-pancuronium in infants with a functional single ventricle. Anesthesiology 2004;101(6):1298-305. [ Links ]
56. Kipps AK, Ramamoorthy CR, Rosenthal DN, et al. Children with cardiomyopathy: complications after noncardiac procedures with general anesthesia. Pediatr Anaesth 2007;17(8):775-81. [ Links ]
57. Wong G, Morton N. Total intravenous anesthesia (TIVA) in pediatric cardiac anesthesia. Pediatr Anaesth 2011;21(5):560-6. [ Links ]
58. Frustad A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J 2009;30(16):1995-2002. [ Links ]
59. Kühl U, Pauschinger M, Schwimmbeck PL, et al. Interferon-beta treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation 2003;107(22):2793-8. [ Links ]
60. Rupp S, Jux C, Bönig H, et al. Intracoronary bone marrow cell application for terminal heart failure in children. Cardiol Young 2012;22(5):558-63. [ Links ]
61. Selem SM, Kaushal S, Hare J. Stem Cell Therapy for Pediatric Dilated Cardiomyopathy. Curr Cardiol Rep 2013;15(6):369-89. [ Links ]
62. Martins W, Ribeiro M, de Oliveira L, et al. Vacunación contra Influenza y Neumococo en la Insuficiencia Cardiaca - Una recomendación poco aplicada. Arq Bras Cardiol 2011;96(3):240-5. [ Links ]














