Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.116 no.6 Buenos Aires dic. 2018
http://dx.doi.org/10.5546/aap.2018.e736
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2018.e736
¿Existe alguna asociación entre la concentración de vitamina D y la ferropenia en los niños?
Dra. Meriç Kaymak Cihana,b y Dra. Elif Ünver Korğalıc
a. División de Hematología y Oncología Pediátricas, Departamento de Pediatría, Facultad de Medicina de Cumhuriyet University.
b. Departamento de Hematología y Oncología Pediátricas, Hospital Oncológico de Formación y Educación de Ankara Dr. Abdurrahman Yuraslan, Ankara.
c. Departamento de Pediatría, Facultad de Medicina de Cumhuriyet University, Sivas Turquía.
Correspondencia: Dra. Merig Kaymak Cihan: merckaymak@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 23-1-2018
Aceptado: 16-8-2018
RESUMEN
Introducción. La vitamina D afecta la eritropoyesis.
Objetivo: evaluar, en niños de 6 meses a 5 años, la asociación entre concentraciones de 25-hidroxi vitamina D (25-OHD) en la madre/niño, ferropenia y anemia ferropénica (AF). Población y métodos. Se incluyeron los niños que asistieron a la consulta entre septiembre de 2014 y enero de 2016. Se excluyeron aquellos con infección aguda/crónica, desnutrición, enfermedades crónicas y prematuros. Se realizó hemograma, hierro sérico, capacidad fijación del hierro, ferritina y 25-OHD. Se investigó suplemento con hierro y vitamina D durante lactancia y embarazo.
Resultados. Se incluyeron 117 niños: 67 tenían ferropenia/AF [Grupo 1, edad (años): 2,05 ± 1,24 (0,5-5)] y 50 niños sanos [Grupo 2, edad (años): 1,87 ± 1,12 (0,58-5)]. Más niños y madres tuvieron deficiencia de vitamina D en Grupo 1 que en Grupo 2 (niños, 49,3 % vs 20 %, p=0,002, y madres: 94 % vs 64 %; p= < 0,001, respectivamente). Hubo correlación positiva entre la hemoglobina en niños y la 25-OHD en madres/niños. Factores independientes de riesgo de AF fueron más tiempo de lactancia (OR: 0,35; IC 95 % [0,1550,789]; p = 0,011), más breve suplementación con hierro durante la lactancia (OR: 1,69; IC 95 % [1,148-2,508]; p = 0,008) y embarazo (OR: 1,39; IC 95 % [1,070-1,820]; p = 0,014) y concentraciones < 25-OHD en madres (OR: 1,16; IC del 95 % [1,034-1,292]; p = 0,011).
Conclusiones. La deficiencia de vitamina D en madres/niños está asociada con ferropenia/AF en los niños.
Palabras clave: Niños; Madres; Hierro; Ferropenia; Vitamina D.
INTRODUCCIÓN
La ferropenia es la carencia alimenticia y el problema de salud más frecuente en todo el mundo.1 Es un problema muy conocido, especialmente en niños y mujeres. La prevalencia mundial de anemia es del 47,4 % entre los niños en edad preescolar, del 41,8 % entre las embarazadas, y del 30,2 % entre las mujeres no embarazadas. A partir de diferentes estudios realizados en niños, se estimó que, en Turquía, la ferropenia y la anemia ferropénica (AF) alcanzan una prevalencia del 21 % al 35 %.2 Según la Organización Mundial de la Salud (OMS), un país en el que la prevalencia de la anemia alcanza alrededor del 40 % enfrenta un problema importante de salud pública. La AF no tratada favorece el retraso en el crecimiento, los trastornos mentales, el deterioro cognitivo y la predisposición a infecciones, y aumenta la mortalidad infantil.
La vitamina D es un nutriente esencial cuya función es importante en la homeostasis del calcio y la salud de los huesos. El 1,25-dihidroxicolecalciferol (1,25(OH)2D) es un mediador importante de la absorción activa del calcio en el intestino, y se sabe que la deficiencia de vitamina D causa raquitismo en niños en edad de crecimiento y osteomalacia en adolescentes mayores y adultos. La vitamina D también es un factor importante en el desarrollo de las células cerebrales y el crecimiento axónico. Los niños son organismos en crecimiento, de modo que la deficiencia de vitamina D puede
causarles ciertos trastornos. Se encontró que los niños con trastorno por déficit de atención con hiperactividad (TDAH) mostraban concentraciones de vitamina D menores que los demás.3 También la ferropenia está asociada con el TDAH.4 Entre las poblaciones en situación de mayor riesgo se incluyen los lactantes alimentados exclusivamente con leche materna, en particular si la madre tuvo deficiencia de vitamina D durante el embarazo, niños de piel oscura, niños que viven en latitudes mayores, y niños que, por diversas razones, se exponen poco al sol.
En los casos de nefropatía crónica, las concentraciones séricas de la prohormona 25-hidroxi vitamina D (25-OHD) se correlacionan de manera inversa con la prevalencia de la anemia5 y la resistencia a los factores estimulantes eritropoyéticos6, y de manera directa con las concentraciones de hemoglobina en sangre.6 Bacchetta et al.7 encontraron que la vitamina D es un potente regulador del eje hepcidina-ferroportina en los seres humanos. In vitro, la unión de la 1,25-dihidroxivitamina D (calcitriol) con el receptor de la vitamina D redujo los niveles de hepcidina en el ARNm.7 Los estudios de glóbulos rojos de la médula ósea realizados in vitro han demostrado que el calcitriol aumenta la expresión del receptor de la eritropoyetina y que, en forma sinérgica con la eritropoyetina, estimula la proliferación.8 El objetivo de este estudio fue investigar si existía una asociación entre las concentraciones de 25-OHD en la madre/el niño y la ferropenia en niños de 6 meses a 5 años de edad.
POBLACIÓN Y MÉTODOS
Se incluyeron en el estudio niños de 6 meses a 5 años que ingresaron a los consultorios externos del Departamento de Pediatría del Hospital de la Facultad de Medicina de Cumhuriyet University entre septiembre de 2014 y enero de 2016. Se excluyó a los niños prematuros (que hubieran nacido con < 37 semanas de gestación), que tuvieran enfermedades crónicas, desnutrición, obesidad, que presentaran rasgos de talasemia, anemia hemolítica, anemia macrocítica o infecciones agudas, y a aquellos niños cuyos padres se negaran a otorgar el consentimiento. El Comité de Ética local aprobó el protocolo de investigación. Se obtuvo el consentimiento informado de los padres o del tutor legal de los niños. Después de un examen médico exhaustivo, se hizo a las madres y sus niños un hemograma completo, se determinó la concentración sérica de hierro, la capacidad total de fijación del hierro (CTFH), la concentración sérica de ferritina, la velocidad de sedimentación globular para la 25-OHD y la concentración sérica de calcio, fósforo y fosfatasa alcalina. Todos los análisis se hicieron a partir de las muestras de sangre venosa obtenidas de los pacientes y sus madres. Las muestras se tomaron en ayunas, la misma mañana en que ingresaron los pacientes. Para los análisis bioquímicos de rutina, se usaron tubos vacíos con gel, y se usó un tubo con K2EDTA para el hemograma completo (todos los tubos provenían de Becton Dickinson, Oxon, Reino Unido). Las muestras de suero se obtuvieron después de centrifugar las muestras de sangre. Los análisis bioquímicos y el hemograma completo se llevaron a cabo de inmediato. Las concentraciones séricas de hierro y la CTFH se determinaron por espectrofotometría en muestras de suero utilizando un analizador automático AU5800 (Beckman Coulter, EE. UU.) La determinación de leucocitos, plaquetas, hemoglobina (Hb), hematocrito, volumen corpuscular medio (VCM) y amplitud de la distribución eritrocitaria (ADE) se llevó a cabo en muestras de sangre entera, con un analizador hematológico automático (Mindray BC 6800, China). Las concentraciones de 25-OHD se determinaron mediante inmunoanálisis con quimioluminiscencia (Beckman UniCel Dxl 600, EE. UU.).
Los participantes se clasificaron en dos grupos: niños con ferropenia/AF (Grupo 1) y niños sanos (Grupo 2). Se definió como ferropenia una concentración normal de Hb con una concentración de ferritina < 12 ng/dl y saturación de transferrina (hierro sérico/CTFH) < 16 %.9 En los casos en que la concentración de Hb del paciente era < 11 g/dl y su VCM < 70 fl + edad, junto con ferropenia, el paciente se aceptó como paciente con anemia ferropénica (AF).1,9 Una concentración de 25-OHD entre 20 y 100 ng/ml (50-250 nmol/L) se consideró suficiente. Se definió como insuficiencia de vitamina D una concentración de 25-OHD entre < 20 ng/mL y > 12 ng/mL (30-50 nmol/L), y como deficiencia de vitamina D, una concentración de 25-OHD < 12 ng/ml (< 30 nmol/L).10 Se definió como ferropenia materna una concentración de ferritina < 15 ng/ml y una concentración de Hb < 12 g/dL.11 La velocidad de sedimentación globular se consideró alta si era > 20 segundos; en estos casos, no se incorporó al paciente a la población del estudio.
En Turquía, la suplementación con hierro se administra como un preparado que contiene hidróxido de hierro III polimaltosado en gotas, cada una de las cuales contiene 2,5 mg de hierro elemental. Los centros de salud familiar administran este preparado a todos los lactantes entre 4 y 12 meses de edad. Los lactantes que nacieron a término reciben 1 mg/kg de hierro elemental. Además, estos centros administran suplemento de vitamina D (400 unidades internacionales [UI], una gota de preparado de vitamina D contiene alrededor de 150 UI de vitamina D) a todos los lactantes desde su nacimiento hasta los 12 meses. A los fines del estudio, a través de un cuestionario que respondieron las madres, se obtuvo información sobre la edad de la madre, el tiempo durante el cual la madre recibió suplementación con hierro en el embarazo, el número de partos que la madre ya había tenido, el número del niño en el orden de nacimiento, el tiempo en el que el niño se alimentó exclusivamente con leche materna, el mes en que comenzó el período de destete, el mes en que se inició la suplementación con hierro en el lactante, el tiempo (meses) que duró la suplementación con hierro, la cantidad de gotas de preparado de hierro administradas al lactante, el tiempo (meses) en que se suplementó con vitamina D durante la lactancia y la cantidad de gotas administradas.
Todos los análisis estadísticos se realizaron con el programa SPSS 15.0 (SPSS, Chicago, IL, EE. UU.). Para las variables continuas con distribución normal, se usó la prueba t de Student. Los datos categóricos se analizaron con la prueba de χ2 o la prueba exacta de Fisher. Para determinar la relación entre la Hb y las concentraciones de ferritina y 25-OHD, se utilizó el coeficiente de correlación de Pearson. Para investigar los factores independientes de riesgo de bajas concentraciones de Hb y ferritina en los niños, se aplicó el análisis de regresión logística multivariante. El tamaño necesario de la muestra se calculó en por lo menos 50 sujetos en cada grupo, con una potencia del 90 % y un error de tipo I de 0,05; se anticipó una desviación de ± 20 % en el grupo de referencia (programa de código abierto R 3.0.1.), en función de los datos bibliográficos.12 Un valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOS
Entre septiembre de 2014 y enero de 2016, ingresaron a los consultorios externos 2900 niños, de los cuales 2250 tenían alguna infección; 180 estaban desnutridos; 33 padecían enfermedades crónicas; 45 habían sido prematuros; 150 fueron derivados a otros hospitales y 75 presentaban otras causas de anemia (deficiencia de vitamina B12, rasgos de talasemia, anemias hemolíticas, etc.). Los padres de 50 niños se negaron a participar en el estudio. Finalmente, se incorporaron al estudio 117 niños: 67 en el grupo de ferropenia/anemia ferropénica (Grupo 1) y 50 en el grupo de niños sanos (Grupo 2). No hubo diferencias entre los grupos en lo que respecta a la edad, el sexo, la semana de nacimiento, el peso y la estatura (Tabla 1). Las madres de los niños del Grupo 1 eran más jóvenes que las del Grupo 2 (Tabla 1; p = 0,04) y tenían más hijos (Tabla 1; p = 0,001); el número de orden de nacimiento de los niños del Grupo 1 era más alto que el de los niños del Grupo 2 (2,24 ± 1,03 frente a 1,72 ± 0,88; p = 0,006). Las madres del Grupo 2 habían recibido suplementación con hierro en el embarazo durante un período más prolongado (Tabla 1; p = 0,03). El tiempo medio de lactancia materna exclusiva fue mayor en el Grupo 1 que en el Grupo 2 (Tabla 1; p = 0,001). Los niños del Grupo 2 habían recibido suplementación con hierro durante más tiempo y mayor cantidad de gotas durante la lactancia (Tabla 1; p < 0,001). La duración media de la suplementación con vitamina D durante la lactancia fue mayor en el Grupo 2 que en el Grupo 1 (Tabla 1, p = 0,003).
Tabla 1. Características demográficas de los niños del Grupo 1 (ferropenia/AF) y del Grupo 2 (sanos)

En la Tabla 2 se resumen los valores hematológicos y bioquímicos de los niños y las madres comparados entre ambos grupos. Las concentraciones de 25-OHD fueron más bajas en el Grupo 1 (21,9 ± 12 frente a 33,3 ± 22; p < 0,001). En las madres del Grupo 1, los valores de concentración de Hb, hematocrito, VCM y concentraciones de ferritina y 25-OHD fueron más bajos que en las madres del Grupo 2 (Tabla 2). Se encontró insuficiencia de vitamina D en 33/67 (49,3 %) niños y en 63/67 (94,0 %) madres del Grupo 1, y en 10/50 (20,0 %) niños y 32/50 (64,0 %) madres del Grupo 2 (niños: p = 0,001; madres: p < 0,001) (Tabla 3). Hubo una correlación positiva entre las concentraciones de Hb en los niños y la duración media de la suplementación regular con hierro durante la lactancia, la cantidad de gotas de preparado de hierro administradas, la concentración de 25-OHD en los niños y las madres, la concentración de Hb en las madres y la concentración de ferritina en las madres (Tabla 4). Hubo una correlación negativa entre las concentraciones de Hb en los niños y la cantidad de hijos de la madre, el número de orden de nacimiento del niño entre sus hermanos, el tiempo de lactancia materna exclusiva y la edad del lactante al inicio del destete (Tabla 4).
Tabla 2. Resultados de los análisis de laboratorio del Grupo 1 (ferropenia/AF) y el Grupo 2 (sanos)
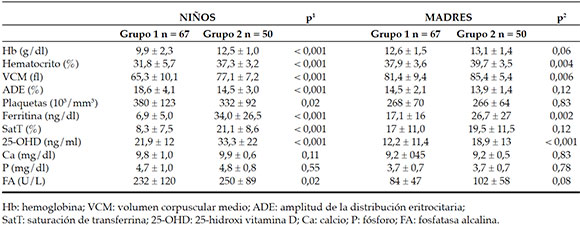
Tabla 3. Distribución de la deficiencia de vitamina D de las madres y los ninos por grupo

Tabla 4. Correlación entre algunos de los parámetros y las concentraciones de ferritina y hemoglobina en los niños

El análisis de regresión logística multivariante determinó que los factores independientes de riesgo de anemia en los niños eran un tiempo más prolongado de lactancia materna exclusiva (p = 0,11), una menor duración de la suplementación regular con hierro durante la lactancia (p = 0,008), concentraciones más bajas de 25-OHD en las madres (p = 0,011), una menor duración de la suplementación con hierro de la madre durante el embarazo (p = 0,014) y el inicio tardío del período de destete (p = 0,006) (Tabla 5).
Tabla 5. Determinantes de concentraciones bajas de hemoglobina y ferritina en los niños

Se determinó que el único factor independiente de riesgo de concentración baja de ferritina en los niños era una menor duración de la suplementación regular con hierro durante la lactancia (p = 0,017) (Tabla 5).
DISCUSIÓN
Según la Sociedad de Endocrinología Pediátrica, todos los bebés alimentados exclusivamente con leche materna deberían recibir diariamente 400 UI de suplemento de vitamina D, comenzando a los pocos días de nacer.10,13 Aunque el 40 % de los niños en Turquía tienen deficiencia de vitamina D,15 no es frecuente que esta cause raquitismo (la prevalencia es del 0,1 %).14 En un estudio llevado a cabo en ese país, se notificó que el 80 % de las madres tenían deficiencia de vitamina D.16 En virtud de un programa del Ministerio de Salud, en Turquía se administran a las embarazadas 40-60 mg/día de un preparado de hierro que contiene hierro elemental desde el comienzo del cuarto mes (segundo trimestre) hasta el noveno mes de embarazo, y durante 3 meses después del parto, es decir, durante un total de 9 meses; sin embargo, las embarazadas no reciben habitualmente suplementos de vitamina D. En este estudio se determinó una correlación positiva entre las concentraciones de Hb/ferritina en los niños y las concentraciones de 25-OHD en los niños/las madres y también en las concentraciones de Hb/ferritina en las madres. En el grupo de AF/ferropenia (Grupo 1), había más madres y niños con insuficiencia + deficiencia de vitamina D que en el grupo de niños sanos. Se demuestra así que los niños con deficiencia de vitamina D o cuyas madres tienen deficiencia de vitamina D tienen mayores probabilidades de ser ferropénicos. El 81 % de las madres tenía deficiencia de vitamina D, dato que coincidió con la bibliografía previa.16 Se sabe también que la ferropenia materna durante el embarazo aumenta el riesgo de ferropenia en el lactante.17 De manera coincidente con los datos incluidos en la bibliografía, en este estudio, se observaron más casos de concentraciones bajas de Hb y ferritina entre las madres del Grupo 1 que en las madres del Grupo 2, y se determinó que la suplementación con hierro durante el embarazo constituye un factor independiente de riesgo de anemia en los niños.
En un estudio llevado a cabo en los Estados Unidos en 10 410 niños y adolescentes, las bajas concentraciones de 25-OHD estuvieron asociadas con un mayor riesgo de anemia.18 En Korea, Lee et al.,12 hallaron que la deficiencia de vitamina D está asociada con un mayor riesgo de anemia, especialmente AF, en las mujeres, los niños y los adolescentes sanos. A partir de un estudio realizado por Jin et al.19 en niños menores de 24 meses, se informó que la deficiencia de vitamina D era más frecuente en los pacientes con ferropenia y que había una estrecha asociación entre las concentraciones de Hb y 25-OHD en los lactantes. En este estudio, también se encontró una correlación positiva entre las concentraciones de Hb y 25-OHD en niños menores de 5 años. Kang et al.,20 encontraron que los lactantes con anemia y sus madres tenían concentraciones de vitamina D más bajas que aquellos que no eran anémicos. Sin embargo, en ese estudio, las concentraciones de 25-OHD no se asociaron con factores independientes de riesgo de ferropenia en los lactantes.20 En nuestro estudio, hubo una correlación positiva entre las concentraciones de 25-OHD en niños/madres y las concentraciones de hemoglobina/ferritina en los niños. Además, el suplemento de vitamina D se administró durante un período más prolongado en el Grupo 2. Por otro lado, el uso de suplementos de hierro y vitamina D durante la lactancia funcionó como predictor de la ferropenia/AF en los niños. La concentración de 25-OHD de las madres fue un factor independiente de riesgo de anemia en los niños. La deficiencia de vitamina D en los niños y sus madres puede haber sido un factor etiológico para la ferropenia en los niños; al aumentar las concentraciones de hepcidina en estos sujetos7 o disminuir la expresión de los receptores de eritropoyetina en las células madre,8 puede haber disminuido la absorción del hierro. Además, el hierro es el elemento fundamental para el funcionamiento de los citocromos P450. Algunos de estos citocromos (CYP27A1, CYP24A1) desempeñan un papel importante en la hidroxilación de la vitamina D. La ferropenia puede afectar la función de estas enzimas y provocar deficiencia de vitamina D.21 Según los hallazgos de este estudio, la deficiencia de vitamina D en las madres y los niños genera ferropenia en los niños. Sin embargo, es necesario llevar a cabo otros estudios para determinar si la deficiencia de vitamina D es la causa de ferropenia/anemia ferropénica o si la ferropenia es la causa de la deficiencia de vitamina D, o si ambas son carencias alimenticias concomitantes. No obstante, en virtud de nuestros hallazgos podemos sugerir que las mujeres deberían recibir suplementos de hierro y vitamina D durante el embarazo y que la suplementación con hierro y vitamina D durante la lactancia debería ser la práctica habitual y estar supervisada por profesionales de la salud.
En nuestro estudio, la alimentación exclusivamente por lactancia materna fue más prolongada en el grupo de ferropenia/AF. Algunas madres alimentaron a sus lactantes solo con leche materna durante 12 meses. Hubo una correlación negativa entre este tiempo y las concentraciones de Hb/ferritina en los niños. También observamos una correlación negativa entre las edades a las que se inició el período de destete. En el Grupo 1, los niños iniciaron su período de destete a una edad más avanzada. Por lo tanto, cuando los lactantes se alimentan exclusivamente con leche materna durante un período prolongado, sus probabilidades de tener ferropenia aumentan. Este hallazgo coincide con la bibliografía.22 En Turquía, el Ministerio de Salud recomienda alimentar a los lactantes exclusivamente con leche materna durante 6 meses, según las pautas de la OMS, y luego incorporar a la alimentación con leche materna alimentos complementarios ricos en hierro.
Otro hallazgo interesante de nuestro estudio fue que las madres del Grupo 1 eran más jóvenes y tenían más hijos que las del Grupo 2. Los niños de madres jóvenes e inexpertas con muchos hijos tenían más riesgo de padecer ferropenia. En los países en desarrollo, como es el caso de Turquía, la edad de la madre y su educación son determinantes para la salud del niño y el lactante. Nuestros hallazgos también respaldan este concepto. A la luz de estos resultados, podemos concluir que es necesario educar a las madres, en especial a las que son jóvenes e inexpertas, en lo que respecta a la importancia de incorporar oportunamente alimentos complementarios con alto contenido de hierro, a fin de prevenir la ferropenia.
Este estudio presenta ciertas limitaciones. Los datos fueron proporcionados por las madres cuando sus niños tenían 2, 3 o 4 años de edad y, por lo tanto, podría haber un sesgo inducido por la falta de memoria.
CONCLUSIÓN
La deficiencia de vitamina D en madres/niños estuvo asociada con ferropenia/AF en los niños de 6 meses a 5 años de edad. Sin embargo, es necesario llevar a cabo otros estudios para determinar si la deficiencia de vitamina D es causa de ferropenia/AF o es una carencia alimenticia concomitante.
REFERENCIAS
1. World Health Organization. Iron deficiency anemia: assessment, prevention and control (Anemia ferropénica: evaluación, prevención y control). A guide for programme managers. 2001. [Fecha de acceso: 18 de diciembre de 2001]. Disponible en: http://apps.who.int/iris/bitstream/10665/66914/1/WHO_NHD_01.3.pdf.
2. Aydin A, Gur E, Erener-Ercan T, Can G, et al. Comparison of different iron preparations in the prophylaxis of iron-deficiency anemia. J Ped Hematol Oncol. 2017; 39(7):495-9. [ Links ]
3. Villagomez A, Ramtekkar U. Iron, Magnesium, Vitamin D, and Zinc Deficiencies in Children Presenting with Symptoms of Attention-Deficit/Hyperactivity Disorder. Children (Basel). 2014; 1(3):261-79. [ Links ]
4. Wang Y, Huang L, Zhang L, Qu Y, et al. Iron Status in Attention-Deficit/Hyperactivity Disorder: A Systematic Review and Meta-Analysis. PLoS One. 2017; 12(1):e0169145. [ Links ]
5. Lac PT, Choi K, Liu IA, Meguerditchian S, et al. The effects of changing vitamin D levels on anemia in chronic kidney disease patients: A retrospective cohort review. Clin Nephrol. 2010; 74(1):25-32. [ Links ]
6. Kiss Z, Ambrus C, Almasi C, Berta K, et al. Serum 25(OH)-cholecalciferol concentration is associated with hemoglobin level and erythropoietin resistance in patients on maintenance hemodialysis. Nephron Clin Pract. 2011; 117(4):c373-8. [ Links ]
7. Bacchetta J, Zaritsky JJ, Sea JL, Chun RF, et al. Suppression of iron-regulatory hepcidin by vitamin D. J Am SocNephrol. 2014; 25(3):564-72. [ Links ]
8. Alon DB, Chaimovitz C, Dvilansky A, Lugassy G, et al. Novel role of 1,25(OH)2D3 in induction of erythroid progenitor cell proliferation. Exper Hematol. 2002; 30(5):403-9. [ Links ]
9. Lanzkowsky P. Iron deficiency anemia. In: Lanzkowsky P, Lipton J, Fish J (eds). Lanzkowsky's Manual of Pediatric Hematology and Oncology. 6th ed. San Diego, CA: Elsevier; 2016.Págs.69-83.
10. Misra M, Pacaud D, Petryk A, Collett-Solberg PF, et al. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics. 2008; 122(2):398-417. [ Links ]
11. Guyatt GH, Oxman AD, Ali M, Willian A, et al. Laboratory diagnosis of iron deficiency anemia: an overview. J Gen Intern Med. 1992; 7(2):145-53. [ Links ]
12. Lee JA, Hwang JS, Hwang IT, Kim DH, et al. Low vitamin D levels are associated with both iron deficiency and anemia in children and adolescents. Pediatr Hematol Oncol. 2015; 32(2):99-108. [ Links ]
13. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(7):1911-30. [ Links ]
14. Ozkan B, Doneray H, Karacan M, Vançelik S, et al. Prevalence of vitamin D deficiency rickets in the eastern part of Turkey. Eur J Pediatr. 2009; 168(1):95-100. [ Links ]
15. Andiran N, Çelik N, Akça H, Dogan G. Vitamin D deficiency in children and adolescents. J Clin Res Pediatr Endocrinol. 2012; 4(1):25-9. [ Links ]
16. Erol M, İşman FK, Kucur M, Hacibekiroglu M. Annede D vitamin eksikliginin degerlendirilmesi. Türk Pediatri Ars¸. 2007; 42(1):29-32. [ Links ]
17. Kumar A, Rai AK, Basu S, Dash D, et al. Cord blood and breast milk iron status in maternal anemia. Pediatrics. 2008; 121(3):e673-7. [ Links ]
18. Atkinson MA, Melamed ML, Kumar J, Roy C, et al. Vitamin D, race, and risk for anemia in children. J Pediatr. 2014; 164(1):153-8.e1. [ Links ]
19. Jin HJ, Lee JH, Kim MK. The prevalence of vitamin D deficiency in iron-deficient and normal children under the age of 24 months. Blood Res. 2013; 48(1):40-5. [ Links ]
20. Kang YS, Kim JH, Ahn EH, Yoo EG, et al. Iron and vitamin D status in breastfed infants and their mothers. Korean J Pediatr. 2015; 58(8):283-7. [ Links ]
21. Nebert DW, Wikvall K, Miller WL. Human cytochromes P450 in health and disease. Philos Trans R Soc Lond B Biol Sci. 2013; 368(1612):20120431. [ Links ]
22. Hong J, Chang JY, Shin S, Oh S. Breastfeeding and red meat intake are associated with iron status in healthy Korean weaning-age infants. J Korean Med Sci. 2017; 32(6):974-84. [ Links ]











 texto en
texto en 


