Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.1 Buenos Aires Feb. 2019
http://dx.doi.org/10.5546/aap.2019.34
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2019.34
Análisis sobre ensayos de farmacología clínica en pediatría, en comparación con ensayos de farmacología clínica en adultos, en Argentina
Dra. Laura Traversia y Dr. Ricardo Bolañosb
a. Dirección de Evaluación y Registro de Medicamentos.
b. Dirección de Evaluación de Tecnologías Sanitarias.
Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), Ciudad Autónoma de Buenos Aires, Buenos Aires, Argentina.
Correspondencia: Dra. Laura Traversi: laura.traversi@anmat.gov.ar
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 29-1-2018
Aceptado: 11-7-2018
RESUMEN
Introducción. Se plantea la necesidad de conocer cuánto y qué se investiga en farmacología pediátrica en Argentina y determinar las diferencias con la población adulta.
Objetivos. Comparar ensayos clínico-farmacológicos pediátricos y de adultos en relación con número, fases, diseños (utilización de placebo como comparador, proporción de ensayos ciegos/abiertos), enfermedades investigadas. En pediatría: determinar si las patologías investigadas coinciden con las principales causas de mortalidad infantil en Argentina.
Métodos. Estudio analítico, observacional, transversal, realizado en la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), que incluyó ensayos autorizados entre 2011 y 2014.
Resultados. Sobre 614 estudios, 552 (90 %) fueron de adultos y 62 (10 %), pediátricos. La fase III fue la más frecuente en adultos (77 %) y pediatría (69 %). En relación con los diseños: se usó más placebo en adultos (49 %) que en pediatría (31 %) y hubo mayor cegamiento en adultos (74 %) que en pediatría (58 %). Patologías más investigadas: en adultos, fueron tumorales; en pediatría, respiratorias y enfermedades del sistema osteomuscular y tejido conjuntivo. En pediatría, no hubo correlación entre las patologías y las causas de mortalidad infantil.
Conclusiones. 1) Hubo más estudios en adultos que en niños; 2) La fase más frecuente fue la III; 3) Hubo diferencias en el diseño de los estudios entre ambas poblaciones; 4) Las patologías investigadas fueron diferentes en cada población; 5) En pediatría, no hubo correlación entre las enfermedades y las principales causas de mortalidad infantil en Argentina.
Palabras clave: Ensayos clínicos; Pediatría; Farmacología clínica.
INTRODUCCIÓN
La investigación clínica farmacológica en pediatría posee características particulares, lo que constituye un verdadero desafío para los actores intervinientes en la investigación en seres humanos. A pesar de ello, resulta imperativo investigar sobre los fármacos para esta población por lo siguiente: 1) la existencia de características fisiológicas y fisiopatológicas propias, entendiendo que, desde el nacimiento hasta la adultez, se producen modificaciones anatómicas, fisiológicas y bioquímicas que influyen en la farmacocinética y en la farmacodinamia de las drogas. Esto genera, en ocasiones, respuestas distintas a los medicamentos en relación con su eficacia y su seguridad;1 2) la existencia de patologías exclusivas de la infancia; 3) la presencia de enfermedades con diferente forma de presentación y evolución; 4) la necesidad de formulaciones de medicamentos apropiadas, que optimicen la adherencia a los tratamientos y adecuen las concentraciones de las dosis de los principios activos por administrar.
Contar con una investigación clínica farmacológica pediátrica de calidad supone una mejora fundamental para la salud pública infantil respecto de los tratamientos que reciben los niños, puesto que, en la práctica clínica, frecuentemente, se usan medicamentos en condiciones distintas de las autorizadas en la ficha técnica ("uso off label o fuera de prospecto").
Sobre la base de esta necesidad, en las últimas dos décadas, las agencias regulatorias de medicamentos de referencia -como la Food and Drug Administration (FDA) de Estados Unidos y la Agencia Europea- han modificado sus legislaciones con el fin de promover la investigación farmacológica en pediatría. Exigieron realizar ensayos de medicamentos en todas las edades, implementar programas de investigación pediátricos, desarrollar formulaciones adaptadas para niños e incluir la información resultante de los estudios pediátricos en los prospectos.
En relación con la República Argentina, en 2010, se sancionó la Disposición 66 772 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), que constituye el régimen de buena práctica clínica para los estudios de farmacología en seres humanos. Esta normativa brinda un marco adecuado para proteger los intereses de los participantes en la investigación y hace referencia a las poblaciones vulnerables, que incluyen a pacientes pediátricos, lo que representa un avance en cuanto a la regulación precedente ya derogada (Disposición ANMAT 5330/97). Las acciones reguladoras, favorecedoras de la investigación en niños, constituyen un avance fundamental para subsanar la problemática prescriptiva existente en la infancia.
Este estudio pretende abrir un camino descriptivo-orientativo que analice cuánto y qué se investiga sobre los medicamentos en pediatría, en Argentina, y que aporte algunas diferencias con la población adulta. Conocer esta información permite evitar duplicaciones en los protocolos que se realicen y promover estudios de interés a fin de direccionar los esfuerzos en la investigación hacia las necesidades terapéuticas de nuestra población infantil.
Objetivos generales. Comparar ensayos de farmacología clínica de pediatría y de adultos en relación con el número; las fases; los aspectos de los diseños, como la utilización de placebo como comparador y la proporción de ensayos ciegos/abiertos; y las enfermedades más investigadas.
Objetivos exploratorios. En pediatría, determinar si las patologías investigadas coinciden con las principales causas de mortalidad infantil en Argentina.
POBLACIÓN Y MÉTODOS
Estudio analítico, observacional, transversal realizado en la ANMAT. Los datos se obtuvieron de la base pública disponible en http://www.anmat.gov.ar/aplicaciones_net/applications/consultas/ensayos_clinicos/principal.asp. Se incluyeron los ensayos de farmacología clínica aprobados por la ANMAT entre el 1° de enero de 2011 y el 31 de diciembre de 2014. Se excluyeron los ensayos que no se encontraban dentro del ámbito de aplicación y alcance de la Disposición 6677/10, los estudios no autorizados, los ensayos de biodisponibilidad/bioequivalencia y los estudios que incluían población pediátrica y adulta conjuntamente.
La metodología utilizada consistió en revisar cada uno de los protocolos exhibidos en la base pública como autorizados entre 2011 y 2014, y estratificarlos en dos grupos: a) estudios exclusivamente en menores de 18 años; b) estudios en adultos (18 años o mayores). Se volcó la información en una base; se excluyeron los ensayos que no cumplían los criterios de selección y se cuantificó aquello que respondía a los objetivos de este trabajo. Frente a la eventualidad de información incompleta, se remitió a la fuente original, a la que también se tuvo acceso.
Los ensayos se estratificaron según la fase clínica en estudios de fase I (fase I a y I b), fase II (fase II a y II b), fase III (fase III a y III b) y otras fases (I/II, I b/II, II/III, II b/III).
Las patologías fueron categorizadas de acuerdo con la Clasificación Internacional de Enfermedades 10 (CIE 10a REVISIÓN) de la Organización Mundial de la Salud (OMS).3
Para cumplir con los objetivos exploratorios, las tasas de mortalidad infantil se obtuvieron de cifras publicadas en 2015 por el Ministerio de Salud de la Nación Argentina.4
Hipótesis. E n Argentina, los ensayos farmacológicos pediátricos y de adultos tienen las siguientes diferencias: El número de estudios realizados en pediatría es menor que en adultos. El número y la proporción de estudios de fase I es menor en niños que en adultos. Diseños: Existe mayor asociación entre el rango etario adulto y el uso de placebo; el número y la proporción de estudios que usan cegamiento es menor en niños que en adultos. Patologías: Las enfermedades sobre las que se investiga más frecuentemente son diferentes en niños que en adultos.
Estadística. Se analizó el total de ensayos que cumplían con los criterios de inclusión/exclusión, y no se debió calcular el tamaño muestral.
Se utilizaron métodos descriptivos e inferenciales. Se calcularon las proporciones, que fueron expresadas en porcentajes con su intervalo de confianza del 95 %, como medida de dispersión.
Los métodos inferenciales utilizados fueron la prueba binomial para la comparación de proporciones y la prueba de chi cuadrado para la determinación de asociación. Se estableció un nivel de error a= 5 % (0,05), y se aceptó, para el rechazo de la hipótesis nula (H0), un nivel de p < a (5 %). Se utilizó el programa BioEstat 5.3.5
Aspectos éticos. Se trabajó con información públicamente disponible, y no existió la posibilidad de identificar datos confidenciales, por lo que no se plantearon conflictos éticos. Este estudio no requirió de la presentación ante un Comité de Ética.
RESULTADOS
Ensayos aprobados entre 2011 y 2014

El total de estudios que cumplía con los criterios de inclusión/exclusión fue de 614. 552 (90 %) eran ensayos de adultos, y 62 (10 %), de pediatría; se encontró una diferencia estadísticamente significativa (p < 0,0001) (Tabla 1).
Tabla 1. Total de ensayos clínicos farmacológicos de fase I/II/III aprobados entre 2011 y 2014 por la ANMAT*

Al analizar los estudios pediátricos anualmente, se observó una tendencia ascendente, y se duplicó el número de ensayos en 2014, en relación con 2011 (Tabla 2).
Tabla 2. Ensayos clínicos de fase I/II/III aprobados por la ANMAT* anualmente entre 2011 y 2014

Fases:
La fase más frecuentemente investigada en Argentina fue la III, tanto en adultos (77 %) como en pediatría (69 %). En relación con los estudios de fase I, en adultos, se investigó en un 2 % y, en pediatría, en un 5 %, y no se evidenciaron diferencias estadísticamente significativas (p= 0,2) entre ambas poblaciones (Tabla 3).
Tabla 3. Fases de los ensayos clínicos aprobados entre 2011 y 2014 por la ANMAT*

Aspectos del diseño
Utilización de placebo. Se usó placebo en el 49 % de los estudios en adultos y en el 31 % de los pediátricos, y se confirmó una mayor asociación entre el rango etario adulto y el uso de placebo (p= 0,0074) (Tabla 4).
Tabla 4. Asociación entre el rango etario y la utilización de placebo de los ensayos clínicos aprobados entre 2011 y 2014 por la ANMAT*

Cegamiento. Tanto en los estudios en adultos como en los pediátricos, fue más frecuente el cegamiento (doble/simple ciego), pero fue mayor en adultos (74 %) que en pediatría (58 %), y existió una diferencia estadísticamente significativa (p= 0,0224).
Patologías
Adultos. Se investigó, en primer lugar, sobre enfermedades tumorales (24 %); en segundo lugar, sobre enfermedades del sistema osteomuscular y tejido conjuntivo (17 %) y, luego, sobre enfermedades endócrinas, nutricionales y metabólicas (11 %) (Figura 1). Entre las patologías tumorales, la más frecuente fue el cáncer de mama (N= 28), que representó el 21 % de las neoplasias (N= 123), y luego el de pulmón (N= 23), que constituyó un 17 % de este grupo. Entre las enfermedades del tejido conjuntivo, la más frecuente fue la artritis reumatoide (N= 59) y, de las enfermedades endócrinas, nutricionales y metabólicas, la más frecuente fue la diabetes (N= 50).

Figura 1. Enfermedades investigadas en adultos (clasificadas por grupo de enfermedades)*
Pediatría. Se investigó, en primer lugar, sobre enfermedades del sistema respiratorio (N= 10, 16 %); el asma fue la más frecuente de esta categoría (N= 8, 13 %). Luego, sobre enfermedades del sistema osteomuscular y tejido conjuntivo (N= 10, 16 %); la artritis idiopática juvenil (AIJ) (N= 7, 11 %) fue la más frecuente del grupo (Figura 2).
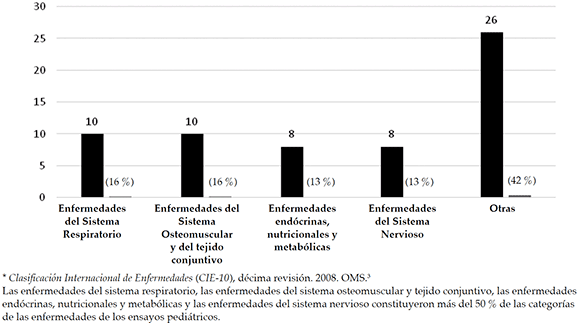
Figura 2. Enfermedades investigadas en pediatría (clasificadas por grupo de enfermedades)*
Relación entre ensayos pediátricos y mortalidad infantil
Causas frecuentes de mortalidad infantil en Argentina:
Entre 0 y 4 años: afecciones perinatales, malformaciones congénitas, accidentes, neumonía/influenza y neumonitis por sólidos y líquidos. Entre 5 y 14 años: accidentes, tumores malignos, malformaciones congénitas, suicidios. Entre 15 y 24 años, accidentes, suicidios, agresiones.
No se observó una correlación entre las patologías más frecuentes de los ensayos pediátricos y las principales causas de mortalidad infantil.
DISCUSIÓN
El estudio titulado "The Globalization of Pediatric Clinical Trials", publicado en 2012 por la Academia Americana de Pediatría,6 analiza características de los ensayos clínicos pediátricos aprobados entre 2007 y 2010, y los compara con un período previo. De las variables analizadas, las coincidentes con este trabajo arrojaron resultados similares: 1) la fase más frecuente fue la III; 2) el placebo fue utilizado en el 38 % de los estudios, análogo a lo hallado en este trabajo, que fue en el 31 %; 3) se observó que, en los países en desarrollo, se investigó, en primer lugar, sobre asma, lo que coincidió con este trabajo. Una diferencia para señalar es que dicha publicación analiza exclusivamente estudios pediátricos, y no se ha realizado la comparación con la población adulta.
Este trabajo permite confirmar que se investiga más en adultos (90 %) que en pediatría (10 %). La menor cantidad de estudios pediátricos podría relacionarse con el hecho de que la investigación farmacológica en niños plantea dificultades y desafíos en los siguientes aspectos:
• Éticos. Al ser población vulnerable, su participación como sujetos de investigación conlleva el riesgo de ocasionar una distribución desigual de cargas y beneficios.7,8 La vulnerabilidad es una característica esencial en los niños, que tienen restringido el ejercicio de su autonomía, de manera relativa o absoluta, al no poder proteger sus intereses e integridad.9 Como consecuencia, tienen más posibilidades de sufrir abuso o daño y los riesgos pueden superar los beneficios al tratarse de moléculas en estudio no totalmente conocidas. Esto exige brindarles una especial protección, pero ampararlos no debe implicar negarles el derecho a participar en la investigación clínica, ya que traería la paradójica consecuencia de tornarlos más vulnerables por exponerlos a tratamientos con medicación no probada para ellos.
• Metodológicos. En el diseño de estos estudios, se debe contemplar lo siguiente:
• existe menor cantidad de pacientes;10
• los datos de dosis, seguridad y tolerabilidad iniciales surgen mayoritariamente de adultos;
• las medidas de resultado deben ser adecuadas para pediatría; es necesario evaluar características propias de esta población, como crecimiento y desarrollo tanto físico como de los mecanismos farmacológicos de absorción, distribución, metabolismo y excreción;11
• se requieren estudios a largo plazo;12
• el placebo debe estar justificado y restringido;12
• se requiere utilizar técnicas lo menos invasivas posible;12
• es necesario minimizar y justificar los volúmenes de sangre por extraer;12
• se debe considerar que la pediatría abarca diferentes estratos etarios, con características propias y que, en un ensayo prolongado, los pacientes pueden cambiar de grupo.12
• Recursos humanos-infraestructura. El personal involucrado debe tener experiencia en la investigación clínica farmacológica y en el trato con pacientes pediátricos. Además, los centros de investigación requieren infraestructura para pediatría a fin de evitar riesgos para los participantes.
• Socioculturales. Es necesario informar a la sociedad (que incluye a los profesionales de la salud) sobre el proceso de desarrollo de medicamentos en niños y remarcar que los participantes no son sometidos a un "experimento" ni objeto de explotación.
A pesar de estas características, cabe destacar que hubo un incremento del 100 % en la cantidad de ensayos pediátricos entre 2011 y 2014. Esto se alinea con la imperante necesidad de contar con medicamentos evaluados científicamente en niños y con el surgimiento, a nivel mundial, de regulación que promueve esta actividad.
Con respecto a las fases investigadas, la III fue la más frecuente en adultos (77 %) y en pediatría (69 %). El número y proporción de estudios de fase temprana fue bajo en ambas poblaciones, no solo en la infantil como fue planteado inicialmente en este trabajo. Un posible fundamento sería que, en Argentina, durante el período estudiado, no existía regulación sobre ensayos de fase I. En 2017, se aprobaron la Disposición 4009/1713 sobre requisitos para centros asistenciales de fase I y la 4008/1714 sobre requerimientos para ensayos clínicos, que incluía la fase I. Esto podría llegar a impulsar la investigación de esta fase en nuestro país.
Con respecto al placebo, los resultados evidenciaron mayor asociación entre su uso y el rango etario adulto, lo que coincidió con las recomendaciones internacionales,15 que establecían que la utilización de placebo en niños debía ser más restringida que en adultos. Respecto del cegamiento, fue mayor la proporción de estudios ciegos que abiertos en ambas poblaciones, lo que coincidió con las recomendaciones existentes, que sostenían que, al igual que en el caso de los adultos, en los ensayos en niños, se debían implementar todas las medidas para evitar sesgos.12
En relación con las enfermedades más frecuentemente investigadas, las patologías en adultos y en pediatría no coincidieron. En la población adulta, se investigó más sobre neoplasias, principalmente, cáncer de mama y pulmón, y se correlacionó con las cifras publicadas por el Ministerio de Salud de la Nación Argentina,4 que evidenciaron que los tumores malignos constituyeron la primera causa de mortalidad entre los 35 y los 74 años.
En pediatría, se investigó más frecuentemente sobre enfermedades del sistema respiratorio (se encontró que la mayor patología de este grupo fue el asma) y sobre enfermedades del sistema osteomuscular y del tejido conjuntivo, principalmente, AIJ.
Las enfermedades más estudiadas en los ensayos pediátricos no se correlacionaron con las principales causas de mortalidad infantil en Argentina.4 Estos resultados podrían explicarse por el hecho de que el objetivo principal de la investigación clínica farmacológica es crear nuevo conocimiento acerca de moléculas para su utilización clínica, aplicables no solamente en enfermedades mortales, sino en cualquier situación sanitaria que requiera intervención farmacoterapéutica. Sería interesante contar con una rama de la farmacología clínica que evaluara medicamentos que redujeran la mortalidad infantil fármaco-dependiente.
Además, se debe considerar que, entre las patologías más investigadas, el asma es la enfermedad respiratoria crónica más frecuente y la principal causa de morbilidad pediátrica crónica,16 y la AIJ es una enfermedad pediátrica que requiere agresividad en su tratamiento inicial.17 Estas consideraciones permiten inferir que, entre 2011 y 2014, en Argentina, en la población pediátrica, se aprobaron ensayos clínicos sobre patologías que representaban necesidades de salud de este grupo, ya fuera por su alta prevalencia y/o por ser pediátricas y requerir iniciar el tratamiento a temprana edad. Esto respeta las pautas de las guías éticas internacionales sobre investigación en población vulnerable que establecen que el propósito de la investigación debe ser obtener el conocimiento relevante sobre las necesidades de salud de ese grupo.7
CONCLUSIONES
1) Se investigó más en adultos que en niños; 2) La fase más frecuente en ambas poblaciones fue la III; 3) Se encontraron diferencias significativas entre ambas poblaciones en aspectos de diseño de los estudios, como el uso de placebo y el cegamiento; 4) Las patologías investigadas en cada población fueron diferentes; 5) Los ensayos de pediatría aprobados durante el período analizado no se correlacionaron con las principales causas de mortalidad infantil en Argentina.
1. Saavedra I, Quiñones L, Saavedra M, et al. Farmacocinética de medicamentos de uso pediátrico, visión actual. Rev Chil Pediatr. 2008; 79(3):249-58. [ Links ]
2. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica. Disposición 6677/10. Buenos Aires: Ministerio de Salud; 2010. [Accessed on: July 12th, 2018]. Available at: http://www.anmat.gov.ar/webanmat/Legislacion/Medicamentos/Dispo_6677-10.pdf.
3. Organización Mundial de la Salud. Clasificación Internacional de Enfermedades. 10.ma rev. [Accessed on: July 12th, 2018]. Available at: http://www.sssalud.gob.ar/hospitales/archivos/cie_10_revi.pdf.
4. Ministerio de Salud de la Nación Argentina - Secretaría de Políticas, Regulación e Institutos Dirección de Estadísticas e Información de Salud. Estadísticas vitales-Información Básica. Argentina-Año 2015. Buenos Aires: DEIS/MSAL, 2016;5(59). [Accessed on: July 12th, 2018]. Available at: http://www.deis.msal.gov.ar/index.php/serie-5-estadisticas-vitales/.
5. Instituto de Desenvolvimento Sustentável Mamirauá. Programa Estadístico Biostat 5.3. [Accessed on: July 12th, 2018]. Available at: https://www.mamiraua.org.br/pt-br/downloads/programas/bioestat-versao-53/.
6. Dunne J, Murphy D, Rodríguez W. The Globalization of Pediatric Clinical Trials. Pediatrics. 2012; 130(6):e1583-91. [ Links ]
7. Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS). Pautas éticas internacionales para la investigación biomédica en seres humanos. Ginebra: CIOMS; 2002. [Accessed on: July 12th, 2018]. Available at: http://www1.paho.org/Spanish/BIO/CIOMS.pdf.
8. Asociación Médica Mundial. Declaración de Helsinki de la AMM - Principios éticos para las investigaciones médicas en seres humanos. 64.a Asamblea General, Fortaleza, Brasil, 2013. [Accessed on: July 12th, 2018]. Available at: https://www.wma.net/es/policies-post/declaracion-de-helsinki-de-la-amm-principios-eticos-para-las-investigaciones-medicas-en-seres-humanos/.
9. Macklin R. Bioethics, vulnerability, and protection. Bioethics. 2003;17(5-6):472-86. [ Links ]
10. European Medicines Agency. Committee for Medicinal Products for Human Use Guideline Oon Clinical Trials in Small Populations. Londres: EMA; 2006. [Accessed on: July 12th, 2018]. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003615.pdf.
11. Kearns GL, Abdel-Rahman SM, Alander SW, et al. Developmental pharmacology--drug disposition, action, and therapy in infants and children. N Engl J Med. 2003; 349(12):1157-67. [ Links ]
12. ICH Expert Working Group. Clinical investigation of medicinal products in the pediatric population (E11). ICH Harmonised Tripartite Guideline. 2000. [Accessed on: July 12th, 2018]. Available at: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E11/Step4/E11_Guideline.pdf.
13. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica. Disposición 4009/17. Buenos Aires: Ministerio de Salud; 2017. [Accessed on: July 12th, 2018]. Available at: http://www.anmat.gov.ar/boletin_anmat/BO/Disposicion_4009-2017.pdf.
14. Administración Nacional de Medicamentos, Alimentos y Tecnología Médica. Disposición 4008/17. Buenos Aires: Ministerio de Salud; 2017. [Accessed on: July 12th, 2018]. Available at: http://www.anmat.gov.ar/boletin_anmat/Abril_2017ADispo_4008-17.pdf.
15. European Medicines Agency. Committee for Medicinal Products for Human Use. Ethical Considerations for Clinical Trials on Medicinal Products Conducted with the Paediatric Population. 2008. [Accessed on: July 12th, 2018]. Available at: http://ec.europa.eu/health//sites/health/files/files/eudralex/vol-10/ethical_considerations_en.pdf.
16. Comité Nacional de Neumonología, Comité Nacional de Alergia, Comité Nacional de Medicina Interna, Comité Nacional de Familia y Salud Mental. Guía de diagnóstico y tratamiento: asma bronquial en niños > 6 años. Actualización 2016. Resumen ejecutivo. Arch Argent Pediatr. 2016; 114(6):595-6. [ Links ]
17. Cuttica R, Cervetto V, Pringe A, et al. Guías de práctica clínica en artritis idiopática juvenil. Sociedad Argentina de Pediatría-Sociedad Argentina de Reumatología; 2011. [Accessed on: July 12th, 2018]. Available at: http://www.reumatologia.org.ar/docs/guias_practica_clinica_artritis_idiopatica_juven il_2011.pdf.














