Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.1 Buenos Aires feb. 2019
http://dx.doi.org/10.5546/aap.2019.e47
PRESENTACIÓN DE CASOS CLÍNICOS
http://dx.doi.org/10.5546/aap.2019.e47
Encefalitis por herpes simple resistente al aciclovir en un niño tratado satisfactoriamente con el agregado de foscarnet. A propósito de un caso
Dra. Zeynep G. Gayretli Aydina, Prof. Asoc. Gonul Tanira, Dra. Cigdem Genc Selb, Dra. Yasemin Tasci Yıldıza, Prof. Asoc. Turkan Aydin Tekea y Dra. Ayse Kamana
a División de Infectología Pediátrica.
b. División de Neurología Pediátrica, Departamento de Pediatría.
c. Departamento de Radiología Pediátrica, Hospital de Formación e Investigación Materno Infantil Dr. Sami Ulus, Angora, Turquía.
Correspondencia: Dra. Zeynep G. Gayretli Aydin: zggayretli@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 23-2-2018
Aceptado: 17-9-2018
RESUMEN
La encefalitis por herpes simple (EHS) es la causa más frecuente de encefalitis focal esporádica en todo el mundo. El aciclovir es el tratamiento preferido para la EHS desde la década de 1980. Después del uso generalizado del aciclovir, se redujo la tasa de mortalidad relacionada con la EHS pero surgieron cepas resistentes. Se ha informado que la incidencia de virus del herpes simple (VHS) resistente al aciclovir es del 0,5 % y del 3,5 %-10 % aproximadamente en los pacientes inmunocompetentes e inmunocomprometidos, respectivamente. En este artículo, describimos el caso de un paciente inmunocompetente de 12 años de edad con encefalitis por VHS-1 tratado satisfactoriamente con aciclovir y foscarnet. En el caso de una condición clínica que desmejora con el tratamiento con aciclovir, incluso si no se demuestra un aumento de la carga viral del VHS en el líquido cefalorraquídeo, se podría considerar la posibilidad de EHS resistente al aciclovir y el agregado de foscarnet al tratamiento con aciclovir.
Palabras clave: Encefalitis por herpes simple; Aciclovir; Foscarnet; Niño.
INTRODUCCIÓN
La encefalitis por herpes simple (EHS) es la causa más frecuente de encefalitis focal esporádica en todo el mundo.1,2 La incidencia varía entre 1 y 2 casos por cada 500 000 habitantes por año.3 El aciclovir, un análogo nucleosídico de la guanosina, es el tratamiento preferido para la EHS. Después del uso de este fármaco, si bien se redujo la tasa de mortalidad relacionada con la EHS, surgieron cepas resistentes. Se ha informado que la incidencia del virus del herpes simple (VHS) resistente al aciclovir es del 0,5 % y del 3,5 %-10 % en los pacientes inmunocompetentes e inmunocomprometidos, respectivamente.4 En este artículo, describimos el caso de un paciente inmunocompetente de 12 años de edad con encefalitis por VHS-1 tratado satisfactoriamente con aciclovir y foscarnet.
A propósito de un caso
Un niño de 12 años de edad ingresó al departamento de emergencias pediátricas con fiebre y cefalea de cuatro días de evolución y con habla irrelevante, desorientación y vómitos intermitentes desde hacía un día. Su temperatura corporal era de 38,5 °C y su frecuencia cardíaca, de 116 latidos por minuto. Estaba letárgico y respondía a las preguntas de manera lenta e ilógica. Presentaba rigidez en el cuello; los signos de Kernig y de Brudzinski fueron negativos. El resto del examen neurológico fue normal. Se realizó una punción lumbar (PL) que mostró pleocitosis del líquido cefalorraquídeo (LCR) (> 610 glóbulos blancos/mm3) con predominio de linfocitos (80 %), proteínas en el LCR por 93,8 mg/dl (rango normal: 15-45 mg/dl) y glucosa en el LCR por 85 mg/dl (glucemia, en simultáneo, 127 mg/dl). La tinción de Gram del LCR no mostró microorganismos. El panel límbico fue negativo tanto en suero como con LCR. Se inició el tratamiento empírico con ceftriaxona (100 mg/kg/día por vía intravenosa [IV] cada 12 horas), claritromicina (15 mg/kg/día por vía i.v. cada 12 horas) y aciclovir (1500 mg/m2/día por vía IV cada 8 horas) para una posible meningitis bacteriana y EHS, respectivamente. Se realizó una resonancia magnética (RM) del cerebro el segundo día de hospitalización; esta mostró hiperintensidad en las secuencias ponderadas en T2 y realce meníngeo en el giro recto del lóbulo frontal, el hipocampo, el núcleo amigdalino, el hipotálamo y los cuerpos mamilares del hemisferio cerebral izquierdo. También se observó hiperintensidad nodular mínima en el lóbulo temporal derecho en las secuencias ponderadas en T2 (Figura 1). Los registros del electroencefalograma (EEG) en vigilia o sueño mostraron una reducción difusa de la actividad de fondo en la región temporo-occipital izquierda. En el seguimiento, la prueba de reacción en cadena de la polimerasa (PCR, por su sigla en inglés) detectó VHS-1 en el LCR, y se hallaron anticuerpos IgG para VHS e IgM negativos para VHS. El VHS-1 en el LCR se detectó con el kit comercial de diagnóstico de meningitis viral PCR multiplex en tiempo real de Fast Track Diagnostics (Fast Track Diagnostics, Luxemburgo) y con la PCR en tiempo real ABI 7500 (Applied Biosystems, EE. UU.). Se diagnosticó EHS y se discontinuó la ceftriaxona. A los 14 días de tratamiento con aciclovir, los síntomas neurológicos del paciente empeoraron y se observó letargo, desorientación y cambios conductuales. El paciente luego presentó vómitos y bradicardia leve sin hipertensión. En el examen neurológico se observaron reflejos tendinosos profundos hiperactivos en las extremidades inferiores. Al día siguiente, se produjeron dos convulsiones tónicas que duraron 40 segundos. Se inició un tratamiento antiepiléptico con levetiracetam. En la oftalmoscopia se observaron dilatación de las venas retinianas en ambos ojos y tortuosidad vascular retiniana con sospecha de aumento de la presión intracraneal. Después de las convulsiones, se repitieron los EEG en vigilia y sueño, cuyos registros mostraron una reducción difusa de la actividad de fondo con actividad paroxística en la región temporal derecha. Se realizó una segunda RM, que mostró aumento del edema que afectaba el giro recto en el lóbulo frontal, el hipocampo, el núcleo amigdalino, el hipotálamo y los cuerpos mamilares del hemisferio izquierdo y un aumento de la hiperintensidad y del edema en el giro recto del lóbulo frontal derecho y la región temporal (Figura 2). En esta instancia, no fue posible realizar una segunda PL para detectar si persistía o no el VHS-1. Se inició la administración de dexametasona y NaCl al 3 % para el edema cerebral. Si bien no fue posible confirmar la farmacorresistencia mediante métodos moleculares, se consideró que se trataba de resistencia clínica al aciclovir. Se agregó foscarnet (60 mg/kg, por vía IV cada 12 horas). Esta alteración en el tratamiento, junto con el manejo del edema cerebral, produjo una mejoría dramática en la condición general del paciente, quien recobró la lucidez y fue capaz de responder preguntas adecuadamente. La oftalmoscopia fue normal. En la PL de control, correspondiente al día 17 del tratamiento con foscarnet y al día 33 del tratamiento con aciclovir, se observaron 20 células/ml, glucosa y proteínas normales y ADN de VHS-1 negativo en el LCR. Con base en estos hallazgos, se interrumpió el tratamiento combinado con ambos fármacos. Durante el transcurso de la enfermedad, se disminuyó la dosis de corticoesteroides. El paciente recibió el alta y no presentaba secuelas neurológicas. Durante el seguimiento, se realizó una RM del cráneo; las secuencias ponderadas en T1 mostraron necrosis corticolaminar en el giro recto del lóbulo frontal, el hipocampo, el núcleo amigdalino, el hipotálamo y los cuerpos mamilares del hemisferio izquierdo y se detectó disminución del edema y de las señales hiperintensas en el lóbulo temporal derecho (Figura 3).
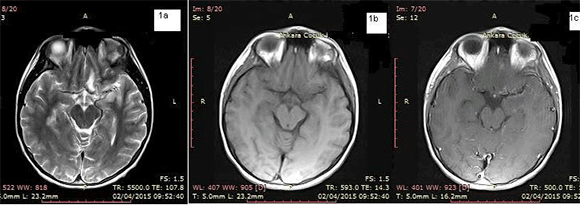
Figura 1: Secuencia transversal ponderada en T2 de la RM realizada el día de la hospitalización en la que se observan edema y aumento de la intensidad de señal en los lóbulos temporal y frontal. Se observan cambios similares en un área pequeña del lóbulo temporal derecho (1a). No se observa hemorragia en la secuencia ponderada en T1 (1b). Después de la administración de un contraste, se observó realce meníngeo de la piamadre hacia la izquierda (1c).

Figura 2: En la secuencia ponderada en T2 se observa aumento del edema y de la intensidad de la señal en los lóbulos temporal y frontal y en el lóbulo temporal derecho (2a). En la secuencia ponderada en T1 obtenida antes de la administración del contraste, se observa aumento de la señal cortical que coincide con la hemorragia (2b). Después de la administración de un contraste, se observó mayor realce meníngeo de la piamadre (2c).
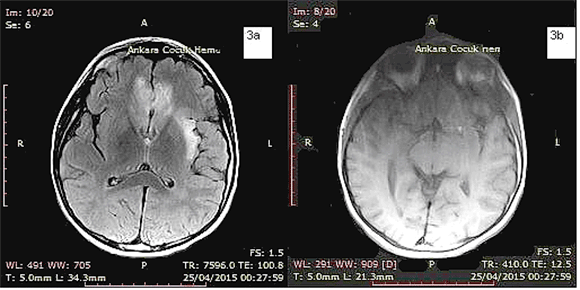
Figura 3: A la tercera semana de hospitalización, en esta secuencia FLAIR ponderada en T2w se observa compromiso del giro recto del lóbulo frontal derecho (3a). La secuencia ponderada en T1 no muestra hemorragia (3b).
DISCUSIÓN
La EHS es la causa identificada más frecuente de la encefalitis viral.5 Las infecciones del sistema nervioso central por herpes simple son las más graves y destructivas de todas las infecciones virales.3 Los pacientes con EHS presentan, en orden de frecuencia, fiebre, alteración de la conciencia, cefalea, desorientación, convulsiones, cambios de la conducta o la personalidad, alteración de la memoria, incapacidad motriz y problemas con el habla.5 Nuestro paciente tenía la mayoría de estos síntomas. Los hallazgos más comunes en el LCR incluyen pleocitosis con predominio de linfocitos, concentración de proteínas moderadamente elevada y concentración de glucosa normal. La RM y el EEG, que mostraron anomalías en el lóbulo temporal, sirven como pruebas de diagnóstico de respaldo.3 Todos los hallazgos en el LCR, la RM y el EEG de nuestro paciente indicaban EHS; el resultado positivo de VHS en el LCR según la PCR confirmó el diagnóstico definitivo. En la EHS, se recomienda repetir la PL 21 días después de iniciar el tratamiento con aciclovir. Si aún se observa VHS en el LCR, se debe realizar una PL semanalmente para determinar la presencia de VHS en el LCR.
El aciclovir es el fármaco preferido para el tratamiento de la EHS. Se sabe que el inicio del aciclovir de manera temprana está asociado con un mejor pronóstico de la EHS.5 El aciclovir actúa afectando dos enzimas virales. La timidina cinasa (TC) viral forsforila el aciclovir para formar monofosfato de aciclovir, que luego es fosforilado por las cinasas celulares para tomar la forma activa de trifosfato de aciclovir (ACV-TP). El ACV-TP inhibe competitivamente la ADN polimerasa viral.6
La tasa de mortalidad de la EHS se redujo después de la introducción del aciclovir. El uso cada vez mayor de este fármaco podría llevar al desarrollo de cepas de VHS resistentes. La causa más frecuente de la resistencia al aciclovir son las mutaciones en la tirosina cinasa (TC) (95 %).7 Una pérdida en la actividad de la TC, una alteración en la especificidad del sustrato de la TC y una alteración en la actividad de la ADN polimerasa son responsables de la resistencia al aciclovir.8 Se ha informado que esta varía entre el 3,5 % y el 10 % en los pacientes inmunocomprometidos. En un estudio reciente con 1425 pacientes con infección por VHS, que buscaba revaluar el estado de resistencia del VHS al aciclovir entre 2002 y 2011, se observó que la prevalencia de resistencia en los pacientes inmunocompetentes no superaba el 0,5 %, mientras que, en los pacientes inmunocomprometidos, se observó un aumento significativo.4 Nuestro paciente era un niño sano de 12 años de edad, pero su situación clínica y los hallazgos en la RM empeoraban a pesar de haberse recomendado el tratamiento con aciclovir en forma temprana. Por este motivo, se pensó en la resistencia al aciclovir. Para tratar las infecciones resistentes al aciclovir, pueden usarse fármacos con diferentes mecanismos de acción.
Una opción alternativa es el foscarnet, que actúa directamente sobre la ADN polimerasa viral. Se informaron algunos casos de EHS resistente al aciclovir que recibieron tratamiento satisfactorio con la combinación de aciclovir y foscarnet. Por ejemplo, el caso de una mujer inmunocompetente de 27 años con EHS cuya evolución clínica había empeorado y que presentó aumento de la carga de VHS-1 mientras recibía aciclovir mejoró después del agregado de foscarnet al tratamiento. Se demostraron cinco mutaciones no sinónimas en las posiciones nucleotídicas del gen timidina cinasa (UL23) de la cepa de VHS-1 de esta paciente.9 Se informó el caso de una mujer de 50 años con EHS con virus mutante en el gen timidina cinasa que recibía el anticuerpo monoclonal antifactor de necrosis tumoral adalimumab. El tratamiento combinado de foscarnet y aciclovir también produjo una mejoría en esta paciente.10 Se informó sobre otro caso de un niño de 13 días con EHS que, mientras recibía aciclovir, tuvo un empeoramiento de su estado clínico, y en quien se demostró una mutación en el gen timidina cinasa (nucleótido G375T, aminoácido Q125H). Se agregó vidarabina al régimen terapéutico a partir de la quinta semana debido a que no se disponía de foscarnet.11 En un estudio previo, se informó sobre una paciente de 19 años con EHS. Esta paciente recibió aciclovir en una dosis y durante un período adecuados, pero empeoró significativamente en los siguientes días. Si bien no fue posible realizar la prueba de resistencia al aciclovir, se agregó foscarnet al tratamiento con aciclovir. Después de esto, la paciente mostró una mejoría clínica notoria.12 Desafortunadamente, en nuestro caso, no fue posible probar el aumento de la carga de VHS-1 ni la resistencia al aciclovir. Debido a que no es posible aislar el virus en el LCR, es muy difícil realizar una prueba de sensibilidad del VHS al aciclovir. Si bien la resistencia al aciclovir en los pacientes inmunocompetentes es relativamente rara, el deterioro del estado clínico y los hallazgos neurológicos en los días siguientes a pesar del tratamiento con aciclovir en nuestro paciente indicaron una posible resistencia al aciclovir. Además de esto, la mejoría clínica inmediata poco después de la administración de foscarnet y el tratamiento sintomático apuntaron a la resistencia clínica al aciclovir.
Consideramos que el edema cerebral como parte del empeoramiento del estado clínico podría suceder durante el transcurso de la EHS a pesar del tratamiento con aciclovir. Por este motivo, podría descartarse la realización de PL de control en la práctica clínica. En el caso de una condición clínica que desmejora con el tratamiento con aciclovir, incluso si no se demuestra un aumento de la carga viral del VHS en el líquido cefalorraquídeo, se podría considerar la posibilidad de EHS resistente al aciclovir y el agregado de foscarnet.
1. Stahl JP, Mailles A, De Broucker T. Herpes simplex encephalitis and management of acyclovir in encephalitis patients in France. Epidemiol Infect. 2012; 140(2):372-81. [ Links ]
2. Granerod J, Ambrose HE, Davies NW, Clewley JP, et al. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study. Lancet Infect Dis. 2010; 10(12):835-44. [ Links ]
3. Whitley RJ, Kimberlin DW. Herpes simplex encephalitis: children and adolescents. Semin Pediatr Infect Dis. 2005; 16(1):17-23. [ Links ]
4. Frobert E, Burrel S, Ducastelle-Lepretre S, Billaud G, et al. Resistance of herpes simplex viruses to acyclovir: an update from a ten-year survey in France. Antiviral Res. 2014; 111:36-41. [ Links ]
5. Schiffer JT, Corey L. Herpes Simplex Virus. En: Bennett J, Dolin R, Blaser M (eds). Mandell, Douglas and Bennet principles and practise of infectious disease. 8th ed. Philadelphia: Saunders - Elsevier; 2015. Pp. 1713-30.
6. Wang LX, Takayama-Ito M, Kinoshita-Yamaguchi H, Ka-kiuchi S, et al. Characterization of DNA Polymerase-Associated Acyclovir-Resistant Herpes Simplex Virus Type 1: Mutations, Sensitivity to Antiviral Compounds, Neurovirulence, and In-Vivo Sensitivity to Treatment. Jpn J Infect Dis. 2013; 66(5):404-10. [ Links ]
7. Hill EL, Hunter GA, Ellis MN. In vitro and in vivo characterization of herpes simplex virus clinical isolates recovered from patients infected with human immunodeficiency virus. Antimicrob Agents Chemother. 1991; 35(11):2322-8. [ Links ]
8. Larder BA, Cheng YC, Darby G. Characterization of abnormal thymidine kinases induced by drug-resistant strains of herpes simplex virus type 1. J Gen Virol. 1983; 64 Pt 3:523-32. [ Links ]
9. Schulte EC, Sauerbrei A, Hoffmann D, Zimmer C, et al. Acyclovir resistance in herpes simplex encephalitis. Ann Neurol. 2010; 67(6):830-3. [ Links ]
10. Schepers K, Hernandez A, Andrei G, Gillemot S, et al. Acyclovir-resistant herpes simplex encephalitis in a patient treated with anti-tumor necrosis factor-a monoclonal antibodies. J Clin Virol. 2014; 59(1):67-70. [ Links ]
11. Kakiuchi S, Nonoyama S, Wakamatsu H, Kogawa K, et al. Neonatal herpes encephalitis caused by a virologically confirmed acyclovir-resistant herpes simplex virus 1 strain. J Clin Microbiol. 2013; 51(1):356-9. [ Links ]
12. Katyal N, Taqui AM, Tepper D, Beary JM, et al. Fulminant Herpes Simplex Virus Type I Encephalitis Despite Maximal Medical Therapy. Cureus. 2018; 10(4):e2467. [ Links ]














