Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.2 Buenos Aires Apr. 2019
http://dx.doi.org/10.5546/aap.2019.105
ARTÍCULOS ORIGINALES
http://dx.doi.org/10.5546/aap.2019.105
Relación entre sobrecarga hídrica y mortalidad en niños conshock séptico
Dr. Horacio Márquez-Gonzáleza,b, Dr. Luis Casanova-Bracamontesa, Dra. C Mireya Muñoz-Ramíreza,c, Dr. Leoncio Peregrino-Bejaranoa, Dra. Bárbara Bolaños-Télleza y Dra. Lucelli Yáñez-Gutiérrezd
a. Hospitalización, Hospital de Pediatría, Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social (IMSS), México.
b. Dirección de Investigación, Hospital Infantil de México Federico Gómez, México.
c. Terapia Intensiva Pediátrica, Instituto Nacional de Pediatría, México.
d. Cardiopatías Congénitas, Hospital de Cardiología, Centro Médico Nacional Siglo XXI, IMSS, México.
Correspondencia: Dr. Horacio Márquez-González: horacioinvestigacion@ hotmail.com
Financiamiento: Ninguno.
Conflicto de intereses:
Ninguno que declarar.
Recibido: 30-10-2017
Aceptado: 30-10-2018
RESUMEN
El shock séptico es una de las principales causas que puede llevar a la muerte. La reanimación hídrica constituye un destacado tratamiento para poder disminuir la mortalidad.
Objetivo: determinar la relación entre el porcentaje de sobrecarga hídrica (%SH) y la mortalidad en niños con shock séptico.
Métodos. Estudio de cohorte en pacientes con shock séptico de entre 1 y 17 años, posterior a la reanimación hídrica con presión venosa central ≥ 5 mmHg con monitoreo invasivo y registro completo de %SH hasta las 96 h. El seguimiento y la variable de desenlace se completaron hasta el día 28. Se registraron las siguientes variables del shock séptico, shock refractario, causa de la insuficiencia renal aguda, anemia, desnutrición, el tiempo de inicio de antimicrobiano, presión oncótica y puntaje de gravedad.
Análisis estadístico: Se calculó el hazard ratio (HR) y se construyeron tres modelos pronósticos por riesgos proporcionales de Cox.
Resultados. La población fue de 263 pacientes; con un promedio de edad de 8 ± 3 años y con mortalidad del 33 %. El %SH ≥ 10,1 acumulado a las 96 h fue el único asociado; el HR (IC 95 %) ajustado fue perfil hemodinámico HR = 2,6 (1,95,6); por shock refractario, HR = 2,5 (1,6-5,6) y por desnutrición, HR = 8,3 (3,5-14).
Conclusiones. El %SH > 10,1 % se relacionó con una mayor mortalidad a 28 días de ajustado al perfil hemodinámico, la refractariedad del shock y el estado nutricional.
Palabras clave: Shock séptico; Mortalidad infantil; Balance hidroelectrolítico.
INTRODUCCIÓN
Se calcula que, anualmente, mueren 7,5 millones de pacientes pediátricos como consecuencia de la sepsis. El shock séptico tiene una mortalidad aproximada del 15 %.1
El shock séptico condiciona un estado de vasodilatación generalizada por la liberación de citocinas inflamatorias que disminuyen el volumen del espacio intravascular, por lo tanto, la administración de soluciones intravenosas es el tratamiento inicial.2 La administración prolongada de líquido en el compartimiento venoso produce congestión que lesiona el glucocálix del endotelio y favorece la fuga al intersticio, lo que condiciona un estado de hipoperfusión secundario y lesión orgánica.3
La Acute Dialysis Quality Initiative (ADQUI) integró un grupo de trabajo que dividió en cuatro estadios la terapia de reanimación hídrica en los pacientes en estado crítico, en los que el aporte debía ser progresivamente disminuido y que eran rescate, optimización, estabilización y desescalamiento.4
En la población adulta, se ha descrito que el balance hídrico positivo condiciona mayor riesgo de muerte, insuficiencia renal aguda (IRA) y requerimientos prolongados de ventilación mecánica. En el área pediátrica, los estudios muestran resultados heterogéneos por la variedad de criterios de selección y variables pronósticas incluidas, por lo que la evidencia respecto a la mortalidad es imprecisa y justifica la realización de estudios de cohorte.5 El apego a la estrategia de reanimación escalonada del shock séptico de las Guías de la Campaña Sobreviviendo a la sepsis ha demostrado que el tiempo del inicio de la administración de líquidos se asocia a una menor mortalidad, no así el volumen administrado.6
El objetivo de este trabajo fue determinar la relación entre el porcentaje de sobrecarga hídrica (%SH) y la mortalidad ajustada por variables confusoras en pacientes con shock séptico.
MATERIAL Y MÉTODOS
Se realizó un estudio de pronóstico en una cohorte prospectiva de un hospital pediátrico, de enero de 2011 a diciembre de 2016, con la aprobación del Comité Local de Ética en Investigación y con el requisito obligado del proceso de la firma del consentimiento informado por los padres. Dicha cohorte se conformó por pacientes de entre 1 y 17 años con shock séptico (sepsis con tensión arterial < 2 desviaciones estándar ajustada en las tablas estandarizadas por sexo, edad y talla,7 y tres o más de los siguientes puntos: taquicardia > 180 en lactantes o > 160 latidos por minuto en preescolares, pulsos disminuidos, gasto urinario < 1 ml/kg/h en niños con peso < 30 kg o < 0,5 ml/kg/h en > 30 kg, con frecuencia respiratoria mayor del percentil 90 para la edad o que requirieron ser apoyados por ventilación mecánica asistida).8
Los criterios de inclusión fueron pacientes de ambos sexos con shock séptico que recibieron tratamiento hídrico temprano (hasta 3 cargas de 20 ml/kg en la primera hora) con presión venosa central (PVC) entre 8 y 16 mmHg9 y toma de muestras sanguíneas durante la primera hora posterior a la reanimación hídrica (gasometría venosa central y arterial, hemocultivos y urocultivo), antropometría (peso y talla) con método estandarizado por técnica de Zerfas10 (con báscula, estadímetro e infantómetro calibrados) e ingreso en la Unidad de Terapia Intensiva Pediátrica (UTIP) el primer día.
Se excluyeron los enfermos con comorbilidades, como cardiopatía congénita, parálisis cerebral infantil, amputación, enfermedades pulmonares graves (intersticiales o con hipertensión pulmonar grave), enfermedad renal crónica en etapa mayor de III, antecedente de shock séptico en los últimos 6 meses y negativa para llenar el consentimiento informado por parte de los padres. Fueron eliminados los pacientes que fallecieron por causas ajenas al shock séptico, en los que hubo pérdida de seguimiento por el traslado a otra unidad y con llenado incompleto de la hoja de balance hídrico.
Se definió como el tiempo cero de la cohorte el momento de completar la reanimación hídrica y el desenlace se registró hasta el día 28. Las variables evaluadas fueron las siguientes:
1. Perfil hemodinámico del shock séptico:8 con el resultado de la gasometría arterial y venosa central, se realizaron los siguientes cálculos.
• Contenido arterial (CaO2) y venoso de oxígeno (CvO2) sustituyendo sus valores en la siguiente fórmula para cada producto: hemoglobina (g/dl) x 1,34 x (saturación de oxígeno (%)/100) + (0,0031 x presión de oxígeno en mmHg).
• Diferencias arteriovenosas de oxígeno (D(a-v) O2)11 = CaO2 - CvO2.
• Consumo de oxígeno (VO2) en ml/min/m2 = 1,39 x peso en kg + 0,84 x talla en cm -35,7.12
• Índice cardíaco (IC) en l/min = VO2/(10 x D(a-v)O2) dividido entre superficie corporal (SC). 2
• Índice de resistencias vasculares sistémicas (IRVS) en dinas = (PVC en mmHg - tensión arterial media) * 80/IC.
Se clasificó en perfil hiperdinámico (IC> 5,5 l/min, IRVS ≤ 800 dinas y D(a-v)O2 ≤ 3) e hipodinámico (IC < 3,3 l/min; IRVS ≤ 800 dinas, D(a-v)O2 ≥ 5 y saturación venosa central de oxígeno menor del 70 %).8 Se definió como shock séptico refractario a inotrópico/vasopresor la persistencia de requerimientos de catecolaminas (epinefrina > 0,1 mcg/kg/min, norepinefrina > 0,1 mcg/kg/min o dopamina > 10 mcg/kg/min) por más de 24 h.13
2. %SH: de la hoja diaria del balance hídrico, se registraron los ingresos y egresos en intervalos de 24 h hasta el cuarto día. Se calculó el %SH acumulado por día con la fórmula propuesta por Sutherland (%SH = ingresos (l) - egresos (l)/peso en kg x 100),14 que se estratificaron en tres categorías: del 0-5 %, del 5,1 % al 10 %, > 10,1 %.
3. Condicionante del shock séptico: se agrupó, según las comorbilidades previas y las condiciones de riesgo del enfermo, en dos categorías, en 1) evento de fiebre y neutropenia, que incluyó a pacientes con diagnóstico de base hematooncológico con fiebre y valor de neutrófilos al ingresar < 500 cel./mm3 durante los primeros 7-10 días posteriores a la administración de quimioterapia y 2) pacientes con aislamiento microbiológico en los hemocultivos.
La escala empleada para estratificar la gravedad en la UCIP fue el Pediatric Index of Mortality 2 (PIM-2)15 de las primeras 24 h correspondiente a la primera hora de ingreso al hospital.
4. El desarrollo de falla renal aguda (lesión, daño, falla) durante el período de seguimiento con base en los criterios diagnósticos de las guías de Acute Kidney Injury (AKI).16
5. Calidad y número de las soluciones intravenosas empleadas durante la reanimación, así como características de los inotrópicos y vasopresores empleados.
6. Se registraron otras variables, como la presencia de desnutrición, que se definió al presentar un valor menor de dos desviaciones estándar del peso para la talla con las gráficas de crecimiento de la Organización Mundial de la Salud (OMS) de 2006;17 el nivel de lactato sérico posterior a la reanimación hídrica, que se consideró alterado con valor > 4 mmol/l; la presencia de anemia con resultado de hemoglobina < 9 g/dl y la presión oncótica [(albúmina sérica x 5,54) + (globulina sérica x 1,43)], en que se consideró anormal el resultado < 19,4 mmHg.18
La metodología empleada para la obtención de la información consistió en el llenado diario de una hoja de captura por el médico tratante (ajeno al proceso de análisis estadístico). El peso y la talla registrados fueron los del ingreso en la última hospitalización (en aquellos con ingreso menor de 3 días y, en los que estuvieron por un período mayor, se empleó el último registrado antes del shock séptico).
Análisis estadístico: Las variables cualitativas se expresaron en frecuencias absolutas y porcentajes. Las variables cuantitativas según su distribución se reportaron con medidas de tendencia central (media, mediana) y dispersión (desviación estándar o rangos).
En el análisis bivariado, se compararon los sobrevivientes vs. los no sobrevivientes con la prueba de c2 en las variables cualitativas y la prueba de T o U de Mann-Whitney en las cuantitativas. Las que fueron estadísticamente significativas se dicotomizaron y se calculó el riesgo absoluto por hazard ratio (HR). Para la construcción de los modelos pronósticos, se realizó, primero, el estadístico de Cochran-Mantel-Haenszel para identificar las principales variables confusoras; posteriormente, aquellas con valor de p < 0,1 o relevancia clínica se introdujeron a la construcción de modelos de proporciones de Cox. Se realizó el análisis de sobrevida por Kaplan-Meier en el caso de %SH. Se consideró significancia estadística al valor de p < 0,05. El paquete estadístico empleado fue SPSS (IBM) para Mac, versión 20.
RESULTADOS
Se obtuvo una muestra final de 242 pacientes (Figura 1), con promedio de edad de 8 ± 3 años, de los cuales 144 (el 59,5 %) fueron mujeres. Del total, 88 (el 36,4 %) desarrollaron algún grado de lesión renal aguda. En 126 enfermos (el 52 %), el diagnóstico fue hematooncológico, de los cuales 102 presentaron evento de fiebre y neutropenia. Se presentaron 80 defunciones (el 33 %).

Figura 1. Diagrama de selección de los pacientes con shock séptico que integraron la cohorte
Se confirmaron 92 aislamientos microbiológicos: 24 Staphyloccocus (18 Staphylococcus aureus y 6 Staphylococcus coagulasa negativo), 23 Pseudomonas aeruginosa, 17 Escherichia coli, 15 Klebsiella spp., 5 Acinetobacter baumannii y 8 Candida spp.
Las variables que presentaron diferencias al comparar el grupo de vivos vs. muertos (Tabla 1) fueron sexo masculino, perfil hipodinámico del shock séptico, shock refractario, ventilación mecánica en las primeras 24 h y la desnutrición.
Tabla 1. Características generales de la población de pacientes con shock séptico y las diferencias entre vivos y muertos
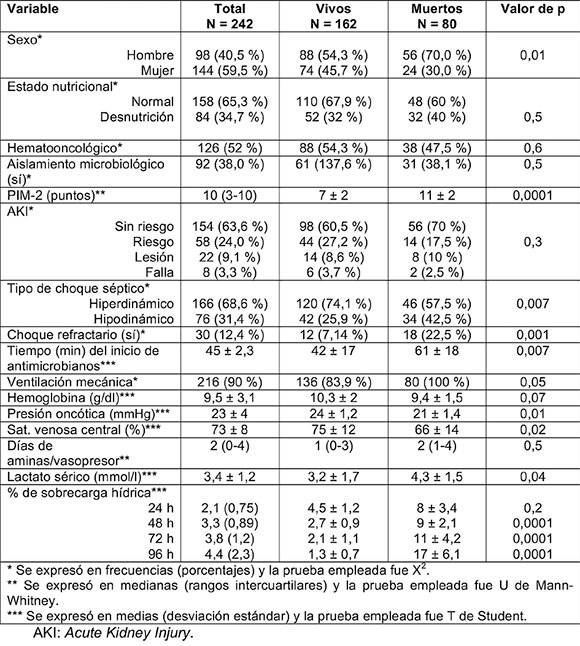
Con respecto a las variables cuantitativas analizadas, las que presentaron diferencias entre vivos y muertos fueron puntaje de la escala PIM-2 (7 ± 2 vs. 11 ± 2), tiempo entre el diagnóstico del shock séptico y el inicio de antimicrobiano (42 ± 17 vs. 61 ± 18 min), presión oncótica (24 ± 1,2 vs. 21 ± 1,4 mmHg) y lactato sérico (3,2 ± 1,7 vs. 4,3 ± 1,5 mmol/l).
El promedio de %SH acumulado por horas de evolución fue mayor en el grupo de muertos a partir de las 48 h (Tabla 1). En la Figura 2, se demuestran las diferencias entre ambos grupos.

Figura 2. Comparación entre el porcentaje de sobrecarga hídrica acumulado por días entre vivos y muertos por shock séptico
Análisis de sobrevida
Para determinar el %SH acumulado que se incluyó en el análisis de sobrevida, se decidió estratificar por horas (24, 48, 72 y 96 h) en cuatro categorías (%SH negativo, de 0 a 5, de 5,1 a 10 y > 10,1 %). El único que representó riesgo con significancia estadística fue el %SH > 10,1 a las 96 h (Tabla 2).
Tabla 2. Comparación entre vivos y muertos al shock séptico y cálculo del hazard ratio según el porcentaje de sobrecarga hídrica en pacientes pediátricos con shock séptico

Para evitar la colinealidad, se realizaron 3 modelos pronósticos (Tabla 3): en el primero, se analizó con una variable de shock séptico que incluyó únicamente el perfil hemodinámico inicial (hiper- o hipodinámico), mientras que, en el segundo, esta variable fue sustituida por una que evaluó la refractariedad del shock séptico (presente o ausente). Se decidió realizar un tercer modelo exclusivamente en los pacientes con desnutrición (en cualquier grado). En los tres, se encontró el %SH > 10,1 % como un factor de riesgo para la mortalidad. La curva de sobrevida de Kaplan-Meier se muestra en la Figura 3.

Figura 3. Cumn de sobrevida en pacientes con shock séptico categorizado por porcentaje de sobrecarga hídrica acumulado a 96 horas
Tabla 3. Cálculo del hazard ratio para presentar la muerte en los pacientes con shock séptico

DISCUSIÓN
En este estudio, la mortalidad de los pacientes con shock séptico fue del 33 %. Los trabajos publicados con objetivos semejantes reportaron diferentes frecuencias debido a los criterios de selección; no obstante, cuando el criterio de selección fue exclusivo de sujetos con shock séptico, como en la cohorte de Chen y cols., la relación en dicho desenlace fue prácticamente la misma (el 30 %).19
En el análisis bivariado, el grupo de sujetos muertos presentaron un promedio mayor de %SH acumulado durante los primeros cuatro días. Cuando el análisis se estratificó por rangos de %SH, el único que condicionó un riesgo significativo fue el correspondiente a las 96 h.
En la población adulta, Garzotto y cols., realizaron un estudio multicéntrico que reportó un incremento de la probabilidad de muerte del 4 % por cada punto porcentual de incremento en el %SH.20
En la población pediátrica, el %SH acumulado se asoció al incremento en los días de asistencia mecánica ventilatoria. Sin embargo, cuando la variable de resultado evaluada fue la muerte, algunos autores, como Abulebda21 y Willson,22 no encontraron dicha asociación; mientras que otros, como Li y Chen19 y Bhaskar23 (con criterios de selección semejantes a este trabajo), sí la documentaron.
En este trabajo, además, se decidió incluir la evaluación del perfil hemodinámico con base en el cálculo del IC en una fórmula derivada del método de Fick, sustentado en los antecedentes de estudios realizados en poblaciones de animales y no pediátricas con un valor de r de 0,61 a 0,8824 con la técnica de termodilución y 0,88 con ultrasonido doppler.25
Como estrategia para determinar la asociación pronóstica del %SH sobre otras variables confusoras, se diseñaron tres modelos pronósticos. En el primero, se consideró el perfil hemodinámico inicial (con el fin de evitar la colinealidad con el desarrollo de refractariedad) y resultó, en el análisis de proporciones de Cox, que el %SH > 10,1, el lactato sérico, la lesión renal y el tiempo de inicio de antimicrobianos fueron los más asociados. El perfil hiperdinámico se presentó en el 68,6 %. Sin embargo, quienes cursaron la fase hipodinámica durante las primeras 24 h presentaron una proporción mayor de muertes, lo cual fue consistente con lo publicado por Ceneviva y cols.,8 que encontraron que el perfil hipodinámico presentó menor sobrevida.
En el segundo modelo, se analizó la presencia de shock refractario y se encontraron como únicas variables asociadas el %SH acumulado a 96 h > 10 y la escala PIM-2. Autores como Weiss y cols.,26 han asociado que, cuando el shock séptico tiene un comportamiento refractario a inotrópico/vasopresor, la mortalidad se incrementa al 34 %. En esta cohorte, la frecuencia de shock refractario fue del 12,4 % con una mayor proporción en el grupo de muertos (el 22,5 % vs. el 7,1 %).
El tercer modelo ajustó el efecto de la desnutrición, la cual se presentó en el 34,6 % con mayor proporción en los muertos; dicha asociación ya ha sido reportada en otros estudios del continente africano como causa de muerte.27 Además del %SH, otras variables con riesgo fueron la presión oncótica y el daño renal. Se explica dicho fenómeno como resultado de la pérdida de la presión oncótica e hidrostática (por el fenómeno del shock séptico), que condiciona la fuga del líquido administrado al espacio intersticial y que concluye en la lesión renal por mecanismo prerrenal.
En los niños, la asociación entre la falla renal y el shock séptico se espera en el 30 % con un incremento en la probabilidad de muerte.28 En esta cohorte, la frecuencia de lesión/falla fue del 36,4 %, con una permanencia en dos de los modelos pronósticos realizados. Sobre esto, Na Wang y cols. documentaron, en un estudio multicéntrico de población adulta (2526 pacientes), un incremento en la mortalidad en presencia de sobrecarga hídrica y lesión renal aguda.29
En nuestro estudio, la variable correspondiente al inicio de antimicrobiano representó un HR = 1,1 (1-1,4) por cada minuto a partir del diagnóstico del estado de shock. Al respecto, Morneau y cols. identificaron, en pacientes adultos con enfermedad oncológica, un incremento del 16 % de hipotensión por cada hora de retraso.30
En otros estudios semejantes, las escalas pediátricas validadas de mortalidad en la
UCIP, independientemente de cuáles fueran, resultaron ser permanentes incluidas en los modelos pronósticos.19,21-23 En el caso de esta cohorte, la seleccionada fue la PIM-2, que mantuvo independencia en todos los modelos pronósticos finales, lo que añadió consistencia con la evidencia reportada y permitió ponderar sobre esta la capacidad predictiva del %SH.
La principal fortaleza de este trabajo radica en la ponderación a través de distintos modelos pronósticos de la capacidad predictiva del %SH sobre otras variables, como la desnutrición, la neutropenia febril y los perfiles hemodinámicos del shock séptico.
Debe señalarse como debilidad de método la inclusión de un solo centro de atención, lo que puede comprometer la validez externa de los resultados al no descartarse sesgos de selección (por la referencia del tipo de enfermos) o mala clasificación, como en la evaluación del perfil hemodinámico, por el empleo de subrogados del estándar de oro.
Se justifica la realización de un estudio multicéntrico que permita ajustar el efecto de otras variables, como el tipo de esquema antimicrobiano, el manejo quirúrgico, la presencia de cardiopatía congénita y otras variables bioquímicas.
CONCLUSIÓN
En los pacientes con shock séptico, el %SH > 10,1 se relaciona con una mayor mortalidad a 28 días ajustado al perfil hemodinámico, a la refractariedad del shock séptico y al estado nutricional.
1. Ruth A, McCracken CE, Fortenberry JD, Hall M, et al. Pediatric severe sepsis: current trends and outcomes from the Pediatric Health Information Systems database. Pediatr Crit Care Med. 2014; 15(9):828-38. [ Links ]
2. Sakr Y, Rubatto Birri PN, Kotfis K, Nanchal R, et al. Higher Fluid Balance Increases the Risk of Death From Sepsis: Results From a Large International Audit. Crit Care Med. 2017; 45(3):386-94. [ Links ]
3. Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth. 2012; 108(3):384-94. [ Links ]
4. Hoste EA, Maitland K, Brudney CS, Mahta R, et al. Four phases of intravenous fluid therapy: a conceptual model. Br J Anaesth. 2014; 113(5):740-7.
5. Glassford NJ, Bellomo R. The Complexities of Intravenous Fluid Research: Questions of Scale, Volume, and Accumulation. Korean J Crit Care Med. 2016; 31(4):276-99. [ Links ]
6. Workman JK, Amess G, Reeder RW, Korgenski EK, et al. Treatment of Pediatric Septic Shock With the Surviving Sepsis Campaign Guidelines and PICU Patient Outcomes. Pediatr Crit Care Med. 2016; 17(10):e451-8. [ Links ]
7. National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics. 2004; 114(2 Suppl 4th Report):555-76. [ Links ]
8. Ceneviva G, Paschall JA, Maffei F, Carcillo JA. Hemodynamic support in fluid-refractory pediatric septic shock. Pediatrics. 1998; 102(2):e19. [ Links ]
9. Keeley A, Hine P, Nsutebu E. The recognition and management of sepsis and septic shock: a guide for non-intensivists. Postgrad Med J. 2017; 93(1104):626-34. [ Links ]
10. Hartman ME, Saeed MJ, Powell KN, Olsen MA. The Comparative Epidemiology of Pediatric Severe Sepsis. J Intensive Care Med. 2017:885066617735783. [ Links ]
11. Mesquida J, Saludes P, Gruartmoner G, Espinal C, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference is associated with lactate evolution in the hemodynamic resuscitation process in early septic shock. Crit Care. 2015; 19:126. [ Links ]
12. Schantz DI, Chen RP. A practical method of measuring oxygen consumption in children with complex mixing circulations by the use of thermodilution cardiac output studies. J Thorac Cardiovasc Surg. 2013; 146(5):1179-84. [ Links ]
13. Williams FZ, Sachdeva R, Travers CD, Walson KH, et al. Characterization of Myocardial Dysfunction in Fluid- and Catecholamine-Refractory Pediatric Septic Shock and Its Clinical Significance. J Intensive Care Med. 2016:885066616685247. [ Links ]
14. Sutherland SM, Zappitelli M, Alexander SR, Chua AN, et al. Fluid overload and mortality in children receiving continuous renal replacement therapy: the prospective pediatric continuous renal replacement therapy registry. Am J Kidney Dis. 2010; 55(2):316-25. [ Links ]
15. Straney L, Clements A, Parslow RC, Pearson G, et al. Paediatric index of mortality 3: an updated model for predicting mortality in pediatric intensive care. Pediatr Crit Care Med. 2013; 14(7):673-81. [ Links ]
16. Selby NM, Lennon R. Be on alert for pediatric AKI. Kidney Int. 2017; 92(2):286-8. [ Links ]
17. Waterlow JC. Classification and definition of protein-calorie malnutrition. Br Med J. 1972; 3(5826):566-9. [ Links ]
18. Vázquez-Rodríguez J. Presión coloidosmótica plasmática, índice de Briones y ascitis en preeclampsia-eclampsia. Cir Cir. 2010; 78(2):137-43. [ Links ]
19. Chen J, Li X, Bai Z, Fang F, et al. Association of Fluid Accumulation with Clinical Outcomes in Critically 1ll Children with Severe Sepsis. PLoS One. 2016; 11(7):e0160093. [ Links ]
20. Garzotto F, Ostermann M, Martin-Langerwerf D, Sanchez-Sanchez M, et al. The Dose Response Multicentre Investigation on Fluid Assessment (DoReMIFA) in critically ill patients. Crit Care. 2016; 20(1):196. [ Links ]
21. Abulebda K, Cvijanovich NZ, Thomas NJ, Allen GL, et al. Post-ICU admission fluid balance and pediatric septic shock outcomes: a risk-stratified analysis. Crit Care Med. 2014; 42(2):397-403. [ Links ]
22. Willson DF, Thomas NJ, Tamburro R, Truemper E, et al. The relationship of fluid administration to outcome in the pediatric calfactant in acute respiratory distress syndrome trial. Pediatr Crit Care Med. 2013; 14(7):666-72. [ Links ]
23. Bhaskar P, Dhar AV, Thompson M, Quigley R, et al. Early fluid accumulation in children with shock and ICU mortality: a matched case-control study. Intensive Care Med. 2015; 41(8):1445-53. [ Links ]
24. Alkhodair A, Tsang MYC, Cairns JA, Swiston JR, et al. Comparison of thermodilution and indirect Fick cardiac outputs in pulmonary hypertension. Int J Cardiol. 2018; 1258:228-31. [ Links ]
25. Chew MS, Poelaert J. Accuracy and repeatability of pediatric cardiac output measurement using Doppler: 20-year review of the literature. Intensive Care Med. 2003; 29(11):1889-94. [ Links ]
26. Weiss SL, Balamuth F, Hensley J, Fitzgerald JC, et al. The Epidemiology of Hospital Death Following Pediatric Severe Sepsis: When, Why, and How Children With Sepsis Die. Pediatr Crit Care Med. 2017; 18(9):823-30. [ Links ]
27. Kambale RM, Kasengi JB, Kivukuto JM, Cubaka LM, et al. Profil infectieux et mortalité des enfants âgés de 0 à 5 ans admis pour malnutrition aiguë sévère: étude de cohorte rétrospective au Centre Nutritionnel et Thérapeutique de Bukavu, République Démocratique du Congo. Pan Afr Med J. 2016; 23:139. [ Links ]
28. Duzova A, Bakkaloglu A, Kalyoncu M, Poyrazoglu H, et al. Etiology and outcome of acute kidney injury in children. Pediatr Nephrol. 2010; 25(8):1453-61. [ Links ]
29. Wang N, Jiang L, Zhu B, Wen Y, et al. Fluid balance and mortality in critically ill patients with acute kidney injury: a multicenter prospective epidemiological study. Crit Care. 2015; 19:371. [ Links ]
30. Morneau K, Chisholm GB, Tverdek F, Bruno J, et al. Timing to antibiotic therapy in septic oncologic patients presenting without hypotension. Support Care Cancer. 2017; 25(11):3357-63. [ Links ]














