Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.3 Buenos Aires jun. 2019
http://dx.doi.org/10.5546/aap.2019.157
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2019.157
Asistencia con membrana de oxigenación extracorpórea en recuperación cardiovascular pediátrica: experiencia de un centro de Argentina
Dra. María L. Pilana, Dr. Guillermo Morenoa, Dra. Mariela Krynskia, Enf. Gisela Poncea, Dra. Mercedes Montonatia, Dra. Mirian Lenza, Dr. Ricardo Rodrígueza, Dr. Javier Cornelisb, Dr. Jorge Barretab, Dr. Ricardo Magliolaa, Lic. Raquel Quiroza y Dr. Pablo García Delucisb
a. Unidad de Cuidados Intensivos.Hospital de Pediatría "Prof. Dr. J. P. Garrahan", Buenos Aires, Argentina.
b. Servicio de Cirugía Cardiovascular. Hospital de Pediatría "Prof. Dr. J. P. Garrahan", Buenos Aires, Argentina.
Correspondencia: María Luisa Pilan: mlpilan@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 8-5-2018.
Aceptado: 8-1-2019
RESUMEN
Objetivo: Describir resultados de membrana de oxigenación extracorpórea en pacientes con cirugía cardíaca y analizar los factores de riesgos de morbimortalidad.
Métodos: Estudio retrospectivo, de pacientes cardíacos con asistencia circulatoria. Se registraron variables, diagnóstico, cirugía, puntaje Risk Adjustment for Congenital Heart Surgery (RACHS), momento de colocación, canulación, días de asistencia en internación, complicaciones, sobrevida y seguimiento. Se analizaron los riesgos edad, peso, RACHS, patología uni- o biventricular, momento de colocación, días de asistencia e internación, y complicaciones. Análisis estadístico descriptivo y de regresión logística para factores de riesgo.
Resultados: En 5295 admisiones, 72 pacientes requirieron membrana de oxigenación extracorpórea (1,37 %). Edad mediana: 6,5 meses (rango intercuartilo -RIQ-: 20 días-2 años); peso: 5,5 kg (RIQ: 3,25-9,5); tiempo de bomba: 188 min (RIQ: 134-246,5); de clampeo: 92 min (65-117). La canulación fue en quirófano en 34 casos (47 %). La mediana de asistencia fue 3 días (RIQ: 2-5), y de internación, 20 (RIQ: 11-32). La sobrevida al alta fue 49 %; 8 pacientes fallecieron durante el seguimiento. La complicación más frecuente fue hemorragia ( 57 %). El peso <5 kg (p = 0,01) y vasopresores en asistencia (p = 0,012) tuvieron riesgo de mortalidad. La sobrevida a 10 años fue del 77 %, con 84 % en clase funcional 1-2 y el 37 % presentaba algún grado de retardo madurativo.
Conclusiones: La complicación más frecuente fue la hemorragia; peso y vasopresores se asociaron con mortalidad.
Palabras clave: Cardiopatías congénitas; Oxigenación por membrana extracorpórea; Factores de riesgo.
INTRODUCCIÓN
La asistencia con membrana de oxigenación extracorpórea (extracorporeal membrane oxygenation; ECMO, por sus siglas en inglés) es un sistema de asistencia vital extracorpórea, que permite proveer, parcial o totalmente, soporte cardíaco y/o pulmonar en los pacientes con falla cardíaca y/o respiratoria refractaria como puente a la decisión, a la recuperación, a la operación quirúrgica o al trasplante. Es una de las terapias más intensas y complejas en cuanto a lo tecnológico ofrecidas en medicina y forma parte del tratamiento estándar en el cuidado perioperatorio de los niños con cardiopatía congénita críticamente enfermos en centros de alta complejidad. Existen distintas formas de asistencia circulatoria mecánica: aquellas que sostienen de modo temporal tanto la función cardíaca como la pulmonar, como la asistencia con ECMO, y aquellas que solo sostienen la función cardíaca, ya sea de un ventrículo o de ambos, conocidas como dispositivos de asistencia ventricular (DAV). ECMO es la forma de asistencia circulatoria mecánica de corto plazo (< 30 días) usada con mayor frecuencia en el cuidado perioperatorio de los niños con cardiopatía congénita.1-3 La indicación más frecuente es la falla del tratamiento médico en la insuficiencia cardíaca y pos cirugía cardíaca.1-3 Se estima que el 1-2 % de los pacientes operados quirúrgicamente requieren este tratamiento, que, por su complejidad, necesita de un conocimiento y entrenamiento altamente específico para lograr buenos resultados.4 La Organización Mundial de Soporte Vital Extracorpóreo (Extracorporeal Life Support Organization; ELSO por sus siglas en inglés), institución que lleva los registros de todos los centros adheridos a ella, reporta una sobrevida al momento del alta del 42 % para los pacientes cardíacos neonatales y del 51 % para los pediátricos.5 En nuestro Hospital, se operan 600 pacientes por año con cardiopatía congénita, con una mortalidad cercana al 5 %, y se cuenta con un programa de ECMO para cirugía cardíaca desde 2006.6-8 El objetivo de este trabajo es describir los resultados de la asistencia con ECMO en los pacientes con cirugía cardíaca y analizar los factores de riesgo de morbimortalidad en nuestra población.
PACIENTES Y MÉTODOS
Se analizaron en forma retrospectiva los datos de los pacientes asistidos con ECMO en la Unidad de Recuperación Cardiovascular, del Hospital de Pediatría J. P. Garrahan, en el período 2006-2016. Se obtuvieron de la base de datos del Servicio, que los recolectaba en forma prospectiva de todos los pacientes intervenidos. El protocolo fue aprobado por el Comité de Revisión Institucional del Hospital. Por tratarse de datos disociados, no se solicitó consentimiento informado. Se incluyeron datos demográficos, diagnóstico cardiológico y procedimiento quirúrgico realizado, tiempo de bomba y de clampeo, complejidad del procedimiento a través de la Escala de Risk Adjustment for Congenital Heart Surgery (RACHS),9 inicio del ECMO en el quirófano o en la Unidad de Cuidados Intensivos Pediátricos (UCIP), canulación central o periférica, días de asistencia circulatoria mecánica, complicaciones, sobrevida ante la decanulación, sobrevida al momento del alta y seguimiento a largo plazo. Los pacientes fueron divididos según su edad en < de 30 días, de 1 mes a 12 meses, de un año a 18 años y adultos. Debido a la amplia variabilidad de diagnósticos, se agruparon en tres grupos para su análisis: lesiones univentriculares, lesiones biventriculares y enfermedades miocárdicas (trasplantes cardíacos y miocarditis).
Las complicaciones fueron categorizadas según el registro de la ELSO en mecánicas (entrada de aire, formación de trombos en el circuito, falla en el oxigenador, problemas en la cánula o cualquiera que haya requerido cambio del circuito), hemorrágicas (hemorragias gastrointestinales, sangrado en el sitio de la canulación, sangrado en el sitio quirúrgico, hemorragia gastrointestinal, hemólisis), neurológicas (convulsiones, hemorragia o infartos cerebrales, muerte encefálica), renales (insuficiencia renal, uso de métodos dialíticos), respiratorias (neumotórax, hemorragia pulmonar), cardiopulmonares (arritmias, paro cardíaco, uso de vasopresores durante la asistencia, hipertensión arterial que requirió vasodilatadores, taponamiento cardíaco) e infecciosas (hemocultivos positivos durante la asistencia). En el seguimiento clínico de 10 años, se evaluaron el estado neurológico (test motor y cognitivo, Clinical Adaptive Test/Clinical Linguistic and Auditory Milestone Scale -CAT/CLAMS-) y la capacidad funcional según la clasificación de la Sociedad Americana de Cardiología, sobre la base de los datos registrados en las historias clínicas.
Definiciones
Sobrevida a la ECMO: presencia de circulación nativa 24 h después de la decanulación. Sobrevida al momento del alta: paciente vivo al momento del alta hospitalaria o cuando era transferido a otro hospital.5
Se analizaron como factores de riesgo de mortalidad la edad y el peso, la complejidad por RACHS, la reparación univentricular o biventricular, el momento de colocación, los días de asistencia e internación, y las complicaciones.
Análisis estadístico: las variables continuas se reportaron como media y desvío estándar o mediana y rango intercuartilo (RIQ). Las variables categóricas, como valores absolutos y porcentaje; se evaluó su asociación con el test de chi2 o el test exacto de Fisher.
Para identificar los factores de riesgo de sobrevida/mortalidad al momento del egreso hospitalario, se realizó un análisis bivariado para evaluar la relación entre esta y otras variables independientes. Posteriormente, se confeccionó un modelo de regresión logística multivariado, en el que las variables seleccionadas para ingresar presentaron p < 0,2 asociada al test de Wald. Luego se incluyeron en el modelo aquellas con asociación estadísticamente significativa con el test de Wald: p < 0,05. Las medidas de efecto se informaron como odds ratio (OR) con sus respectivos intervalos de confianza (IC) del 95 %. Se utilizó el paquete estadístico Stata 10.1.
RESULTADOS
Durante el período del estudio, se operaron 5295 pacientes con circulación extracorpórea (CEC), de los cuales 72 requirieron ECMO (el 1,37 %). La forma de asistencia fue ECMO venoarterial en todos los casos. En la Tabla 1, se describen los datos de la población. La mediana de edad fue de 6,5 meses (RIQ: 20 días-2 años), con peso de 5,5 kg (RIQ: 3,25-9,5). El tiempo de bomba fue 188 minutos (RIQ: 134-246,5); el tiempo de clampeo, 92 minutos (RIQ: 65-117). Los datos de los pacientes agrupados por edad se describen en la Tabla 2. El 12 % (n = 9) tuvo una reparación univentricular (hipoplasia de corazón izquierdo). El 72 % (n = 52) requirió un procedimiento quirúrgico de complejidad 3 y 4 de la Escala de RACHS. En 34 pacientes (el 47 %), la conexión a ECMO se realizó en el quirófano; solo en 4 pacientes, se utilizó como tratamiento de estabilización preoperatoria (neonatos con cianosis crítica) para permitir realizar la reparación quirúrgica en condiciones favorables. En el 94,5 % de los casos, se realizó la canulación central. La indicación más frecuente fue disfunción miocárdica (el 69 %) y disfunción asociada a hipertensión pulmonar (HTP) (el 11 %), seguida de cianosis (el 10 %), paro cardiorrespiratorio (el 3 %), causas respiratorias (el 3 %), sepsis (el 3 %) y arritmias (el 1 %).
Tabla 1. Descripción de la población. N: 72

Tabla 2. Descripción de la población separada por grupos de edad
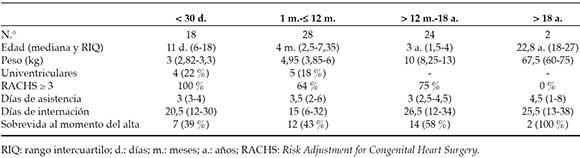
La mediana de asistencia fue de 3 días (RIQ: 1-12 días); el 46 % de los pacientes requirió hemofiltración o hemodiafiltración. En el 12 %, se requirió el uso de drogas vasoactivas durante la asistencia. El 72 % de los pacientes presentó complicaciones, y el sangrado fue la más frecuente (el 56,9 %). La mediana de internación hospitalaria fue de 20 días (RIQ: 1 día-34 días). La sobrevida al momento del alta fue del 49 % (n = 35) (Tabla 2).
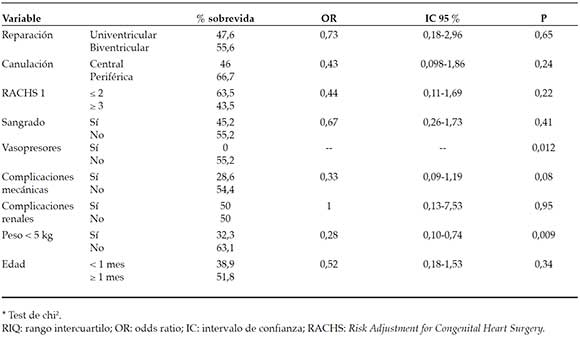
En la Tabla 3, se detallan los resultados del análisis bivariado de los factores de riesgo para sobrevida/mortalidad. En la confección del modelo multivariado, se observó que todos los pacientes que requirieron drogas vasopresoras en ECMO fallecieron (p = 0,012). Dado que esta variable predecía perfectamente la mortalidad, no pudo ser ingresada al modelo multivariado y, por ello, no se pudo estimar OR e IC 95 %. En el modelo múltiple, la variable peso < 5 kg fue un factor asociado como predictor de riesgo de sobrevida/mortalidad al momento del egreso hospitalario, independientemente de otras variales evaluadas (p = 0,01), OR 0,28 (IC 95 %: 0,10-0,74).
Tabla 3. Análisis bivariado de factores de riesgo de sobrevida al momento del egreso hospitalario*
Durante el seguimiento de 10 años, 19 pacientes se encontraban vivos al momento de este estudio, mientras que 8 fallecieron durante él. El 84 % (n = 16) se encontraban en clase funcional 1-2. Con respecto al desarrollo neurológico, 10 pacientes (el 53 %) tenían desarrollo acorde a la edad, 7 (el 37 %) presentaban diferentes grados de retardo madurativo y, en dos (el 10 %), no se pudieron recabar datos (Figura 1).

Figura 1. Seguimiento clínico a 10 años
DISCUSIÓN
En los últimos años, ha habido un aumento en la complejidad de la cirugía cardíaca de las cardiopatías congénitas, con la consiguiente necesidad de ofrecer terapéuticas como ECMO, que ofrecen tiempo a la recuperación de la función miocárdica.110 La ELSO reporta, a enero de 2016, una sobrevida del 51 % con ECMO cardíaca en los pacientes pediátricos.5 Numerosos artículos mencionan la importancia en la asociación de volumen del centro y la mejora en la sobrevida en los pacientes que requieren este tratamiento por indicaciones cardíacas; de ahí la importancia de la regionalización y de la centralización de los servicios para técnicas de tratamiento tan específicas.4,11 En nuestro Hospital, uno de los principales centros de derivación, el 1,37 % de los pacientes operados necesitaron de ECMO, con una sobrevida al momento del alta del 49 %. La indicación más frecuente fue la disfunción miocárdica en el quirófano (dificultad para desconectar de la CEC) o dentro de las 24 h poscardiotomía en la UCIP.
Numerosos estudios han observado una mayor mortalidad en aquellos pacientes que requirieron ECMO en el quirófano frente a los que lo hicieron en la Unidad de Cuidados Intensivos (UCI), mientras que otros reportaron un incremento de la mortalidad en los pacientes a los que se les colocó la ECMO de modo temprano en la UCI luego de la cirugía cardíaca.2,311,12 Recientemente, en un estudio retrospectivo sobre la base de un análisis de múltiples bases de datos, no se encontró asociación entre el tiempo de la iniciación de la ECMO y la mortalidad.13
En nuestra serie, no hubo diferencia significativa entre uno y otro grupo. Uno de los aspectos más importantes en la indicación de este procedimiento es la elección del momento oportuno de asistencia. Identificar este momento es fundamental, ya que la intervención tardía empeora los resultados. Se han desarrollado diferentes escalas de puntuación a este respecto; sin embargo, en su mayoría, son para pacientes adultos, por lo que es difícil adaptarlas a nuestra población.14 La mayoría de los grupos coinciden en que el momento óptimo de la iniciación de ECMO debe basarse en el escenario clínico.13
Un análisis de la ELSO sobre los factores asociados con la mortalidad en los neonatos que requieren ECMO por indicaciones cardíacas refiere la acidosis (pH sangre arterial < 7,20), ácido láctico > 5 mmol (como marcadores de perfusión tisular), además de la necesidad de asistencia respiratoria mecánica (ARM) pre-ECMO como factores asociados al aumento de la mortalidad.12,13 Estos estudios sugieren que una indicación oportuna, en cuanto al momento de inicio del soporte con ECMO, es uno de los factores pronósticos más importantes, sobre todo, en la población neonatal.15
En nuestra experiencia, se considera la necesidad de ECMO en aquellos pacientes que no salen de bomba o que presentan bajo gasto cardíaco grave poscardiotomía, refractario al tratamiento convencional, tomando como parámetros objetivos los signos de hipoperfusión tisular (acidosis metabólica -ph < 7,25- y láctica -lact. > 4 mmol en ascenso-), saturación venosa < del 40 %, oligoanuria y dosis crecientes de inotrópicos (adrenalina > 0,15, noradrenalina > 0,15 y en ascenso, y vasopresina > 0,002).
Otro factor de riesgo de mortalidad reconocido en la mayoría de las series es la fisiología univentricular.15-17 En nuestra serie, la mayoría de los pacientes asistidos tenían reparaciones biventriculares; no se encontraron diferencias significativas en la mortalidad entre uno y otro grupo.
El peso menor de 4 kg, la prematurez, la duración de la asistencia > 8 días, la necesidad de drogas inotrópicas y/o técnicas dialíticas durante la ECMO son otras variables asociadas a la mortalidad en numerosas series.13,17
En nuestra serie, solo el peso < 5 kg y la necesidad de vasopresores endovenosos se asociaron de manera significativa con la mortalidad. La complicación más frecuente en nuestros pacientes fue el sangrado (el 56,9 %).
Werho et al., en un análisis retrospectivo de los datos de la ELSO, en pacientes pediátricos cardíacos con ECMO, concluyeron que la hemorragia fue una complicación presente en más de la mitad de los casos, que la exploración mediastinal previa a la ECMO, la mayor complejidad de la cirugía, la canulación en el posoperatorio temprano y el mayor tiempo de CEC eran factores asociados a la complicación hemorrágica en estos pacientes y que constituía un factor de riesgo asociado a la morbimortalidad.18
La implementación de un protocolo de anticoagulación con la participación de hematólogos, que incluye la realización de estudios complementarios de hemostasia, ha ayudado a disminuir, en nuestro centro, esta complicación, sobre todo, en la población de mayor riesgo, como los neonatos.19,20 En nuestra serie, el 46 % de los pacientes requirió hemofiltración y/o hemodiafiltración, pero no se asoció con mayor mortalidad. La indicación de estas medidas dialíticas se debió, en la mayoría de los casos, al exceso de líquido ganado durante el perioperatorio y la necesidad de lograr un balance negativo y no a la presencia de insuficiencia renal aguda.21,22
La ECMO también se asocia con la morbilidad. Las causas son multifactoriales. La gravedad de la cardiopatía, las anomalías no cardíacas, la hipoperfusión de los órganos durante la fase crítica de la enfermedad y el propio procedimiento de la ECMO pueden contribuir a esta.2,10,23,24 Es así que, en los últimos años, además de la sobrevida al momento del alta hospitalaria, se evalúan otros resultados, como el desarrollo neurològico, la calidad de vida y la mortalidad tardía.25-27 En el seguimiento a largo plazo, centros de primer nivel concluyen que la mayoría de estos pacientes tienen una significativa morbilidad, un peor desarrollo neurològico y una calidad de vida menor que la población normal.28-30
En nuestra serie, 8 pacientes fallecieron durante el seguimiento y solo 19 presentaron consultas posteriores. De ellos, el 84 % (n: 16) se encontraba en clase funcional 1-2, y el 37 % (n: 7) presentaban diferentes grados de retardo madurativo. La incorporación de estos pacientes en el programa de seguimiento de pacientes con enfermedades crónicas complejas del Hospital nos permitirá, en el futuro, un mejor conocimiento del desarrollo neurológico y de la calidad de vida de nuestra población.31
CONCLUSIONES
La sobrevida al momento del alta del programa de ECMO cardíaca del Hospital de Pediatría J. P. Garrahan fue del 49 %. Los factores que se asociaron con mayor riesgo de mortalidad fueron el peso menor de 5 kg y la necesidad de vasopresores durante la asistencia. La complicación más frecuente fue el sangrado; sin embargo, no se asoció con mayor mortalidad. En el seguimiento de 10 años, la sobrevida fue del 77 %, y permaneció en clase funcional 1-2 el 84 % de los casos y con diferentes grados de retardo madurativo el 37 %.
Agradecimientos
Al Dr. José Suárez por su gran aporte en la realización de este programa. A la Dra. Maria Althabe por su lectura crítica.
1. Thiagarajan RR. Extracorporeal Membrane Oxygenation for Cardiac Indications in Children. Pediatr Critic Care Med. 2016; 17(8 Suppl 1):S155-9. [ Links ]
2. Cashen K, Hollis TK, Delius RE, Meert KL. Extracorporeal Membrane Oxygenation for Pediatric Cardiac Failure: Review with a Focus on Unique Subgroups. Prog Pediatr Cardiol. 2016; 43:105-11. [ Links ]
3. Mesher AL, McMullan DM. Extracorporeal Life Support for the Neonatal Cardiac Patients: Outcomes and New Directions. Semin Perinatol. 2014; 38(2):97-103. [ Links ]
4. Freeman CL, Bennett TD, Casper C, Larsen GY, et al. Pediatric and neonatal extracorporeal membrane oxygenation: does center volume impact mortality? Crit care Med. 2014; 42(3):512-9. [ Links ]
5. Extracorporeal Life Support Organization. ECLS Registry Report: International Summary. January 2016. [Consulta: 8 de enero de 2019]. Disponible en: https://www.elso.org/Registry/Statistics/InternationalSummary.aspx.
6. Althabe M, Rodríguez R, Balestrini M, Charroqui A, et al. Morbilidad en cirugía de cardiopatía congénita en un hospital público en Argentina. Arch Argent Pediatr. 2018; 116(1):e14-8. [ Links ]
7. Moreno GE, Magliola RH, Pilan ML, Althabe M, et al. Asistencia circulatoria mecánica en pediatría. Experiencia en el Hospital de Pediatría Dr. Juan P. Garrahan. Argentina. Arch Cardiol Mex. 2014; 84(4):256-61. [ Links ]
8. Magliola R, Althabe M, Moreno G, Lenz A, et al. Cirugía cardíaca reparadora en recién nacidos. Experiencia de 5 años en cirugia neonatal con circulación extracorpórea. Arch Argent Pediatr. 2009; 107(5):417-22. [ Links ]
9. Jenkins K, Gauvreau K, Newburger J, Spray TL, et al. Consensus-based method for risk adjustment for Surgery for congenital heart disease. J Thorac Cardiovasc Surg. 2002; 123(1):110-8. [ Links ]
10. Paden ML, Rycus PT, Thiagarajan RR, ELSO Registry. Update and Outcomes in Extracorporeal Life Support. Semin Perinatol. 214; 38(2):65-70. [ Links ]
11. Allan CK, Thiagarajan RR, Del Nido PJ, Roth SJ, et al. Indication for initiation of mechanical circulatory supports impacts survival of infants with shunted single-ventricle circulation supported with extracorporeal membrane oxygenation. J Thorac Cardiovasc Surg. 2007; 133(3):660-7. [ Links ]
12. Chrysostomou C, Morell VO, Kuch BA, O'Malley E, et al. Short- and intermediate-term survival after extracorporeal membrane oxygenation in children with cardiac disease. J Thorac Cardiovasc Surg. 2013; 146(2):317-25. [ Links ]
13. Gupta P, Robertson MJ, Rettiganti M, Seib PM, et al. Impact of timing of ECMO initiation on outcomes after pediatric heart surgery: a multi-institutional analysis. Pediatr Cardiol. 2016; 37(5):971-8. [ Links ]
14. Schmidt M, Burrel A, Roberts L, Bailey M, et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. Eur Heart J. 2015; 36(33):2246-56. [ Links ]
15. Kumer TK, Zuracowski D, Dalton H, Talwar S, et al. Extracorporeal membrane oxygenation in postcardiotomy patients: factors influencing outcomes. J Thorac Cardiovasc Surg. 2010; 140(2):330-6. [ Links ]
16. Mascio CE, Austin E 3rd, Jacobs JP, Jacobs ML, el at. Perioperative mechanical circulatory support in children: an analysis of the Society of Thoracic Surgeons Congenital Heart Surgery Database. J Thorac Cardiovasc Surg. 2014; 147(2):658-64. [ Links ]
17. Ford MA, Gauvreau K, McMullan M, Almodovar MC, et al. Factors associated with mortality in neonates requiring extracorporeal membrane oxygenation for cardiac indications: analysis of the extracorporeal life support organization registry data. Pediatr Crit Care Med. 2016; 17(9):860-70. [ Links ]
18. Werho DK, Pasquali SK, Yu S, Donohue J, et al. Hemorrhagic complications in pediatric cardiac patients on extracorporeal membrane oxygenation: an analysis of the Extracorporeal Life Support Organization Registry. Pediatr Crit Care Med. 2015; 16(3):276-88. [ Links ]
19. Saini A, Spinella PC. Management of anticoagulation and hemostasis for pediatric extracorporeal membrane oxygenation. Clin Lab Med. 2014; 34(3):655-73. [ Links ]
20. Baird CW, Zurakowski D, Robinson B, Gandhi S, et al. Anticoagulation and extracorporeal membrane oxygenation: impact of activated clotting time a heparin dose on survival. Ann Thorac Surg. 2007; 83(3):912-9. [ Links ]
21. Askenazi DJ, Ambalavanan N, Hamilton K, Cutter G, et al. Acute kidney injury a renal replacement therapy independently predict mortality in neonatal and pediatric noncardiac patients on extracorporeal membrane oxygenation. Pediatr Crit Care Med. 2011; 12(1):e1-6. [ Links ]
22. Han SS, Kim, HJ, Lee SJ, Kim WJ, et al. Effects of renal replacement therapy in patients receiving extracorporeal membrane oxygenation: a meta- analysis. Ann Thorac Surg. 2015; 100(4):1485-95. [ Links ]
23. Chandler HK, Teppa B, Johnson KA, McCracken C, et al. Determining comorbidities and quality of life among pediatric survivors of extracorporeal life support. J Crit Care. 2015; 30(5):1085-9. [ Links ]
24. García Guerra G, Robertson CM, Alton GY, Joffe AR, et al. Quality of life 4 years after complex heart surgery in infancy. J Thorac Cardiovasc Surg. 2013; 145(2):482-8.e2. [ Links ]
25. Wagner K, Risnes I, Bermtsen T, Skarbo AB, et al. Clinical and psychosocial follow-up study of children treated with extracorporeal membrane oxygenation. Ann Thorac Surg. 2007; 84(4):1349-55. [ Links ]
26. Massaro AN, El-Dib M, Glass P, Aly H. Factors associated with adverse neurodevelopmental outcomes in infants with congenital heart disease. Brain Dev. 2008; 30(7):437-46. [ Links ]
27. Elias MD, Achuff BJ, Ittenbach RF, Ravishankar C, et al. Long-term outcomes of pediatric cardiac patients supported by extracorporeal membrane oxygenation. Pediatr Critc Care Med. 2017; 18(8):787-94 [ Links ]
28. García Guerra G, Robertson CMT, Alton GY, Joffe AR, et al. Heath-related quality of life in pediatric cardiac extracorporeal life support survivors. Pediatr Crit Care Med. 2014; 15(8):720-7. [ Links ]
29. Ibrahim AE, Duncan BW, Blume ED, Jonas RA. Long-term follow-up of pediatric cardiac patients requiring mechanical circulatory support. Ann Thorac Surg. 2000; 69(1):186-92. [ Links ]
30. Costello JM, O'Brien M, Wypij D, Shubert J, et al. Quality of life of pediatric cardiac patients who previously required extracorporeal membrane oxygenation. Pediatr Crit Care Med. 2012; 13(4):428-34. [ Links ]
31. Marin DN, Sorbara L. conducta adaptativa y calidad de vida en niños de 3 a 6 años con cardiopatías congénitas. Su relación con el medio ambiente de crianza. Med Infant. 2017; 24(2):78-86. [ Links ]











 texto en
texto en 


