Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos argentinos de pediatría
versión impresa ISSN 0325-0075versión On-line ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.3 Buenos Aires jun. 2019
http://dx.doi.org/10.5546/aap.2019.e205
ARTÍCULO ORIGINAL
http://dx.doi.org/10.5546/aap.2019.e205
Eficacia y seguridad de ceftarolina fosamil en niños: revisión sistemática y metaanálisis
Dra. M. Teresa Rosanovaa, Farm. Norma Sbernab y Dr. Roberto Ledec
a. Servicio de Control Epidemiológico e Infectología, Hospital J. P. Garrahan.
b. Servicio de Farmacia, Hospital J. P. Garrahan.
c. Universidad Abierta Interamericana (UAI).
Correspondencia: Dra. M. Teresa Rosanova: margris2@yahoo.com.ar
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 6-8-2018
Aceptado: 10-12-2018
RESUMEN
Introducción. La resistencia a los antibióticos plantea un problema de salud mundial cada vez mayor, por lo que la búsqueda de nuevos y más efectivos antibióticos es prioritaria. La ceftarolina tiene un amplio espectro de actividad contra cepas Gram-positivas clínicamente relevantes, que incluyen el Staphylococcus aureus meticilino resistente y cepas de Streptococcus pneumoniae resistentes, así como algunos patógenos Gram-negativos implicados en infecciones de piel y tejidos blandos o en la neumonía adquirida en la comunidad; es una potencial opción terapéutica. Se realizó una revisión sistemática que evaluó si la ceftarolina era más efectiva y segura que los comparadores.
Material y métodos. Se realizó una búsqueda bibliográfica exhaustiva para identificar estudios clínicos experimentales que compararan la seguridad y eficacia de la ceftarolina con un comparador en la población pediátrica. El criterio de evaluación de eficacia fue la tasa de fracaso terapéutico y, para seguridad, la presencia de cualquier efecto adverso.
Resultados. Se identificaron tres estudios, 2 de neumonía adquirida en la comunidad y uno de infecciones de piel y tejidos blandos. En ninguno, se detectó diferencia en el riesgo de fracaso terapéutico, RR 0,97 (0,54-1,73), ni en el criterio de seguridad, RR 0,79 (0,51-1,23).
Conclusiones. La evidencia disponible sugiere que la ceftarolina podría ser una opción terapéutica válida en el tratamiento de las infecciones de piel y tejidos blandos o neumonía adquirida en la comunidad en pacientes pediátricos. No se encontraron trabajos de alta calidad de evidencia en otro tipo de infecciones o en pacientes admitidos en la Unidad de Cuidados Críticos.
Palabras clave: Ceftarolina; Revisión sistemática; Eficacia; Seguridad.
INTRODUCCIÓN
El aumento de la resistencia a los antibióticos plantea un problema de salud mundial cada vez mayor. El Staphylococcus aureus resistente a la meticilina (SAMR) se ha convertido en una causa frecuente de infecciones cutáneas complicadas y neumonía, entre otras, lo que lleva a la necesidad de evaluar nuevas terapias efectivas y seguras.
La vancomicina sigue siendo la primera opción de tratamiento en pacientes con infecciones invasivas por SAMR, pero su toxicidad renal, su reducido espectro y la baja concentración que alcanza a nivel tisular justificarían la búsqueda de nuevas alternativas de tratamiento.1-5
En 2011, la Sociedad de Enfermedades Infecciosas de América recomendó dosis de vancomicina de 15 mg/kg por dosis cada 6 horas para los niños con infecciones invasivas debidas al SAMR con el objetivo de alcanzar altos niveles de concentración en valle.1 Esto permitiría que se estableciera un área de vancomicina bajo la curva, que, en los adultos, predecía mejor la eficacia, pero, después de la incorporación de estas recomendaciones, varios autores informaron que, en los pacientes pediátricos, se evidenciaba una asociación entre las dosis mayores de vancomicina y la falla renal.2,3
La ceftarolina fosamil es una cefalosporina que ha generado mucho interés como una posible opción de tratamiento. Como es el caso de otras cefalosporinas, la actividad antibacteriana de la ceftarolina es el resultado de la unión a proteínas esenciales que inhibe la síntesis de la pared celular bacteriana. Dicho fármaco tiene un amplio espectro de actividad contra cepas Gram-positivas clínicamente relevantes, que incluyen SAMR y cepas de Streptococcus pneumoniae resistentes, así como algunos patógenos Gram-negativos implicados en infecciones de piel y tejidos blandos (IPTB) y neumonía adquirida en la comunidad (NAC).
Este antibiótico está aprobado por la Administración de Alimentos y Medicamentos de EE. UU. (Food and Drug Administration, FDA) para ser utilizado en adultos y niños (desde los 2 meses de edad) con IPTB causadas por cepas de Staphylococcus aureus sensibles y resistentes a la meticilina, Streptococcus pyogenes, Streptococcus agalactiae, Escherichia coli, Klebsiella pneumoniae y Klebsiella oxytoca. También ha sido aprobado para la NAC causada por Streptococcus pneumoniae, Staphylococcus aureus sensible a meticilina, Escherichia coli, Haemophilus influenzae, Klebsiella pneumonia y Klebsiella oxytoca.4'8 En Argentina, está aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), pero el prospecto autorizado destaca que no debe utilizarse en niños y adolescentes, ya que no existen datos suficientes en estas poblaciones.
La experiencia internacional con ceftarolina en la población pediátrica es escasa, lo que motivó a realizar una revisión sistemática de la evidencia existente sobre el tema. Esta tuvo por objetivo principal evaluar si la ceftarolina era efectiva y segura en los niños, especialmente en IPTB y NAC.
MATERIAL Y MÉTODOS
Se realizó una búsqueda bibliográfica exhaustiva, cuyo detalle se detalla en la Tabla 1. Básicamente, se utilizaron los términos de búsqueda ceftaroline y ceftaroline fosamil con los siguientes filtros: ensayo clínico, revisión, estudio comparativo, revisiones sistemáticas, ensayo controlado aleatorizado (ECA), ensayo clínico controlado, metaanálisis y uso en estudios humanos. Se revisaron los artículos publicados en inglés, en español o en francés hasta diciembre de 2017. Las listas de referencias de los artículos se examinaron manualmente para identificar estudios relevantes adicionales. De los artículos hallados se seleccionaron aquellos efectuados sobre la población pediátrica.
Tabla 1. Búsqueda bibliográfica

Se adoptó la incidencia de fracaso terapéutico como el punto final de eficacia, sobre la base del concepto de que, al indicar un tratamiento, era interés primordial del médico conocer el riesgo de no alcanzar el objetivo terapéutico, ya fuera por ineficacia o por razones de seguridad. Una menor tasa de fracasos terapéuticos sugería un mejor comportamiento del tratamiento. Para evaluar la seguridad, se computó la cantidad de pacientes que presentaron, al menos, un efecto adverso. Los análisis de resultados se realizaron con la estrategia según intención de tratar.
Selección de los estudios: Dos revisores (MTR y NS) realizaron la extracción de datos y la evaluación cualitativa de los estudios, en forma independiente. En caso de desacuerdo, un tercer revisor (RL) analizó los datos y coordinó la discusión científica hasta que se alcanzó un consenso.
Los estudios se incluyeron en los siguientes casos: (1) si era un ECA, independientemente del hecho de que fueran ciegos o no, y (2) si comparaban la eficacia y la seguridad de la ceftarolina con otros agentes antibacterianos en niños. La calidad metodológica de los estudios se evaluó por medio de la escala de Jadad,9 y los que alcanzaron una puntuación > 2 fueron considerados para la evaluación.
Análisis de datos y métodos estadísticos: Se calculó el riesgo relativo (RR) individual de cada estudio y el común y sus intervalos de confianza (IC) del 95 % para el riesgo de fracaso terapéutico y de presencia de eventos adversos, utilizando el método de efecto fijo (Mantel-Haenszel) o el modelo de efectos aleatorios (DerSimonian-Laird), según el análisis de heterogeneidad. Los cálculos se llevaron a cabo utilizando el software Metaanalysis propuesto por la red Critical Appraisal Skills Programme (CASPE).10 El sesgo de heterogeneidad se estimó de acuerdo con el estimador P de Higgins.11 El sesgo de publicación, mediante la prueba de Egger. La hipótesis nula fue rechazada si p < 0,05. El presente informe se ajusta a las sugerencias del Acuerdo Preferred Reporting Items for Systematic Reviews and Metaanalyses (PRISMA).12
RESULTADOS
Estudios incluidos y características principales
La búsqueda bibliográfica identificó un total de 1021 resúmenes potencialmente relevantes. De acuerdo con la revisión por título y resumen, se seleccionaron 30 ECA.
Finalmente, se seleccionaron 3 estudios6-8 para analizar e incluir en esta revisión sistemática (Figura 1), ya que cumplían con los criterios de elegibilidad mencionados, lo que sumó un total de 359 individuos. En dos de los estudios,7,8 los pacientes presentaron NAC (n: 181), mientras que, en el restante,6 tuvieron IPTB (n: 159).

Figura 1. Flujo de la búsqueda, evaluación e inclusión de artículos
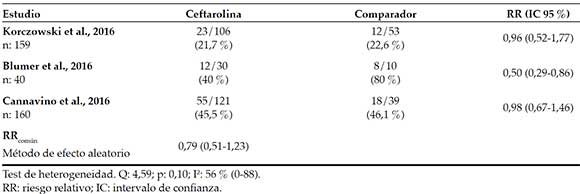
En la Tabla 2, se resumen las principales características de los estudios incluidos; en la Tabla 3, se presentan los riesgos de fracaso terapéutico entre ceftarolina y los comparadores (vancomicina6,7 y ceftriaxona)8 en los estudios primarios y el RR obtenido por el método de efecto fijo, puesto que no hay evidencias de heterogeneidad (I2 = 0). La Figura 2 expone lo hallado en forma de resultados acumulados, lo que muestra que no hay diferencias en la incidencia de fracasos terapéuticos entre la ceftarolina y los comparadores con ninguno de los dos métodos de cálculo (aleatorio y fijo).
Tabla 2. Características de los ensayos controlados aleatorizados incluidos
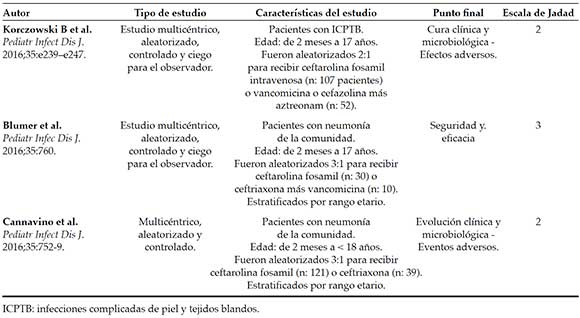
Tabla 3. Riesgo de fracaso terapéutico


Figura 2. Gráfico Forest-plot del riesgo de fracaso terapéutico. Metanálisis acumulativo
La Tabla 4 expone el riesgo de que los pacientes presenten algún efecto adverso. Para este punto final, el conjunto es claramente heterogéneo (l2 56 %). Puede deberse a que uno de los estudios (Blumer)7 presenta una incidencia notable de eventos adversos (el 80 %) en el grupo del comparador contra solo un 40 % en el grupo de ceftarolina. Es posible que este fenómeno esté relacionado con el escaso número de sujetos incluidos (n: 10) en el grupo comparador. Por lo tanto, el resultado del metaanálisis sobre seguridad es poco confiable y podría obviarse el cálculo del RR , , pero, si se lo calcula, debe considerarse el valor obtenido por el método de efecto aleatorio, tal como está expresado en la Tabla 4. Las reacciones adversas más comúnmente reportadas para la ceftarolina fueron la erupción cutánea, la fiebre y los síntomas gastrointestinales.
Tabla 4. Seguridad (pacientes con, al menos, un efecto adverso)
En los tres estudios incluidos, la tasa de seroconversión de prueba directa de Coombs fue mayor en el grupo de ceftarolina que en los grupos de comparación; sin embargo, no se informaron casos de anemia hemolítica.
No se detectó sesgo de publicación, ni en el análisis de eficacia (p: 0,64) (véase la Figura 3) ni en el de seguridad (p: 0,29).

Figura 3. Gráfico de Egger sobre el sesgo de publicación para el criterio de fracaso terapéutico
DISCUSIÓN
Se desarrolló esta revisión sistemática para evaluar el riesgo de fracaso terapéutico y seguridad con ceftarolina en niños frente a los comparadores disponibles.
Los resultados del metaanálisis mostraron que el riesgo de fracaso terapéutico y la incidencia de eventos adversos fueron similares entre la ceftarolina y su comparador, hechos acordes al buen perfil terapéutico de las cefalosporinas.13
Analizando por separado el riesgo de fracaso terapéutico de ceftarolina en las infecciones por SAMR, solo en el estudio de Korczowski6 se evidenció una mejor respuesta con ceftarolina (el 89 %) vs. el comparador (el 57 %) en IPTB. En los otros dos referidos a NAC,7,8 se observó que, en el trabajo de Cannavino,8 uno de los criterios de exclusión era el aislamiento de SAMR, ya que el comparador era ceftriaxona, que no tenía cobertura frente a ese patógeno; en el estudio de Blumer,7 la incidencia de aislamiento de SAMR fue muy baja, por lo que no se pudieron obtener conclusiones válidas en este aspecto. Además, en ese estudio, las dosis utilizadas de ceftarolina fueron mayores que las aprobadas por la FDA. Sin embargo, la incidencia de eventos adversos observada fue menor en ese grupo. El reducido tamaño muestral de este estudio imposibilitó la interpretación confiable de sus resultados.
En la NAC, la ceftriaxona es la única cefalosporina que se ha demostrado superior a la penicilina en S. pneumoniae, incluso en cepas resistentes a la penicilina.14
Para la neumonía complicada y para los pacientes admitidos en las unidades de cuidados intensivos, la terapia antimicrobiana empírica debe ampliarse para cubrir patógenos, tales como el SAMR,1 y, en los casos de pacientes refractarios o intolerantes a la vancomicina, podría evaluarse la ceftarolina como alternativa terapéutica, a pesar de la poca evidencia disponible.
En otras infecciones, como la endocarditis, las infecciones osteoarticulares, la sepsis, las infecciones del sistema nervioso central y la bacteriemia, solo se encontraron series de casos que mostraban buenos resultados con ceftarolina fosamil, pero, dado que eran conclusiones procedentes de diseños con menor validez interna, no se analizaron en este estudio.15-18
Al momento, la FDA tiene aprobado el uso de la ceftarolina para la NAC e IPTB que requieren hospitalización en los niños mayores de 2 meses de edad.
Una limitación del presente estudio fue que los ECA incluidos se realizaron solo en pacientes con NAC y en IPTB y que no estaban ingresados en unidades de cuidados intensivos y con pocos aislamientos microbiológicos de SAMR, lo que restringió el alcance de las conclusiones.
La baja potencia estadística proveniente de los pocos estudios aptos para ser incluidos también fue una limitante. En razón de la evidencia expuesta y considerando las ventajas farmacocinéticas que ofrece el tratamiento con ceftarolina, se justificaría la realización de estudios clínicos rigurosos para responder definitivamente sobre la seguridad y la eficacia de este agente terapéutico en los cuadros clínicos mencionados y en otras infecciones invasivas por SAMR.
CONCLUSIONES
La síntesis de la evidencia experimental publicada muestra que la ceftarolina como monoterapia no se demostró diferente ni en seguridad ni en eficacia con respecto a sus comparadores, por lo que podría considerarse como un antibiótico adicional por estudiar para el tratamiento de pacientes pediátricos con NAC e IPTB, intolerantes o refractarios a los tratamientos convencionales.
Se requieren nuevos estudios experimentales controlados para evaluar el rol de esta terapéutica, también en pacientes admitidos en Terapia Intensiva y con aislamiento de SAMR, así como en otro tipo de infecciones.
1. Liu C, Bayer A, Cosgrove, S, Daum R, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin Infect Dis. 2011; 52(3):e18-55. [ Links ]
2. Knoderer CA, Nichols KR, Lyon KC, Veverka MM, et al. Are elevated vancomycin serum trough concentrations achieved within the first 7 days of therapy associated with acute kidney injury in children? J Pediatric Infect Dis Soc. 2014; 3(2):127-31. [ Links ]
3. McKamy S, Hernandez E, Jahng M, Moriwaki T, et al. Incidence and risk factors influencing the development of vancomycin nephrotoxicity in children. J Pediatr. 2011; 158(3):422-6. [ Links ]
4. Yim J, Molloy LJ, Newland G. Use of Ceftaroline Fosamil in Children: Review of Current Knowledge and its Application. Infect Dis Ther. 2017; 6(1):57-67. [ Links ]
5. Kiang TK, Wilby KJ, Ensom MH. A critical review on the clinical pharmacokinetics, pharmacodynamics, and clinical trials of ceftaroline. Clin Pharmacokinet. 2015; 54(9):915-31. [ Links ]
6. Korczowski B, Antadze T, Giorgobiani M, Stryjewski ME, et al. A Multicenter, Randomized, Observer-blinded, Active-controlled Study to Evaluate the Safety and Efficacy of Ceftaroline Versus Comparator in Pediatric Patients with Acute Bacterial Skin and Skin Structure Infection. Pediatr Infect Dis J. 2016; 35(8):e239-47. [ Links ]
7. Blumer JL, Ghonghadze T, Cannavino C, O'Neal T, et al. A Multicenter, Randomized, Observer-blinded, Active-controlled Study Evaluating the Safety and Effectiveness of Ceftaroline Compared with Ceftriaxone plus Vancomycin in Pediatric Patients with Complicated Community-acquired Bacterial Pneumonia. Pediatr Infect Dis J. 2016; 35(7):760-6. [ Links ]
8. Cannavino CR, Nemeth A, Korczowski B, Bradley JS, et al. A Randomized, Prospective Study of Pediatric Patients with Community-acquired Pneumonia Treated with Ceftaroline versus Ceftriaxone. Pediatr Infect Dis J. 2016; 35(7):752-9. [ Links ]
9. Jadad AR, Moore RA, Carrol D, Jenkinson C, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996; 17(1):1-12. [ Links ]
10. Critical Appraisal Skills Programme Español (CASPe). Calculadoras. [Consulta: 12 de diciembre de 2018]. Disponible en: http://www.redcaspe.org/herramientas/calculadoras.
11. Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med. 2002; 21(11):1539-58. [ Links ]
12. Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and metaanalyses: the PRISMA statement. BMJ. 2009; 339:b2535. [ Links ]
13. El Hajj M, Turgeon R, Wilby K. Ceftaroline fosamil for community-acquired pneumonia and skin and skin structure infections: a systematic review. Int J Clin Pharm. 2017; 39(1):26-32. [ Links ]
14. Lopardo HA, Fossati S. Viviendo treinta años con el enemigo: neumococos resistentes a los antibióticos en la Argentina. Acta Bioquím Clín Latinoam. 2016; 50(4):693-712. [ Links ]
15. Cosimi R, Beik N, Kubiak D, Johnson J. Ceftaroline for Severe Methicillin-Resistant Staphylococcus aureus Infections: A Systematic Review. Open Forum Infect Dis. 2017; 4(2):ofx084. [ Links ]
16. Horcajada J, Cantón R. Ceftarolina, un nuevo antimicrobiano de amplio espectro en la era de las multirresistencias. Enferm Infecc Microbiol Clin. 2014; 32(Supl 2):1-7. [ Links ]
17. Pasquale TR, Tan MJ, Trienski TL, File TM Jr. Methicillin-resistant Staphylococcus aureus nosocomial pneumonia patients treated with ceftaroline: retrospective case series of 10 patients. J Chemother. 2015; 27(1):29-34. [ Links ]
18. Casapao AM, Davis SL, Barr VO, Klinker KP, et al. Large retrospective evaluation of the effectiveness and safety of ceftaroline fosamil therapy. Antimicrob Agents Chemother. 2014; 58(5):2541-6. [ Links ]











 texto en
texto en 


