Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos argentinos de pediatría
Print version ISSN 0325-0075On-line version ISSN 1668-3501
Arch. argent. pediatr. vol.117 no.5 Buenos Aires Oct. 2019
http://dx.doi.org/10.5546/aap.2019.e466
ARTÍCULOS ORIGINALES
http://dx.doi.org/10.5546/aap.2019.e466
Factores de riesgo asociados a exacerbaciones respiratorias en pacientes pediátricos con fibrosis quística
Dra. Silvina Lubovicha, Dra. Silvina Zaragozaa, Dra. Viviana Rodrígueza, Dr. Jefferson Buendíab, Dra. Bethy Camargo Vargasa, Dra. Jessica Alchundia Moreiraa, Bacterióloga Laura Galanternikc, Klga. Patricia Rattod y Dr. Alejandro Tepera
a. Centro Respiratorio, Unidad 3, Hospital de Niños Ricardo Gutiérrez, Buenos Aires.
b. Sección de Neumonología Pediátrica, Hospital Italiano de Buenos Aires.
c. Servicio de Microbiología, Hospital de Niños Ricardo Gutiérrez, Buenos Aires.
d. Servicio de Kinesiología, Hospital de Niños Ricardo Gutiérrez, Buenos Aires.
Correspondencia: Dra. Silvina Lubovich: slubovich@gmail.com
Financiamiento: Ninguno.
Conflicto de intereses: Ninguno que declarar.
Recibido: 8-9-2018
Aceptado:25-2-2019
RESUMEN
Introducción. Los pacientes con fibrosis quística presentan exacerbaciones respiratorias (ER) que requieren tratamiento endovenoso. El objetivo fue determinar los factores de riesgo asociados a ER y obtener porcentaje de pacientes que no recuperaban su función pulmonar previa.
Población y métodos. Observacional, de cohorte, retrospectivo. Se revisaron las historias clínicas de los pacientes con fibrosis quística atendidos en el Hospital de Niños Ricardo Gutiérrez durante 2013. Se dividieron en: grupo 1, con ER (criterios de Fuchs), y grupo 2, sin ER. Se registró edad, género, mutación p.F508del, porcentaje del volumen espiratorio forzado en el primer segundo basal, puntaje Z de índice de masa corporal basal, colonización crónica (criterios de Leeds) por Pseudomonas aeruginosa, Staphylococcus aureus meticilino resistente y complejo Burkholderia cepacia, porcentaje de diabetes relacionada con fibrosis quística y recuperación del volumen espiratorio forzado en el primer segundo basal.
Resultados. Se incluyeron 117 pacientes. Grupo 1: 50; y grupo 2: 67 pacientes. Se asociaron a las ER: el menor puntaje Z de IMC (RR: 1,45; p=0,002), p.F508del (RR: 3,23; p=0,05) y colonización crónica por el complejo Burkholderia cepacia (RR: 3,69; p = 0,002), Pseudomonas aeruginosa (RR: 1,89; p = 0,01) y Staphylococcus aureus meticilino resistente (RR: 2,32; p = 0,002). El 24 % no recuperó su función pulmonar.
Conclusiones. p.F508del, el bajo estado nutricional y la colonización crónica fueron factores de riesgo para exacerbación. Una cuarta parte de los pacientes no recuperó su función pulmonar previa.
Palabras clave: Exacerbaciones respiratorias; Fibrosis quística.
INTRODUCCIÓN
La fibrosis quística (FQ) es una enfermedad genética de herencia autosómica recesiva, caracterizada por una alteración en el funcionamiento de las glándulas de secreción exócrina. Esta enfermedad con compromiso multisistémico, de curso crónico y progresivo, es causada por mutaciones en la proteína reguladora de conductancia transmembrana (cystic fibrosis transmembrane conductance regulator; CFTR, por sus siglas en inglés).
La historia natural de la enfermedad está caracterizada por una declinación progresiva de la función pulmonar, con episodios de empeoramiento de los síntomas respiratorios, denominados "exacerbaciones respiratorias".1,2 A pesar de la notable mejoría en la función pulmonar y en el estado nutricional de los pacientes en los últimos años, no ha habido cambios sustanciales en la frecuencia de las exacerbaciones respiratorias.3 Según el Registro Americano de Fibrosis Quística, en 2013, el porcentaje de exacerbaciones con requerimiento de antibióticos endovenosos para toda la población con FQ fue del 35 % y, en 2016, del 33,8 %.3 Los pacientes con edades comprendidas entre los 15 y los 30 años son los que tienen mayor probabilidad de presentar una exacerbación.3
No hay una definición universal de exacerbación respiratoria, pero los síntomas más característicos son incremento de la tos o de la producción de esputo, fiebre, pérdida de peso, disminución en la tolerancia al ejercicio y nuevos hallazgos clínicos, como taquipnea, nuevos rales en la auscultación, disminución de la función pulmonar, descenso en la saturación o nuevos hallazgos radiográficos.4 Bilton y colaboradores5 definen la exacerbación respiratoria como la necesidad de indicar un tratamiento antibiótico por un cambio reciente en los parámetros clínicos. Cuando las reagudizaciones son graves, requieren tratamiento antibiótico endovenoso. Varias publicaciones han tenido en cuenta la necesidad de tratamiento antibiótico endovenoso para definir una exacerbación.6,7 En este trabajo, se han considerado para la definición de exacerbación los criterios de Fuchs.8
Las exacerbaciones respiratorias se asocian con una mayor declinación de la función pulmonar y una reducción en la calidad de vida y sobrevida.9-11 Luego de una exacerbación respiratoria, tratada con antibióticos endovenosos, hasta un 25 % de los pacientes no recuperan su función pulmonar previa.12
Existen pocos estudios que determinen los factores de riesgo para presentar exacerbaciones respiratorias en FQ. En un estudio retrospectivo, Schechter y colaboradores13 encontraron que los pacientes con bajo nivel socioeconómico eran más propensos a presentar reagudizaciones respiratorias. En un estudio prospectivo realizado en pacientes adultos infectados con bacterias multirresistentes, Block y colaboradores14 determinaron que los pacientes más jóvenes, el sexo femenino, la función pulmonar basal más baja y una historia previa de múltiples exacerbaciones respiratorias eran circunstancias asociadas a presentar exacerbaciones. Conocer estos factores de riesgo nos permitiría identificarlos precozmente y realizar una intervención oportuna que evitara la reagudización.
El objetivo de este trabajo fue identificar los factores de riesgo asociados a la exacerbación respiratoria en los niños con FQ y describir el porcentaje de pacientes que no recuperan su función pulmonar basal luego de una exacerbación
POBLACIÓN Y MÉTODOS
Se diseñó un estudio observacional, analítico, de cohorte, retrospectivo. Fue aprobado por el Comité de Ética y Docencia del Hospital de Niños Ricardo Gutiérrez.
Población
Criterios de inclusión
• Pacientes menores de 18 años de edad, con diagnóstico confirmado de FQ (2 test del sudor positivos o 2 mutaciones del gen del CFTR causantes de FQ), que realizaron el seguimiento en el Centro Respiratorio del Hospital de Niños Ricardo Gutiérrez durante 2013 y que tuvieron, al menos, 4 controles en el año.
Criterios de exclusión
• Pacientes en lista de espera para un trasplante pulmonar.
• Pacientes que realizaron una internación programada.
Procedimientos
Se revisaron las historias clínicas de todos los pacientes que cumplían con los criterios de inclusión. Los datos extraídos fueron anonimizados. Se definió exacerbación respiratoria según los criterios de Fuchs8 (internación con antibióticos parenterales cuando el paciente presentaba 4 o más de los siguientes 12 signos o síntomas: cambios en el esputo, hemoptisis, incremento de la tos, aumento de la disnea, malestar, fatiga o letargia, fiebre, anorexia o pérdida de peso, dolor sinusal, aumento de la descarga sinusal, cambios en la auscultación respiratoria, descenso de la función pulmonar en un 10 % o más, o cambios radiográficos). Se registraron las características demográficas, clínicas, bacteriológicas y funcionales de los pacientes con FQ que habían presentado, al menos, una vez, una exacerbación respiratoria durante 2013 que había requerido internación. Se los denominó grupo 1 (con exacerbación), y se compararon con aquellos pacientes con FQ que habían realizado controles en el mismo Centro, que no habían requerido internación por exacerbación en el mismo período, y se los denominó grupo 2 (sin exacerbación). Se documentaron 83 episodios de exacerbación en total. No se analizó, en ninguno de los grupos, la necesidad de antibióticos orales. Se registraron las siguientes variables clínicas: edad, género, puntaje Z de índice de masa corporal (IMC) basal en mayores de 2 años (obtenido con peso y talla de 3 a 6 meses antes de la exacerbación en un momento de estabilidad y, en el grupo 2, el mejor obtenido en el mismo período), diabetes relacionada con fibrosis quística (DRFQ), presencia de, al menos, una mutación p.F508del.
También se registró el porcentaje de pacientes con infección crónica por Staphylococcus aureus meticilino resistente (SAMR), Pseudomonas aeruginosa (PA) y complejo Burkholderia cepacia (CBC). Se consideró que el paciente presentaba infección crónica por estas bacterias cuando tenía más del 50 % de los cultivos del año positivos, con un mínimo de 4 cultivos realizados en ese año (criterios de Leeds).15 La toma de la muestra de secreciones bronquiales en los menores de 4 años se obtuvo mediante el hisopado orofaríngeo y, en los mayores, por esputo espontáneo. Las muestras fueron sembradas en agar sangre, agar cistina-lactosa deficiente en electrólitos (agar CLDE), agar chocolate, agar cetrimida, agar manitol salado y medio Burkholderia cepacia Selective Agar (BCSA). Los microorganismos aislados fueron identificados por pruebas bioquímicas convencionales.
En los niños de 6 años o más, se realizó una espirometría, según los criterios de la American Thoracic Society (ATS). Se registró el porcentaje del predictivo del volumen espiratorio forzado en el primer segundo (VEF1) basal según Knudson (que consideraba el mejor VEF1 de 3 a 6 meses antes de la exacerbación respiratoria) y, en el grupo 2, el mejor VEF1 obtenido ese mismo año. También se registró el VEF1 al inicio y al final de la exacerbación. Para obtener el porcentaje de los pacientes que recuperaban su función pulmonar luego de la exacerbación, se consideró el VEF1 el último día de la internación, y se comparó con el VEF1 basal (de 3 a 6 meses antes de la exacerbación). Si el paciente lograba obtener el 90 % o más de su VEF1 basal, se consideró que había recuperado su función pulmonar.
La duración del tratamiento antibiótico fue decidida sobre la base de la recuperación de los síntomas, y de la función pulmonar, por el médico especialista en FQ.
Se compararon todas las variables mencionadas en uno y otro grupo para hallar asociaciones entre las variables y la frecuencia de las exacerbaciones.
Análisis estadístico
Las variables categóricas se expresaron en frecuencia y porcentajes, y las variables numéricas, en medias, desvío estándar e intervalos de confianza (IC) si eran de distribución normal o mediana y rango intercuartilo en las distribuciones no normales.
Se aplicó el modelo de regresión de Poisson para medir la asociación entre las tasas de exacerbaciones anuales y las distintas covariables recolectadas. Se utilizó la técnica backward, con la eliminación de las variables que no alcanzaban un valor de p menor del 20 %. Para la permanencia en el modelo, se adoptó como criterio el nivel de significancia menor del 5 % o igual. Todos los análisis fueron realizados utilizando el programa STATA 11.0®.
Para el tamaño muestral, con la n de 117 pacientes, se estimó un odds ratio (OR) de 0,39 y un IC del 95 % entre 0,20 y 0,55, una frecuencia del evento en el grupo expuesto de 0,59, un error alfa de 0,05 y un poder (1- error beta) del 90 %, según la magnitud de asociación encontrada entre distintos factores de riesgo y la exacerbación reportada en el estudio de Block.14
RESULTADOS
De un total de 125 pacientes en seguimiento, se incluyeron 117, con edades comprendidas entre 2 meses y 18 años: 50 en el grupo con exacerbación y 67 en el grupo sin exacerbación. Dos pacientes fueron excluidos por estar en la lista de trasplante bipulmonar, 4 pacientes por no tener, al menos, 4 cultivos de secreciones en el año y 2 pacientes por ser mayores de 18 años. La descripción de los grupos se presenta en la Tabla 1.
Tabla 1. Población de pacientes con diagnóstico de fibrosis quística menores de 18 anos en seguimiento en el Hospital de Niños Ricardo Gutiérrez, en 2013

De los 67 pacientes sin exacerbación, 50 (el 74,6 %) presentaban, en sus secreciones bronquiales, flora habitual o Staphylococcus aureus meticilino sensible (SAMS); ninguno presentaba colonización crónica por CBC, y solo 2 presentaban coinfección por SAMR y PA. En el grupo de los 50 pacientes con exacerbación, solo 5 (el 10 %) presentaban flora habitual o SAMS, y 9 (el 18 %) estaban coinfectados por SAMR y PA.
Con respecto a la función pulmonar, de los 117 pacientes, se pudo obtener la espirometría basal en los niños de 6 años de edad o más, en 38 pacientes del grupo sin exacerbación y en 33 pacientes del grupo con exacerbación. El VEFj basal (porcentaje predicho) promedio fue del 102 % ± 15 en el grupo sin exacerbación y del 68,9 % ± 20,28 en el grupo con exacerbación (OR 0,88; IC 95 %: 0,84-0,93; p < 0,0001) (Figura 1).

Figura 1. Volumen espiratorio forzado en el primer segundo basal en porcentaje del predicho en pacientes con y sin exacerbación
Ninguno de los 38 pacientes sin exacerbación tenía VEF: basal menor del 60 %, mientras que 10 de los 33 pacientes con exacerbaciones (el 30 %) presentaban VEF1 basal menor del 60 % del predictivo (p < 0,001).
Al comparar ambos grupos en el análisis univariado, se observaron diferencias significativas en edad, el puntaje Z de IMC, la presencia de DRFQ, tener, al menos, una mutación p.F508, el porcentaje del VEF: basal y estar colonizado crónicamente con cualquiera de las 3 bacterias (Tabla 2). Sin embargo, al realizar el análisis multivariado, las variables que resultaron ser predictores de exacerbaciones fueron el menor puntaje Z de IMC, tener, al menos, una mutación F508del y estar colonizado crónicamente con CBC, PA o SAMR (Tabla 3).
Tabla 2. Análisis univariado
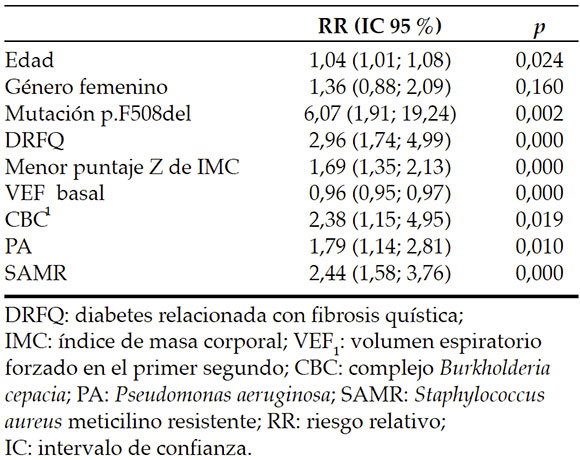
Tabla 3. Modelo predictivo por regresión logística de Poisson que utiliza exacerbaciones respiratorias como variable dependiente

Grupo con exacerbaciones respiratorias
Se registraron 83 exacerbaciones. La mediana de tiempo de internación fue de 14 días (rango de 13 a 36). En 16 episodios de exacerbaciones (el 18,8 %), los pacientes requirieron el uso de ventilación no invasiva. Ningún paciente falleció durante una exacerbación respiratoria.
De un total de 50 episodios de exacerbaciones con valores espirométricos disponibles, en 46 episodios, los pacientes mejoraron su VEF1 con respecto al inicio de la exacerbación luego del tratamiento antibiótico (el 92 %). Además, de 33 pacientes con exacerbación en los cuales se disponía de valores espirométricos basales, 8 (el 24 %) no recuperaron su función pulmonar basal previa (Figura 2).
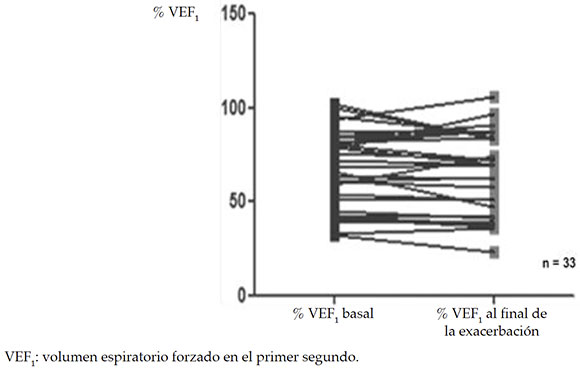
Figura 2. Volumen espiratorio forzado en el primer segundo basal (de 3 a 6 meses antes de la exacerbación) y al final de la exacerbación en porcentaje del predicho en pacientes con exacerbación
DISCUSIÓN
Las exacerbaciones respiratorias en FQ determinan un claro impacto en la calidad de vida de los pacientes y es reconocido el deterioro de la función pulmonar que estas provocan y su contribución a la morbimortalidad en la enfermedad. Liou y colaboradores,16 en 2001, demostraron cómo las exacerbaciones respiratorias disminuían un 12 % la sobrevida de los pacientes.
Schechter y colaboradores13 encontraron que el bajo nivel socioeconómico era un factor de riesgo asociado a presentar exacerbación respiratoria en pacientes con FQ. En nuestro estudio, no se evaluó como factor de riesgo, pues la mayoría de nuestros pacientes presentaban un bajo nivel socioeconómico.
Block y cois.,14 encontraron que el género femenino, los pacientes más jóvenes, tener una función pulmonar basal más baja y la historia de múltiples exacerbaciones respiratorias previas eran factores de riesgo para presentar exacerbaciones respiratorias. Este trabajo fue realizado en adultos y en pocos adolescentes, y todos los pacientes estaban crónicamente infectados con bacterias multirresistentes. En nuestro estudio, se encontró que la infección crónica por SAMR y/o PA y/o CBC eran factores de riesgo para presentar exacerbación respiratoria. La infección crónica por SAMR ha sido objeto de numerosos estudios. En algunos de ellos, se ha demostrado que deterioraba la función pulmonar y requería mayor número de cursos de antibióticos endovenosos.17 En nuestro trabajo, se encontró que aumentaba la posibilidad de tener exacerbaciones respiratorias. En 2008, Jarad y colaboradores18 demostraron que la infección por PA, la función pulmonar baja y la DRFQ eran factores de riesgo para exacerbaciones respiratorias en la población adulta. La infección crónica por PA19,20 y por el CBC21 estaba asociada a un deterioro progresivo de la función pulmonar, y aquí se encontró que presentar infección crónica por cualquiera de estas bacterias era un importante factor de riesgo para que los niños con FQ presentaran una exacerbación.
Es conocida la asociación del estado nutricional y la función pulmonar en FQ.22 Los pacientes que tienen mejor estado nutricional presentan mejores valores de función pulmonar y una mayor sobrevida. En nuestro estudio, el estado nutricional deficiente fue un factor de riesgo para presentar exacerbación respiratoria.
La mutación p.F508del es la más frecuente en la población mundial. En Argentina, se encuentra, al menos, en uno de los alelos de pacientes con FQ, en el 59 % de los casos.23 Es una mutación grave, y, en nuestro estudio, se ha demostrado que es un factor de riesgo para presentar exacerbación respiratoria.
Al igual que en el estudio de Sanders,12 la cuarta parte de los pacientes de nuestro estudio no recuperó su función pulmonar previa. En 2017, Sanders24 demostró que la falta de recuperación de la función pulmonar estaba asociada a un tiempo más corto hasta la próxima exacerbación, una pobre recuperación en la siguiente y mayor posibilidad de futuras exacerbaciones. Este mismo autor demostró también que el aumento del número de exacerbaciones estaba relacionado con un incremento en la tasa de declinación de la función pulmonar.9
Se considera que nuestro estudio presenta dos limitaciones. Una de ellas es tomar el VEFj al final de la internación para comprobar si los pacientes recuperan su función pulmonar basal. El estudio de Sanders12 sugiere que el mejor momento para evaluar la recuperación de la función pulmonar es en los meses subsiguientes a la exacerbación. La segunda limitación es que es retrospectivo y de 12 meses de duración. En un futuro, sería recomendable planear un estudio prospectivo, multicéntrico y de mayor duración. Lo destacable es que es realizado en población pediátrica, y no existen, hasta el momento, estudios de factores de riesgo para exacerbación respiratoria en este grupo etario.
La exacerbación respiratoria es un evento crítico en la determinación del curso de la enfermedad pulmonar de la FQ. Conocer los factores de riesgo asociados a presentar una exacerbación respiratoria podría colaborar a monitorear más estrictamente a los pacientes que presentaran dichos factores y, de esta manera, prevenir el evento.
CONCLUSIONES
La mutación p.F508del, el pobre estado nutricional y la colonización crónica por SAMR, PA y el CBC son factores de riesgo predictivos de exacerbación respiratoria en pacientes pediátricos con FQ. Luego de una exacerbación respiratoria, la cuarta parte de los pacientes no recuperan su función pulmonar previa.
1. Bhatt J. Pulmonary exacerbation in Cystic Fibrosis. Eur Respir Rev. 2013; 22(129):205-16. [ Links ]
2. Flume PA, Mogayzel PJ Jr, Robinson KA, Goss CH, et al. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations. Am J Respir Crit Care Med. 2009; 180(9):802-8. [ Links ]
3. Cystic Fibrosis Foundation Patient Registry. 2016 Patient Registry Annual Data Report. Bethesda, Maryland: Cystic Fibrosis Foundation; 2016. [Consulta: 13 de marzo de 2019]. Disponible en: https://www.cff.org/Research/Researcher-Resources/Patient-Registry/2016-Patient-Registry-Annual-Data-Report/.
4. Rosenfeld M, Emerson J, Williams-Warren J, Pepe M, et al. Defining a pulmonary exacerbation in cystic fibrosis. J Pediatr. 2001; 139(3):359-65. [ Links ]
5. Bilton D, Canny G, Conway S, Dumcius S, et al. Pulmonary exacerbation: Towards a definition for use in clinical trials. Report from the EuroCareCF Working Group on outcome parameters in clinical trials. J Cyst Fibros. 2011; 10(Suppl 2):S79-81. [ Links ]
6. Ramsey BW, Pepe MS, Quan JM, Otto KL, et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. Cystic Fibrosis Inhaled Tobramycin Study Group. N Engl J Med. 1999; 340(1):23-30. [ Links ]
7. Saiman L, Marshall BC, Mayer-Hamblett N, Burns JL, et al. Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial. JAMA. 2003; 290(13):1749-56. [ Links ]
8. Fuchs HJ, Borowitz DS, Christiansen DH, Morris EM, et al. Effect of aerosolized recombinant human DNase on exacerbations of respiratory symptoms and on pulmonary function in patients with cystic fibrosis. The Pulmozyme Study Group. N Engl J Med. 1994; 331(10):637-42. [ Links ]
9. Sanders DB, Bittner RC, Rosenfeld M, Redding GJ, et al. Pulmonary exacerbations are associated with subsequent FEV1 decline in both adults and children with cystic fibrosis. Pediatr Pulmonol. 2011; 46(4):393-400. [ Links ]
10. Britto M, Kotagal U, Hornung R, Atherton HD, et al. Impact of recent pulmonary exacerbations on quality of life in patients with cystic fibrosis. Chest. 2002; 121(1):64-72. [ Links ]
11. De Boer K, Vandemheen KL, Tullis E, Doucette S, et al. Exacerbation frequency and clinical outcomes in adult patients with cystic fibrosis. Thorax. 2011; 66(8):680-5. [ Links ]
12. Sanders D, Bittner R, Rosenfeld M, Hoffman L, et al. Failure to recover to baseline pulmonary function after cystic fibrosis pulmonary exacerbation. Am J Respir Crit Care Med. 2010; 182(5):627-32. [ Links ]
13. Schechter MS, Shelton BJ, Margolis PA, Fitzsimmons SC. The association of socioeconomic status with outcomes in cystic fibrosis patients in the United States. Am J Respir Crit Care Med. 2001; 163(6):1331-7. [ Links ]
14. Block J, Vandemheen K, Tullis E, Fergusson D, et al, Predictors of pulmonary exacerbations in patients with cystic fibrosis infected with multi-resistant bacteria. Thorax. 2006; 61(11):969-74. [ Links ]
15. Lee TW, Brownlee KG, Conway SP, Denton M, et al. Evaluation of a new definition for chronic Pseudomonas aeruginosa infection in cystic fibrosis patients. J Cyst Fibros.2003; 2(1):29-34. [ Links ]
16. Liou TG, Adler FR, Fitsimmons SC, Cahill BC, et al. Predictive 5-year survivorship model of cystic fibrosis. Am J Epidemiol. 2001; 153(4):345-52. [ Links ]
17. Sawicki MD, Rasouliyan L, Pasta DJ, Regelmann WE, et al. The impact of incident methicillin resistant staphylococcus aureus detection on pulmonary function in cystic fibrosis. Pediatr Pulmonol. 2008; 43(11):1117-23. [ Links ]
18. Jarad NA, Giles K. Risk factors for increased need for intravenous antibiotics for pulmonary exacerbations in adult patients with cystic fibrosis. Chron Respir Dis. 2008; 5(1):29-33. [ Links ]
19. Kosorok M, Zeng L, West S, Rock M, et al. Acceleration of lung disease in children with cystic fibrosis after Pseudomonas aeruginosa acquisition. Pediatr Pulmonol.2001; 32(4):277-87. [ Links ]
20. Demko C, Byard P, Davis P. Gender differences in cystic fibrosis: Pseudomonas aeruginosa infection. J Clin Epidemiol.1995; 48(8):1041-9. [ Links ]
21. Waters V. New treatments for emerging cystic fibrosis pathogens other than Pseudomonas. Curr Pharm Des. 2012: 18(5):696-725. [ Links ]
22. Konstan MW, Butler SM, Wohl ME, Stoddard M, et al. Growth and nutritional indexes in early life predict pulmonary function in cystic fibrosis. J Pediatr. 2003; 142(6):624-30. [ Links ]
23. Visich A, Zielenski J, Castaños C, Diez G, et al. Complete screening of the CFTR gene in Argentine cystic fibrosis patients. Clin Genet. 2002; 61(3):207-13. [ Links ]
24. Sanders DB, Qianqian Z, Li Z, Farrell PM. Poor recovery for cystic fibrosis pulmonary exacerbations is associated with poor long-term outcomes. Pediatr Pulmonol. 2017; 52(10):1268-75. [ Links ]











 text in
text in 


