INTRODUCCIÓN
La lesión renal aguda (LRA) ha sido descrita como una complicaciónfrecuente de las cirugías cardíacas enpacientes pediátricos, con impactodocumentado en la morbimortalidad. Se estima una incidencia de alrededordel 40 % en este grupo de pacientes.1 Dicha patología se ve asociada conun aumento en la duración de la asistencia respiratoria mecánica, elrequerimiento de inotrópicos, losdías de internación y la mortalidad, incluso en pacientes con pequeñasvariaciones en el nivel de creatinina.2,4 A largo plazo, se han descrito retrasodel crecimiento, hipertensión einsuficiencia renal crónica.5,6
Entre los factores de riesgo, se incluyen niveles preoperatorios decreatininemia elevados, edad menorde 1 año, tiempo prolongado decirculación extracorpórea, mayorrequerimiento de inotrópicos y bajogasto cardíaco posoperatorio.1,3,7 Asimismo, se ha descrito la asociacióncon la mayor complejidad delprocedimiento realizado,8 reflejado en la clasificación de riesgo ajustado paracirugía de cardiopatías congénitas (risk adjustment for congenital heartsurgery, RACHS-1 ).9,10
Existen distintas definiciones de LRA que han ido evolucionando al buscar una evaluaciónmás acertada de esta patología. Entre ellas, seencuentran los criterios Risk-Injury-Failure-Loss-End stage (RIFLE), su adaptación pediátrica (p RIFLE) y de la Acute Kidney Injury Network(AKIN). Más recientemente, en 20l2, el Grupo Kidney Disease: Improving Global Outcomes(KDIGO) desarrolló nuevos criterios, quetrataron de reconciliar las diferencias entre losanteriores,2,11,12 validados tanto en niños como enadultos.13,15
Múltiples mecanismos se ven involucrados en la fisiopatología de la LRA en estos pacientes:el bajo gasto cardíaco, la liberación de citoquinasproinflamatorias, el fenómeno de isquemia-reperfusión, el trauma mecánico sanguíneo, elestrés oxidativo y las nefrotoxinas.5,15
Identificar los factores de riesgo permitiría el desarrollo de estrategias que contribuyeran areducir la morbimortalidad. Por ello, el objetivodel trabajo fue estimar la incidencia de LRA en los pacientes que tuvieron cirugía cardiovascular, determinar los factores de riesgo asociados y elimpacto de la LRA en la evolución posquirúrgica.
POBLACIÓN Y MÉTODOS
Diseño
Se desarrolló un estudio observacional de cohorte retrospectivo sobre pacientes pediátricoscon cirugías cardiovasculares, operados entreenero de 2015 y diciembre de 2017 en el Hospital Británico de Buenos Aires (hospital de tercernivel de complejidad y centro de derivación). Serevisaron las historias clínicas para obtener losdatos de las variables por analizar.
Criterios de elegibilidad
Criterios de inclusión
Ser menor de 16 años de edad.
Haber sido intervenido por el equipo de Cirugía Cardíaca del Hospital entre enero de2015 y diciembre de 2017.
Criterios de exclusión
Variables registradas
Incidencia de la LRA: Según los criterios de KDIGO (ver Anexo).
Factores de riesgo: Edad, sexo, peso, edadgestacional, peso al nacer, antecedentesfamiliares, comorbilidades, tipo decardiopatía, cirugía previa, nefrotóxicos, uso de inotrópicos, categoría RACHS-1, hipotensión, transfusiones, líquidosendovenosos, hiperglucemia, infecciones, arritmias, cateterismo posoperatorio, tiempode bomba de circulación extracorpórea y declampeo, cierre del tórax diferido, lactatomáximo, temperatura mínima, uso de injertoso material protésico.
Evaluación de la LRA: Valores de creatinina, urea y ritmo diurético (prequirúrgicos, posquirúrgicos, al momento del diagnósticode LRA y peor valor alcanzado).
Parámetros de evolución posquirúrgica: Díasde internación, de asistencia respiratoriamecánica (ARM), inotrópicos, terapia dereemplazo renal, paro cardiorrespiratorio, requerimiento de oxigenación por membranaextracorpórea (extracorporeal membraneoxygenation; ECMO, por sus siglas en inglés), falla multiorgánica y muerte. Además, sedefinió un evento combinado, que incluyóla ocurrencia de muerte, de complicacionesneurológicas, hepáticas e infecciosas o desangrado posoperatorio.
Aspectos éticos
Este estudio fue aprobado por el Comité de Revisión Institucional del Hospital en función delas normas de Helsinki. Se solicitó la eximicióndel consentimiento informado por la naturalezaretrospectiva del estudio.
Análisis estadístico
Las variables continuas se presentaron como medias y desvíos estándar (DE) en caso dedistribución normal o como medianas y rangosintercuartilos (RIQ) en caso de distribución nonormal. Los datos categóricos se expresaroncomo frecuencias y porcentajes. El supuesto denormalidad fue evaluado mediante el test de Shapiro-Wilk. Para comparar datos continuos, se utilizó el test de T cuando la distribución fuenormal o el test U de Mann-Whitney en casos dedistribución no normal. Los datos categóricosfueron comparados con el test de chi2 o el testexacto de Fisher, según correspondiera.
La asociación entre los factores de riesgo potenciales y la ocurrencia de LRA se evaluóutilizando un modelo de regresión logísticamultivariado, en el cual se introdujeron todaslas variables con un valor de p menor de 0,1 en el análisis univariado (además de la edad, elsexo y el peso). La selección del modelo final serealizó efectuando todas las combinaciones devariables predictoras posibles incorporadas almodelo inicial y dejando las que demostraronuna asociación estadísticamente significativa y elmejor poder predictivo (evaluado con el criteriode información de Akaike). En el caso de que lasvariables predictoras fueran variables continuas, se construyeron curvas de receiver operatingcharacteristic (ROC) y se identificó el mejor puntode corte mediante el método de Youden. Luegose repitieron los análisis de regresión con lasvariables dicotomizadas. Para cada variablepredictora, se calculó el odds ratio (OR) y suscorrespondientes intervalos de confianza del 95 %(IC 95 %).
Para evaluar la asociación entre la LRA y los resultados posoperatorios, se utilizaron modelosde regresión multivariados (logística para elevento combinado y de Poisson para los díasde internación), con el desarrollo de LRA comovariable predictora, y se ajustó para otros factoresde confusión. La selección de variables en estosmodelos se realizó de la misma manera que la anteriormente descrita para la ocurrencia de LRA, con la diferencia de que se forzó el ingreso de la LRA en ambos casos. La asociación multivariadaentre días de internación y LRA del análisis deregresión de Poisson se expresó como razón detasas de incidencia (RTI) con sus respectivos IC 95 %.
Todos los análisis fueron a dos colas y un valor de p < 0,05 se consideró indicador designificancia estadística. El tamaño de la muestrafue determinado por conveniencia, debido aque, por motivos logísticos, fue posible incluir apacientes entre las fechas señaladas previamente. Los análisis fueron realizados con los software G raph Pad Prism 8.0.1® y R versión 3.5.1.
RESULTADOS
Características de la población estudiada
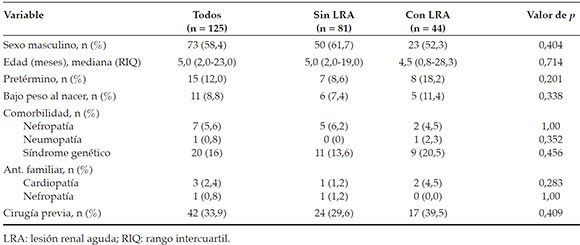
Durante el período estudiado, se operaron 145 pacientes, de los cuales 20 presentaron criteriosde exclusión, por lo que quedó un total de 125pacientes elegibles, que constituyeron el grupo enestudio. La incidencia de LRA posoperatoria fuedel 35 % (n = 44). Dentro de este grupo, definidocomo pacientes "LRA", el 70,5 % (n = 31), el22,7 % (n = 10) y el 6,8 % (n = 3) cumplieron loscriterios para ingresar a la categoría 1, 2 y 3 de LRA, respectivamente. La Tabla 1 muestra lascaracterísticas de la población estudiada.
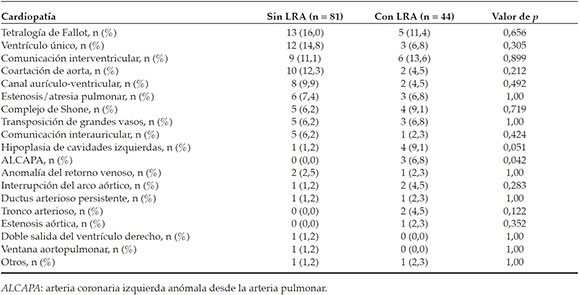
No hubo diferencias estadísticamente significativas según el tipo de cardiopatía, exceptoen el caso de arteria coronaria izquierda anómaladesde la arteria pulmonar (anomalous origin of leftcoronary artery from pulmonary artery; ALCAPA, por sus siglas en inglés), el cual fue más frecuenteentre los pacientes LRA (Tabla 2).
Factores de riesgo para la lesión renal aguda
La Tabla 3 muestra la distribución de los factores de riesgo para la LRA. Las variablesasociadas con el desarrollo de LRA en elanálisis univariado fueron la administraciónde vancomicina (p = 0,012) y el uso de tiazidas (p = 0,015). Sin embargo, no se observó asociaciónentre LRA e infecciones, trombosis, arritmias, mayor complejidad quirúrgica según RACHS-1 ocateterismo posquirúrgico como factores de riesgo.
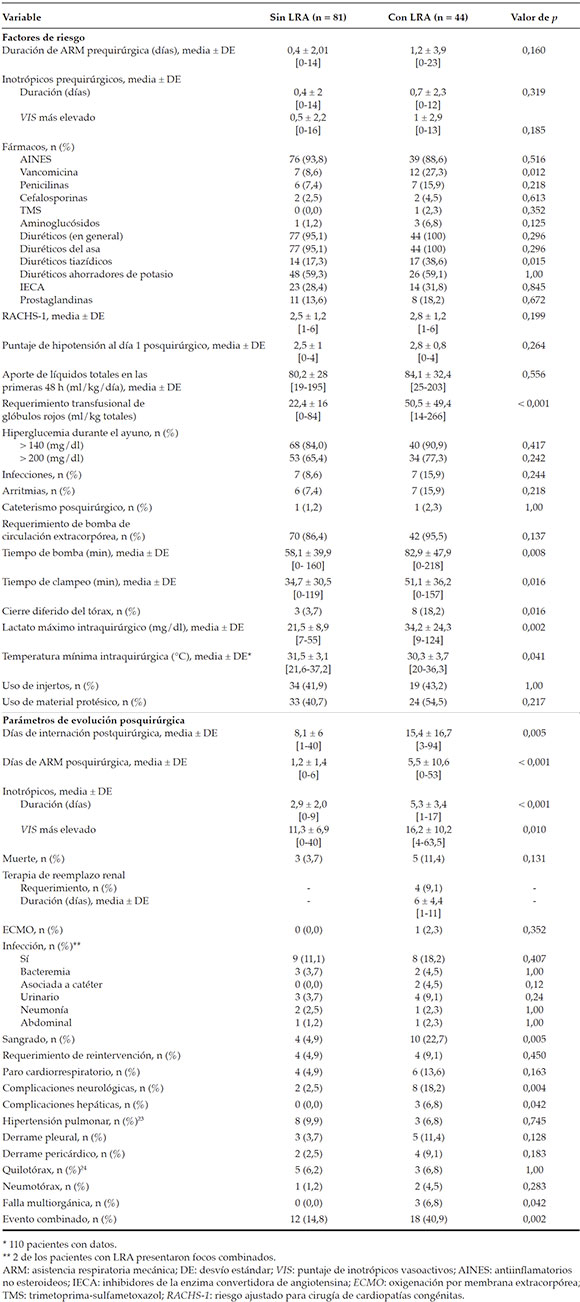
Tabla 3 Variables pre-, intra- y posquirúrgicas analizadas como posibles factores de riesgo y parámetros de evolución posquirúrgica
Los pacientes LRA tuvieron una tendencia no significativa a tener mayor frecuencia dehiperglucemia. Al analizar variables dehipoperfusión e hipoxia tisular como posiblesdesencadenantes del evento, se observó quelos pacientes LRA tuvieron un requerimientosignificativamente mayor de transfusiones deglóbulos rojos (p < 0,001). Sin embargo, no hubodiferencias significativas para el requerimientode inotrópicos prequirúrgicos según el puntaje deinotrópicos vasoactivos (vasoactive inotropic score;VIS, por sus siglas en inglés),16,17 el puntaje dehipotensión (apartado cardiovascular del Pediatric Sequential Organ Failure Assessment -p SOFA-)1,18 oel aporte de líquidos en las primeras 48 h, comomedición indirecta de bajo gasto cardíaco.
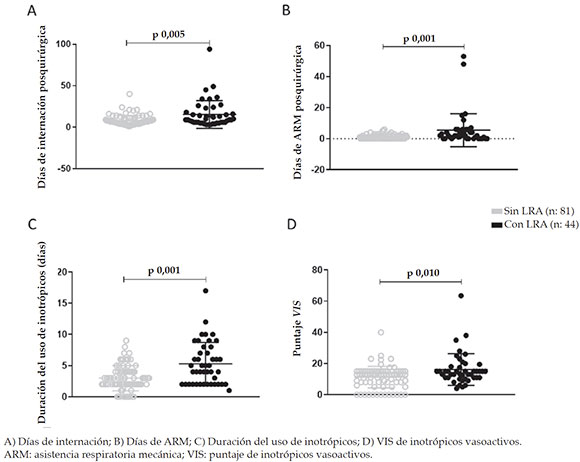
Se detectó una diferencia estadísticamente significativa dentro de los factores de riesgointraoperatorios, tales como el tiempo de bombade circulación extracorpórea (p = 0,008), el tiempode clampeo (p = 0,016), el cierre diferido del tórax (p = 0,016), el lactato máximo (p = 0,002) y latemperatura mínima (p = 0,041) (Figura 1).
En los análisis de regresión logística multivariados, se identificaron como variablesindependientes las transfusiones de glóbulos rojosy el valor de lactato máximo. Para la primera, seidentificó como punto de corte un valor igual a35 ml/kg o mayor ( OR 3,26; IC 95 %: 1,31-8,21; p = 0,011) y, para el lactato máximo, un valorigual a 26,5 mg/dl o mayor (OR 3,11; IC 95 %:1,28-7,61; p = 0,012).
Parámetros de evolución posquirúrgica
La Tabla 3 muestra el análisis de dichos parámetros. Se detectó un incrementoestadísticamente significativo de la cantidad dedías de internación y ARM entre los pacientesque desarrollaron LRA (p = 0,005 y p < 0,001, respectivamente) (Figura 2. A-B). Asimismo, se observó una mayor duración de inotrópicos (p < 0,001) y en la medición de su administraciónsegún el VIS (p = 0,010) (Figura 2. C-D).
El desarrollo de LRA se asoció a un incremento del riesgo de sangrado (p = 0,005) y las complicaciones neurológicas (p = 0,004). Un 11,4 % (n = 5) de los pacientes con LRA fallecieron, en comparación al 3,7 % (n = 3) delos que no la desarrollaron (p = 0,131). Todos lospacientes con falla multiorgánica (n = 3) habíanpresentado LRA, que representó el 6,8 % de estos. El único ingreso a ECMO había desarrolladolesión renal en estadio 3 con requerimiento dediálisis peritoneal. Del total de pacientes LRA, un 9,1 % requirió diálisis peritoneal. El eventocombinado ocurrió en 12 pacientes (el 14,8 %) sin LRA y en 18 (el 40,9 %) con LRA (p = 0,002).
La asociación entre los días de internación y la ocurrencia de LRA dejó de ser estadísticamentesignificativa tras el ajuste para factoresconfusores (RTI 1,05; IC 95 %: 0,91-1,20; p = 0,505). Algo similar ocurrió con el eventocombinado: la asociación entre este y LRA dejóde ser significativa tras el ajuste para variablesconfusoras (OR 1,88; IC 95 %: 0,46-7,62; p = 0,370).
Parámetros de medición de lesión renal aguda
Los pacientes que desarrollaron LRA presentaron, en el período posquirúrgico inmediato, un mayor valor de creatininemia (0,42 ± 0,2 vs. 0,36 ± 0,1 mg/dl; p = 0,020) ymenor ritmo diurético (1,6 ± 1,3 ml/kg/h vs. 2,5 ± 1,4 ml/kg/h; p < 0,001) (Figura 3. A-B). En cuanto al momento de desarrollo de LRA, el 57 %se presentó al primer día posquirúrgico; el 29 %, al segundo día; y el resto, en los siguientes días deinternación; el caso más alejado fue a los 27 días. Con respecto a la duración en horas, la mayorproporción se resolvió dentro de 24 h (el 65 %)(Figura 3. C-D).
Se analizó la relación entre el estadio de LRA y las categorías de riesgo quirúrgico (RACHS-1), y no se halló asociación estadísticamentesignificativa, pero sí se observó un incrementoproporcional del estadio de LRA en función de lacategoría del RACHS-1.
DISCUSIÓN
La LRA es una de las complicaciones más frecuentes en pacientes pediátricos con cirugíasde cardiopatía congénita. La incidencia de LRA en nuestros pacientes, según los criterios de KDIGO, fue del 35 %, ligeramente por debajo delo descrito en la bibliografía. 1,3,5,19 Se atribuye dichadiferencia a que la mayoría de las series de casospublicadas utilizaron como definición los criteriosp RIFLE (antes de la validación de KDIGO enpediatría), que tenían mayor sensibilidad y menorespecificidad,19,20 especialmente en los primerosestadios de riesgo. La mayoría de los casos sedesarrolló dentro del primer día posoperatorio; se cumplieron los criterios para el estadio 1 de LRA; y se resolvió en las primeras 24 h, similar alo descrito hasta el momento.1,3
Además, no se observó mayor incidencia de lesión en los pacientes menores de un mesde vida, a diferencia de lo publicado en labibliografía.3,5 Se estima que dicha discrepanciapodría deberse al hecho de que los criterios de KDIGO miden variación de creatininemia (no clearance de creatinina) y se ha descrito que, en dicha población, se observan niveles elevados de creatininemia durante los primeros días devida provenientes de la madre, por lo que elvalor absoluto basal podría ser mayor.19 Estodificultaría la detección de un aumento porcentualpara cumplir con el criterio diagnóstico. Sinembargo, los criterios de KDIGO recomendadosen la actualidad para la definición de LRA presentan una sensibilidad intermedia entresus dos predecesores12,19,20 y resultan fáciles deimplementar debido a las variables empleadas (no se requiere indefectiblemente de la talla parael cálculo estimado del filtrado glomerular, el cualsuele ser subregistrado en las historias clínicas).
Dentro de los factores de riesgo analizados, no se hallaron diferencias en cuanto a la incidenciade LRA según la categoría RACHS-1, pero sí entreesta y el estadio de LRA alcanzado en aquellospacientes que sí la desarrollaron. De ello podríainferirse que, si bien la cirugía de cardiopatíascongénitas es un factor de riesgo en sí mismopara el desarrollo de LRA y esta complicación podría tener un origen multifactorial, el mayor nivel de complejidad quirúrgico favorecería eldesarrollo de estadios de lesión más elevados. Entre los fármacos nefrotóxicos analizados, se observó asociación entre LRA y uso devancomicina y diuréticos tiazídicos. Por dichomotivo, podría concluirse que, del mismo modoque en la población pediátrica general, en estospacientes, deben recomendarse estrategias deuso racional de antibióticos, diuréticos y otrosfármacos, porque, si bien se trata de pacientescomplejos con internaciones prolongadas y riesgode infección, debe considerarse el mayor impactoque la nefrotoxicidad por drogas tiene en ellos. Coincidentemente con las publicaciones previas, se demostró una mayor incidencia de LRA en los pacientes que alcanzaron mayores niveles dehiperglucemia;21,22 sin embargo, la asociación nofue estadísticamente significativa y, sobre la basede los trabajos revisados hasta el momento, nose ha recomendado un control estricto de esta.7,22
Teniendo en cuenta que una de las hipótesis fisiopatológicas sugiere que el bajo gasto cardíacoy la hipoxia tisular podrían ser desencadenantesde LRA,1,19 se analizaron variables de mediciónindirecta de estos. Se observó asociación entre elmayor requerimiento de transfusión de glóbulosrojos e incidencia de LRA, pero no entre esta y elmayor requerimiento de inotrópicos previos a lacirugía, puntaje de hipotensión o mayor aportede líquidos totales.
De ello se concluye que resultaría mayor el impacto de la hipoxia tisular (medidaindirectamente por el requerimientotransfusional) que el del bajo gasto cardíaco. Además, tomando en cuenta las variables dentrodel período intraoperatorio, se observó mayorincidencia de LRA a mayor tiempo de bomba, tiempo de clampeo y lactato plasmático, y amenor temperatura alcanzada durante la cirugía. Estos hallazgos fueron similares en la bibliografíaconsultada.1,3,14,19
Finalmente, al analizar el impacto de la LRA en la morbimortalidad, la mayor proporción defalla multiorgánica y muerte se observó en lospacientes con LRA. Del mismo modo, en estegrupo, se detectó un aumento en la duraciónde la internación posquirúrgica, en la duraciónde ARM, el requerimiento de inotrópicos y unamayor incidencia de sangrado, complicacioneshepáticas y neurológicas.
CONCLUSIONES
La incidencia de LRA en pacientes pediátricos con cirugías cardiovasculares, en este estudio, fuedel 35 %.
Dentro de los factores de riesgo evaluados, se observó una diferencia estadísticamentesignificativa para la administración devancomicina y diuréticos tiazídicos, elrequerimiento transfusional de glóbulos rojos, el tiempo de circulación extracorpórea y declampeo, el lactato máximo intraquirúrgico, la temperatura mínima y el cierre diferido del tórax. Entre los parámetros de evolución posquirúrgica, se detectó un incremento estadísticamentesignificativo en la duración de la internación, elrequerimiento de inotrópicos, los días de ARM, el sangrado y las complicaciones neurológicas.











 texto en
texto en