INTRODUCCIÓN
El plomo (Pb) es un metal no esencial para el hombre, aunque ampliamente distribuido en la naturaleza, tanto por su producción natural como por su empleo en actividades industriales.1 La mayoría de los estudios que se han llevado a cabo en América Latina corresponden a exposiciones resultantes de fuentes puntuales, por lo que el desafío de los países de la región recae en la identificación de los efectos del Pb en poblaciones de niños expuestos a fuentes desconocidas o de aquellos resultantes de la exposición ambiental al metal por largos períodos de tiempo.2,3
Debido a la convincente evidencia en relación con los efectos tóxicos del Pb aún a bajas concentraciones, los valores de referencia disminuyeron en las últimas décadas. En 2012, el Comité Asesor para la Prevención del Envenenamiento Infantil por Plomo (ACCLPP, por su sigla en inglés) aconsejó reducir el valor recomendado de 10 pg/dL a 5 pg/dL,4 una cifra que debe ser revisada de manera periódica, puesto que numerosos estudios multicéntricos concluyen que no existe un nivel seguro de este metal en organismos inmaduros.5,6
Los efectos del Pb son multisistémicos; el sistema nervioso central es el blanco principal para su toxicidad, particularmente si la exposición ocurre durante el desarrollo, y se constituye en un factor causal de alteraciones neuroconductuales.7,8
Hasta el presente, no se ha descripto un proceso único que explique su toxicidad, a pesar de que numerosos estudios sugieren que el estrés oxidativo podría representar un mecanismo primario asociado a su toxicidad.9-11 La generación de un desbalance redox puede ser el resultado de un efecto directo del metal sobre las membranas celulares, que induce peroxidación lipídica, generación de especies reactivas de oxígeno y/o depleción del sistema de defensa enzimático antioxidante.12-14
Con base en estos antecedentes, el objetivo del presente estudio fue determinar los niveles de Pb en sangre (Pb-S) en niños de 1 a 6 años de La Plata y alrededores con exposición ambiental, y su relación con biomarcadores de estrés oxidativo.
POBLACIÓN Y MÉTODOS
Se realizó un estudio observacional analítico, de corte transversal en el que participaron niños entre 1 y 6 años de uno y otro sexo, clínicamente sanos que asistieron a los Consultorios Pediátricos del Observatorio de Salud del Instituto de Desarrollo e Investigaciones Pediátricas (IDIP) del Hospital de Niños Sor María Ludovica de La Plata desde mayo de 2014 hasta marzo de 2015. Cabe señalar que La Plata, la capital de la provincia de Buenos Aires, Argentina, se encuentra próxima a uno de los complejos industriales más grandes de América del Sur dedicado a la refinería de petróleo. Se excluyeron los niños con enfermedades crónicas diagnosticadas, enfermedades agudas y/o infecciosas en el momento de realizar el estudio, niños con síndromes genéticos y antecedentes neurológicos, y con desnutrición moderada o grave.
La muestra fue no probabilística, por conveniencia. El tamaño muestral se calculó para determinar una correlación de 0,3 entre los niveles de plombemia y los biomarcadores de estrés oxidativo, con un intervalo de confianza del 95 % y una potencia del 80 %. El número de casos fue de 85.
El protocolo de investigación fue aprobado por el Comité Institucional de Revisión de Protocolos e Investigación (CIRPI) del Instituto de Desarrollo e Investigaciones Pediátricas del Hospital de Niños Sor María Ludovica, La Plata (Argentina). Los padres o tutores que participaron en el estudio firmaron el consentimiento informado en presencia de un testigo. Los resultados fueron comunicados a los padres, y los niños cuyos valores de plombemia superaron 5 ^g/dL fueron derivados al Servicio de Toxicología para realizar el seguimiento.
Técnicas e instrumentos de recolección de datos
A todos los niños se les realizó una extracción de sangre por punción venosa; la muestra se repartió en dos tubos con heparina: 1 ml en un tubo que fue usado para la determinación de plombemia y el resto de la muestra en un tubo que fue sometido inmediatamente a centrifugación para la obtención del plasma y paquete eritrocitario, conservados a -70 °C hasta su procesamiento. El plasma se utilizó para la determinación de sustancias reactivas al ácido tiobarbitúrico (TBARS) y el paquete eritrocitario, para la determinación de las enzimas catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx).
Determinaciones bioquímicas
Para medir los niveles de Pb-S, las muestras heparinizadas fueron diluidas 1:10 en ácido nítrico al 15 % (Merck, Argentina) y luego centrifugadas. El sobrenadante resultante se analizó por espectroscopia de absorción atómica a una longitud de onda de 283,3 nm (equipo Varian AA 240 Z3, con dispensador de muestras programable 120, corrección de fondo Zeeman, Mulgrave, Australia). El control de calidad interno (CCI) se realizó usando el control de metales en sangre entera Lyphochek3 de Laboratorios BIO-RAD, 8,03 pg/dL, con un coeficiente de variación porcentual (CV %) de 6,8 % entre corridas. Los materiales para el CCI preparados en el laboratorio se basaron en sangre entera con el agregado de nitrato de Pb, Pb(NO3)2 (Merck, Argentina) con un nivel promedio de 5,1 pg/dL y un CV % de 8,8 % entre corridas. Es de destacar que el laboratorio ha participado de un programa de control de calidad externo (CCE) denominado esquema alemán de evaluación de la calidad externa (G-EQUAS, por su sigla en inglés). El error relativo porcentual reportado por este laboratorio en comparación con el valor consensuado estuvo entre el 7,3 % y el 11,0 %; es decir, dentro del rango de aceptabilidad del esquema de CCE. El límite de detección (LD) con este método fue de 0,8 pg/dL y el límite de cuantificación (LC) fue de 2,7 pg/dL.
Las actividades enzimáticas y los niveles de peroxidación lipídica fueron determinados por espectroscopia usando un equipo Shimadzu UV-18003. El índice de peroxidación lipídica fue determinado por el método descripto por Ohkawa y cols.15 En este, el malonaldehído (MDA) y el ácido tiobarbitúrico (TBA) reaccionan a altas temperaturas (90-100 oC) en medio ácido para formar el aducto TBA/MDA que fue medido a 532 nm, y el resultado fue expresado como nmol MDA/mL plasma.
Para determinar la actividad de CAT eritrocitaria, los glóbulos rojos fueron primero hemolizados con agua destilada (dilución 1 /20) y centrifugados a 10000 g durante 10 min; el hemolizado resultante fue diluido nuevamente 1/100 con amortiguador fosfato pH 7,0. La actividad enzimática fue medida de acuerdo con el método descripto por Aebi,16 mediante la disminución de la absorbancia del sustrato (H2O2) durante 5 min a 240 nm (e240 M 0,0394 por mmol/cm). Los resultados fueron expresados como una unidad (U) correspondiente a 1 ^mol de H2O2 consumido por minuto por gramo de hemoglobina (Hb).
La actividad de SOD fue medida usando un kit comercial (Ransod®; Randox Labs, Argentina). Este método emplea xantina y xantina oxidasa para generar radicales superóxidos que reaccionan con 2-(4-iodofenil)-3-(4-nitrofenol)- cloruro de feniltetrazolio (INT) para formar un colorante de rojo formazán. La actividad de SOD fue determinada por el grado de inhibición de esta reacción. Se considera una U a la que causa un 50 % de inhibición de la velocidad de reducción de INT bajo las condiciones del ensayo. Los valores fueron referidos a los niveles de Hb.
Para la determinación de la actividad de GPx los eritrocitos fueron hemolizados 1/5 con agua destilada y centrifugados a 10 000 g durante 10 min. El sobrenadante resultante fue usado para medir la actividad enzimática mediante el método de Paglia y Valentine,17 en la cual se determina la velocidad de consumo de NADPH por minuto durante 10 min a 340 nm. Una U es definida como 1 ^mol de NADPH consumido por minuto y expresado como U/g Hb.
Caracterización de la población
Para caracterizar a la población bajo estudio, se construyó el indicador de necesidades básicas insatisfechas (NBI) usando la metodología descripta por el Instituto Nacional de Estadísticas y Censos de Argentina, y se relevó el nivel educativo materno.
Análisis estadístico
El tratamiento estadístico de los datos fue realizado usando el programa R versión 3.5.1. La normalidad de todas las variables fue examinada usando la prueba Kolmogórov-Smirnov. Para un primer análisis, el nivel de Pb-S fue considerado como una variable continua y expresado como la media con un intervalo de confianza del 95 % considerando la distribución de la variable como un log normal. En aquellos casos en los cuales los niveles de Pb-S se encontraron por debajo del LD, el cálculo de la media fue ajustado por el método de extrapolación basado en una regresión lineal que considera las características de la distribución de los valores por encima del LD para estimar los valores por debajo del LD y presenta frecuencias de error más pequeñas que todas las técnicas estándar de reemplazo.18 Así, se clasificaron los niveles de Pb-S en tres grupos: <2,7 ^g/dL (LC), entre 2,7 y 4,9 ^g/dL y >5,0 ^g/dL.
El estado de los parámetros redox presentó una distribución no normalizada y fue expresado como la mediana y el rango intercuartílico (RIC). Sin embargo, la enzima GPx presentó una distribución normal por lo que fue expresada como la media geométrica ± desviación estándar (DE).
Se utilizó la prueba de Spearman para evaluar la correlación entre las concentraciones de Pb y los niveles de los indicadores de estrés oxidativo. Se utilizó la prueba de Mann Whitney (MW) o Kruskal Wallis (KW) para realizar las comparaciones entre TBARS, actividades enzimáticas y los niveles de Pb-S mayores o menores al LC (2,7 ^g/dL). Se utilizó este valor porque es el nivel a partir del cual se pueden cuantificar los niveles de Pb-S.
En todos los casos, se consideró estadísticamente significativo un valor de p < 0,05.
RESULTADOS
Participaron del estudio 131 niños entre 1 y 6 años de edad (el 43,5 % de sexo femenino). La media de la edad fue de 2,33 años y el RIC: (1,51 3,68). En relación con las variables sociales, se encontró que el 53,2 % de las familias vivían en hogares con NBI y el 78 % de las madres tenían más de 7 años de educación formal.
La media geométrica de los niveles de Pb-S fue de 1,90 ^g/dL (1,71-2,10). El 67,9 % (n = 89) de los niños presentaron valores de Pb-S menores al LC (2,7 ^g/dL); 29,0 % (n = 38) entre el LC y 5 ^g/dL. Solo 4 niños (3,1 %) tuvieron valores por encima de 5 ^g/dL, valor límite recomendado por los Centros de Control de Enfermedades de los Estados Unidos.
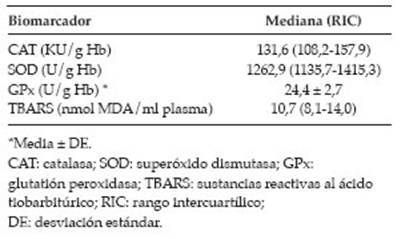
En la Tabla 1 se presentan las actividades de las enzimas antioxidantes y la concentración de los productos de peroxidación lipídica.
En la Tabla 2 se presentan los niveles de biomarcadores de estrés oxidativo según la división en categorías de las concentraciones de Pb-S.
Del análisis estadístico de la correlación entre las plombemias y cada biomarcador de estrés oxidativo, solo se observó una diferencia estadísticamente diferente entre TBARS (r = 0,24;
p = 0,012).
DISCUSIÓN
La exposición ambiental a Pb es un reconocido problema de salud pública, puesto que este metal aún está presente en centros urbanos y en cinturones industriales de países de la región.19 A este respecto, los estudios a gran escala desarrollados en países como Estados Unidos contrastan con la escasez de datos de niveles de Pb-S en niños con exposición ambiental en diferentes regiones de América Latina.
El presente estudio revela una exposición ambiental no industrial al metal, puesto que el 97 % de los niños presentaron niveles de Pb-S <5 g/dL y es apoyada por los menores niveles de Pb-S obtenidos aquí en comparación con estudios previos. En el primer artículo,20 la media de los niveles de Pb-S reportados en niños menores de 5 años fue de 4,3 pg/dL. En coincidencia, una reducción sustancial de Pb-S fue también observada en una población pediátrica de la ciudad de Córdoba (Argentina),21 donde los niveles Pb-S fueron de 2,58 ± 0,30 pg/dL, un valor significativamente menor que los niveles de 7,70 ± 1,10 pg/dL reportados previamente.22 Sin embargo, los niveles de Pb-S encontrados en ambas poblaciones son ligeramente más altos que los de EE. UU., donde se han informado niveles de Pb-S en niños de 0,86 pg/dL.23
Así, estudios como el presente son esenciales para la implementación de políticas públicas o para comprobar el éxito de estas en regiones como América Latina, donde las encuestas a gran escala y los estudios regulares de trazabilidad de Pb no son frecuentes.2,3 Además, la mayor parte de los estudios que se realizan son de corte transversal, un abordaje que puede minimizar cambios permanentes producidos por el contacto prolongado con Pb, aun a bajos niveles de exposición.
Otro factor de confusión que requiere consideración es la inclusión de niños que viven cerca de fuentes puntuales de Pb, lo que puede implicar exposición prenatal no solo a este metal, sino también a otras sustancias tóxicas. Además, las zonas industrializadas son, en general, áreas habitadas por poblaciones con desventajas socioeconómicas y con déficits nutricionales, y que pueden determinar una mayor absorción de varios neurotóxicos, incluido el Pb.
Por otra parte, es de destacar que el biomonitoreo de rutina para determinar la exposición a Pb, en general, está limitado a la medición de los niveles de este metal en diferentes matrices biológicas y a la actividad de las enzimas ácido 5-amino levulínico dehidratasa (bALAd) y ferroquelatasa, todos parámetros que son modificados a niveles de Pb-S más elevados que los presentados en este reporte.24 Por estas razones, la exploración de una asociación entre plombemia y biomarcadores de estrés oxidativo merece mayor investigación. En línea con esto, los estudios epidemiológicos desarrollados en niños25-27 no han podido proveer hasta el momento evidencia concluyente relacionada a enzimas antioxidantes y a los niveles de peroxidación lipídica.10,11,25-27 Así en el presente trabajo, a pesar de que no encontramos diferencias en los niveles de CAT, SOD o GPx, los niveles de peroxidación lipídica se relacionaron con plombemias más altas que el LC, en concordancia con la mayoría de los estudios en niños que reportan mayor peroxidación lipídica en correlación directa con altos niveles de Pb-S.11
Por consiguiente, con base en los resultados obtenidos, se muestran aquí evidencias de la implicancia de la peroxidación lipídica en los efectos adversos causados por la exposición ambiental a Pb, un biomarcador que puede ser propuesto como un complemento de las herramientas de diagnóstico temprano de la exposición ambiental a Pb.
Tabla 1: Concentraciones de los biomarcadores de estrés oxidativo.
Tabla 2: Comparación de las concentraciones de biomarcadores de estrés oxidativo según los valores de plombemia.
En resumen, en Argentina, la investigación de salud pública referida a la exposición de poblaciones pediátricas a contaminantes ambientales es un campo de estudio incipiente. Estudios como el presente contribuyen a mejorar el conocimiento del problema de la exposición a Pb en niños e intentan proveer un abordaje mecanístico a la toxicidad de este metal.
CONCLUSIONES
Los niveles de Pb-S encontrados en niños entre 1 y 6 años de edad sugieren una exposición a bajos niveles de este metal. Así, aun a niveles de Pb más bajos que los recomendados por las agencias internacionales, este metal puede inducir daño a nivel celular causando alteraciones permanentes que pueden determinar una mayor vulnerabilidad a eventos desafiantes en la vida futura.
Agradecimientos
Los autores desean agradecer al personal del Laboratorio de Análisis de Toxicología Ambiental y Nutrición (LaTAN) del Instituto de Desarrollo e Investigaciones Pediátricas (IDIP), a Enrique Martins y Natalia Matamoros, y en particular a la técnica Natalia Álvarez por su colaboración en la toma de muestras y análisis de Pb-S. A Samanta Martínez, por su ayuda en las determinaciones enzimáticas. Asimismo, a las madres, padres y/o tutores de los niños y a los niños, por su participación en este estudio.