INTRODUCCIÓN
La población pediátrica tiene una serie de características fisiológicas y de desarrollo muy diferentes a las de los adultos. Se trata de un grupo heterogéneo, cuya farmacocinética y farmacodinamia es cambiante en función del tramo de edad en el que nos encontremos.1,2Mientras que en la población adulta se emplean generalmente medicamentos con eficacia y seguridad probadas en ensayos clínicos, los profesionales sanitarios de las áreas pediátricas se ven obligados a manejar fármacos sin que hayan sido evaluados específicamente en menores, ajustándolos según el peso y/o la superficie corporal.3 La población pediátrica no cuenta con los mismos datos, debido a una serie de conocidos obstáculos que limitan las investigaciones clínicas para evaluar el uso de los fármacos en esta población4'5 (el escaso interés comercial de las farmacéuticas en este grupo de edad y las dificultades éticas y metodológicas que conlleva la investigación en este colectivo).6 Por ello, muchos fármacos no han sido estudiados específicamente en niños y tienen un limitado nivel de evidencia.6'7 La falta de datos sobre niños en las fichas técnicas (FT) obliga a la prescripción de fármacos en condiciones distintas a las especificadas en estas,8 práctica que conlleva riesgos9 como el aumento en la incidencia y gravedad de las reacciones adversas advertido por la Agencia Europea del Medicamento (EMA).10
La FT reúne la información científicamente probada de los medicamentos orientada a los profesionales sanitarios.11 Cuando los fármacos se utilizan fuera del marco definido en esta, se lo denomina uso off-label (OL).12 Entre los motivos más utilizados para clasificar una prescripción como OL, están13 las prescripciones realizadas en diferente indicación, rango de edad, posología y/o vía de administración a las reflejadas en el documento de autorización del fármaco.
Otra situación de uso especial de fármacos motivada por la falta de desarrollo de fármacos pediátricos es la identificada internacionalmente como unlicensed (UL), término (amplio, heterogéneo y a veces ambiguo) bajo el cual los diferentes autores12-16 clasifican los medicamentos extranjeros, aquellos que deben ser manipulados (machacar, disolver en agua, concentrar o diluir más de lo autorizado en FT) para su administración y las fórmulas magistrales.
Aunque actualmente existe una extensa relación de medicamentos eficaces, seguros y rentables recogidos por la lista de medicamentos esenciales para niños17 de la Organización Mundial de la Salud (OMS) y un esfuerzo por los entes regulatorios para aumentar la investigación en esta población, se siguen prescribiendo fármacos fuera de las condiciones establecidas en su ficha técnica.18
Centrándonos en el ámbito de los cuidados intensivos pediátricos (UCIP), donde existe una amplia exposición del paciente a fármacos, muchos de ellos son OL y UL6’19 a pesar del incremento de las iniciativas adoptadas en todo el mundo para mejorar esta práctica.20 Por tanto, el objetivo del presente estudio fue describir el uso de medicamentos en una UCIP y estimar la prevalencia de fármacos OL y UL en ella.
POBLACIÓN Y MÉTODOS
Se realizó un estudio transversal, observacional, con recogida retrospectiva de datos, en la UCIP del Hospital 12 de Octubre de Madrid (España) en el año 2017. La unidad constaba de 16 camas y la historia clínica de los pacientes estaba formada por registros electrónicos (prescripción médica) y en papel (registros de enfermería).
Se incluyeron las historias clínicas de los pacientes de 1 mes a 14 años ingresados en la UCIP desde el 1 de enero hasta el 31 de diciembre de 2016, independientemente del tipo de procedencia y/o patología que presentaban. Se excluyeron los registros que no estaban completos.
El tamaño muestral se calculó teniendo en cuenta la proporción de pacientes pediátricos ingresados en cuidados intensivos que reciben al menos una prescripción fuera de prospecto descrito por la literatura revisada6(89 %); se definió un error alfa del 5 %, una precisión de +/-7 % y unas posibles pérdidas del 30 % (GRANMO V7.12 abril 2012). Se obtuvo un total 110 pacientes.
Las historias clínicas analizadas en este estudio fueron seleccionadas al azar entre todos los ingresos de la UCIP realizados durante el período de estudio. De las historias clínicas, se obtuvieron las siguientes variables: edad, sexo, peso, motivo de ingreso, duración de la internación, nombre del fármaco prescrito por principio activo, código ATC21 (Anatomical, Therapeutic, Chemical Classification System), indicación, edad de la indicación específica, posología (dosis e intervalo) y vía de administración para cada prescripción.
Para el estudio, se recogieron y analizaron los datos desde el día del ingreso hasta el día del alta de cada paciente. Se consideró una nueva prescripción cuando se modificaba el fármaco, vía de administración, forma farmacéutica y/o se variaba la posología de cada principio activo.
Además, se revisó la información disponible en la FT publicada en el Centro de Información online de Medicamentos (CIMA)22 de la Agencia Española de Medicamentos y Productos Sanitarios para cada uno de los medicamentos prescritos. Según la información contenida en esta, las prescripciones se clasificaron como prescripciones realizadas bajo ficha técnica (ON), prescripciones off-label (OL)13 (prescripciones realizadas en diferente indicación, posología, rango de edad y/o vía de administración a las reflejadas en el documento oficial de autorización del fármaco) y prescripciones unlicensed (UL) (fármacos no autorizados en España, fórmulas magistrales y fármacos que requerían ser manipulados para su administración).
Análisis estadístico
Se efectuó un análisis descriptivo; así, las variables cualitativas se presentan con frecuencia absoluta y relativa en porcentaje. La normalidad de las variables cuantitativas fue estudiada mediante la prueba estadística de Kolmogorov-Smirnov, pudiendo constatar que no se adaptaban a la distribución normal (p-valor < 0,05) por lo que la tendencia central de estas variables se expresó mediante la mediana y la dispersión, mediante el rango intercuartílico (RIC).
Para el análisis estadístico, se utilizó el software informático estadístico SPSS® versión 20.0 (SPSS Science, Chicago, Illinois, USA).
Consideraciones éticas
El acceso a los datos se realizó conforme a los protocolos establecidos en el hospital y tras el consentimiento y aprobación de la Comisión de Investigación y del Comité de Ética del centro (Número de registro: TP17/0058).
Para este estudio no se consideró necesario el consentimiento informado de los pacientes, ya que se trató de un estudio retrospectivo y de revisión de historias clínicas anonimizadas.
RESULTADOS
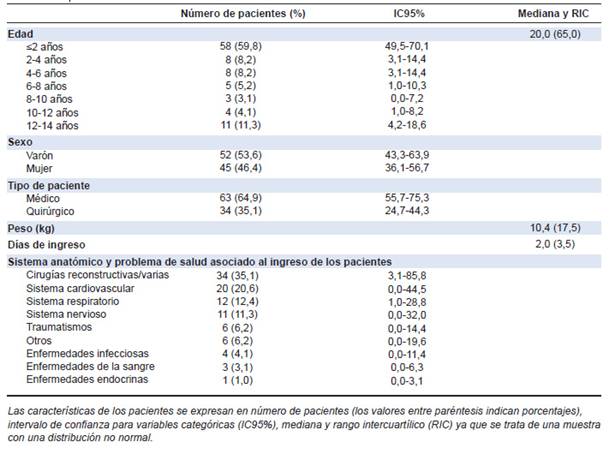
Desde el 1 de enero hasta el 31 de diciembre del 2016, estuvieron ingresados 139 niños en la UCIP del Hospital 12 de Octubre. Se revisaron para el estudio un total de 110 historias clínicas, de las cuales excluimos 13 por falta de datos relevantes. La muestra final reunió 97 pacientes, cuya mediana de edad 20,0 (65) meses. El 53,6 % (n = 52, IC95%: 43,3-63,9) de los pacientes fueron de sexo masculino. El sujeto de menor edad tenía 1 mes y el mayor, 168 meses (14 años). En niños, a mediana de edad fue de 12,5 (51,0) meses y en las niñas, 24,0 (117,5) meses. El 59,8 % (n = 58, IC95%: 49,5-70,1) de la muestra estuvo constituida por niños menores de 24 meses. La mediana de días de internación fue de 2,0 (3,5) días.
Las principales características de los pacientes y sus motivos de ingreso pueden consultarse en la Tabla 1.
Tabla 1: Características de los pacientes (n = 97)
Durante su estancia hospitalaria, los 97 pacientes recibieron un total de 1017 prescripciones que implicaron un total de 143 principios activos diferentes. La mediana de fármacos prescritos por paciente fue de 8 (7,5). El paciente al que más fármacos se le prescribieron recibió 43 y 1 el que menos.
De las 1017 prescripciones, 685 (67,4 %) fueron prescritas según FT, 243 (23,9 %) en condiciones OL y 89 (8,8 %) en condiciones UL. El porcentaje total de prescripciones que no seguían la información contenida en la FT del fármaco (OL+UL) fue del 32,6 % (n = 332). La mediana de fármacos por paciente prescritos según lo indicado en su FT fue de 6,0 (4,0); de fármacos OL, de 1,0 (4,0); y de fármacos UL, de 0,0 (1,0).
Los datos mostraron que un 25,8 % (n = 25) de la muestra recibió todas sus prescripciones bajo FT, mientras que el 74,2 % (n = 72) de los pacientes recibieron, al menos, 1 fármaco en condiciones diferentes. Setenta pacientes (72,2 %) tenían al menos una prescripción OL y 34 (35,1 %), al menos un fármaco UL (Tablas 2 y 3).
El subanálisis realizado por grupos de edad muestra que el grupo etario que recibió mayor número de prescripciones en total, así como el mayor porcentaje de prescripciones off- label/unlicensed, fue el de menores de 2 años (Tabla 3).
Algunos de los fármacos prescritos con mayor frecuencia OL fueron dopamina (n = 24, 100 %), pantoprazol (n = 15, 100 %) y fitomenadiona (n = 15, 88,2 %). En condiciones UL: furosemida (n = 15, 33,3 %), diazepam (n = 9, 100 %) y captopril (n = 8, 100 %).
Las causas más frecuentes de uso OL en este estudio fueron edad e indicación. Dopamina, pantoprazol, levetiracetam y levosimendán intravenosos fueron prescritos en el 100 % de los casos como OL por edad. En todos ellos, la FT recogía la no indicación en población pediátrica en general. Por último, en el caso de milrinona intravenosa, fue prescrita en el 71,4 % (n = 10) de las ocasiones OL por indicación y por dosificación distinta a la indicada en su FT.
Las causas encontradas más frecuentemente para el empleo de un medicamento como UL fueron tratarse de medicamento extranjero o de una fórmula magistral preparada y proporcionada por el servicio de farmacia del hospital.
Ranitidina, metadona, espironolactona e hidroclorotiazida se utilizaron UL (como fórmula magistral líquida); furosemida y captopril se suministraban como comprimidos aun en edades donde no es posible la ingestión de comprimidos (10 pacientes menores de 24 meses recibieron furosemida y 5, captopril). No existían registros sobre si un fármaco se manipulaba o no para su administración. En la Tabla 4 se presentan los motivos de las prescripciones OL y UL.
DISCUSIÓN
Diferentes autores han explorado el uso de fármacos en condiciones OL y UL hasta el momento, y se describen frecuencias entre el 36 %23 y el 57 %,6 cifras con amplias diferencias e interpretables, debido a que la comercialización de los fármacos y los contenidos de las FT pueden variar entre los diferentes países.
La frecuencia calculada de prescripciones OL y UL en el presente estudio (32,6 %) difiere de estudios similares en nuestro país: Blanco-Reina6 identifica un 57 %; García-López,19 un 62,5 %; y Saldaña-Valderas,24 un 46 %. La diferencia fundamental puede atribuirse a que estos estudios incluyeron en su muestra pacientes neonatales y los porcentajes más altos de prescripciones OL y UL suelen darse en los grupos de menor edad 19,23,25. Parece existir una relación lineal entre la frecuencia de uso de medicamentos OL y UL y la edad del paciente: aumenta esta frecuencia según disminuye la edad del paciente.26 Es importante recordar que, conforme disminuye la edad del paciente, desarrollar investigación se complica y, por tanto, también la posibilidad de obtener datos que nutran las FT de los medicamentos.5 Este mismo motivo puede ser el causante de que el número de pacientes que reciben al menos un fármaco OL detectado en nuestra población (72,1 %) sea inferior que el calculado por otros autores (89 %6 y 96 %24).
El porcentaje de fármacos UL hallado en nuestra muestra (8,7 %) es muy similar al encontrado en otros estudios nacionales,6'19 pero se encuentra muy por debajo de trabajos desarrollados en otros países, como la India25 (21,0 %) o Malasia26 (27,3 %). Es importante tener en cuenta que no se encontraron registros sobre la manipulación de fármacos para posibilitar su administración en niños, hecho que podría aumentar el porcentaje de fármacos de este tipo. Aunque no existieran registros sobre la manipulación de los fármacos furosemida y captopril, todos eran prescritos como comprimidos, por lo que debían ser partidos, machacados y/o disueltos para poder ser ingeridos por los niños, sobre todo por los más pequeños. La furosemida, por ejemplo, en su FT27 establece que debe ser tragada sin masticar y con agua; modificar la administración en este sentido modificará la absorción del fármaco y puede producir que se absorba más rápido y/o en cantidades mayores, con una posible variación del efecto esperado (inicio y magnitud). Algo similar ocurre con el captopril28 con el añadido de que no se ha establecido la seguridad y eficacia de este medicamento en niños.
Un aspecto en el que encontramos diferencias destacables con respecto a otros estudios es la causa por la que el fármaco fue utilizado en condiciones OL. En estudios semejantes, la dosis fue el principal motivo para clasificar la prescripción como OL,6'23'29 mientras que en este trabajo la causa principal fue la edad en la que se utilizaron. Esta diferencia puede deberse a las desigualdades en las terapéuticas farmacológicas dependientes de la zona geográfica ya comentadas anteriormente.
Las actualizaciones de las FT consultadas databan de años previos a 2015. Esto puede motivar que algunos de los OL o UL descritos en el presente artículo no se consideren como tal en la práctica clínica diaria, ya que, a veces, la experiencia en el uso de un fármaco pasa a nutrir las guías clínicas y, sin embargo, esta información no se refleja en la FT del fármaco, debido a que no se ha recogido por medio de investigaciones regladas y/o por el laboratorio responsable de la comercialización. Este hecho corrobora la necesidad de evaluar los medicamentos en menores, realizando ensayos clínicos con medicamentos en población pediátrica.30
La principal limitación del estudio es su diseño retrospectivo en el que se incluyen datos registrados en las historias clínicas, lo que podría haber supuesto una pérdida de información. Por ello se consideró como pérdidas a los pacientes cuyas historias no recogían las variables predefinidas en este estudio.
Como fortalezas, este estudio aporta valiosa información sobre el empleo de fármacos en una UCIP, especialmente sobre off-label/unlicensed. Esta información puede nutrir el conocimiento sobre prescripción en población pediátrica críticamente enferma y aumentar la conciencia sobre el uso de fármacos eficaces y seguros.
CONCLUSIÓN
En nuestra muestra la prevalencia de fármacos OL y UL fue de un 32,6 %. Pese al gran esfuerzo que se está realizando por el desarrollo de fármacos para niños, sigue siendo frecuente la prescripción OL y UL, y continúan faltando datos evidentes sobre su seguridad y eficacia, así como el reflejo de estos en las fichas técnicas.
Agradecimientos
Los autores desean agradecer al Hospital 12 de Octubre su colaboración para el desarrollo de este trabajo y, especialmente, a los pacientes incluidos en este estudio.