INTRODUCCIÓN
La histoplasmosis es una micosis endémica producida por el hongo dimorfo denominado Histoplasma capsulatum. Su incidencia real es desconocida por tratarse de una enfermedad cuya notificación no es obligatoria.1 La mayor parte del conocimiento de la histoplasmosis pediátrica se deriva de reportes de series y casos; el manejo clínico se basa en datos y experiencia de pacientes adultos.2 En nuestro país, se han documentado diferentes brotes epidémicos y existe reportada solo una serie de casos en niños.3-5 La forma diseminada en pediatría conlleva alta morbimortalidad y se da con mayor frecuencia en huéspedes con compromiso de la inmunidad celular y en niños menores de 2 años.6 Los signos y síntomas son fiebre, malestar general, anorexia, hepatoesplenomegalia y anomalías hematológicas.7
Reportamos el caso de una niña de 3 años de edad, residente en zona endémica de histoplasmosis, con diagnóstico de histoplasmosis diseminada, sin alteración de la inmunidad.
CASO CLÍNICO
Paciente de sexo femenino de 3 años de edad sin antecedentes de relevancia previos, oriunda de la región rural de la ciudad de James Craik, provincia de Córdoba, con cuadro clínico de síndrome febril prolongado acompañado de hepatoesplenomegalia confirmada por ecografía. Laboratorio con anemia normocítica, normocrómica (hemoglobina 9,1 g/dL) y leucopenia (leucocitos 2000/mm3), transaminasa glutámico oxalacética 63 U/l, gamma-glutamil-transpeptidasa 51 U/l, elevación de fosfatasa alcalina (214 U/l), lactato-deshidrogenasa (LDH) 407 U/l, eritrosedimentación >120 mm/h, función renal, ionograma y orina completa normales. Serologías negativas para virus de la inmunodeficiencia humana, virus linfotrópico T humano 1, virus linfotrópico T humano 2, VDRL, virus de hepatitis C, Huddleson, prueba rosa de Bengala, citomegalovirus, Toxocara canis-catis, Mycoplasma pneumoniae, parvovirus y Brucella abortus; virus de Epstein-Barr y toxoplasmosis: inmunoglobulina G (IgG) positivo e inmunoglobulina M (IgM) negativo, y Bartonella henselae IgM e IgG positivo. Se tomaron hemocultivos y urocultivo con resultado negativo; ecocardiograma y fondo de ojo normales. Prueba de Mantoux 3 milímetros. Tomografía axial computarizada (TAC) de abdomen con contraste reveló hepatoesplenomegalia homogénea (bazo 16 cm, hígado 14 cm) (Figura 1). TAC de tórax: normal. Punción aspirativa de médula ósea con celularidad ligeramente disminuida y biopsia de médula ósea con presencia en el intersticio de granulomas compuestos por células epiteliales.
Figura 1: Tomografía axial computarizada de abdomen con contraste: esplenomegalia marcada homogénea. Bazo 16 cm. Hepatomegalia homogénea. Hígado 14 cm
Se inició tratamiento con azitromicina 10 mg/ kg/día por probable enfermedad por arañazo de gato; la fiebre cedió a las 48 horas. Cumplió 5 días de tratamiento, con reinicio de la fiebre al finalizarlo. Se realizó nuevamente serología IgM e IgG para Bartonella henselae, que arrojó resultado negativo. Se repitió ecografía abdominal con persistencia de hepatoesplenomegalia, y con presencia de adenomegalias en hilio hepático y esplénico no visualizadas previamente. Persistió con bicitopenia, aumento en los reactantes de fase aguda y elevación de LDH. Se agregó alteración en la coagulación con disminución de la actividad protrombínica del plasma (APP) del 54 %.
Se ampliaron estudios: ácido vanilmandélico y homovanílico en orina, lavado gástrico para cultivo de Mycobacterium tuberculosis y detección de anticuerpos en suero para Coccidioides spp., Histoplasma capsulatum, Paracoccidioides brasiliensis, Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger y antígeno de Cryptococcus complejo neoformans, que resultaron todos negativos. Se realizó biopsia por vía laparoscópica y se extirpó un ganglio periportal y uno periesplénico. El material se envió para cultivo de hongos, gérmenes comunes, micobacterias, Brucella spp. y estudios histopatológicos.
A los 7 días de la toma de biopsia, desarrolló hongos levaduriformes, por lo que comenzó tratamiento con anfotericina B desoxicolato (1 mg/ kg/día). En los cultivos se obtuvo desarrollo en agar de Sabouraud a dos temperaturas: hongo levaduriforme a 37 °C y hongo micelial a 28 °C, con características macro- y micromorfológicas compatibles con Histoplasma capsulatum, que confirmó el diagnóstico de histoplasmosis diseminada. Concomitantemente, se recibió el informe histopatológico de biopsia ganglionar que informó linfadenitis granulomatosa con elementos levaduriformes intracelulares (Figuras 2, 3 y 4).
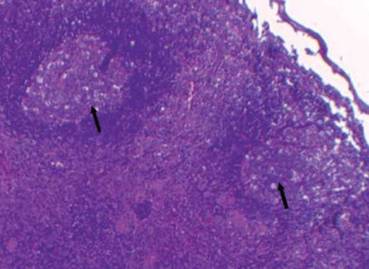
Figura 2: Biopsia ganglionar: imagen panorámica 4x, tinción con hematoxilina-eosina. Sinusoides distendidos e infiltrados por histiocitos (flechas negras)
Presentó buena evolución clínica, con resolución de cuadro febril a las 72 horas de iniciada la terapia antifúngica, y normalización de los valores de laboratorio. Cumplió en total 6 semanas de tratamiento endovenoso. Se continuó al alta hospitalaria con itraconazol (10 mg/kg/día) vía oral durante 6 meses.
Se estudió a la paciente para descartar errores innatos de la inmunidad. Complemento (C3, C4) normal. Inmunidad humoral: hipergamaglobulinemia con IgG e IgM elevadas. IgA e IgE normales, respuesta de anticuerpos para virus (hepatitis A, B y rubéola), polisacáridos (neumococo) y antígenos proteicos (toxoide tetánico) normal. Estudio de la fagocitosis: prueba de reducción del nitroazul de tetrazolio (NBT) y poblaciones linfocitarias normales. Autoanticuerpos (anticuerpo antinuclear ANA, anticuerpo anticitoplasma de neutrófilo ANCA, antipéptidos cíclicos citrulinados [anti-CCP]) negativos. Se realizó secuenciación del exoma completo de genes implicados en la susceptibilidad mendeliana a enfermedades micobacterianas (MSMD) IL12RB1, IL12RB2, IL12B, IL23R, ISG15, USP18, IFNGR1, IFNGR2, IFNG, STAT1, JAK1, TYK2, IKBKG, TBX21, ZNFX1, CYBB, ISG15, IRF8, SPPL2A, y otros genes, CYBB, CYBA, CYBC1, NCF1, NCF2, NCF4, IL17RA, IL17RC, IL17F, CARD9; no se identificó mutación.
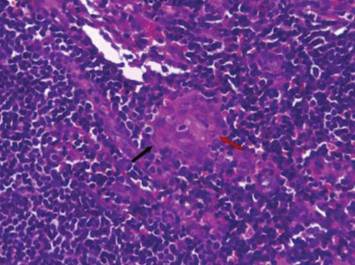
Figura 3: Biopsia ganglionar 40x, tinción don hematoxilia-eosina: granuloma pequeño sin necrosis central (flecha negra) con elementos levaduriformes intracelulares compatibles con Histoplasma capsulatum (flecha roja)
Figura 4: Biopsia ganglionar: 100x, PAS: se observan levaduras intracelulares (flechas rojas) compatibles con Histoplasma capsulatum en el citoplasma de histiocitos (flechas negras)
A los 2 años de seguimiento, la paciente continúa con buena evolución sin recaída en su enfermedad.
DISCUSIÓN
Reportamos el caso de una paciente de 3 años de edad, inmunocompetente, con diagnóstico de histoplasmosis diseminada, proveniente de una zona endémica de Argentina. Se arribó al diagnóstico luego de 40 días de internación. El retraso diagnóstico es frecuente, por lo que se debe tener un alto índice de sospecha en zonas endémicas. En un estudio de casos publicado por el Hospital de Pediatría Prof. Dr. Juan P. Garrahan, se informó una mediana de tiempo desde el inicio de los síntomas hasta el diagnóstico de 2 meses.5
El principal síntoma en nuestra publicación fue fiebre, en concordancia con lo publicado en la literatura, donde este síntoma fue el más prevalente, en un 62 % y un 76 % de los pacientes según las diferentes series.5'8
Las alteraciones hematológicas están presentes en la mayoría de los pacientes con histoplasmosis diseminada.5,7 Ávila et al., comunicaron que el 60-85 % de los casos de pacientes lactantes con histoplasmosis diseminada presentaron alteraciones de la médula ósea,9 en concordancia con Odio et al. y Tobón et al., donde el 100 % de los pacientes estudiados tenían enfermedad diseminada con anomalías observables de la médula ósea.7,10 El aumento de la LDH se observó en un 25 % de los pacientes.11
El diagnóstico definitivo se establece cuando se aísla el hongo en cultivos a dos temperaturas (28 °C y 37 °C) o se logra su observación por microscopía directa con distintos tipos de coloraciones. Histoplasma capsulatum se puede visualizar a partir de secciones de biopsias de tejidos infectados cuando se tiñen con hematoxilina y eosina, ácido peryódico de
Schiff (PAS) y metenamina plata de Grocott-Gomori y el método de Wright-Giemsa. Nuestro aislamiento de H. capsulatum fue en biopsia de ganglio intraabdominal. El método de diagnóstico mediante cultivo tiene la limitación de ser de crecimiento lento y en alrededor de un 20 % de los casos diseminados pueden ser falsos negativos.12
Otros métodos diagnósticos disponibles son la detección de antígenos en sangre y en orina, con una sensibilidad mayor al 80 % en la histoplasmosis pulmonar y del 90 % en la histoplasmosis diseminada.13 La detección de anticuerpos por inmunodifusión, fijación de completo o inmunoensayo muestran una sensibilidad variable, se describe en pacientes con histoplasmosis diseminada en un 75 %.14
El tratamiento de primera línea en las formas diseminadas es la anfotericina B durante 4-6 semanas. En pediatría la forma convencional (desoxicolato de sodio) generalmente es bien tolerada y se prefiere sobre la liposomal. El itraconazol se recomienda en la fase de consolidación, en dosis de 50 a 100 mg/kg/día.2
Dentro del algoritmo diagnóstico para descartar errores innatos de la inmunidad, realizamos un panel básico de evaluaciones inmunológicas y posteriormente se logró evaluar defectos genéticos de la inmunidad dependiente de interferón gamma (IFN-y), conocidos como susceptibilidad mendeliana a enfermedades por micobacterias (MSMD). Es una inmunodeficiencia primaria rara y la enfermedad clínica causada por micobacterias es la única manifestación en algunos de estos trastornos, mientras que otros tienen una mayor susceptibilidad a una gama más amplia de patógenos, incluido Histoplasma spp. Infecciones fúngicas endémicas se han informado en AR IL12Rp1, AR IFN-yR1 y mutación autosómica dominante de STAT1 con ganancia de función.6,15
Lee et al., proponen un algoritmo para estudiar errores innatos de la inmunidad en pacientes con micosis endémicas, comenzando por una historia clínica que recabe antecedentes sobre infecciones previas, candidiasis mucocutánea crónica, manifestaciones autoinmunes y antecedentes familiares. El estudio incluye un panel básico de evaluaciones inmunológicas que incluya determinación de inmunoglobulinas (IgG, IgA, IgM e IgE), poblaciones linfocitarias, NBT (examen de azul de nitrotetrazolio) o pruebas de dihidrorodamina para evaluar la actividad del estallido oxidativo y la evaluación por un especialista en inmunología para estudiar la presencia de autoanticuerpos anti-IFN-Y y del eje IL-12/IFN-y-.6
CONCLUSIÓN
Si bien es conocido el rol patogénico del Histoplasma capsulatum como un microorganismo oportunista en pacientes inmunocomprometidos, nosotros reportamos el caso de una paciente inmunocompetente. Se debe considerar dentro del algoritmo diagnóstico la histoplasmosis diseminada en aquellos pacientes provenientes de zonas endémicas que presentan la tríada de fiebre, hepatoesplenomegalia y citopenias, para poder brindar un tratamiento oportuno, mejorar el pronóstico y disminuir la mortalidad de la enfermedad.
Agradecimiento
Agradecemos a la Dra. Jacinta Bustamante por su colaboración en el estudio inmunológico de nuestra paciente.
Laboratory of Human Genetics of Infectious Diseases. Imagine Institute, Paris University, Paris, France.
Recibido: 10-5-2022
Aceptado: 27-7-2022