INTRODUCCIÓN
Los Andes son una región que incluye varios países de Sudamérica, donde el poblador se ha aclimatado a la hipoxia crónica. Sobre ello se realizaron varios estudios,1-3 sin embargo, son menos conocidos los efectos de esta exposición crónica en el desarrollo fetal y las repercusiones en neonatos nacidos a grandes altitudes. Se sabe que estos últimos tienen menor saturación de oxígeno al nacer y puntajes de Apgar más bajos en comparación con los nacidos a nivel del mar,4 debido a ello se ha sugerido que se producen alteraciones cognitivas y conductuales por adaptación incompleta a la hipoxia,5 que se sostiene inclusive en la edad adulta.6 No obstante, las repercusiones sobre el sistema nervioso central en neonatos son de muy difícil evaluación a través de métodos accesibles, rápidos y no invasivos. Una alternativa para ello es emplear técnicas neurofisiológicas, como los potenciales evocados auditivos de tronco cerebral (PEAT).
Los PEAT son resultado de la respuesta neuroeléctrica a estímulos sonoros en el sistema auditivo -desde el nervio coclear hasta el tronco cerebral a nivel de los tubérculos cuadrigéminos inferiores-; se manifiestan como ondas en cada estación donde una neurona releva a otra, conformando una secuencia de ondas que reflejan la integridad de dicha parte del sistema nervioso.7 Lo usual es que se conformen cinco ondas (I a V), y se miden las latencias (tiempo desde el origen del estímulo hasta el acmé de la onda) y los intervalos entre ondas. Si bien se espera que cada centro evalúe los valores normales para su población, se considera que en neonatos de 36-37 semanas y bajo un estímulo de 70 dB, la onda I presente una latencia de 1,80 ms, y los intervalos de las ondas I-III sean de 3 ms, III-V a 2,2 ms, I-V a 5,2 ms.8
Al compararlas con las ondas producidas en una “población normal”, se pueden identificar desviaciones que pueden requerir ampliar el diagnóstico audiológico. Latencias prolongadas o intervalos más amplios nos sugieren problemas relacionados con la maduración fisiológica. Varios estudios han señalado cambios en los PEAT asociados a estados de hipoxia,9-11 incluido el rápido ascenso a grandes altitudes en adultos sanos12 o en niños entre 5 a 15 años residentes a grandes altitudes.13 Sin embargo, no hay información sobre valores en neonatos nacidos a gran altitud, o si esta se desvía de la normalidad en otras altitudes. Por ello, nuestro objetivo fue determinar los valores de los PEAT en una población de neonatos nacidos a gran altitud (Cusco, 3399 msnm).
POBLACIÓN Y MÉTODOS
Diseño y población
Se realizó un estudio transversal prospectivo en neonatos nacidos en Cusco, ciudad ubicada a 3399 metros sobre el nivel del mar. La población muestral estuvo conformada por neonatos atendidos en el Hospital Nacional Adolfo Guevara Velasco (HNAGV), Cusco, desde octubre de 2019 hasta enero de 2020. El HNAGV es un hospital de referencia nacional y de alta complejidad, con servicios especializados en neurología y neonatología, brinda atención a neonatos sanos, así como a prematuros con y sin complicaciones.
Muestra y criterios de elecciónEl tamaño de la muestra se calculó a partir de la información del estudio de Jiang ZD,14 donde la población de neonatos a término presentó una latencia promedio de la onda I de 2,3 ms con una desviación estándar de 0,16 ms, ya que no existen parámetros sobre los neonatos peruanos. Se estimó el tamaño de la muestra de n = 160 para una media, considerando un nivel de confianza del 95 % y una precisión del 2,5 %. Considerando que cada participante daba dos mediciones independientes (una por cada oído) y que el examen podría no realizarse en el 10 % de los pacientes, el mínimo calculado fue de 86 participantes. Se utilizó el programa PASS 11.
Los criterios de inclusión fueron neonatos de hasta 14 días de vida con alta hospitalaria durante la primera semana de edad, que acudían a su evaluación en consulta de neonatos sanos, con carné de crecimiento y desarrollo con los datos completos, y cuyas madres dieron su consentimiento informado para la realización del examen de PEAT. Se excluyeron los pacientes con tratamiento anticonvulsivante, con cuadros sindrómicos identificables o que presentaran malformaciones de oído visibles.
Para constituir la muestra, se acudió al consultorio de evaluación de niño sano 3 veces a la semana y se eligió sistemáticamente a 1 de cada 4 madres de neonatos elegibles, considerando que cada día se identificaban aproximadamente 12 madres. Con ello se estimó un periodo aproximado de 10 semanas para completar el tamaño muestral.
Protocolo de PEAT
Los exámenes se realizaron con los neonatos bajo sueño espontáneo o en lactancia en el regazo de sus madres, durante aproximadamente 45 min, en un ambiente aislado y diseñado para la obtención de exámenes neurofisiológicos.
Los PEAT fueron obtenidos en equipos de la marca Nihon Kohden, Neuropack, con el software MEB 08.11. El protocolo de PEAT inicia con la limpieza retroauricular, de la frente y del cuero cabelludo con pasta limpiadora abrasiva (Nuprep) y colocación de electrodos con pasta conductiva en Cz (activo), A1, A2 (referencia), y Fpz (tierra).
Luego, se aplican estímulos tipo clic, iniciando con estímulos en el oído derecho con una intensidad de 70 dB y con enmascaramiento de 30 dB en el oído izquierdo, para luego realizar el mismo procedimiento invirtiendo el orden (70 dB en el oído izquierdo y 30 dB en el oído derecho). A continuación, se volvió a estimular el oído derecho a 80 dB con enmascaramiento del oído izquierdo a 40 dB, se repitió el mismo proceso y luego a 90 dB.
Por cada estimulación, se realizaron 2000 repeticiones a 10 Hz. Se consideró como adecuada toma de los PEAT cuando las ondas fueron replicables y de similares características en las estimulaciones a diferentes decibelios. Se eligieron los umbrales de 70 dB a 90 dB, dado que estudios previos habían indicado la mala configuración de ondas con 60 dB o menos.15
Plan de análisis de datosLas variables cuantitativas se presentan como medianas con sus respectivos rangos intercuartílicos, mientras que las variables categóricas se presentan en frecuencias absolutas y relativas (porcentajes).
Los PEAT brindan información sobre latencias de las ondas I a V e intervalos entre estas, las cuales fueron procesadas como variables cuantitativas continuas de razón. Se evaluó, además, la edad gestacional (prematuros -36 a 37 semanas de edad gestacional al nacer- y no prematuros -38 semanas o más-), tipo de parto (eutócico, por cesárea), Apgar a 1 min y 5 min, peso al nacer (<3000 g, 3001-3500 g, >3500 g), talla (<50 cm, 50 cm o más) y perímetro cefálico al nacer (<35 cm, 35 cm o más). Se calcularon las diferencias de las medianas de las latencias e intervalos de las ondas según las categorías de estas variables; para ello se empleó la prueba U Mann Whitney si eran dos medianas, y la prueba de Kruskal Wallis para diferencias de múltiples medianas. Se consideró como significativo un valor de p <0,05. El procesamiento de los datos se realizó con el programa estadístico STATA 16.0.
Aspectos éticosEl estudio contó con la aprobación del Comité de Ética e Investigación del HNAGV. Se solicitó consentimiento informado a todas las madres, quienes recibieron los resultados de sus neonatos, y, cuando fue necesario, se les brindó otra atención médica para complementar estudios. Debido a la alerta por la pandemia por COVID-19, los exámenes ambulatorios fueron suspendidos y el estudio fue interrumpido definitivamente en febrero de 2020.
RESULTADOS
Se invitó a participar a 120 neonatos, de los cuales 24 padres no aceptaron participar, por lo que finalmente se incluyeron 96 neonatos cuyos padres consintieron. La mediana para la edad gestacional fue de 39 semanas, peso de 3270 g, talla de 49 cm, Apgar de 8/9. De ellos, 17 (17,7 %) fueron prematuros. Las características de la población se describen en la Tabla 1.
De las 192 secuencias de ondas evaluadas (oído izquierdo-derecho), se evaluó la distribución normal de cada onda (I a V), y de los intervalos entre ellas. Dado que presentan una distribución sesgada a la izquierda, se decide presentar los valores en medianas.
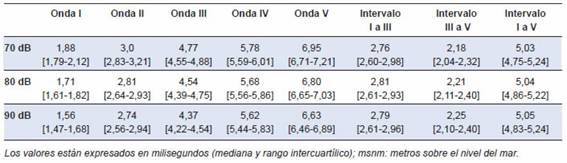
Se obtienen latencias de la onda I para 90 dB, 80 dB y 70 dB con una mediana de 1,6 ms, 1,7 ms y 1,9 ms. Los demás valores se muestran en la Tabla 2. También, los intervalos para las ondas (I-III), (III-V) y (I-V) fueron de 2,7, 2,2 y 5,0 respectivamente, sin que existan diferencias entre 90 dB, 80 dB y 70 dB (p >0,05). La representación gráfica de los valores de las ondas e intervalos se presenta en la Figura 1.
En la Tabla 3, se aprecian los valores del comportamiento de las ondas, intervalos y secuencias según tipo de parto, Apgar a 1 min, perímetro cefálico, o edad al momento del examen, entre las cuales no se obtienen diferencias significativas (p >0,05). Se encontraron diferencias en los prematuros, donde la latencia de la onda I se prolonga en 0,09 ms (p = 0,03). También se encontraron diferencias según talla (p = 0,01) y peso al nacer (p = 0,04).
En un análisis estratificado por edad gestacional, se encontró que las diferencias en la variable talla ya no se mantenían. En su lugar, para el peso, los nacidos con <3000 g tenían latencias prolongadas independientemente de ser prematuros.
Tabla 1: Características de la población de neonatos clínicamente sanos (n = 96), nacidos a gran altitud (Cusco, 3399 msnm)
Tabla 2: Latencias de las ondas I a V, según intensidad sonora (70 dB, 80 dB y 90 dB) en neonatos clínicamente sanos (n = 96), nacidos a gran altitud (Cusco, 3399 msnm)
Los valores están expresados en milisegundos (mediana y rango intercuartílico); msnm: metros sobre el nivel del mar.
DISCUSIÓN
Nuestro estudio constituye una primera evaluación para establecer valores de latencias e intervalos en los PEAT en neonatos nacidos a gran altitud, siendo esa su principal fortaleza. Tanto los PEAT como las emisiones otoacústicas son opciones para la evaluación audiológica en niños, las cuales forman parte de la pesquisa de varios programas regionales.16-18 En un estudio realizado en Perú con niños de 0 a 4 años, se concluyó que la sensibilidad y especificidad de las emisiones otoacústicas eran menores en comparación con los PEAT.19 Sin embargo, la elección de PEAT o emisiones otoacústicas se basa en la disponibilidad de recursos y las características de los pacientes, por lo que se deben conocer los valores normales de cada estudio en la población.
Sobre nuestros valores de latencias e intervalos entre ondas, en un estudio en neonatos de 36-37 semanas y a 70 dB, la onda I presentó una latencia de 1,80 ms y los intervalos de las ondas I-III a 2,99 ms, III-V a 2,27 ms, I-V a 5,27 ms.8 En un estudio en neonatos a término y a 65 dB,20 presentó una latencia de 1,86 ms para la onda I; el intervalo onda I-III fue de 2,76 ms. En otro estudio en neonatos brasileños a término a 80 dB,21 la onda I tenía una latencia de 1,79 ms; el intervalo onda I-III fue de 2,75 ms y el intervalo I-V fue de 4,97 ms. Estos estudios presentan valores que se encuentran en el intervalo de los nuestros; las pequeñas diferencias en las medidas de tendencia central podrían deberse al tamaño de muestra de cada estudio, y no parecen ser clínicamente relevantes. Ello sugiere que los valores de los PEAT son similares entre neonatos que se conciben a nivel del mar o a gran altitud, por lo tanto, independientemente de la región o altitud donde nazca el neonato debería cumplir con similares parámetros de madurez neurofisiológica. Se podrían realizar intervenciones precoces si se desvían de los parámetros previamente establecidos (por ejemplo, latencias prolongadas o intervalos entre ondas más amplios). La evidencia sugiere que las intervenciones precoces en neonatos con desviaciones en los valores de evaluaciones auditivas, especialmente asociadas a la prematuridad, pueden evitar dificultades en el aprendizaje y en el desarrollo del lenguaje, y predecir alteraciones en el neurodesarrollo.22-26
Figura 1: Potenciales evocados auditivos de tronco cerebral en neonatos sanos (pretérmino y a término, n = 96) nacidos en Cusco. Representación de las ondas I a V e intervalos entre estas según la intensidad sonora
Tabla 3: Latencias de las ondas I, según características de la población de neonatos clínicamente sanos (n = 96), nacidos a gran altitud (Cusco, 3399 msnm)
Contrario a nuestros resultados, otro estudio realizado en 12 niños de 5 a 15 años residentes a 3000 msnm, mostró un tiempo promedio de latencia de la onda I a 80 dB prolongado (1,75 ms) y, al compararlo con otros 22 niños que vivían a nivel del mar (1,60), las diferencias fueron significativas;13 no obstante, sus tiempos de conducción central (intervalo I-V) fueron menores (4,02 ms) que en nuestro estudio. Aunque el tamaño muestral es escueto y no permite sacar mayores conclusiones, no hemos encontrado otros estudios que sustenten cambios de los PEAT en neonatos o niños nacidos a gran altitud, por lo que sus efectos aún requieren exploración. Debido a que la hipoxia se asocia fuertemente a cambios en los PEAT,9-12 es probable que se observen diferencias durante el desarrollo neonatal o infantil, como lo sustenta Counter et al.,13 debido probablemente a adaptaciones asociadas a los cambios en la presión en el oído medio o interno27'28 que podría repercutir en la sensibilidad auditiva. Dado que nuestra población es neonatal, estos cambios adaptativos aún no estarían instalados como sí lo estarían en los niños.
También, identificamos que, a diferentes decibeles (70 dB, 80 dB o 90 dB), no hay diferencias en los intervalos de la onda I a V, pudiendo diferenciarlas por las latencias para la onda I. Esta sí es una diferencia con el estudio de Stockard y Westmoreland8, quienes identificaron que, a menos intensidad, es mayor el intervalo entre las ondas I a V, aunque esta diferencia se podría deber a que en dicho estudio trabajaron entre 30 dB y 70 dB. En nuestro caso, conocer ello nos permite plantear estudios a una única intensidad sonora, que podría ser 80 dB, debido a que se encuentran menos artefactos que a 70 dB,15 y permiten que el neonato permanezca tranquilo, a diferencia de a 90 dB.
La prematuridad y el bajo peso al nacer se asociaron a una latencia más prolongada, lo que da consistencia a nuestros resultados al compararlos con otros estudios. En el estudio de Jiang ZD et al.,29 se encontró una diferencia de 0,2 ms a favor de los neonatos con muy bajo peso al nacer (<1500 g) al compararlos con los neonatos con >2500 g. En nuestro estudio, los neonatos con menos de 3000 g mostraban diferencias significativas (0,1 ms), independientemente de si eran o no prematuros. Nuestras diferencias fueron pequeñas porque la muestra incluyó solo 17 prematuros cercanos al término, a diferencia de otros estudios con prematuros extremos o pacientes en la unidad de cuidado intensivo neonatal en los que las latencias de la onda I pueden ser superiores a 2 ms.30-32
La pandemia limitó la posibilidad de ampliar el tamaño muestral por encima de la estimación que se presenta aquí, lo que hubiera permitido un análisis de datos más complejo que incluyera la estandarización por edades gestacionales. Aun así, el tamaño de la muestra exhibe diferencias compatibles con otros estudios. También, la población proviene de gestaciones de bajo riesgo, pero no disponemos de mayores datos sobre las madres, tales como sus niveles de nutrición durante la gestación, lo cual podría influenciar en los procesos de desarrollo del sistema nervioso central fetal. No disponemos de datos sobre la genética poblacional. Cusco y gran parte de los Andes sudamericanos tienen un alto nivel de mestizaje y la adaptación fisiológica es menor en comparación con los nativos tibetanos.33 Por último, otros aspectos sobre la evaluación neurofisiológica de los PEAT, tales como las amplitudes, no han sido consideradas en este estudio.
CONCLUSIONES
Presentamos valores de los PEAT en neonatos nacidos a gran altitud, siendo los valores similares a los reportados en poblaciones que viven a nivel del mar y de la misma edad. Solo se encontraron diferencias atribuibles a la prematuridad y al bajo peso al nacer, dentro de los parámetros ya indicados por la literatura existente.
Agradecimientos
A los médicos del servicio de Neonatología del HNAGV por las facilidades brindadas para la ejecución del estudio.
Recibido: 8-6-2022
Aceptado: 26-1-2023