Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.38 no.1 La Plata Jan./Mar. 2004
INMUNOLOGÍA
Obtención de 35S-proinsulina humana recombinante y su aplicación en un ensayo radiométrico combinado. Utilidad del método desarrollado para predecir el requerimiento de insulina en pacientes diabéticos adultos*
Preparation of rembinant human 35S-proinsulin and its application in a combined radioligand-binding assay. Usefulness of the novel method as first-line screening for predicting insulin requirement in adult onset diabetic patients
Silvina Noemí Valdez1, Anabel Villalba2, Ruben Francisco Iacono3, Edgardo Poskus4
1. Dra. de la UBA.
2. Bioquímica.
3. Dr. de la UBA.
4. Dr. en Bioquímica.
* Cátedra de Inmunología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires (UBA) e Instituto de Estudios de la Inmunidad Humoral (IDEHU), CONICET-UBA. Junín 956, 4° piso (C1113AAD) Buenos Aires, Argentina Teléfono: 54-11-4964-8260 Fax: 54-11-4964-0024
Resumen
Los autoanticuerpos anti glutamato decarboxilasa y anti insulina/proinsulina (GADA e IAA/PAA) tienen valor predictivo del requerimiento insulínico en pacientes diabéticos con comienzo clínico en edad adulta. En este trabajo se desarrolló un nuevo trazador 35S-Proinsulina y se lo utilizó en un ensayo de unión de radioligando combinado con el trazador 35S-GAD para la determinación simultánea de GADA y PAA (RBA-combi). Se aplicó el ensayo a 85 pacientes infanto-juveniles con diabetes tipo 1, a 98 pacientes con comienzo clínico en edad adulta y a 53 controles normales. El 100% de los pacientes con diabetes tipo 1 con al menos un marcador positivo, y el 17,7% de los que eran negativos para ambos marcadores, fueron positivos por el RBA-combi (RBA-combi+). El 100% de los pacientes adultos PAA+ (GADA+ o GADA-), el 92,3% de los pacientes GADA+/PAA-, y el 1,3% de los pacientes GADA-/PAA-, fueron RBA-combi+. El 88,9% de los pacientes adultos RBA-combi+ evolucionaron a requerimiento insulínico. En conclusión, el nuevo trazador 35S-Proinsulina fue apto para su utilización en el método radiométrico combinado, permitiendo la detección simultánea de los marcadores GADA y PAA. El RBA-combi es una herramienta valiosa para detectar procesos autoinmunes asociados a un futuro requerimiento insulínico, en pacientes diabéticos adultos.
Palabras clave: Autoanticuerpos; Diabetes mellitus del adulto; Insulina; Proinsulina; Glutamato decarboxilasa; Ensayo de unión de radioligando.
Summary
The presence of the glutamate decarboxylase and insulin/proinsulin autoantibodies (GADA and IAA/PAA) can have predictive value about the insulin requirement in adult-onset diabetic patients. In this work, we developed a new tracer 35S-Proinsulin and it was employed in a combined radioligand binding assay with 35S-GAD for the simultaneous determination of GADA and PAA (RBA-combi). This novel assay was applied to sera from 85 young type 1 and 98 adult-onset diabetic patients, and to 53 normal control. Among type 1 diabetes sera, 100% of those with at least one positive marker by single methods, and 17.7% of those with double negative markers, were positive by RBA-combi (RBA-combi+). Among sera from adult-onset diabetes, 100% of those PAA+ (GADA+ or GADA-), 92.3% of GADA+/PAA-, and 1.3% of GADA-/PAA-, were RBA-combi+. Moreover, 88.9% of adult patients RBA-combi+ evolved to insulin requirement, suggesting a good predictive value for this method. In conclusion, the new tracer 35S-Proinsulin was able to be used in the RBA-combi allowing the simultaneous detection of GADA and PAA markers. Such marker combination is a valuable tool for assessing autoimmune processes associated to future insulin requirement in adult-onset diabetes.
Key words: Autoantibodies; Adult-onset diabetes mellitus; Insulin; Proinsulin; Glutamate decarboxylase; Radioligand-binding assay.
Introducción
La diabetes mellitus (DM) tipo 1 normalmente aparece antes de los 20 años y se caracteriza por la deficiencia absoluta de insulina circulante, consecuencia de la destrucción autoinmune de las células beta de los islotes pancreáticos, la presencia de autoanticuerpos circulantes y la asociación con ciertos alelos HLA de alta susceptibilidad. La diabetes tipo 2 aparece frecuentemente en personas mayores de 40 años, y se atribuye a un defecto en los mecanismos moleculares que intermedian la acción de la insulina a nivel de las distintas células del organismo pudiendo coexistir defecto secretorio a nivel de las células beta en diferentes grados, generalmente sin agresión inmunológica (1). Sin embargo, se ha descripto la existencia de autoinmunidad en pacientes adultos considerados diabéticos tipo 2. Así, 10-25% de los pacientes con fenotipo de diabetes tipo 2 presentan autoinmunidad (2-7) Los autoanticuerpos anti-glutamato decarboxilasa (GADA), anti-tirosina fosfatasa IA-2 (IA-2A) y anti-insulina (IAA) identifican a los pacientes con insuficiencia progresiva de las células beta, la mayoría de los cuales desarrollará insulino-dependencia (8).
La detección temprana de los pacientes con riesgo de tornarse insulino-dependientes es altamente deseable independientemente del tipo de diabetes involucrada (9-13). La presencia de autoanticuerpos en adultos con un perfil de diabetes tipo 2 puede predecir la necesidad de administrar insulina evitando en estos pacientes un control metabólico inadecuado (10).
En un trabajo previo, se ha determinado el perfil de los marcadores GADA, IA-2A e IAA en 115 pacientes diabéticos con comienzo clínico en edad adulta, detectando una alta prevalencia de los marcadores GADA e IAA, comparada con la de IA-2A (14). Otros autores también han demostrado una baja prevalencia de IA-2A(15). En este sentido, de acuerdo con Kasuga et al. (8), se encontró que la presencia de IAA en asociación con GADA es predictiva del requerimiento insulínico. También se han detectado algunos pacientes IAA positivos, GADA negativos que evolucionaron lentamente a insulino-dependencia.
Existen ensayos de unión de radioligando (RBA) confiables y altamente reproducibles para la detección de IAA y GADA útiles para el screening de individuos con alto riesgo de contraer diabetes insulino-dependiente.(16)(17).Sin embargo, es interesante considerar la posibilidad de desarrollar un método radiométrico combinado para la detección simultánea de GADA e IAA. Dicho ensayo permitiría el screening de autoinmunidad en pacientes diabéticos con comienzo clínico en edad adulta de manera más rápida y menos costosa. Sin embargo la determinación simultánea de GADA e IAA posee dificultades técnicas debido a los diferentes isótopos involucrados en los análisis convencionales de referencia (125I-Insulina y 35S-GAD) y a los diferentes sistemas de separación (PEG y proteína A-Sepharose).
Por los motivos citados, se decidió desarrollar un nuevo método combinado mejor adaptado al perfil serológico de la diabetes del adulto. Por ello se concibió un diseño analítico para la detección en un solo test de los marcadores GADA e IAA/PAA. Dicho análisis resultaría útil para predecir el requerimiento de insulina en pacientes diabéticos con comienzo clínico en edad adulta. Para ello fue necesario 1) desarrollar un trazador de proinsulina (u otro precursor monocatenario de la insulina) marcado metabólicamente con [35S]-Cys apto para un método radiométrico para IAA/PAA análogo al de los GADA; 2) desarrollar un RBA combinado utilizando los trazadores [35S]-Proinsulina y [35S]-GAD para la detección simultánea de los dos marcadores en un único test.
Materiales y Métodos
MUESTRAS DE PACIENTES
Se incluyó en este estudio una población de 98 sujetos adultos atendidos en el Servicio de Nutrición y Endocrinología del Hospital Español, La Plata, Buenos Aires, Argentina, con diagnóstico previo de diabetes a una edad media de 47,7 ± 9,3 años. El diagnóstico se realizó según la American Diabetes Association (1). Estos sujetos, principalmente caucásicos, fueron agrupados en tres categorías de acuerdo a los criterios dados más adelante. La información clínica más relevante se muestra en la Tabla I y los criterios para la terapia con agentes hipoglucemiantes orales se realizó de acuerdo al UK Prospective Diabetes Study (18). Estos pacientes no habían sido tratados con insulina en forma previa a la colección de muestra para los análisis inmunológicos.
Adultos requirentes de insulina de rápida evolución (ARI r): Este grupo incluyó 25 pacientes diabéticos adultos que requirieron insulina en forma inmediata o dentro de los dos años desde el momento del diagnóstico. La mayoría de estos pacientes eran mayores de 40 años (edad media: 50,0 ± 12,4 años; rango etario: 28-74 años), evidenciaron pérdida de peso, poliuria, niveles de glucemia > 15 mM, glucosuria y en la mayoría de los casos cetonuria. En los casos sin cetonuria, la alteración en la producción pancreática se confirmó mediante la determinación en ayunas del péptido C plasmático.
Adultos requirentes de insulina de lenta evolución (ARI l): Se incluyeron 32 pacientes diabéticos adultos quienes mantuvieron durante dos o más años un adecuado control metabólico de la enfermedad con dieta y/o hipoglucemiantes orales, pero que luego cayeron en el requerimiento de insulina. La edad promedio para este grupo fue de 47,0 ± 8,9 años (rango etario: 33-71) en el momento del diagnóstico de la DM.
Adultos con diabetes mellitus tipo 2 (DM 2): Este grupo incluyó 41 pacientes diabéticos adultos con diabetes tipo 2, quienes no requirieron insulina para lograr un adecuado control metabólico de su enfermedad, al menos hasta el momento de inclusión en este estudio. La edad promedio al momento del diagnóstico fue de 46,6 ± 7,3 años (rango etario: 30-59 años).
Para validar las metodologías desarrolladas se utilizaron sueros provenientes de 85 pacientes infanto-juveniles, principalmente caucásicos, admitidos al Servicio de Nutrición, Unidad Metabólica del Hospital de Pediatría J. P. Garrahan, Buenos Aires, Argentina. La edad media en el momento del diagnóstico fue 9,03 ± 3,99 años (rango 1 a 17 años).Setenta y nueve pacientes (93%) presentaban sintomatología clínica(poliuria, polidipsia y pérdida de peso) y6 (7%) eranasintomáticos. Las muestras de suero fueron colectadas antes o dentro de las 72 h de comenzar el tratamiento con insulina.
Para calcular los valores de corte en cada ensayo y la especificidad de las metodologías desarrolladas, se emplearon sueros controles normales obtenidos a partir de individuos sanos, sin historia familiar de DM, libres de enfermedades autoinmunes, ninguno de los cuales había recibido insulina, o experimentado episodios de hiperglucemia.
DETERMINACIÓN DE AUTOANTICUERPOS ANTI-INSULINA (IAA)
La insulina humana homogénea monoiodada ([125 I] Tyr A14 insulina) se preparó a partir de Na125I (New England Nuclear, Boston, MA, USA) y Humulin C (Eli Lilly, Indinapolis, IN, USA), previo pasaje por una columna de Sephadex G 25 (Amersham Biosciences, Piscataway, NJ), para separarla de las sustancias preservativas interferentes. Los procesos de unión y purificación se realizaron según lo descripto por Linde et al. (1981) y Jørgensen et al. (1980), respectivamente (19)(20). El trazador obtenido tuvo una actividad específica de ~300 µCi/µg. El ensayo de unión de radioligando (RBA) para la determinación de IAA (test de referencia) se basó en el procedimiento original (16) con menores modificaciones (21). Alícuotas de 30 µL de los sueros normales o de los sueros problema, por duplicado, fueron incubadas a 4 °C durante 6 días con buffer fosfato de sodio 0,04 M pH 7,4, conteniendo 10.000 cpm del trazador ([125 I]Tyr A14 insulina) en un volumen final de 120 µL por tubo. Para cada muestra de suero se preparó una serie adicional de tubos por duplicado con exceso de insulina humana no marcada (7,5 x 10-6 M), para evaluar la unión inespecífica. Luego de la incubación, la fracción de insulina unida fue precipitada y separada utilizando polietilenglicol 6.000 (PEG) 12,5% en buffer barbital 0,05 M, pH 8,6, Tween 20 0,01 g/L, centrifugando 20 min a 3.500 rpm en centrífuga refrigerada a 4 ºC. Los tubos se leyeron en un contador gamma (Cambiador automático de tubos Modelo MP, Alfanuclear, Buenos Aires, Argentina). Los resultados fueron expresados como porcentajes de unión específica (Be%) de insulina o como SD scores (SDs).Be% = B% preincubado sólo con el trazador
- B% preincubado con exceso de insulina fría.
SD scores= (Be% del suero analizado - Be% media de los controles normales)/desvío estándar de los controles normales.
Los resultados obtenidos con los sueros de los sujetos normales fueron utilizados para calcular el valor de corte (cut-off) del ensayo, expresado como la media más 3 desvíos estándar.
DETERMINACIÓN DE AUTOANTICUERPOS ANTI-GLUTAMATO DECARBOXILASA (GADA)
La [35S]GAD65 humana fue producida mediante un sistema eucarionte de expresión de proteínas recombinantes, con alto grado de pureza. Para ello, 1 µg del ADN codificante para la GAD65 humana (clonado en el vector pEX9, gentilmente cedido por el Dr. Å. Lernmark - Karolinska Institutet, Suecia; University of Washington, Seattle, WA, USA), fue transcripto y traducido in vitro empleando 25 µL de un sistema de lisado de reticulocitos de conejo (Promega, Madison, WI, USA) en presencia de 40 µCi de [35S]metionina (actividad específica 1.175 Ci/mmol, New England Nuclear, Boston, MA, USA) durante 2 h a 30 ºC. Los productos de traducción se diluyeron en buffer RBA (Tris-HCl 20 mM, NaCl 0,15 M, Tween 20 0,15%, aprotinina 0,1%, BSA 0,1%, pH 7,4) y se sembraron en una columna PD10 (Sephadex G25, Amersham Biosciences, Piscataway, NJ, USA) previamente equilibrada en buffer RBA, para remover la [35S]metionina libre. Las proteínas marcadas radiactivamente fueron analizadas por SDS-PAGE y fluorografía revelando una única banda de 64 kDa. Generalmente el porcentaje de incorporación de [35S]metionina a la proteína mediante este procedimiento fue de 15-25%, obteniéndose aproximadamente 5-10 x 106 cpm de proteína marcada. Para el RBA se incubaron aproximadamente 10.000 cpm del trazador con alícuotas de 2,5 µL de sueros humanos (en un volumen final de 60 µL en buffer RBA) durante toda la noche a 4 ºC. A continuación, a cada muestra se le agregó 50 µL de proteína A-Sepharose 4B FF 50% (Amersham Biosciences, Piscataway, NJ) equilibrada en buffer RBA y las mezclas se incubaron durante 2 h a temperatura ambiente, con agitación. Las muestras fueron centrifugadas y los precipitados conteniendo los inmunocomplejos se lavaron tres veces con 200 µL de buffer RBA y una vez con buffer RBA que contenía NaCl 0,35 M. Luego, los precipitados se resuspendieron en 100 µL de SDS 1% y se centrifugaron a 6.000 g durante 5 min. Los sobrenadantes fueron transferidos a viales para ser contados en un contador automático de centelleo líquido (Liquid Scintillation Analyzer Model 1.600TR, Packard, Canberra, Australia). Los resultados se expresaron como GAD index (17) o como SD scores (SDs).
GAD index = (cpm del suero analizado - cpm media de los controles normales)/ (cpm del suero de referencia - cpm media de los controles normales).
SD score = (GAD index del suero analizado - GAD index media de los controles normales)/desvío estándar de los controles normales.
Se procesaron simultáneamente 30 sueros normales para calcular el cut-off como la media más 3 desvíos estándar.
OBTENCIÓN DE [35S]PROINSULINA HUMANA RECOMBINANTE POR TRANSCRIPCIÓN Y TRADUCCIÓN IN VITRO
La [35S]proinsulina humana ([35S]PI),fue producida mediante transcripción y traducción in vitro empleando un lisado de reticulocitos de conejo en presencia de [35S]cisteína (actividad específica 1.075 Ci/mmol, New England Nuclear, Boston, MA, USA) durante 1,5 h a 30 ºC. Para ello, el ADN codificante para la PI humana (gentilmente cedido por el Dr. Graeme Bell, University of Chicago, USA) fue clonado en el vector pSP64. Los productos de traducción se diluyeron en buffer RBA (fosfato de sodio 50 mM, NaCl 100 mM, aprotinina 0,1%, BSA 0,1%, pH 7) y se sembraron en una columna PD10 (Amersham Biosciences, Piscataway, NJ) previamente equilibrada en buffer RBA, para remover la [35S]cisteína libre.
Con el propósito que los puentes disulfuro de la proinsulina se formaran correctamente el trazador de proinsulina fue sometido a un tratamiento reductor y posteriormente fue replegado in vitro. Para ello el producto de traducción fue diluido en buffer Tris-HCl 100 mM (pH 8,5) que contenía DTT 0,2 M. La reducción de la proteína fue llevada a cabo durante 2 h a temperatura ambiente. Seguidamente se realizó un cambio de buffer por Tris-HCl 50 mM, pH 8,5, usando una columna PD10 (Amersham Biosciences, Piscataway, NJ) y se agregó aprotinina 0,1%. El procedimiento de replegado de la proteína completamente reducida fue llevado a cabo mediante diálisis durante toda la noche a 4 °C contra un buffer de refolding (l-Arg 0,5 M, Tris-HCl 50 mM, EDTA 5 mM, GSH 5 mM, y GSSG 0,5 mM, pH 9,5) (22).
Las proteínas marcadas radiactivamente se analizaron por SDS-PAGE y fluorografía para evaluar la presencia de una banda de 9 kDa correspondiente a la proinsulina.
El porcentaje de incorporación de [35S]cisteína a las proteínas mediante este procedimiento generalmente fue del 3-9%, obteniéndose aproximadamente 2-10 x 106 cpm de proteína marcada.
SEPARACIÓN Y PURIFICACIÓN DE [35S]PI
La separación de [35S]PI, luego del procedimiento inductor del plegamiento in vitro, se realizó por HPLC fase reversa, empleando una columna C18 de 4,6 x 250 mm (Vydac, Hesperia, CA, USA). Se utilizó como solvente A una solución acuosa de ácido trifluoroacético 0,07% y como solvente B una solución de acetonitrilo 90% que contenía ácido trifluoroacético 0,07%. Se utilizó para la corrida un gradiente lineal del solvente A con 22-33% del solvente B en 20 min y luego 33-67% de solvente B en 40 min, empleando un flujo de 1 mL/ min. Se colectaron fracciones de 0,5 mL, las cuales fueron monitoreadas por centelleo líquido. Los picos principales fueron analizados por SDS-PAGE (12%) y fluorografía. Como control se corrió un estándar de proinsulina en las mismas condiciones, realizándose la detección a 215 nm.
SDS-PAGE Y FLUOROGRAFÍA
Las muestras se analizaron mediante SDS-PAGE en condiciones reductoras (23). Para las corridas electroforéticas se utilizaron minicubas (Mini-PROTEAN II Cell, BioRad Laboratories, Richmond, CA, USA). Para la precipitación del material fluorescente dentro del gel, éste se sumergió en una solución fijadora (ácido acético 10% V/V, metanol 30% V/V) y la impregnación se realizó con una solución intensificadora (Enhance, New England Nuclear, Boston, MA). Una vez secado, la exposición del gel se realizó en placas radiográficas a -70 °C, durante 3-4 días, antes del revelado.
ENSAYO DE UNIÓN DE RADIOLIGANDO (RBA) PARA LA DETERMINACIÓN DE PAA UTILIZANDO [35S]PI
Alícuotas de 30 µL de sueros humanos fueron incubados durante 7 días a 4 °C con 1.000 cpm de [35S]PI en un volumen final de 120 µL en buffer RBA (fosfato de sodio 50 mM, NaCl 100 mM, aprotinina 0,1%, BSA 0,1%, pH 7). La actividad total agregada en el ensayo se estandarizó en experimentos previos de calibración. Posteriormente, se agregaron 50 µL de proteína G-Sepharose 4B FF (Amersham Biosciences, Piscataway, NJ) 50% en buffer RBA y la suspensión fue incubada durante 2 h a temperatura ambiente, con agitación. Las muestras fueron centrifugadas y los precipitados conteniendo inmunocomplejos se lavaron cuatro veces con 200 µL de buffer RBA. Luego se resuspendieron en 100 µL de SDS 1%, y se centrifugaron a 6.000 g durante 5 min. Los sobrenadantes fueron transferidos a viales para ser contados (5 min por tubo) en un contador automático de centelleo líquido. Los resultados se expresaron como porcentajes de unión (B%) con respecto a las cuentas totales agregadas en el ensayo, o como SD scores (SDs).
B% = cpm del suero analizado x 100/CT.
D scores = (B% del suero analizado - B% media de los controles normales)/desvío estándar de los controles normales.
Se procesaron simultáneamente 25 sueros normales para calcular el cut-off como la media más 3 desvíos estándar.
La especificidad de la unión a la 35S-PI en los RBA fue confirmada realizando ensayos de inhibición de la unión de los PAA al trazador, empleando exceso de proinsulina humana no marcada. Para este estudio se emplearon los sueros en los cuales se había determinado la positividad para PAA empleando el ensayo de RBA descripto. En dichos sueros se determinó nuevamente la presencia de PAA empleando el trazador 35S-PI, en presencia o ausencia de proinsulina humana en exceso (7,5 µM).
PROCEDIMIENTO DEL GADA/PAA COMBI
Para el RBA combinado se incubaron aproximadamente 500 cpm de [35S]GAD65 y 1.000 cpm de [35S]PI con alícuotas de 30 µL de sueros humanos en un volumen final de 120 µL en buffer RBA (fosfato de sodio 50 mM, NaCl 100 mM, aprotinina 0,1%, BSA 0,1%, pH 7), durante 7 días a 4 °C. Las concentraciones óptimas de ambos trazadores se obtuvieron de experimentos previos de calibración. Posteriormente, se agregaron 50 µL de proteína G-Sepharose 4B FF (Amersham Biosciences, Piscataway, NJ) 50% en buffer RBA y la suspensión se incubó durante 2 h a temperatura ambiente, con agitación. Las muestras se centrifugaron y los precipitados que contenían los inmunocomplejos se lavaron cuatro veces con 200 µL de buffer RBA, se resuspendieron en 100 µL de SDS 1% y se centrifugaron a 6.000 g durante 5 min. Los sobrenadantes fueron transferidos a viales para ser contados durante 5 min en un contador automático de centelleo líquido. Los resultados se expresaron como porcentajes de unión (B%) con respecto a las cuentas totales agregadas en el ensayo o como SD scores (SDs).
B% = cpm del suero analizado x 100 / CT.
D scores = (B% del suero analizado -B% media de los controles normales)/desvío estándar de los controles normales.
Se procesaron simultáneamente 53 sueros normales para calcular el cut-off como la media más 2 desvíos estándar.
ANÁLISIS ESTADÍSTICO
Para obtener los niveles de corte de los RBAs y de la variante combinada, primero se evaluó la distribución de los datos correspondientes a los individuos normales (controles). Para ello se realizó el test de Normalidad de Kolmogorov-Smirnoff empleando el programa de computación GraphPad Prism, GraphPad Software v.2. Tanto en los RBAs individuales como en la variante combinada desarrollada, los resultados de los sueros controles siguieron una distribución normal. Por lo tanto, para todos los ensayos, se consideró como valor de corte a la media + 2 ó 3 desvíos estándar de los resultados de los controles normales.
Para evaluar diferencias significativas entre los resultados obtenidos por GADA/PAA combi versus aquellos obtenidos a partir de los métodos individuales se aplicó un testt de muestras apareadas. Para estudiar si existía diferencia significativa entre los sueros positivos para ambos marcadores versus los sueros positivos para un solo marcador se aplicó el test de Mann-Whitney. Para evaluar diferencias significativas entre los resultados positivos por GADA/PAA combi de pacientes diabéticos adultos requirientes de insulina versus aquellos de pacientes no insulino-requirientes se aplicó el test de Mann-Whitney.
Resultados
OBTENCIÓN DE [35S]PROINSULINA HUMANA
A partir del vector pSP64-PI se realizó el proceso de transcripción y traducción in vitro empleando el sistema de lisado de reticulocitos de conejo, tal como fue descripto en Materiales y Métodos. La proteína marcada radiactivamente fue analizada por SDS-PAGE y fluorografía revelando una banda de 9 kDa compatible con [35S]PI (Fig. 1). Además, apareció una banda de aproximadamente 15 kDa compatible con la hemoglobina monomérica. Con el objeto de obtener un trazador de proinsulina con su inmunorreactividad intacta, la [35S]-PI fue reducida completamente con DTT y sometida in vitro a un protocolo reoxidativo inductor del replegamiento. El procedimiento de replegado consistió en una diálisis contra un buffer que contenía proporciones adecuadas de glutatión oxidado y reducido. Posteriormente la [35S]-PI fue purificada por HPLC utilizando una columna C18 y un protocolo altamente optimizado, capaz de resolver el producto deseado, de la hemoglobina y de otros productos marcados. Consecutivamente se analizó por HPLC un patrón de proinsulina con el objeto de establecer el tiempo de retención de la proteína correctamente plegada (Fig. 2, panel A). La purificación de [35S]-PI fue monitoreada por medio de las lecturas de radiactividad (Fig. 2, panel B) y los principales picos eluídos se analizaron por SDS-PAGE y fluorografía (Fig. 2, panel B inserto).

En el perfil de elución de HPLC, el primer pico (2-4,5 min) presentó el mismo tiempo de retención que la [35S]-Cys libre (Fig. 2, panel B). El análisis de ese material por SDS-PAGE se muestra en el inserto del panel B de la Figura 2, calle 1. En la corrida de HPLC la [35S]-PI eluyó a los 30 min, coincidiendo con el tiempo de retención observado para el patrón de PI (Fig. 2, panel B, pico 2). Los dos picos radiactivos rojizos eluídos a los 43 y 45 min correspondieron a la banda de 15 kDa en el análisis por SDS-PAGE (Fig. 2, panel B, picos 3 y 4). Así, estos picos fueron tentativamente atribuidos a la hemoglobina modificada oxidativamente con [35S]-Cys.
DETECCIÓN DE ANTICUERPOS EMPEANDO [35S]-CYS-PI Y [125I]-INSULINA. CORRELACIÓN ENTRE LOS RESULTADOS OBTENIDOS
Para estudiar el comportamiento inmunoquímico del nuevo trazador, se desarrolló un RBA para la detección de PAA en sueros humanos empleando como trazador el producto eluído a los 30 min (pico 2) en el perfil de HPLC (Fig. 2, panel B) y en la etapa de separación se utilizó proteína G-Sepharose. El RBA desarrollado se aplicó en el estudio de 41 sueros de pacientes diabéticos preseleccionados por sus títulos de anticuerpos anti-insulina, incluyéndose 25 controles normales. Los resultados obtenidos fueron comparados con el test de referencia para IAA, el cual utiliza como trazador [125I]-insulina y PEG en la etapa separativa (Fig. 3). Ninguno de los sueros controles normales resultó positivo empleando [35S]-PI o [125I]-insulina. De esta manera ambos RBAs tuvieron 100% de especificidad (calculada como 100 menos el porcentaje de falsos positivos). Por otra parte, se estudió la correlación entre los resultados obtenidos con el RBA desarrollado y con el RBA de referencia (Fig. 3). De los 41 sueros de pacientes evaluados 7 presentaron discordancia entre ambos RBAs. Así, 5 sueros resultaron positivos aplicando el RBA con el trazador [125I]-insulina y negativos con el trazador [35S]-PI, mientras que 2 fueron positivos únicamente con este último. A pesar de ello, ambas metodologías presentaron alta correlación (Fig. 3) obteniéndose un r2 = 0,77 y una pendiente no significativamente diferente de la unidad (m = 1,16 ± 0,10, para un intervalo de confianza 95%). Por otra parte, los pares de datos obtenidos entre los dos métodos fueron sometidos a un testt de muestras apareadas. El coeficiente de correlación (r = 0,649) y el valor de P (P < 0,0001) indicaron que el apareamiento fue efectivo. El promedio de las diferencias (δx) fue 0,6 y su intervalo de confianza 95% fue 3,42 > δx > -2,12, no significativamente diferente de cero.

ENSAYO RADIOMÉTRICO COMBINADO PARA LA DETECCIÓN SIMULTÁNEA DE GADA Y PAA (RBA GADA/PAA COMBI)
SENSIBILIDAD Y ESPECIFICIDAD DEL RBA GADA/PAA COMBI
Para el nuevo método combinado que determina simultáneamente los marcadores GADA y PAA (RBA GADA/PAA combi) se realizó la incubación de los sueros de los pacientes con ambos trazadores, [35S]-Met-GAD y [35S]-Cys-PI. Los resultados fueron comparados con los obtenidos a partir de los métodos individuales para GADA o PAA.
Con el objeto de conocer la performance relativa del RBA GADA/PAA combi frente a los métodos individuales, se utilizaron 85 sueros de pacientes con reciente diagnóstico de DM tipo 1 con alta prevalencia de marcadores (Fig. 4). Como era esperable, en ese grupo de pacientes con alto grado de componente autoinmune, 61 (71,8%) resultaron positivos para GADA (Fig. 4 A), 20 (23,5%) fueron positivos para PAA (Fig. 4 B) y 71 (83,5%) fueron positivos para el RBA GADA/PAA combi (Fig. 4 C).
Por otra parte, se evaluaron por los métodos individuales y el combinado 98 sueros de pacientes diabéticos con comienzo clínico en edad adulta. Quince pacientes (15,3%) fueron GADA positivos (Fig. 4 A), 5 pacientes (5,1%) fueron PAA positivos (Figura 4 B) y 18 pacientes (18,4%) fueron positivos según el RBA/GADA/ PAA combi (Fig. 4 C).

Asimismo, 53 sueros controles normales fueron ensayados para establecer el valor de corte para el RBA GADAi/PAA combi el cual fue establecido en 2 desvíos estándar. Para estudiar la distribución de los datos obtenidos con los sueros normales se aplicó el test de normalidad de Kolmogorov-Smirnoff el que indicó que los resultados estaban normalmente distribuidos (r2 = 0,98). La especificidad, calculada como 100 menos el porcentaje de resultados positivos en el grupo control, fue 100% para GADA, 98,1% para PAA y 96,2% para el RBA GADA/PAA combi. Los coeficientes de variación intra-ensayo para el RBA GADA/PAA combi, en triplicados, fueron 2,65% para un SD score de 3,9 y 9,22% para un SD score de 8,9.
En la Tabla II se resumen los resultados de especificidad y prevalencia obtenidas con los métodos radiométricos individuales y con la variante combinada.
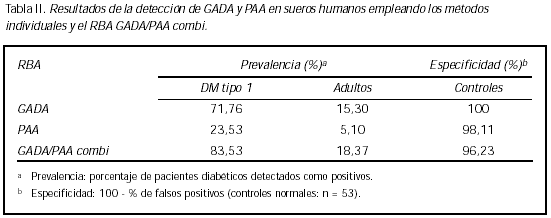
ANÁLISIS ESTADÍSTICO DE LOS RESULTADOS DEL RBA GADA/PAA COMBI.
COMPARACIÓN CON LOS MÉTODOS INDIVIDUALES
Para evaluar más acabadamente la performance relativa del RBA GADA/PAA combi, los resultados obtenidos con los sueros de pacientes con DM tipo 1 fueron comparados con los obtenidos con los métodos individuales para GADA o PAA (Tabla III). Las 13 muestras GADA+ /PAA+, las 48 muestras GADA+/PAA- y las 7 muestras GADA-/PAA+ fueron identificadas como positivas por el RBA GADA/PAA combi. De las 17 muestras GADA-/P AA-, 3 (17,65%) resultaron positivas por el RBA GADA/ PAA combi, incrementando la sensibilidad para el screening de los marcadores del 80% (utilizando ambos RBAs individuales) al 83,5% (GADA/ PAA combi).Por otra parte, los pares de datos fueron analizados mediante un test de muestras apareadas (n =85). Los coeficientes de correlación y los valores de P indicaron que el apareamiento fue efectivo en ambos casos (r = 0,48, P < 0,0001 para GADA/PAA combi vs GADA y r = 0,34, P = 0,0008 para GADA/PAA combi vs PAA). Asimismo, los sueros de pacientes positivos para ambos marcadores (n = 13) presentaron valores mayores según el RBA GADA/PAA combi respecto de aquellos provenientes de pacientes con un solo marcador positivo (n = 55); (mediana 3,9 vs 3,6 SD scores, test de Mann Whitney, P < 0,05).
Las mismas comparaciones fueron realizadas con los resultados obtenidos con los 98 sueros de pacientes diabéticos con comienzo clínico en edad adulta. Las 2 muestras GADA+/PAA+ y las 3 muestras GADA-/PAA+ fueron identificadas como positivas por el RBA GADA/ PAA combi, mientras que 12 de 13 muestras GADA+/ PAA- (92,3%) fueron positivas según el RBA GADA/ PAA combi. Solamente 1 de los 80 sueros GADA-/PAA- resultó positivo por el RBA GADA/PAA combi. Por lo tanto, en este grupo la sensibilidad total permaneció sin cambios, aunque con una parcial discordancia en el panel completo de resultados.
ASOCIACIÓN ENTRE LOS RESULTADOS DEL RBA GADA/PAA COMBI Y EL REQUERIMIENTO DE INSULINA
A los fines de posibles aplicaciones predictivas, se estudió en los pacientes diabéticos adultos GADA/PAA combi+, la vinculación entre el requerimiento de insulina (decidido por el profesional médico actuante según los parámetros clínicos y del laboratorio bioquímico) y la respuesta inmune humoral específica. De los 18 pacientes GADA/PAA combi+, 16 (88,9%) progresaron al requerimiento de insulina (Tabla IV). Nueve de estos 18 pacientes (50,0%) requirieron tratamiento con insulina inmediatamente o dentro de los dos primeros años de aparición de la sintomatología clínica (ARI r), 7 pacientes (38,9%) requirieron tratamiento insulínico dos o más años después del diagnóstico (ARI l) y 2 pacientes (11,1%) no requirieron insulina, al menos hasta la fecha del estudio.
Entre los pacientes GADA/PAA combi+ definidos como ARI r, 100% eran GADA+ (Fig. 5 A) mientras que 11% eran PAA+ (Fig. 5 B). Contrariamente, entre los pacientes GADA/PAA combi+ definidos como ARI l, 43% eran GADA+ (Fig. 5 A) mientras que 57% eran PAA+ (Figura 5 B). Para el grupo de pacientes con DM tipo 2, las dos únicas muestras GADA/PAA combi+ eran GADA+ (Fig. 5 A) y PAA- (Fig. 5 B). El panel C de la Figura 5 muestra las señales obtenidas por el RBA GADA/ PAA combi en los tres subgrupos de pacientes diabéticos con comienzo clínico en edad adulta. Asimismo, los sueros de pacientes ARI r y ARI l produjeron señales significativamente mayores en el RBA GADA/PAA combi respecto de las obtenidas para el grupo de pacientes con DM tipo 2 (mediana 3,65 vs 2,23 SD scores para ARI r, 4,47 vs 2,23 SD scores para ARI l, respectivamente; test de Mann Whitney, P < 0,05) (Tabla IV).
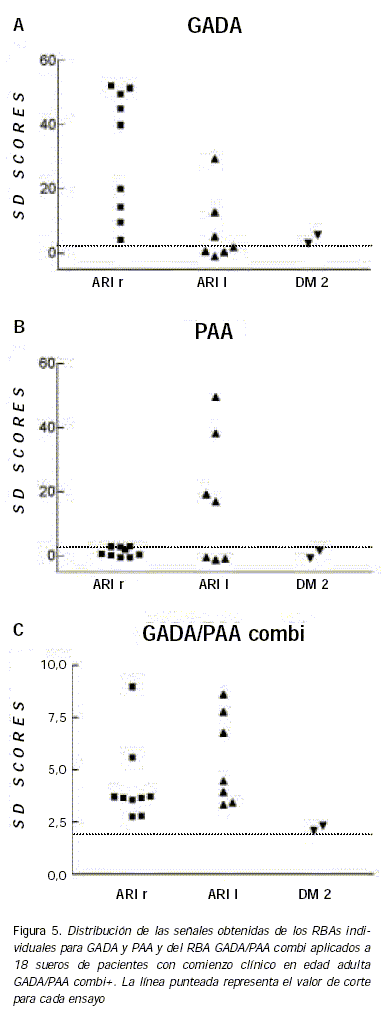
Discusión y Conclusiones
En las formas de diabetes mediadas por inmunidad (IMD), la aparición de autoanticuerpos dirigidos contra diferentes componentes del páncreas, constituye una valiosa herramienta para el diagnóstico precoz, el seguimiento y control de la enfermedad. La aparición de estos autoanticuerpos en grupos de riesgo es de suma utilidad para intentar nuevas terapias preventivas de la DM tipo 1. Por otra parte, en las formas de DM del adulto la presencia de autoanticuerpos puede predecir la necesidad de administrar insulina, evitando en estos pacientes un inadecuado control metabólico de la enfermedad.
Asimismo, la detección temprana de la existencia de un fenómeno autoinmune asociado a la enfermedad cobra cada vez más importancia debido al surgimiento de intervenciones terapéuticas prometedoras: por ejemplo la administración oral o parenteral de insulina (10)(12)(13) o de nicotinamida (9)(11).
Los marcadores IAA, GADA e IA-2A se detectan por técnicas radiométricas (RBA) cuantitativas y reproducibles, las cuales no presentan variaciones importantes en la sensibilidad y especificidad del diagnóstico. La limitación más importante es el alto costo de las determinaciones, sobre todo si se pretende aplicarlas en programas amplios de predicción y prevención de la diabetes. Por esta razón, es necesario simplificar el screening de los marcadores para hacerlo aplicable a la población de pacientes diabéticos. Con este propósito se han implementado ensayos radiométricos combinados en los cuales se evalúa la presencia de dos marcadores simultáneamente en un único test para el screening de la DM tipo 1 (24-26).
Sería de suma importancia contar con una técnica radiométrica combinada (sensible, específica y de fácil aplicación) para el screening de pacientes diabéticos con comienzo clínico en edad adulta, muchos de los cuales mostraron evidencia de un componente autoinmune asociado a la enfermedad. Desde el punto de vista epidemiológico se observa que la autoinmunidad asociada a la diabetes ya no es un tema con impacto mayoritario en la medicina pediátrica, puesto que aún con los recursos convencionales para el screening se ha visto que la IMD en los adultos es más frecuente de lo supuesto anteriormente. En efecto, alrededor del 60% de la IMD aparece luego de los 20 años (4) y la incidencia acumulativa de tal patología a partir de los 30 años es constante, indicando que el riesgo de padecerla a lo largo de la vida adulta es mayor de lo sospechado tradicionalmente (27).
En un trabajo previo, se analizó el perfil de marcadores de autoinmunidad en tres subgrupos de pacientes con comienzo clínico en edad adulta, clasificados de acuerdo a sus características clínicas, incluyendo la dependencia insulínica (14). Se encontró que el marcador GADA fue el de mayor prevalencia entre los individuos que evolucionaron rápidamente al requerimiento insulínico (ARI r), lo cual también fue descripto por otros autores (2)(28)(29). Sin embargo, en los pacientes que evolucionaron lentamente al requerimiento insulínico (ARI l) IAA fue el marcador de mayor prevalencia; en este grupo, entre los pacientes GADA negativos, 27,9% fueron positivos para IAA. Estos resultados evidencian una respuesta humoral específica para moléculas relacionadas a insulina, no asociada a GADA, en una proporción considerable de los pacientes ARI l. Más aún, este grupo ya había demostrado que 15% de los pacientes diabéticos tipo 2 con falla secundaria a los HGO, eran IAA positivos (30). Estos resultados indican que es necesario incluir al marcador IAA/PAA, además del GADA en el screening de pacientes diabéticos con comienzo clínico en edad adulta. Por lo tanto sería interesante desarrollar un RBA combinado para la detección simultánea de ambos marcadores.
Es importante desarrollar un método combinado para GADA e IAA que permitiera el screening en pacientes diabéticos con comienzo clínico en edad adulta para predecir la insulino-dependencia. Interesantemente, el tratamiento preventivo con pequeñas dosis de insulina produjo alta ocurrencia de seroconversión para el marcador ICA y mejoró los niveles de péptido-C en un grupo de pacientes diabéticos no insulino-dependiente con un daño lentamente progresivo de las células beta (10). Este procedimiento debería establecer amplia aplicación promoviendo fuertemente la detección temprana de marcadores del daño de la célula beta en pacientes diabéticos con comienzo clínico en edad adulta.
Como primera etapa del trabajo, y con el objetivo de contar con un método radiactivo combinado para la detección conjunta de GADA e IAA/PAA se encaró la obtención de 35S-PI a través de un extracto de reticulocitos libre de células. Este sistema de transcripción y traducción in vitro está disponible comercialmente, es fácil de implementar y generalmente produce cantidad suficiente de proteína correctamente plegada lista para usar como trazador. Sin embargo, no puede utilizarse para la producción de las dos cadenas de la insulina madura ampliamente procesada, y varios intentos fallidos en aplicar este protocolo a los precursores monocatenarios de la insulina (pre-proinsulina y proinsulina) condujo a la impresión inicial que tal sistema era inadecuado para la expresión del trazador correctamente plegado y en cantidad suficiente. Las dificultades mencionadas anteriormente podrían estar relacionadas a un plegamiento incorrecto y/o al apareamiento inapropiado de los puentes disulfuro de la molécula naciente. Para resolver el problema descripto, el producto de síntesis que contenía el trazador 35S-PI, se sometió a la reducción completa de sus puentes disulfuro y posteriormente se permitió el intercambio oxidativo empleando el sistema redox GSH/GSSG. Este tratamiento permitió el correcto apareamiento de puentes disulfuro y el replegamiento óptimo de la molécula 35S-PI. Finalmente la mezcla de síntesis metabólica completa se sometió a un procedimiento de purificación por HPLC altamente optimizado, para aislar la forma correctamente plegada de 35S-PI, de la hemoglobina y otros productos radiomarcados.
Posteriormente, el comportamiento inmunoquímico de 35S-PI se comparó con el de 125I-Insulina (trazador utilizado en el método de referencia). La correlación entre los resultados obtenidos con los dos RBAs fue satisfactoria, obteniéndose una pendiente con valor cercano a la unidad (Figura 3). Considerando los pares de resultados, la performance obtenida con los dos trazadores fue semejante para la mayoría de las muestras estudiadas. El nuevo trazador 35S-PI desarrollado puede ser aplicado para la determinación simultánea de PAA y GADA ya que los protocolos para la determinación de ambos marcadores son totalmente compatibles.
Luego del desarrollo de un RBA para PAA/IAA empleando 35S-PI recombinante fue posible diseñar un RBA combinado para la determinación simultánea de los marcadores GADA y PAA (RBA GADA/PAA combi). La performance del RBA-combi fue evaluada primero empleando sueros de pacientes con DM tipo 1, los cuales fueron también evaluados por los métodos radiométricos individuales. Así el RBA-combi mostró alta correspondencia con los métodos individuales (Fig. 4) (Tabla III). De esta forma todos los sueros positivos para GADA y/o PAA determinados individualmente, fueron también positivos por el RBA GADA/PAA combi, reflejando la correspondencia perfecta de los resultados. Además, 17,7% de los sueros GADA-/PAA- resultaron positivos por el RBA GADA/PAA combi sugiriendo una mayor sensibilidad o menor especificidad del método combinado respecto de los individuales. Mientras que la especificidad del RBA GADA/ PAA combi (96,2%) fue algo menor que la de los métodos individuales (100% para GADA y 98,1% para PAA), esta diferencia no explica el porcentaje de pacientes diabéticos tipo 1 GADA-/PAA-, que obtuvieron resultados positivos por RBA GADA/PAA combi. Así el aumento de la sensibilidad parece ser la explicación más apropiada.
Luego de validar el RBA GADA/PAA combi frente a los métodos individuales, la nueva metodología desarrollada fue aplicada a 98 sueros de pacientes diabéticos con comienzo clínico en edad adulta, de los cuales el 18,4% resultaron positivos. Este valor es mayor que los obtenidos con los RBAs individuales (15,3% para GADA y 5,1% para PAA). Posteriormente, se estudió el uso potencial del RBA-combi para predecir el requerimiento insulínico en pacientes diabéticos con comienzo clínico en edad adulta. De los 18 pacientes adultos que resultaron positivos empleando el RBA GADA/PAA combi, 16 (88,9%) progresaron a dependencia insulínica, sugiriendo que dicho ensayo puede ser utilizado como una herramienta analítica predictiva. Más aún, los 16 pacientes RBA-combi+, que evolucionaron al requerimiento insulínico, presentaron mayores señales de autoanticuerpos que los dos pacientes que no requirieron terapia insulínica. Si bien la positividad para GADA predominó entre los pacientes ARI r (relación GADA:PAA, 9:3), pero no entre los pacientes ARI l (relación GADA:PAA, 3:4), el RBA-combi pudo detectar la totalidad de los pacientes con componente autoinmune, independientemente de cuál sea el subgrupo al cual pertenezca.
En conclusión, los resultados descriptos en el presente trabajo muestran que 35S-PI puede ser eficientemente producida empleando el sistema de lisado de reticulocitos de conejo y empleada como trazador en un RBA altamente sensible y específico para la detección de IAA/PAA. Dado que el isótopo utilizado en este ensayo es 35S, dicho procedimiento es totalmente compatible con el método de referencia para GADA, y de esta manera permitió el diseño de un ensayo combinado en un mismo tubo de los marcadores GADA y PAA.
El RBA-combi puede ser una buena alternativa para el screening del requerimiento insulínico en pacientes diabéticos con comienzo clínico en edad adulta. No obstante como segundo paso se requiere la determinación individual de todos los marcadores disponibles y la tipificación de los alelos HLA DQB1 para mejorar el diagnóstico. Por otra parte, es importante destacar que el desarrollo del trazador 35S-PI aplicado en este método radiométrico combinado, posibilitará la determinación simultánea de GADA, IA-2A y PAA. Este triple ensayo combinado debería ser fuertemente considerado para el screening de autoinmunidad en niños menores de 5 años como fue sugerido por otros autores (26).
AGRADECIMIENTOS
Agradecemos a G Krochik y C Mazza (Hospital de Pediatría JP Garraham, Buenos Aires, Argentina) y a N Cédola (Hospital Español, La Plata, Buenos Aires, Argentina) por la provisión de sueros de pacientes diabéticos. A Graeme Bell (University of Chicago, USA) por el vector pBR328 preproinsulin y a A. Lernmark (Karolinska Institutet) por el vector pEX9 GAD. Este trabajo fue financiado en parte por el subsidio FONTAR de la Agencia Nacional de Promoción Científica y Tecnológica y por la Universidad de Buenos Aires.
CORRESPONDENCIA
Silvina Noemí VALDEZ
Cátedra de Inmunología
Facultad de Farmacia y Bioquímica, UBA
Junín 956 - 4º piso
C1113AAD Ciudad Autónoma de Buenos Aires
Tel.: 54-11- 4964-8259/60
E-mail: silval@ffyb.uba.ar
1.Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20 (7): 1183-97. [ Links ]
2.Zimmet PZ, Tuomi T, Mackay IR, Rowley MJ, Knowles W, Cohen M, et al. Latent autoimmune diabetes mellitus in adults (LADA): the role of antibodies to glutamic acid decarboxylase in diagnosis and prediction of insulin dependency. Diabet Med 1994; 11 (3): 299-303. [ Links ]
3.Tuomi T, Groop LC, Zimmet PZ, Rowley MJ, Knowles W, Mackay IR. Antibodies to glutamic acid decarboxylase reveal latent autoimmune diabetes mellitus in adults with a non-insulin-dependent onset of disease. Diabetes 1993; 42 (2): 359-62. [ Links ]
4.Zimmet PZ. The pathogenesis and prevention of diabetes in adults. Genes, autoimmunity, and demography. Diabetes Care 1995; 18 (7): 1050-64. [ Links ]
5.Molbak AG, Christau B, Marner B, Borch Johnsen K, Nerup J. Incidence of insulin-dependent diabetes mellitus in age groups over 30 years in Denmark. Diabet Med 1994; 11 (7): 650-5. [ Links ]
6.Borg H, Gottsater A, Landin Olsson M, Fernlund P, Sundkvist G. High levels of antigen-specific islet antibodies predict future beta-cell failure in patients with onset of diabetes in adult age. J Clin Endocrinol Metab 2001; 86 (7): 3032-8. [ Links ]
7.Borg H, Gottsater A, Fernlund P, Sundkvist G. A 12-year prospective study of the relationship between islet antibodies and beta-cell function at and after the diagnosis in patients with adult-onset diabetes. Diabetes 2002; 51 (6): 1754-62. [ Links ]
8.Kasuga A, Maruyama T, Nakamoto S, Ozawa Y, Suzuki Y, Saruta T. High-titer autoantibodies against glutamic acid decarboxylase plus autoantibodies against insulin and IA-2 predicts insulin requirement in adult diabetic patients. J Autoimmun 1999; 12 (2): 131-5. [ Links ]
9.Gale EA. Molecular mechanisms of beta-cell destruction in IDDM: the role of nicotinamide. Horm Res 1996; 45 Suppl 1 39-43. [ Links ]
10.Kobayashi T, Nakanishi K, Murase T, Kosaka K. Small doses of subcutaneous insulin as a strategy for preventing slowly progressive beta-cell failure in islet cell antibody-positive patients with clinical features of NIDDM. Diabetes 1996; 45 (5): 622-6. [ Links ]
11.Pozzilli P, Browne PD, Kolb H. Meta-analysis of nicotinamide treatment in patients with recent-onset IDDM. The Nicotinamide Trialists. Diabetes Care 1996; 19 (12): 1357-63. [ Links ]
12.Winter WE, House DV, Schatz D. Pharmacological approaches to the prevention of autoimmune diabetes. Drugs 1997; 53 (6): 943-56. [ Links ]
13.Fuchtenbusch M, Rabl W, Grassl B, Bachmann W, Standl E, Ziegler A. Delay of type I diabetes in high risk, first degree relatives by parenteral antigen administration: the Schwabing Insulin Prophylaxis Pilot Trial. Diabetologia 1998; 41 (5): 536-41. [ Links ]
14.Valdez SN, Sica MP, Labovsky V, Iacono RF, Cardoso AL, Krochik AG, et al. Combined measurement of diabetes mellitus immunological markers: an assessment of its benefits in adult-onset patients. Autoimmunity 2001; 33 (4): 227-36. [ Links ]
15.Lohmann T, Sessler J, Verlohren HJ, Schroder S, Rotger J, Dahn K, et al. Distinct genetic and immunological features in patients with onset of IDDM before and after age 40. Diabetes Care 1997; 20 (4): 524-9. [ Links ]
16.Palmer JP, Asplin CM, Clemons P, Lyen K, Tatpati O, Raghu PK, et al. Insulin antibodies in insulin-dependent diabetics before insulin treatment. Science 1983; 222 (4630): 1337-9. [ Links ]
17.Grubin CE, Daniels T, Toivola B, Landin Olsson M, Hagopian WA, Li L, et al. A novel radioligand binding assay to determine diagnostic accuracy of isoform-specific glutamic acid decarboxylase antibodies in childhood IDDM. Diabetologia 1994; 37 (4): 344-50. [ Links ]
18.Matthews DR, Cull CA, Stratton IM, Holman RR, Turner RC. UKPDS 26: Sulphonylurea failure in non-insulin-dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group. Diabet Med 1998; 15 (4): 297-303. [ Links ]
19.Linde S, Hansen B, Sonne O, Holst JJ, Gliemann J. Tyrosine A14 [1251] monoiodo insulin. Preparation, biological properties, and long term stability. Diabetes 1981; 30 (1): 1-8. [ Links ]
20.Jorgensen KH, Larsen UD. Homogeneous mono-125I-insulins. Preparation and characterization of mono-125I-(Tyr A14)- and mono-125I-(Tyr A19)-insulin. Diabetologia 1980; 19: 546-54. [ Links ]
21.Stumpo RR, Llera AS, Cardoso AI, Poskus E. Solid versus liquid phase assays in detection of insulin antibodies. Influence of iodination site on labelled insulin binding. J Immunol Methods 1994; 169 (2): 241-9. [ Links ]
22.Qiao ZS, Guo ZY, Feng YM. Putative disulfide-forming pathway of porcine insulin precursor during its refolding in vitro. Biochemistry 2001; 40 (9): 2662-8. [ Links ]
23.Shägger H, von Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem 1987; 166, 368-79. [ Links ]
24.Bonifacio E, Lampasona V, Genovese S, Ferrari M, Bosi E. Identification of protein tyrosine phosphatase-like IA2 (islet cell antigen 512) as the insulin-dependent diabetes-related 37/40K autoantigen and a target of islet-cell antibodies. J Immunol 1995; 155 (11): 5419-26. [ Links ]
25.Wiest Ladenburger U, Hartmann R, Hartmann U, Berling K, Bohm BO, Richter W. Combined analysis and single-step detection of GAD65 and IA2 autoantibodies in IDDM can replace the histochemical islet cell antibody test. Diabetes 1997; 46 (4): 565-71. [ Links ]
26.Dittler J, Seidel D, Schenker M, Ziegler AG. GADIA2-combi determination as first-line screening for improved prediction of type 1 diabetes in relatives. Diabetes 1998; 47 (4): 592-7. [ Links ]
27.Zimmet P, Turner R, McCarty D, Rowley M, Mackay I. Crucial points at diagnosis. Type 2 diabetes or slow type 1 diabetes. Diabetes Care 1999; 22 Suppl 2 B 59-64. [ Links ]
28.Hagopian WA, Michelsen B, Karlsen AE, Larsen F, Moody A, Grubin CE, et al. Autoantibodies in IDDM primarily recognize the 65,000-M(r) rather than the 67,000-M(r) isoform of glutamic acid decarboxylase. Diabetes 1993; 42 (4): 631-6. [ Links ]
29.Turner R, Stratton I, Horton V, Manley S, Zimmet P, Mackay IR, et al. UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. UK Prospective Diabetes Study Group. Lancet 1997; 350 (9087): 1288-93. [ Links ]
30.Zavala AV, Fabiano de Bruno LE, Cardoso AI, Mota AH, Capucchio M, Poskus E, et al. Cellular and humoural autoimmunity markers in type 2 (non-insulin-dependent) diabetic patients with secondary drug failure. Diabetologia 1992; 35 (12): 1159-64. [ Links ]














