Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.38 n.1 La Plata ene./mar. 2004
TEMAS DE INTERÉS
Espectro de tumores y síndromes carcinoides*
*Adaptado y traducido de Cornelis JM Lips, Eef GWM Lentjes and Jo WM Höppener. The spectrum of carcinoid tumours and carcinoid syndromes. Ann Clin Biochem 2003; 40: 612-27
Introducción
DEFINICIÓN DE TUMORES CARCINOIDES
Los carcinoides son tumores neuroendocrinos que usualmente surgen de células enterocromafínicas (EC), que se encuentran esparcidas en todo el cuerpo pero principalmente en la submucosa del intestino y de los bronquios (Células de Kulchitsky). Muchos tipos de tumores, tales como carcinomas bronquiales, tumores endocrinos pancreáticos y gástricos, forman parte de un espectro de tumores carcinoides. Carcinoide es un término colectivo para tumores que tienen características histológicas, citoquímicas y ultraestructurales comunes. Ellos comparten el patrón de expresión de un fenotipo neuroendocrino y pueden producir y contener aminas, polipéptidos y/o prostaglandinas. El síndrome carcinoide es causado por liberación sistemática de uno o más de estos productos. El cuadro clínico depende del perfil de los productos liberados.
Originalmente, el término carcinoide fue usado por los patólogos; posteriormente fue adoptado por todos los médicos, pero en un futuro el término puede tornarse cada vez más inapropiado para designar el rango completo de neoplasmas neuroendocrinas de potencial maligno bajo o intermedio. Marcadores biológicos que reflejen los perfiles específicos de expresión génica permitirán una clasificación más precisa de esos tumores, la cual será necesaria para obtener tratamientos objetivos y mejorar la expectativa y calidad de vida de los pacientes.
CLASIFICACIÓN
Williams y Sandler (1) clasificaron a los tumores carcinoides de acuerdo a su origen embriológico (intestino anterior, intestino medio, intestino inferior), características de tinción (histoquímica) comportamiento clínico (Tabla I).
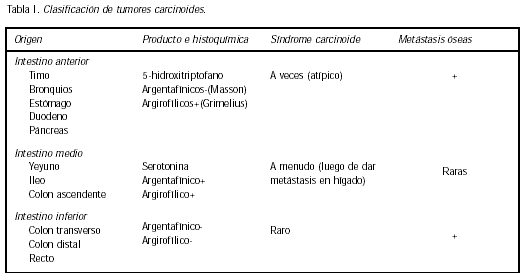
Los tumores carcinoides de intestino anterior son capaces de reducir las sales de plata a plata metálica negra sólo después de un tratamiento con un agente reductor y son llamados"argirofílicos". Los carcinoides de intestino medio se tiñen con sales de plata sin tratamiento previo con un agente reductor, porque la serotonina en sí misma tiene suficiente capacidad reductora, y se los denomina "argentafínicos". Los carcinoides de intestino inferior no muestran ninguna reacción con la plata.
INCIDENCIA Y PREVALENCIA
En investigaciones post morten consecutivas fueron encontrados tumores carcinoides del intestino delgado en aproximadamente uno de cada 150 individuos (2). Además, fueron detectados en el apéndice en aproximadamente 1 de 300 apendicectomías (3). Pueden ser descubiertos incidentalmente durante la proctoscopía (1 en 2.500). La incidencia total de los tumores carcinoides manifestados clínicamente en EEUU ha sido estimada en uno o dos casos cada 100.000 habitantes (4)(5). Un estudio sueco, en el que la frecuencia de los carcinoides fue calculada sobre la base tanto de especímenes quirúrgicos como de autopsias en una sola ubicación geográfica, reportó una incidencia de 8.4 casos cada 100.000 personas (6). Un estudio a nivel nacional en Suecia reveló una incidencia de 2.0/100.000 para los hombres (sitio principal: intestino delgado) y 2.4/100.000 para las mujeres (sitio principal: apéndice) (7). Sobre la base de todos estos datos, uno puede concluir que los tumores carcinoides ocurren en forma relativamente frecuente pero que se manifiestan sólo raramente. Hay un mayor riesgo de desarrollar un tumor carcinoide entre los familiares en primer grado de pacientes con tumores carcinoides. Estos pacientes pueden también tener un mayor riesgo para otras enfermedades malignas. Alternativamente, de acuerdo a un estudio en la Clínica Mayo, puede haber predisposición familiar para un carcinoide sin la concurrencia de otros tipos de tumores (8).
LOCALIZACIÓN DE LOS TUMORES (DISTRIBUCIÓN Y FRECUENCIA DE LOS TUMORES CARCINOIDES)
Una revisión de los autores Modlin y Sandor del National Cancer Data Registry muestra que sobre 8.305 tumores carcinoides estudiados 74% estaban localizados en el intestino y 25% en el sistema pulmonar (5). Estos autores compararon sus datos obtenidos desde 1973 a 1991 con aquellos de Godwyn (4) desde 1950 a 1971 y concluyeron que la incidencia se había incrementado en los últimos 10 años; ellos atribuyeron esto a un mejoramiento de las técnicas diagnósticas, incluyendo el amplio uso de la endoscopía, ultrasonografía, tomografía axial computarizada (CT) y somatostatina escintigrafía. Además, el mayor reconocimiento de diferentes manifestaciones clínicas ha cambiado las limitaciones quirúrgicas y los criterios de registro.
PATOLOGÍA
Los tumores carcinoides del tracto gastrointestinal son generalmente de crecimiento lento pero algunas veces son agresivos.
Existe una buena correlación entre el tamaño del tumor y la expansión metastática. Tumores menores de un centímetro de diámetro raramente forman metástasis mientras que los tumores mayores de dos centímetros casi siempre metastatizan a los nódulos linfáticos regionales y al hígado. Se pueden presentar formas histológicas diferentes: insular, trabecular, glandular, indiferenciada, o mixta (9). La coloración a base de plata de Grimelius y Masson se basa en la capacidad reductora (donación de H+)del tumor. La tinción con plata de Grimelius es positiva si hay 5-hidroxitriptofano presente. La reacción argentafínica (Masson) es positiva si hay presente 5-hidroxitriptamina (serotonina). Frecuentemente hay una reacción histológica positiva con polipéptidos tales como cromogranina A, sinaptofisina, endolasa neurona específica, citoqueratina y proteína S100. El índice mitótico, basado en la tinción Ki-67, da una indicación del grado de malignidad del tumor.
PRODUCTOS DE LOS TUMORES CARCINOIDES
Biosíntesis de serotonina
El triptofano es el precursor de la serotonina y es un aminoácido esencial. Bajo circunstancias normales sólo 1% es transformado en serotonina, más del 90% está disponible para la síntesis de proteínas y de niacina (Vitamina B7). La niacina es el componente esencial de la nicotinamida (Vitamina B3) y sirve para la formación de NAD y NADP, las coenzimas y transportadores de H+ en el metabolismo tisular, glicólisis y síntesis de lípidos.
La escasez de triptofano, debido a una excesiva conversión a serotonina en los tumores carcinoides, puede causar deficiencias de nicotinamida. En adición, los pacientes pueden desarrollar pelagra (i.e. diarrea y demencia) así como hipoproteinemia y malnutrición proteica (Fig. 1).
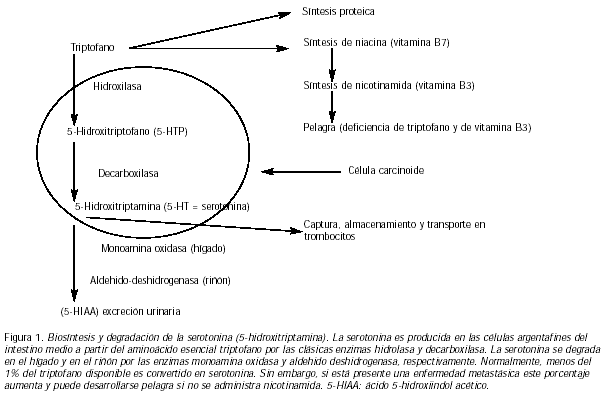
Grandes cantidades de serotonina pueden ser producidas por carcinoides intestinales (intestino medio). Consistentemente, mayores concentraciones, principalmente en plaquetas, fueron observadas en el 96%, 43% y 0% de pacientes con carcinoides de intestino medio, intestino anterior y intestino inferior, respectivamente (10). La serotonina es metabolizada en el hígado por la enzima monoamina oxidasa y en la circulación sistémica normalmente sólo se encuentran presentes bajas concentraciones de serotonina; sin embargo, en presencia de metástasis carcinoides en el hígado, gran cantidad de serotonina no es degradada allí y puede actuar sobre el corazón y los pulmones, teniendo un efecto mutagénico sobre los músculos lisos, causando vasoconstricción, broncoconstricción y agregación plaquetaria y resultando en hipertensión pulmonar y fibrosis endocordial.
Noradrenalina
Muchos carcinoides producen noradrenalina. La noradrenalina urinaria / metabolitos de adrenalina, así como normetadrenalina y metadrenalina, estuvieron incrementados en 33%, 20% y 14% de pacientes con carcinoides de intestino anterior, medio e inferior, respectivamente. El contenido de catecolaminas, que aumenta la producción y liberación de serotonina en los tumores carcinoides es independiente de la localización primaria (10). La catecolamina noradrenalina producida por carcinoides intestinales es degradada por la monoamina oxidasa y por la catecol-O-metil transferasa en el hígado.
Otros productos, otros síndromes
Muchos otros productos (aminas, polipétidos y prostaglandinas) pueden ser liberados por los tumores carcinoides y pueden causar distintos síndromes. Ejemplos de síndromes relacionados a tumores carcinoides incluyen el síndrome de Zollinger-Ellison (ZES), el síndrome de Cushing, el síndrome de diarrea acuosa, hipocalemia y aclorhidria, y el síndrome glucagonoma (Tabla II).

Genética
ASOCIACIÓN DE CARCINOIDES CON SÍNDROMES GENÉTICOS
Los carcinoides se producen esporádicamente o en el contexto de un síndrome tumoral hereditario. Tres diferentes tumores genéticos parecen estar relacionados con el desarrollo de tumores carcinoides. Se ha identificado el gen mutado en cada uno de estos síndromes. Cada uno de estos genes funciona como un gen supresor de tumor y los correspondientes síndromes son causados por pérdida de la función del gen. Debido a esta predisposición genética para la formación de tumores, como una consecuencia de una mutación en células germinales del cuerpo, los tumores carcinoides son a menudo multicéntricos en pacientes de una familia, en oposición a tumores carcinoides solitarios en contextos no familiares (esporádicos). Hasta en un 40% de pacientes con tumores carcinoides esporádicos que se han estudiado está presente una mutación somática inactivante, en el mismo gen que causa el correspondiente síndrome tumoral hereditario (11).
Los tres síndromes familiares son:
1. Síndrome de neoplasia endocrina múltiple tipo 1 (MEN1). Los pacientes con MEN1 desarrollan hiperplasia paratiroide o adenoma en aproximadamente el 95% de los casos. Casi dos tercios de los pacientes MEN1 desarrollan tumores endocrinos pancreáticos (PETs) los cuales son principalmente no funcionales o producen gastrina o insulina. Sobre la base de criterios patológicos, los PETs en los pacientes MEN1 pueden ser clasificados como tumores carcinoides del intestino anterior. En aproximadamente un tercio de los pacientes están presentes tumores carcinoides del timo, estómago o el árbol bronquial. Adenomas pituitarios se encuentran en aproximadamente 40%, tumores adrenocorticales en aproximadamente 20%.
El gen MEN1 está localizado sobre el brazo largo del cromosoma 11 (región 11q13).
2. Enfermedad de Von Hippel-Lindau (VHL). Los pacientes con esta enfermedad desarrollan hemangioblastomas en el cerebelo (55%), mielum (15%) y retina (50%). En adición, carcinomas de células renales (30%) y feocromocitomas (10%). Se detecta al 15% de pacientes VHL, PETs no funcionales. En todos los pacientes se encuentra una mutación en el gen VHL localizado en el cromosoma 3q25.
3. Neurofibromatosis tipo 1 (NF-1), o enfermedad de Von Recklinehausen. En pacientes con NF-1, neurofibroma y manchas de piel color café con leche están combinados con nódulos de Lisch en el iris. En una minoría significativa de pacientes, pueden producirse carcinoides de duodeno (somatostatinomas). Se pueden encontrar mutaciones en el gen NF-1 localizado sobre el cromosoma 17q11.
Incidentalmente se pueden encontrar PETs no funcionales en pacientes con esclerosis tuberosa compleja (TSC). Estos pacientes tienen pequeños nódulos (tuberas) en el sistema nervioso central y raramente, angiomiolipomas en los riñones. Dos loci están ubicados en el defecto en las líneas germinales en TSC: TSC1 sobre el cromosoma 9q34 y TSC2 en el cromosoma 16 p13.3 (12).
Los pacientes con paraganglioma carotídeo familiar no tienen un riesgo aumentado de desarrollar tumores carcinoides de intestino anterior, medio o posterior en relación a los individuos normales. Sin embargo, sus paragangliomas pueden ser productores de serotonina (13)(14). El defecto se encuentra en el cromosoma 11q.
GENES INVOLUCRADOS EN TUMORES CARCINÓGENOS DE INTESTINO ANTERIOR E INTESTINO MEDIO
Carcinoides de intestino anterior
Los carcinoides en MEN1 son principalmente originados en el intestino anterior (timo, pulmón, islotes pancreáticos, estómago, duodeno), mientras que los carcinoides intestino medio y intestino posterior generalmente no se presentan en estos pacientes. Se ha observado pérdida de heterocigocidad en el locus del gen MEN1 en el cromosoma 11q13 en la mayoría de los carcinoides asociados a MEN1 (15)(16).
Pueden también ser observados tumores carcinoides esporádicos, pérdida de heterocigocidad 11q13, indicando un mecanismo similar de formación del tumor (16-18). También ha sido demostrada en el 65% de los carcinoides de timo pérdida de heterocigocidad en 11q13, así como en 48% de carcinoides esporádicos de estómago (tipo 1, relacionado a gastritis atrófica), en 36% de carcinoides de pulmón (11) y en 44% y 93% de gastrinomas esporádicos de páncreas, de la región peripancreática o de la pared del duodeno (16-18). La consistente extensión de pérdida de heterocigocidad de la región MEN1 en 11q13 a la región distal del brazo largo del cromosoma 11 en PEPs esporádicos sugiere ruptura cromosómica y pérdida completa del cromosoma 11q como el mecanismo subyacente en los tumores endocrinos de intestino anterior. También han sido reportadas pérdidas de heterocigocidad distales a 11q13 en tumores carcinoides esporádicos de pulmón (19) y en tumores MEN1 (20). Estos datos sugieren que está involucrado un gen supresor de tumor adicional localizado más distalmente con respecto a 11q13 (por ejemplo el gen SDHD).
Se encontró una asociación entre deleciones ligadas al cromosoma X y tumores entre 17 PETs (tumores endocrinos de intestino anterior), pero no entre 17 de intestino medio o de intestino posterior, sugiriendo que están involucrados diferentes mecanismos moleculares en la tumorigénesis de estas dos categorías de neoplasias endocrinas (21). Aunque el mecanismo subyacente no está claro, es notable que los carcinoides tímicos se producen sólo en pacientes varones (que sólo tienen un cromosoma X por célula).
Carcinoides de intestino medio
Varias regiones cromosómicas y genes han sido implicados en la patogénesis de estos carcinoides. El gen supresor del tumor que codifica para la subunidad D de la succinato-ubiquinona óxido-reductasa (SDHD) está constitucionalmente mutado en paragangliomas familiares de la cabeza y el cuello, y está localizado en la parte distal de 11q (i.e. telomérico respecto del gen MEN1 sobre 11q13). Se ha detectado pérdida de heterocigocidad en el locus del gen SDHD en cinco de ocho carcinoides de intestino medio (22). En dos de estos cinco carcinoides de intestino medio, se ha demostrado una mutación sin sentido en el gen SDHD, en asociación con pérdida de heterocigocidad de otro alelo, lo cual sugiere que las alteraciones del gen SDHD podrían estar involucradas en la tumorigénesis de carcinoides de intestino medio. Como los pacientes con paragangliomas familiares no tienen riesgo incrementado de carcinoides en intestino, las mutaciones en el gen SDHD probablemente no actúan como el evento primario iniciador de la formación del carcinoide.
En un estudio previo de 18 carcinoides de intestino medio (23) se demostraron desequilibrios cromosómicos numéricos. Las aberraciones más comunes fueron pérdidas de 18q22-qter y de 11q22-q23. Estas pérdidas estuvieron presentes tanto en los tumores primarios como en las metástasis indicando que estas deleciones representan eventos tempranos en la tumorigénesis de carcinoides de intestino medio. En otro estudio de 8 carcinoides de intestino medio clásicos, se demostró la pérdida de heterocigocidad por deleciones en el cromosoma 18 en 7 de esos casos (24). Estos datos sugieren fuertemente la presencia de un posible gen supresor de tumores telomérico respecto a 18q22 y sería éste un evento temprano específico en el desarrollo de carcinoides de intestino medio.
Resumiendo, los carcinoides "intestino anterior" a menudo están asociados con el gen MEN1 sobre 11q13. En los carcinoides "intestino medio e inferior" no se encontró pérdida de heterocigocidad en esta región. Similarmente, ha sido demostrada una asociación entre deleciones del cromosoma X y procesos malignos para los carcinoides de intestino anterior (carcinoides gástricos tipo 1 y PETs) (25), pero no para carcinoides intestino medio. En los carcinoides intestino medio, se ha demostrado frecuentemente pérdida de heterocigocidad en el gen SDHD (11q distal) y 18q distal.
EVENTOS MOLECULARES ADICIONALES
Acumulación celular de la proteína β-catenina y mutaciones en el gen de β-catenina en 3p21 indican que la desregulación de la vía de transducción de señales Wnt es un evento común en los carcinoides gastrointestinales (26). No hay indicación de inestabilidad genómica, i.e. reparación defectuosa del DNA, que se encuentra en otros varios tipos de tumores (27). Tampoco ha sido encontrada asociación entre los carcinoides y p53 o Rv, dos genes supresores de tumores comúnmente mutados en carcinomas (28)(29).
El diagnóstico diferencial, el pronóstico y tratamiento podrán ser mejorados con una mayor caracterización genética de los diferentes tipos y estados de desarrollo carcinoide así como con determinaciones de los perfiles de expresión génica (RNA mensajero y proteína) usando tecnologías de microarray.
PRESENTACIÓN CLÍNICA
Signos y síntomas del síndrome carcinoide
El síndrome carcinoide está mediado por factores tumorales producidos por los tumores carcinoides (Tabla II). Las manifestaciones más comunes son cambios vasomotores (enrojecimiento), hipermotilidad gastrointestinal (diarrea), broncoespasmo (respiración tipo asmática, disnea) e hipotención.
El síndrome carcinoide asociado con carcinoides gastrointestinales se desarrolla en menos del 10% de tales pacientes y requiere la presencia de metástasis en el hígado. Esto se debe a la inactivación hepática de los productos del tumor liberados en la circulación portal. Los carcinoides bronquiales y ováricos secretan sus productos directamente en el torrente sanguíneo y se asocian con síndrome carcinoide en ausencia de metástasis hepáticas. Los principales síntomas son enrojecimiento y taquicardia (90%), diarrea, hipotención y sudoración (75%) (30). Los síntomas asmáticos pueden ser causados por histamina, bradiquinina, taquiquininas y prostaglandinas. Los efectos a largo término incluyen hipertensión pulmonar y fibrosis valvular endocardial, que pueden conducir a insuficiencia cardíaca (30%) (31). Además, altas concentraciones de serotonina pueden causar fibrosis retroperitoneal o mesentérica y artritis.
En relación al enrojecimiento, dependiendo de la localización y estado de desarrollo del tumor, se pueden distinguir cuatro tipos diferentes de enrojecimiento (32).
Diferentes sustancias pertenecientes a diversos grupos de mensajeros neuroendocrinos pueden contribuir al enrojecimiento (enrojecimiento, acaloramiento). Las aminas pueden jugar un rol menor, aunque las catecolaminas inducen la liberación de calicreína, que se cree provoca el fenómeno de enrojecimiento. La histamina puede causar enrojecimiento atípico en carcinoides estomacales.
Las hormonas polipeptídicas en particular son responsables del enrojecimiento. Las células de los tumores carcinoides producen calicreína que promueve la conversión de quininógeno a bradiquinina en el torrente sanguíneo. La bradiquinina se relaciona con el veneno de abeja y es un potente vasodilatador (33). También actúa sobre las células endoteliales activando la fosfolipasa A2. También produce la constricción del músculo liso bronquiolar y es la principal candidata para los síntomas pulmonares del síndrome carcinoide (34). Las taquiquininas, una familia de péptidos vasoactivos, es también conocida como la familia de sustancia P. El neuropéptido K, la neuroquinina A y la neuroquinina B también pertenecen a esta familia. Las más altas concentraciones de las taquiquininas en plasma se encuentran durante los períodos de enrojecimiento carcinoide. Otras hormonas polipeptídicas tales como el péptido liberador de gastrina, el péptido intestinal vasoactivo (VIP), la neurotensina, la motilina y la somatostatina pueden contribuir también al enrojecimiento.
La serotonina generalmente no causa enrojecimiento pero es quizás el principal factor causante de diarrea (35). Ella estimula la secreción y la motilidad intestinal e inhibe la absorción. El paciente con tumores carcinoides de islotes pancreáticos, puede producir VIP resultando en diarrea secretoria. Además, otras sustancias producidas por los tumores carcinoides (por ejemplo, las prostaglandinas EF) también estimulan la motilidad intestinal.
FACTORES PRECIPITANTES Y PROVOCACIÓN DE UN ATAQUE DE SÍNDROME CARCINOIDE
Un ataque puede ser provocado por estrés emocional, calor, ingestión de comidas particulares o alcohol, estreñimiento, o estimulación exógena con adrenalina, noradrenalina, dopamina, gastrina y colecistoquinina. Durante el comienzo de un ataque, la liberación de noradrenalina inicia una reacción en cadena con liberación aumentada de noradrenalina, serotonina y todos los otros productos disponibles.
TUMORES CARCINOIDES DE INTESTINO ANTERIOR
Los síntomas dependen del sitio de ubicación del tumor, por ejemplo, el sistema broncopulmonar, estómago, duodeno, páncreas o glándula del timo (36-40).
TUMORES CARCINOIDES DE INTESTINO MEDIO (ILIUM)
Estos tumores constituyen aproximadamente un tercio de todas las neoplasias intestinales. El síntoma inicial más común es el dolor abdominal que es vago, no específico y causado por isquemia debido a la invasión microvascular mesentérica, compresión vascular y obstrucción del drenaje linfático por metástasis en el nódulo linfático.
Aproximadamente 10% de pacientes con carcinoide de intestino medio presentan síntomas de síndrome carcinoide debido a las metástasis en hígado y esto está generalmente asociado con complicaciones pulmonares y cardíacas.
ENFERMEDAD CARDÍACA CARCINOIDE
Dos tercios de los pacientes, especialmente aquellos con carcinoides de intestino medio que metastatizan en el hígado, desarrollan signos de enfermedad cardíaca carcinoide. Clásicamente, ésta involucra el lado derecho del corazón, debido a la inactivación de sustancias humorales (por ejemplo, serotonina) por el pulmón protegiendo así el lado izquierdo del corazón pero ocasionalmente también este lado puede estar afectado (41).
La serotonina tiene un efecto mitogénico sobre los miofibroblastos y causa fibroplasia, vasoconstricción, broncoconstricción y agregación plaquetaria. Las consecuencias son una combinación de hipertensión pulmonar, fibrosis endocardial del lado derecho, estenosis tricúspide (97%), estenosis pulmonar (72%) y regurgitación (42-44).
En los carcinoides de intestino medio, grandes cantidades de triptofano pueden ser utilizadas para la producción de serotonina. La limitada disponibilidad de este aminoácido causa deficiencia del mismo y de nicotinamida resultando en debilitamiento y pelagra, incluyendo diarrea, dermatitis y demencia.
Crisis carcinoide
Esta emergencia médica puede producirse espontáneamente, luego de la palpación del tumor, durante la inducción de la anestesia o cirugía, luego de la administración de agentes o luego de la embolización arterial hepática. Los síntomas son enrojecimiento profundo, hipotensión o cambios extremos en la presión arterial, diarrea, confusión, estupor, broncoconstricción, arritmias e hipertermia. A menos que sean tratados los pacientes pueden morir durante una crisis. A pacientes con tumores muy extensos se les deben suministrar análogos de somatostatina para reducir la secreción de hormonas polipeptídicas por parte del tumor antes de ser sometidos a cirugía en embolización o quimioterapia.
CARCINOIDES DE INTESTINO INFERIOR (COLON Y RECTO)
Estos tumores mayoritariamente se desarrollan a edad avanzada (> 70 años), particularmente en el lado derecho del colon y caecun. Los síntomas aparecen cuando los tumores tienen un tamaño mayor de cinco centímetros de diámetro y aparecen metástasis distantes. Los carcinoides rectales son mayoritariamente encontrados al azar.
TESTS DIAGNÓSTICOS: INVESTIGACIÓN DE LABORATORIO
Para la identidad de productos de carcinoides de intestino anterior, medio e inferior y su significancia como biomarcadores ver la Tabla III.
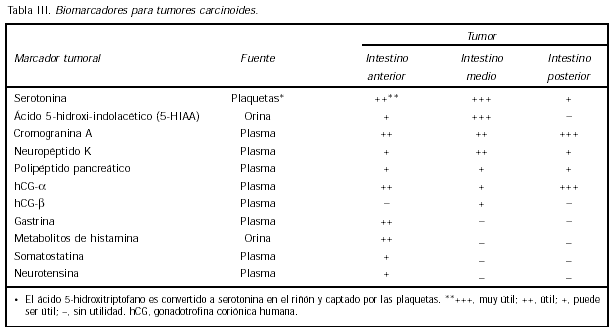
Entre estos productos, como ya ha sido mencionado previamente se encuentra la serotonina. Sin embargo la producción de serotonina no es específica de los tumores carcinoides (13)(14).
Para análisis de la serotonina, teniendo en cuenta la baja concentración de la misma en sangre y orina, así como las complicaciones metodológicas es necesario utilizar mediciones de la misma en orina de 24 h para el diagnóstico y seguimiento de los tumores carcinoides. Existe una amplia variedad de métodos analíticos para este dosaje (45-47). El método colorimétrico original (48) ha sido superado por métodos más selectivos y sensibles, fundamentalmente basados en cromatografía líquida de alta performance o en cromatografía gas líquido. Estos métodos cromatográficos permiten la determinación simultánea de varios compuestos relacionados, incrementando la sensibilidad diagnóstica (49).
La medición de serotonina por cualquier método tiene el inconveniente de las interferencias producidas por comidas ricas en aminas, cuya ingesta debe ser evitada al menos 12 h antes de la recolección de las muestras de orina (50)(51). La ingesta de alimentos ricos en aminas y de medicaciones para la tos que contienen guayacolato de glicerol o acetaminofeno (paracetamol) pueden producir resultados falso positivos y su ingesta debe ser restringida durante tres o cuatro días antes de la recolección de la orina. Drogas con fenotiacina y levodopa causan falsos negativos (31)(52). En contraste con el ácido 5-HIAA urinario, la serotonina plaquetaria no es afectada por el consumo de alimentos ricos en serotonina. La concentración de serotonina plaquetaria es dependiente de la edad, y esto debe ser tenido en cuenta cuando se interpretan los resultados de su determinación (53)(54).
En más del 30% de los carcinoides de intestino medio, hay una elevación constante de dopamina, noradrenalina y sus metabolitos (10). Esto puede explicar la presencia de efectos colaterales tales como la arritmia y la hipertensión.
Por otro lado, la cromogranina A (CgA) es un miembro de la familia de las cromograninas y es un precursor de varios péptidos incluyendo pancreastatina, y vasostatina I y II (55).
Dado que la CgA es almacenada en la mayoría de los tumores neuroendocrinos, su liberación a la circulación puede ser usada como un marcador general de tumor, aun para tumores no funcionantes (56)(57).
Concentraciones elevadas de CgA no son específicas para un tumor neuroendocrino, ya que los carcinomas prostáticos también causan elevación de su concentración. Pueden ser observados falsos positivos en insuficiencia renal, falla hepática, gastritis atrófica y enfermedades inflamatorias intestinales (58). El ejercicio, el trauma inducido por estrés físico o la hipertensión no tratada también pueden producir aumentos en las concentraciones de CgA (56).
VISUALIZACIÓN PARA LA LOCALIZACIÓN DE LOS TUMORES CARCINOIDES
Después que el diagnóstico bioquímico del tumor carcinoide ha sido realizado, este tumor debe ser localizado. Para tumores de carcinoide de intestino medio con metástasis, se realiza CT abdominal con contraste intravenoso y oral y esta técnica presenta una alta sensibilidad (87%). Sin embargo, el tumor primario raramente es visible debido a su localización submucosal. En pacientes con un síndrome carcinoide, las metástasis hepáticas están invariablemente presentes. También se pueden ver radiológicamente reacciones fibróticas mesentéricas y agrandamiento de los nódulos linfáticos. Existen además técnicas complementarias (59)(60).
Si el tumor primario no es detectado por escintigrafía octreotide (59), la localización por precursores de aminas marcados puede permitir la detección y la subsecuente cirugía curativa. La tomografía por emisión de positrones (61-63) ha permitido la localización exitosa de tumores en casos similares.
Tratamiento
MEDICACIÓN PALIATIVA
La frecuencia y la intensidad de los enrojecimientos pueden ser inhibidas por bloqueo del receptor H2 (cimetidina, famotidina, vantidina, etc, especialmente para tumores carcinoides de estómago), por bloqueantes del receptor α1 (doxazosina), por fenotiazinas o por glucocorticoides. La diarrea es inhibida por bloqueantes del receptor de serotoninas (ketancerina, ondansatrón) y bloqueantes del receptor opiáceo (codeína, loperamida). Clorpromazinas y corticosteroides pueden ser usados para aliviar los síntomas del broncoespasmo.
Análogos de la somatostatina pueden inhibir el enrojecimiento así como mejorar la disfunción motora del colon (64).
Si uno de los síntomas es la pelagra, se debe administrar 50-100 mg de nicotinamida intravenosa una o dos veces por día. Para prevenir la pelagra, pueden ser dados 50 mg en una sola dosis oral diaria.
CIRUGÍA Y TERAPIA CITORREDUCTIVA ALTERNATIVA
La cirugía debería ser considerada para todos los pacientes, porque la resección de un tumor local puede resultar en una cura. Cuando se encuentran presentes metástasis extensas, la remoción del tumor primario es aún importante especialmente si causa problemas locales (por ejemplo, obstrucción del tracto gastrointestinal). También se puede obtener un alivio sintomático con cirugía hepática.
La citorreducción puede ser realizada por medio de cirugía, ligazón arterial hepática, quimioembolización, criocirugía, ablación por radiofrecuencia, radiación interna o aun trasplante hepático (65-67).
La cirugía citodestructiva de pacientes con etapas avanzadas de tumores carcinoides puede mejorar los síntomas y tiene, relativamente, pocas complicaciones menores (68)(69).
Por otro lado, la cirugía cardíaca puede resolver síntomas de debilitamiento por enfermedad cardíaca carcinoide y mejorar la calidad de vida (70).
QUIMIOTERAPIA DIRIGIDA Y RADIOTERAPIA
La demostración de internalización eficiente de complejos receptor-ligando en células tumorales positivas para receptores de somatostatina (SSTR) permitió establecer el concepto de quimioterapia mediada o radioterapia de metástasis carcinoides que expresan SSTR. Este camino es promisorio debido a las dosis bajas de agentes quimioterápicos tales como el metotrexato y la doxorubicina que pueden ser usados con menor toxicidad (71)(72).
En pacientes con enfermedad metastática carcinoide que no responde a otras terapias, alivio sintomático prolongado puede ser provisto por M131 IBG (73). La radioterapia local es importante solamente para aliviar metástasis óseas y de la piel.
QUIMIOTERAPIA
La quimioterapia no ha resultado adecuada para el tratamiento de los tumores carcinoides. Se puede obtener hasta un 40% de reducción de la masa tumoral, pero esto tiene una duración promedio de sólo siete meses aunque recientemente se han reportado resultados favorables combinando dos agentes quimioterápicos (74).
Pronóstico
En general, los tumores carcinoides crecen lentamente. El pronóstico se basa en el tamaño, la invasividad y la histología. Los predictores patológicos de sobrevida disminuida son marcadores moleculares de la proliferación de las células tumorales (por ejemplo, Ki-67 también conocido como antígeno nuclear celular proliferativo, o MIB-1) (75).
En caso de tumores carcinoides con metástasis distante, una sobrevida de 5 años es posible en sólo un 20-30% de los casos, esto puede aumentar a un 65% si sólo los nódulos linfáticos regionales son positivos. Una sobrevida de cinco años es posible en el 95% de los casos si sólo se ha detectado histológicamente un tumor local invasivo. Pacientes con tumores carcinoides tratados quirúrgicamente tienen una sobrevida más favorable que aquellos que no han sido operados (76). La sobrevida también ha mejorado luego de la introducción de análogos de la somatostatina. Finalmente muchos pacientes mueren por el avance de la enfermedad cardíaca carcinoide.
SEGUIMIENTO
La frecuencia recomendada del examen clínico depende de la expansión y manifestaciones clínicas de la enfermedad. Si hay metástasis presentes los exámenes periódicos pueden prevenir complicaciones (por ejemplo, prevención por irradiación local o tratamiento octreotide de fracturas patológicas provocadas por metástasis óseas de tumores carcinoides de la glándula del timo).
Perspectivas del diagnóstico molecular predictivo
CRITERIOS PARA ANÁLISIS DE ADN
Hay una predisposición genética para desarrollar tumores carcinoides en portadores del gen de la enfermedad en familias con síndromes tumorales hereditarios específicos. La detección de una mutación germinal en los genes supresores de tumor implicados identifica individuos con un riesgo aumentado de desarrollar tales tumores. Se justifican los análisis de ADN para MEN1 y VHL en los carcinoides de intestino anterior en casos de historia familiar positiva de tumores neuroendocrinos. Criterios adicionales posibles para análisis de ADN incluyen la afectación de más de un órgano o el desarrollo de tumores multicéntricos en un órgano y/o si el paciente es menor de 35 años al momento del diagnóstico.
Para los carcinoides de duodeno, el análisis de ADN para NF-1 se encuentra bajo discusión (77).
RELEVANCIA CLÍNICA DE LOS PERFILES DE EXPRESIÓN CARCINOIDE: TRANSCRIPTÓNICOS Y PROTEÓMICOS
Un enfoque principal en la investigación de los tumores carcinoides es encontrar marcadores que puedan predecir los efectos en un paciente o la respuesta de un tumor individual a terapias específicas. Actualmente, microarrays de ADN permiten el análisis simultáneo de la expresión de miles de genes en un tumor en un solo experimento. Los perfiles de expresión génica pueden proveer información pronóstica que es importante para las decisiones clínicas a tomar (78-81).
Resumen, conclusiones y recomendaciones
Los carcinoides representan un amplio espectro de tumores. Genes supresores de tumores están involucrados en la inducción y progresión de esta enfermedad. El cuadro clínico depende del patrón de expresión y la liberación de sustancias bioactivas específicas. El registro de la historia familiar es el primer paso en la detección de la susceptibilidad para la enfermedad.
En una etapa temprana de la enfermedad el diagnóstico está facilitado por la detección de la concentración de serotonina plaquetaria. La determinación de serotonina urinaria es importante para el seguimiento, ya que la concentración de serotonina plaquetaria es saturable. La cromogranina A es un marcador importante aunque no es específico. La determinación de polipéptidos puede ser útil en ciertos síndromes.
La visualización de tumores carcinoides ocultos debe ser realizada por escintigrafía octreotide.
En relación al tratamiento, la cirugía puede ser justificada aún cuando haya metástasis presente a fin de evitar problemas locales. La cirugía criorreductiva y el tratamiento adicional tal como la quimioembolización pueden aliviar síntomas y mejorar la sobrevida.
En pacientes con metástasis extensas, tratamiento octreotide o quimio y radioterapias dirigidas pueden tener un efecto beneficioso sobre la calidad y expectativa de vida.
1.Williams ED, Sandler M. The classification of carcinoid tumours. Lancet 1963; i: 238-9.
2. Moertel CG, Sauer WG, Dockerty MB, Baggenstoss AH. Life history of the carcinoid tumor of the small intestine. Cancer 1961; 14: 901-12.
3. Moertel CG, Dockerty MB, Judd ES. Carcinoid tumors of the vermiform appendix. Cancer 1968; 21: 270-8.
4. Godwin JD. Carcinoid tumours: an analysis of 2837 cases. Cancer 1975; 36: 560-9.
5. Modlin IM, Sandor A. An analysis of 8305 cases of carcinoid tumors. Cancer 1997; 79: 813-29.
6. Berge T, Linell F. Carcinoid tumors, frequency in a defined population during a 12-year period. Acta Pathol Microbiol Scand A 1976; 84: 322-30.
7. Hemminki K, Li X. Incidence trends and risk factors of carcinoid tumors: a nationwide epidemiological study from Sweden. Cancer 2001; 92: 2204-10.
8. Babovic-Vuksanovic D, Constantinou CL, Rubin J, Rowland CM, Schaid DJ, Karnes PS. Familial occurrence of carcinoid tumors and association with other malignant neoplasms. Cancer Epidemiol Biomarkers Prev 1999; 8: 715-9.
9. Soga J, Tazawa K. Pathologic analysis of carcinoids: histologic re-evaluation of 62 cases. Cancer 1971; 28: 990-8.
10.Kema IP, De Vries EG, Slooff MJ, Biesma B, Muskiet FA. Serotonin, catecholamines, histamine, and their metabolites in urine, platelets and tumor tissue of patients with carcinoid tumors. Clin Chem 1994; 40: 86-95.
11.Debelenko LV, Brambilla E, Agarwal SK, Swalwell JI, Kester MB, Lubenski IA, et al. Identification of MEN1 gene mutations in sporadic carcinoid tumors of the lung. Hum Mol Genet 1997; 6: 2285-90.
12.Verhoef S, van Diemen-Steenvoorde R, Akkersdijk WL, Bax NM, Ariyurek Y, Hermans CJ, et al. Malignant pancreatic tumour within the spectrum of tuberous sclerosis complex in childhood. Eur J Pediatr 1999; 158: 284-7.
13.Le Bodic MF, Fiche M, Aillet G, Sagan C, Bouc M, Liebault C, Legent F. Immunohistochemical study of six multiple familial cervical paragangliomas with Iymph node metastasis in one case. Ann Palhol 1991; 11: 176-80.
14.Patetsios P, Gable DR, Garret WV, Lamont JP, Kuhn JA, Shutze WP, et al. Management of carotid body paragangliomas and review of a 30-year experience. Ann Vasc Surg 2002; 16: 331-8.
15.Debelenko LV, Emmert-Buch MR, Zhuang Z, Epshteyn E, Moskaluk CA, Jensen RT, et al. The multiple endocrine neoplasia type 1 gene locus is involved in the pathogenesis of type II gastric carcinoids. Gastroenterology 1997; 113: 773-81.
16.Debelenko LV, Zhuang Z, Emmert-Buch MR, Chandrasekharappa SC, Manickam P, Guru SC, et al. Allelic deletions on chromosome 11q13 in multiple endocrine neoplasia type 1-associated and sporadic gastrinomas and pancreatic endocrine tumors. Cancer Res 1997; 57: 2238-43.
17.D'Adda T, Pizzi S, Azzoni C, Bottarelli L, Crafa P. Different patterns of 11q allelic losses in digestive endocrine tumors. Hum Pathol 2002; 33: 322-9.
18.Zhuang ZP, Vortmeyer AO, Pack S, Huang S, Pham T, Wang C. Somatic mutations of the MEN1 tumor suppressor gene in sporadic gastrinomas and insulinomas. Cancer Res 1997; 57: 4682-6.
19.Petzmann S, Ullmann R, Klemen H, Renner H, Popper HH. Loss of heterozygosity on chromosome arm 11q in lung carcinoids. Hum Pathol 2001; 32: 333-8.
20.Pourani J, Kaserer K, Pfragner R. Cytogenetic and molecular analyses of multiple endocrine neoplasias of the MEN1 syndrome. Int J Oncol 2002; 20: 971-6.
21.Pizzi S, D'Adda T, Azoni C, et al. Malignancy-associated allelic losses on the X-chromosome in foregut but not in midgut endocrine tumours. J Pathol 2002; 196: 401-7.
22.Kytölä S, Nord B, Elder EE, Carling T, Kjellman M, Cedermark B, et al. Alterations of the SDHD gene locus in midgut carcinoids. Merkel cell carcinomas, pheochromocytomas, and abdominal paragangliomas. Genes, Chromosomes Cancer 2002; 34: 325-32.
23.Kytölä S, Höög A, Cedermark B, Frisk T, Larsson C, Kjellman M. Comparative genomic hybridization identifies loss of 18q22-qter as an early and specific event in tumorigenesis of midgut carcinoids. Am J Pathol 2001; 158: 1803-8.
24.LolIgen RM, Hessman O, Szabo E, Westing G, Akerstrom G. Chromosome 18 deletions are common events in classical midgut carcinoid tumors. Int J Cancer 2001; 92: 812-5.
25.D'Adda T, Candidus S, Denk H, Bordi C, Hofler H. Gastric neuroendocrine neoplasms: tumour clonality and malignancy-associated large X-chromosomal deletions. J Pathol 1999; 189: 394-401.
26.Fujimori M, Ikeda S, Shimizu Y, Okajima M, Asahara T. Accumulation of beta-catenin protein and mutations in exon 3 of beta-catenin gene in gastrointestinal carcinoid tumor. Cancer Res 2001; 61: 6656-9.
27.Ghimenti C, Lonobile A, Campani D, Bevilacqua G, Caligo MA. Microsatellite instability and allelic losses in neuroendocrine tumors of the gastro-entero-pancreatic system. Int J Oncol 1999; 15: 361-6.
28.Gugger M, Burckhardt E, Kappeler A, Hirsiger H, Laissue JA, Mazzucchelli L. Quantitative expansion of structural genomic alterations in the spectrum of neuroendocrine lung carcinomas. J Pathol 2002; 196: 408-15.
29.Weckstrom P, Hedrum A, Makridis C, Akerstrom G, Rastad J, Scheibenpflug L, et al. Intestino medio carcinoids and solid carcinomas of the intestine: differences in endocrine markers and p53 mutations. Endocrinol Pathol 1996; 7: 273-9.
30.Oates JA. The carcinoid syndrome. N Engl J Med 1986; 315: 702-4.
31.Maton PN. The carcinoid syndrome: grand rounds at the National Institutes of Health. JAMA 1988; 260: 1602-6.
32.Bordi C. Endocrine tumors of the stomach. Pathol Res Pract 1995; 191: 373-80.
33.Murphey LJ, Hachey DL, Oates JA, Morrow JD, Brown NJ. Metabolism of bradykinin in vivo in humans: identification of BK1-5 as a stable plasma peptide metabolite. Pharmacol Exp Ther 2000; 294: 263-9.
34.Oates JA, Pettinger WA, Doctor RB. Evidence for the release of bradykinin in carcinoid syndrome. J Clin Invest 1966; 45: 173-8.
35.Wilkin JK. Flushing reactions: consequences and mechanisms. Ann Intern Med 1981; 95: 468-76.
36.Modlin IM, Tang LH, Svennevik E. Gastric carcinoid tumors. In: Doherty GM, Skogseid B, eds. Surgical Endocrinology. Philadelphia: Lippincott, Williams & Wilkins, 2001: 431-46.
37.Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology 1993; 104: 994-1006.
38.Bordi C, Falchetti A, Azzoni C, D'Adda T, Canavese G, Guariglia A, et al. Aggressive forms of gastric neuroendocrine tumors in MEN1. Am J Surg Pathol 1997; 21: 1075-82.
39.Teh BT. Thymic carcinoids in multiple endocrine neoplasia type 1. J Intem Med 1998; 243: 501-4.
40.Wick MR, Scott RE, Li C-Y, Carney JA. Carcinoid tumor of the thymus. A clinicopathologic report of seven cases with a review of the literature. Mayo Clin Proc 1980; 55: 246-54.
41.Roberts WC. A unique heart disease associated with a unique cancer: carcinoid heart disease. Am J Cardiol 1997; 80: 251-6.
42.Egermayer P, Town GI, Peacock A. Role of serotonin in the pathogenesis of acute and chronic pulmonary hypertension. Thorax 1999; 54: 161-8.
43.Sakai D, Murakami M, Kawazoe K, Tsutsumi Y. IIeal carcinoid complicating carcinoid heart disease and secondary retroperitoneal fibrosis. Pathol lnt 2000; 50: 404-11.
44.Moller JE, Conolly HM, Rubin J, Seward JB, Modesto K, Pellikka PA. Factors associated with progression of carcinoid heart disease. N Engl J Med 2003; 348: 1005-15.
45.Deacon AC. The measurement of 5-hydroxyindoleacetic acid in urine, a review. Ann Clin Biochem 1994; 31: 215-32.
46.Van Haard PM, Pavel S. Chromatography of urinary indole derivatives. J Chromatogr 1988; 429: 59-94.
47.Kema IP, de Vries EG, Muskiet FA. Clinical chemistry of serotonin and metabolites. J Chromatogr B Biomed Sci Appl 2000; 747: 33-48.
48.Udenfriend S, Titus E, Weissbach H. The identification of 5-hydroxy-3-indoleacetic acid in normal urine and a method for its assay. J Biol Chem 1955; 216: 499-505.
49.Kema IP, Meijer WG, Meiborg G, Ooms B, Willemse PH, de Vries EG. Profiling of tryptophan-related plasma indoles in patients with carcinoid tumors by automated, on-line, solid-phase extraction and HPLC with fluorescence detection. Clin Chem 2001; 47: 1811-20.
50.Kema IP, Schellings AM, Meiborg G, Hoppenbrouwers CJ, Muskiet FA. Influence of a serotonin- and dopamine-rich diet on platelet serotonin cantent and urinary excretion of biogenic amines and their metabolites. Clin Chem 1992; 38: 1730-6
51.Feldman JM, Lee EM. Serotonin content of foods: effect on urinary excretion of 5-hydroxyindoleacetic acid. Am J Clin Nutr 1985; 42: 639-43.
52.Young DS, ed. Effects of Drugs on Clinical Laboratory Tests. Washington, DC: AACC Press, 2000.
53.Nuttall KL, Pingree SS. The incidence of elevations in urine 5-hydroxyindole acetic acid. Ann Clin Lab Sci 1998; 28: 167-74.
54.Flachaire E, Beney C, Berthier A, Salandre J, Quincy C, Renaud B. Determination of reference values for serotonin concentration in platelets of healthy newborns, children, adults, and elderly subjects by HPLC with electrochemical detection. Clin Chem 1990; 36: 2117-20.
55.Eriksson B, Öberg K, Stridsberg M. Tumor markers in neuroendocrine tumors. Digestion 2000; 62 (Suppl 1): 33-8.
56.Janson ET, Holmberg L, Stridsberg M, Eriksson B, Theodorsson E, Wilander E, et al. Carcinoid tumors: analysis of prognostic factors and survival in 301 patients from a referral center. Ann Oncol 1997; 8: 685-90.
57.Eriksson B, Arnberg H, Lindgren PG, Lorelius LE, Magnusson A, Lundqvist G, et al. Neuroendocrine pancreatic tumours: clinical presentation, biochemical and histological findings in 84 patients. J Intern Med 1990; 228: 103-13.
58.Granberg D, Stridsberg M, Seensalu R, Eriksson B, Lundqvist G, Öberg K, Skogseid B. Plasma chromogranin A in patients with multiple endocrine neoplasia type 1. J Clin Endocrinol Metab 1999; 84: 2712-7.
59.Reubi JC, Kvols L, Krenning E, Lamberts SW. Distribution of somatostatin receptors in normal and tumor tissue. Metabolism 1990; 39: 78-81.
60.Kölby L, Wängberg B, Ahlman H, Tisell LE, Fjälling M, Forssell-Aronsson E, Nilsson O. Somatostatin receptor subtypes, octreotide scintigraphy, and clinical response to octreotide treatment in patients with neuroendocrine tumors. World J Surg 1998; 22: 679-83.
61.Örlefors H, Sundin A, Ahlström H, Bjurling P, Bergström M, Langström B, et al. Positron emission tomography with 5-hydroxytryptophan in neuroendocrine tumors. J Clin Oncol 1998; 16: 2534-42.
62.Hoegerle S, Schneider B, Kraft A, Moser E, Nitzsche EU. Imaging of a metastatic gastrointestinal carcinoid by F-18-DOPA positron emission tomography. Nuklearmedizin 1999; 38: 127-30.
63.Jager PL, Meijer WG, Kema IP, Willemse PH, Piers DA, De Vries EG. L-3-123 lodo-alpha-methyltyrosine scintigraphy in carcinoid tumors: correlation with biochemical activity and comparison with 111In-DTPA-D-Phe1-octreotide imaging. J Nucl Med 2000; 41: 1793-800.
64.Saslow SB, O'Brien MD, Camilleri M, van der Ohe M, Homburger HA, Klee GG, et al. Octreotide inhibition of flushing and colonic motor dysfunction in carcinoid syndrome. Am J Gastroenterol 1997; 92: 2250-6.
65.De Vries H, Verschueren RC, Willemse PH, Kema IP, De Vries EG. Diagnostic, surgical and medical aspects of midgut carcinoids. Cancer Treat Rev 2002; 28: 11-25.
66.Drougas JG, Anthony LB, Blair TK, Lopez RR, Wright JK, Chapman WC, et al. Hepatic artery chemoembolization for management of patients with advanced metastatic carcinoid tumors. Am J Surg 1998; 175: 408-12.
67.Ruszniewski P, Malka D. Hepatic arterial chemoembolization in the management of advanced digestive endocrine tumors. Digestion 2000; 62 (SuppL 1): 79-83.
68.Que FG, Nagomey DM, Batts KP, Linz LJ, Kvols LK. Hepatic resection for metastatic neuroendocrine carcinomas. Am J Surg 1995; 169: 36-43.
69.Gulec SA, Mountcastle TS, Frey D, Cundiff JD, Mathews E, Anthony L, et al. Cytoreductive surgery in patients with advanced-stage carcinoid tumors. Am Surg 2002; 68: 667-71.
70.McDonald ML, Nagorney DM, Connolly HM, Nishimura RA, Schaff HV. Carcinoid heart disease and carcinoid syndrome: successful surgical treatment. Ann Thorac Surg 1999; 67: 537-9.
71.Schally AV, Nagy A. Cancer chemotherapy based on targeting of cytotoxic peptide conjugates to their receptors on tumors. Eur J Endocrinol 1999; 141: 1-14.
72.Nagy A, Schally AV. Targeted cytotoxic Somatostatin analogs: a modern approach to the therapy of various cancers. Drugs Future 2001; 26: 261-70.
73.Prvulovich EM, Stein, Bomanji JB, Lederman JA, Taylor I, Ell PJ. lodine-131-MIBG therapy of a patient with carcinoid liver metastases. J Nucl Med 1998; 39: 1743-5.
74.Kaltsas GA, Mukherjee JJ, Isidori A, Kola B, Plowman PN, Monson JP, et al. Treatment of advanced neuroendocrine tumours using combination chemotherapy with lomustine and 5-fluorour-acil. Clin Endocrinol (Oxf) 2002; 57: 169-83.
75.Sokmensuer C, Gedikoglu G, Uzunalimoglu B. Importance of proliferation markers in gastrointestinal carcinoid tumors: a clinicopathologic study. Hepatogastroenterology 2001; 48: 720-3.
76.Shebani KO, Souba WW, Finkelstein DM, Stark PC, Elgadi KM, Tanabe KK, et al. Prognosis and survival in patients with gastrointestinal tract carcinoid tumors. Ann Surg 1999; 229: 815-23.
77.Thomson SA, Fishbein L, Wallace MR. NF1 mutations and molecular testing. J Child Neurol 2002; 17: 555-61.
78.Sauter G, Simon R. Predictive molecular pathology: perspective. N Engl J Med 2002; 347: 1995-6.
79.van de Vijver MJ, He YD, van 't Veer LJ, Dai H, Hart AA, Voskuil DW, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347: 1999-2009.
80.Kallioniemi A. Molecular signatures of breast cancer; predicting the future. N Engl J Med 2002; 347: 2067-8.
81. Yeatman TJ. The future of cancer management: translating the genome, transcriptome, and proteome. Ann Surg Oncol 2003; 10: 7-14.














